INTRODUCCIÓN
La nutrigenética y la nutrigenómica son dos conceptos utilizados muchas veces como sinónimos para referirnos al estudio conjunto de la alimentación-nutrición con genómica y otras ciencias ómicas y su influencia en los distintos fenotipos de salud-enfermedad.
Sin embargo, desde un punto de vista más académico, existe una distinción entre ambos términos. Así, suele emplearse el concepto "nutrigenética" para referirnos a los estudios epidemiológicos en los que se analiza de manera estadística el distinto efecto de la dieta según el genotipo 1. Por su parte, "nutrigenómica" haría referencia a los estudios que intentarían explicar las bases moleculares mediante las cuales puede entenderse el efecto nutrigenético observado 2. Ambos conceptos son complementarios y entran en el marco de la disciplina genómica nutricional que los engloba 1,2.
Actualmente, los estudios de nutrigenética y nutrigenómica cobran especial relevancia en el ámbito de la nueva medicina de precisión 3. En esta nueva era de avance hacia la medicina de precisión, se propone adaptar las medidas preventivas y los tratamientos a las características particulares del individuo para optimizarlos más en lugar de aplicar la estrategia general de utilizar la misma recomendación para todos 3.
Entre los parámetros que se pretenden evaluar para adaptar las recomendaciones a las características del individuo, destacan los nuevos marcadores ómicos. Estos nuevos marcadores tanto genómicos como epigenómicos, transcriptómicos, metabolómicos y metagenómicos proporcionan información nueva y complementaria a las determinaciones clásicas. Para la aplicación de estos marcadores a la medicina de precisión todavía son necesarios más estudios, ya que se encuentran en una fase todavía preliminar de investigación.
Por analogía a la medicina de precisión, ha surgido el concepto de "nutrición de precisión" 4, que sería la disciplina que tendría en cuenta las características diferenciales del individuo (incluyendo marcadores ómicos) para aconsejar la mejor dieta para prevenir o tratar la enfermedad. Para la aplicación de la nutrición de precisión son necesarios los resultados de estudios previos de investigación en los que se analicen los datos ómicos y la dieta para evaluar su influencia en los distintos estados de salud-enfermedad. En este sentido, son necesarios estudios nutrigenéticos y nutrigenómicos previos que generen un conocimiento que proporcione un nivel suficiente de evidencia para su aplicación práctica 5.
A pesar de que desde los años noventa están realizándose muchos estudios de genómica nutricional, los resultados de dichos estudios son, en general, poco consistentes y es necesario aumentar el nivel de evidencia 5. A ello ha contribuido la gran heterogeneidad de diseños epidemiológicos y de poblaciones analizadas, así como la ausencia de estandarización en las variables principales a analizar y la gran complejidad de la dieta 4.
La dieta puede considerarse como un exposoma complejo en el que forman parte alimentos, nutrientes, componentes no nutritivos de los alimentos, grupos de alimentos, patrones de dieta, formas de cocción, tiempo en el que se ingieren las comidas, número de comidas al día, etc. Por ello, no es extraño que los estudios de interacción gen-dieta realizados tengan un nivel de replicación bajo que limita su aplicación en nutrición de precisión. Además, muchos de ellos no han tenido en cuenta otras variables, como la edad y el sexo, que pueden ser fundamentales modulando los efectos.
Tampoco se han estudiado con detalle las modulaciones adicionales de los efectos de las interacciones gen-dieta por otras variables del estilo de vida, como la actividad física, el consumo de tabaco, el nivel socioeconómico, etc. Una vez conscientes de dicha complejidad, hay que mejorar el diseño de los estudios nutrigenéticos y nutrigenómicos para que proporcionen una información más generalizable 2.
En este sentido, más que estudiar interacciones con macronutrientes de la dieta, como ha sido una constante significativa en los últimos años, puede resultar más informativo analizar patrones completos de dieta. Entre los patrones de dieta, destaca por su especial interés la dieta mediterránea.
En este artículo revisaremos los principales estudios nutrigenéticos y nutrigenómicos que han analizado las ómicas y la dieta mediterránea en varios fenotipos de salud-enfermedad y comentaremos también las implicaciones que pueden tener estos resultados para aportar una nueva visión a la gastronomía.
DIETA MEDITERRÁNEA
La dieta mediterránea como patrón de consumo de alimentos típicos de los países del litoral mediterráneo tiene muchas definiciones. Varios artículos han revisado con detalle este concepto y sus características 6,7,8,9, y no es nuestro objetivo entrar en los detalles de estas diferencias. En general, el patrón de dieta mediterránea según algunos autores 10 se caracteriza por: a) un alto consumo de verduras, frutas, cereales, legumbres y frutos secos; b) un consumo relativamente alto en grasas no saturadas, principalmente aportadas por el aceite de oliva; c) un consumo moderado-alto de pescado; d) aves de corral y productos lácteos consumidos en cantidades moderadas; e) un bajo consumo de carnes rojas y productos cárnicos derivados; y f) un consumo moderado de alcohol, generalmente vino tinto. Es precisamente este punto de la inclusión o no del consumo moderado de alcohol en la definición de la dieta mediterránea el más conflictivo 11,12, ya que, debido a los riesgos que puede tener su consumo, sería mejor mantenerlo al margen de la definición de este patrón alimentario.
Para tratar de medir la adherencia al patrón de dieta mediterránea, varios investigadores, a través de preguntas o de la recopilación de información sobre alimentos o nutrientes típicos de la dieta mediterránea, han desarrollado índices o escalas que permiten obtener una puntuación que nos da información sobre si la persona sigue más o menos una dieta mediterránea.
Existen varios tipos de escalas con distinto cálculo y distinta complejidad, que, a su vez, añaden una nueva heterogeneidad en la medición del concepto "dieta mediterránea". Entre estas escalas destaca la propuesta por Trichopoulou y cols. en 1995 13, que posteriormente fue actualizada por el mismo grupo 14. Este índice, también llamado t-MED, tiene en cuenta nueve componentes de dieta mediterránea. En lugar de establecer varios valores fijos de la ingesta de alimentos y nutrientes como puntos de corte, utiliza medianas poblacionales específicas del sexo como los respectivos puntos de corte para cada componente. Se consideran seis componentes beneficiosos: alto consumo de verduras, frutas y frutos secos, legumbres, cereales sin procesar, pescado y una alta proporción de ácidos grasos monoinsaturados en relación a los ácidos grasos saturados. Además, hay dos componentes que se consideran dañinos y se califican de forma inversa: la carne y sus productos derivados. El alcohol es el último componente de la escala, en la que se otorga un punto para el consumo moderado de alcohol y cero puntos tanto para un consumo alto como para un consumo nulo. Una puntuación de nueve puntos representaría la mayor adherencia a la dieta mediterránea.
La mayor limitación de esta escala es que no representa un instrumento independiente, administrado por sí mismo, ya que es necesario conocer la ingesta total de la dieta y de alcohol para poder derivar el aporte de los ácidos grasos que se utilizan en el cociente.
El mismo grupo ha seguido modificando este índice con publicaciones posteriores que perfilaban las puntuaciones y los alimentos incluidos, pero en general ha seguido la misma línea de complejidad en su cálculo 15, a pesar de lo cual estos índices, en sus distintas versiones, han sido ampliamente utilizados en varias poblaciones para medir la adherencia a la dieta mediterránea.
Sin embargo, otros autores han desarrollado escalas más sencillas para simplificar los cálculos 8,16,17. Entre ellas, destaca por su rapidez, facilidad de administración y validez la escala de 14 puntos de adherencia a dieta mediterránea diseñada por los investigadores del estudio Prevención con dieta mediterránea (Predimed).
Esta escala 17 consta de 14 preguntas sobre consumo o no de alimentos típicos de la dieta mediterránea. Cuando el consumo del ítem correspondiente se adapta a la definición de dieta mediterránea, se puntúa con un uno; si el consumo no es el típico, se puntúa con un cero. En total, la máxima adherencia a la dieta mediterránea serían 14 puntos, y la mínima, cero puntos. No es necesario obtener datos de energía total, grasa consumida o alcohol total en la dieta para elaborar este índice, lo que contribuye a su facilidad de administración y a que ya haya sido validado en otros países 18.
Pueden encontrarse más detalles sobre las preguntas incluidas en la escala y su validación en la bibliografía 17.
EFECTOS DE LA DIETA MEDITERRÁNEA SOBRE LA SALUD E INTERACCIONES GEN-DIETA
En general, y a pesar de las limitaciones que genera la heterogeneidad en su definición, una mayor adherencia a la dieta mediterránea se ha relacionado con protección frente a distintas enfermedades, en particular frente a las enfermedades cardiovasculares 19,20. Integrando múltiples estudios individuales para aumentar el tamaño de muestra al examinar los efectos de la dieta mediterránea, de manera global podemos referirnos a un reciente metaanálisis 21, incluyendo 13 metaanálisis de estudios observacionales y 16 metaanálisis de ensayos de intervención con dieta mediterránea, en los que se ha analizado en total a unas 12. 800.000 personas y 37 fenotipos de salud. Este meta-análisis encontró que una mayor adherencia a la dieta mediterránea se asociaba en general con mayor protección frente a muchas de las enfermedades analizadas, en particular frente al total de enfermedades cardiovasculares, infarto de miocardio, enfermedad coronaria, diabetes, incidencia global de cáncer y mortalidad total.
Para muchas de estas enfermedades y sus fenotipos intermedios, como concentraciones plasmáticas de lípidos, glucemia en ayunas, marcadores de inflamación, obesidad, etc., se han descrito varios genes y variantes genéticas que pueden ser relevantes, y que aumentan el riesgo de enfermedad de las personas portadoras de los alelos de riesgo 22,23,24,25. Por lo tanto, en el marco de la nueva nutrición de precisión es necesario disponer de datos sobre si los efectos de la dieta mediterránea son iguales para todos los individuos o existen determinados grupos que en función de sus variantes genéticas pueden tener un mayor o menor efecto protector de la dieta mediterránea para distintas enfermedades, incluyendo las alteraciones del metabolismo lipídico, enfermedades cardiovasculares, neurodegenerativas, obesidad, diabetes, determinados tipos de cáncer, etc. La mayoría de estos interrogantes todavía necesitan ser resueltos en estudios nutrigenéticos y nutrigenómicos en curso o en futura realización.
Aún son escasos los resultados que proceden de estudios en los que se hayan examinado interacciones gen-dieta con el patrón de dieta mediterránea, por lo que es necesario proseguir las investigaciones tanto con diseños observacionales como con estudios de intervención dietética con dieta mediterránea.
A pesar de que el nivel de evidencia todavía es bajo, sí que disponemos de resultados de estudios preliminares que han mostrado que una mayor adherencia a la dieta mediterránea puede contrarrestar un mayor riesgo genético de fenotipo de enfermedad (tanto intermedios como finales) en distintos diseños de estudios epidemiológicos 26.
A modo de ejemplo, comentaremos algunas de las interacciones gen-dieta mediterránea que de manera pionera describió nuestro grupo de investigación, ya que revisar con detalle cada uno de los estudios publicados escapa de los objetivos de este trabajo.
INTERACCIONES GEN-ADHERENCIA A LA DIETA MEDITERRÁNEA DETERMINANDO DISTINTOS FENOTIPOS
Para medir la adherencia a la dieta mediterránea, hemos utilizado la escala de 14 puntos del estudio Predimed 17. Los participantes que se han analizado para medir su adherencia a la dieta mediterránea, sus variantes genéticas y sus fenotipos de riesgo cardiovascular son los más de 7000 participantes del estudio en la visita basal de los que se disponía de muestra para el análisis de laboratorio y de las demás variables. Las interacciones gen-dieta mediterránea en las que nos centraremos serán dos de las más relevantes, que se detallan seguidamente:
INTERACCIÓN CON LOS POLIMORFISMOS EN LOS GENES FTO (FAT MASS AND OBESITY) Y MC4R (MELANOCORTIN 4 RECEPTOR) DETERMINANDO EL RIESGO DE DIABETES
Los genes FTO y MC4R se consideran unos de los principales loci asociados con la obesidad común 22. Paralelamente, algunos estudios relacionaron también estos genes con un mayor riesgo de diabetes. Teniendo en cuenta la gran asociación que existe entre obesidad y diabetes, no estaba claro si estos genes incrementaban el riesgo de diabetes por mecanismos propios o era un efecto secundario a su asociación con la obesidad. En algunos estudios, la asociación con el riesgo de diabetes desaparecía tras controlar por obesidad, mientras que en otros se mantenía, aunque también existían estudios en los que no se asociaban con diabetes.
A pesar del gran número de estudios que se habían realizado para conocer la asociación de las principales variantes genéticas en dichos genes (FTO rs9939609 y MC4R-rs17782313) y el riesgo de diabetes, ninguno de ellos había examinado la modulación por la dieta. Nuestro estudio 27 fue el primero que investigó la influencia de la dieta mediterránea en los efectos de sus alelos de riesgo en diabetes tipo 2. Para ello, analizamos 7.052 participantes en el estudio Predimed a nivel basal utilizando una aproximación de casos y controles (3.430 casos de diabetes tipo 2 y 3.622 sujetos no diabéticos). Se consideraron dos grupos de adherencia a dieta mediterránea según la escala de 14-ítems Predimed 17 y la media de la población. Así, se consideró baja adherencia una puntuación inferior a 9 puntos y alta adherencia, una puntuación mayor o igual a 9 puntos. Se utilizaron modelos de ajuste multivariante que se ajustaron también por índice de masa corporal (IMC). Los polimorfismos se analizaron de manera independiente y también de manera combinada mediante el sumatorio de sus alelos de riesgo en forma de puntuación de riesgo genético, más conocida por sus siglas en inglés (GRS, Genetic Risk Score).
Para cada polimorfismo por separado, y también para su puntuación agregada, se observaron interacciones gen-dieta estadísticamente significativas (Tabla I). En una situación de baja adherencia a la dieta mediterránea, la variante alélica de riesgo de diabetes se asociaba significativamente con un mayor riesgo de diabetes. Sin embargo, la misma variante genética de riesgo, tanto del gen FTO como del MC4R o su combinación, perdía la asociación con un mayor riesgo de diabetes cuando la adherencia a la dieta mediterránea era alta.
Tabla I. Asociación entre los polimorfismos en los genes FTO, MC4R y la puntuación combinada (GRS de ambos) y diabetes tipo 2 en participantes del estudio Predimed
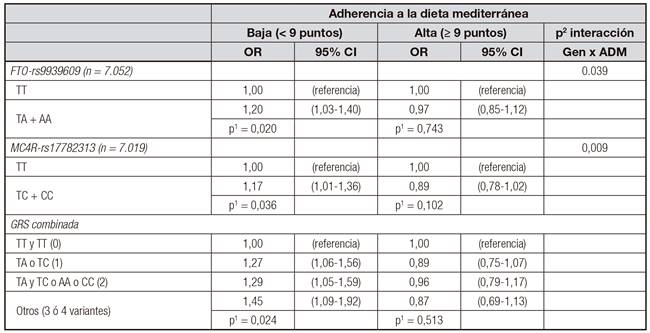
Análisis de regresión logística estratificado multivariante* según la adherencia a la dieta mediterránea (ADM).
*:Modelos ajustados por sexo, edad, centro, consumo total de energía, actividad física e IMC.
p1:valor p obtenido para el efecto global del polimorfismo en los modelos de regresión logística multivariante.
p2:valor de p para el término de interacción entre adherencia a la dieta mediterránea y el polimorfismo correspondiente en el modelo de regresión logística.
GRS: Genetic Risc Score (puntuación de riesgo genético).
Tabla adaptada de referencia (27).
Estos resultados fueron muy relevantes en su día y todavía están investigándose los mecanismos por los que esta interacción puede tener lugar. Nuestra hipótesis inicial estaba centrada en el alto contenido en folato de la dieta mediterránea y su capacidad de actuar epigenéticamente en el gen FTO y MC4R induciendo metilaciones que alterarían su nivel de expresión 27. Sin embargo, esta hipótesis está todavía por confirmar.
INTERACCIÓN CON EL POLIMORFISMO MLXIPL (MAX-LIKE PROTEIN X INTERACTING PROTEIN-LIKE) DETERMINANDO EL RIESGO DE HIPERTRIGLICERIDEMIA
La hipertrigliceridemia es un factor de riesgo de enfermedad cardiovascular y a ella contribuyen tanto factores genéticos como ambientales.
Nuestro grupo de investigación participó en un estudio de asociación de genoma completo, más conocido por sus siglas en inglés (GWAS), en el que propusimos el gen MLXIPL como un nuevo gen asociado con las concentraciones de triglicéridos en humanos 28. Este gen codifica la proteína de unión del elemento de respuesta a los carbohidratos (ChREBP). En nuestro GWAS, el polimorfismo que estudiamos fue el rs17145738. Posteriormente, se descubrió una variante funcional en dicho gen, que consiste en un cambio de aminoácido (el polimorfismo rs3812316, C771G, cambio de aminoácido Gln241His). La variante alélica menor estaría asociada con una menor funcionalidad del gen y menores concentraciones de triglicéridos plasmáticos, de manera consistente con lo observado en ratones deficientes en ChREBP.
Con el objetivo de analizar la influencia del polimorfismo rs3812316-MLXIP en una población mediterránea de alto riesgo cardiovascular, determinamos dicho polimorfismo en 7.166 participantes (3.055 hombres y 4.111 mujeres) en el estudio Predimed de manera basal y analizamos su asociación con las concentraciones de triglicéridos, obteniendo una fuerte asociación muy significativa con menores concentraciones de triglicéridos en los portadores del alelo menor (p = 5,5 × 10-5) y menor hipertrigliceridemia (odds ratio, OR, 0,73; intervalo de confianza [IC] del 95%, 0,63-0,85; p = 1,4 × 10-6 en portadores G frente a CC).
Posteriormente, estudiamos el efecto de la dieta mediterránea en tal asociación. Al igual que anteriormente, se consideró alta adherencia a la dieta mediterránea cuando la puntuación en la escala de 14 ítems era igual o superior a 9 puntos. Se encontró una interacción gen-dieta estadísticamente significativa sobre la hipertrigliceridemia (p-interacción: 0,025) que se mantuvo estadísticamente significativa después del ajuste multivariante.
La alta adherencia a la dieta mediterránea permitía ver claramente el efecto protector del alelo menor contra la hipertrigliceridemia (OR, 0,63, IC 95%, 0,51-0,77; p = 8,6 × 10-6). Sin embargo, cuando la adherencia a la dieta mediterránea era baja, se perdía el efecto protector sin alcanzar la significación estadística. En la Tabla II se muestran con mayor detalle las estimaciones para dicha interacción, así como la homogeneidad del efecto en distintos estratos (como hombres y mujeres, diabéticos y no diabéticos), que añaden consistencia a la interacción.
Tabla II. Asociación entre el polimorfismo MLXIPL-rs3812316 (modelo dominante) y la hipertrigliceridemia dependiendo de la adherencia a la dieta mediterránea en los participantes Predimed y estratificado por sexo y diabetes
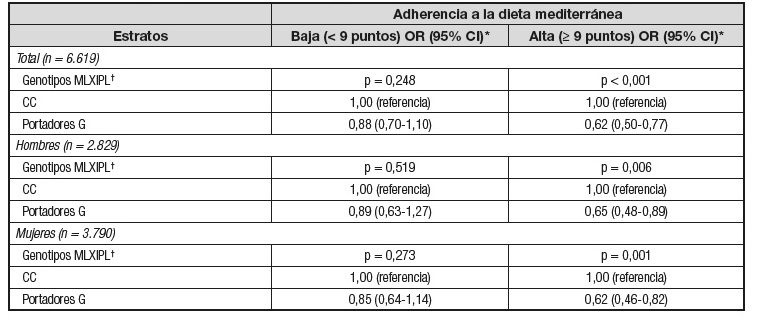

Diabéticos Tipo 2 (n = 3.189)
*OR indica odds ratio y CI, intervalo de confianza.
†Valores del modelo y p ajustados por sexo, edad, centro, diabetes, fármacos, alcohol, tabaco, actividad física y consumo total de energía.
Tabla adaptada de la referencia (29).
INTERACCIONES GEN-DIETA MEDITERRÁNEA, OTRAS ÓMICAS, BIOINFORMÁTICA Y GASTRONOMÍA
Estos dos ejemplos de interacciones gen-dieta mediterránea ponen de manifiesto cómo la mayor adherencia a la dieta mediterránea puede neutralizar un mayor riesgo genético de diabetes tipo 2 en el caso de polimorfismos en los genes FTO y MC4R 27 o ser necesaria para que una variante genética ejerza su efecto protector frente a la hipertrigliceridemia en el caso del gen MLXIPL 29. Otras ómicas son necesarias para caracterizar los mecanismos moleculares que subyacen en estos efectos.
Sabemos que la dieta mediterránea influye en la expresión de genes, haciendo que se exprese más un perfil de genes más antiinflamatorios en células circulantes, tal como pudimos comprobar después de tres meses de intervención en una submuestra de participantes en el estudio Predimed en un análisis de transcriptoma completo 30. Aunque no disponemos de datos todavía para estos participantes, posiblemente en estos efectos influyan también mecanismos epigenómicos, como cambios de metilaciones en el ADN, modificación de histonas o regulación de ARN no codificantes, fundamentalmente los denominados microARN, que son unos ARN de muy pequeño tamaño (unas 20-25 pb) y que son capaces de influir en la expresión de genes uniéndose al ARN mensajero complementario 31,32. Paralelamente, la metabolómica 33 puede proporcionarnos información adicional de los perfiles de metabolitos que se generan con una mayor o menor adherencia a la dieta mediterránea en personas con las variantes alélicas para los polimorfismos estudiados, contribuyendo así a aumentar el conocimiento de la observación nutrigenética inicial.
Con la integración de varias ómicas, los conocimientos que deriven sobre los efectos de la dieta mediterránea serán más completos, tal como propusimos para explicar los efectos de otra interacción observada entre la dieta mediterránea y el polimorfismo en el gen TCF7L2 en las concentraciones plasmáticas de glucosa y otros fenotipos cardiovasculares 34. En los próximos años asistiremos a nuevos hallazgos de interacciones entre el genoma y la dieta mediterránea determinando distintos fenotipos. Estas interacciones implicarán el uso de decenas o centenares de variantes genéticas agrupadas en forma de puntuaciones de riesgo genético para analizar su contribución conjunta, ya que el coste del genotipado será progresivamente menor y la tecnología nos permite analizar centenares de miles o millones de variantes genéticas en los chips de genotipado al mismo tiempo que está extendiéndose el uso de la secuenciación de nueva generación 35. Todo ello contribuirá a que sea necesario utilizar modelos computacionales avanzados para poder analizar e integrar toda la información generada, al mismo tiempo que serán necesarios conocimientos bioinformáticos más especializados, tanto para comprender mejor las rutas metabólicas mecanísticamente implicadas como para poder gestionar el conocimiento generado y sus aplicaciones prácticas 36,37.
En estas aplicaciones prácticas de las recomendaciones más personalizadas para prevenir o tratar la enfermedad según el genoma y otras ómicas, será muy relevante la gastronomía, entendida como la práctica en el arte de elegir, cocinar y comer los alimentos, ya que ayudará a que cada persona pueda seguir mejor la dieta más específica según sus variantes genéticas para modular el riesgo de enfermedad. Por ejemplo, en el caso de personas con las variantes alélicas de los genes FTO, MC4R y MLXIPL, los resultados de nuestros estudios parecen indicar que su riesgo de diabetes y de hipertrigliceridemia será menor con una mayor adherencia a la dieta mediterránea 27,29.
La gastronomía puede ayudar a seleccionar los mejores alimentos y a combinarlos en platos más personalizados, cocinándolos de la manera más adecuada para conseguir el máximo patrón de dieta mediterránea en menús personalizados para favorecer el cumplimiento de la adherencia. Esto requiere una gran capacidad de innovación para adaptarse a esta y a otras personalizaciones, pero también es una excelente oportunidad 38, ya que no solo hay que entender la nutrición de precisión para prevenir o tratar la enfermedad, sino también desde un punto de vista más holístico, centrada en la salud positiva. La nutrición de precisión puede tener aplicaciones importantes para retrasar el envejecimiento 39 o mejorar la calidad de vida, ya que los resultados de varios estudios ómicos están aportando datos para su aplicación en este sentido.
DISFRUTANDO EL SABOR: OTRO COMPONENTE EN LA NUTRICIÓN DE PRECISIÓN Y GASTRONOMÍA
Para finalizar, y siendo conscientes de las limitaciones de espacio, no queremos dejar de mencionar la relación entre genómica y percepción del sabor 40. Esto condiciona que unas personas perciban mejor unos sabores que otros y que se inclinen por el consumo preferente de determinados alimentos 41. A la vez, puede condicionar que pueda disfrutarse más de las experiencias gastronómicas si están más adaptadas a las características sensoriales de cada persona, un punto también importante y que hay que tener en cuenta en el diseño de dietas en la nutrición de precisión.
Se sabe que la elección de alimentos está determinada por necesidades nutritivas y psicológicas, además de por influencies socioculturales, como las propias experiencias individuales, el coste de los alimentos o la percepción de los beneficios para la salud. Pero algunas personas no valoran tanto el hecho de comer sano, sino que una de las propiedades más importantes a la hora de elegir un alimento son las características organolépticas, fundamentalmente el sabor.
Los sabores actualmente reconocidos son dulce, salado, amargo, ácido y umami, y se estudia la aceptación del sabor graso. De manera importante, se sabe que no todas las personas perciben cada sabor de la misma manera. Existe una gran variabilidad poblacional que se asemeja a una función gaussiana, con un porcentaje importante de población que no es capaz de percibir un sabor en una concentración que la mayoría de la población lo percibe, y otro porcentaje que lo percibe de manera extrema a la misma concentración.
Estas variaciones en la percepción del sabor han sido asociadas al rechazo o la preferencia por los alimentos consumidos. Así, es muy conocida la relación entre una mayor percepción de sabor amargo y el rechazo a los alimentos amargos, como endivias, brócoli, espinacas, acelgas, aceite de oliva con muchos polifenoles, etc. 42,43; en este caso, todos ellos alimentos clave de la dieta mediterránea. También se ha descrito una relación entre la mayor o menor percepción del sabor umami (denominado el quinto sabor o sabor sabroso) y el consumo de carnes, quesos curados, champiñones, tomates y otras verduras que poseen este sabor 44, así como relaciones entre la capacidad de percibir el sabor dulce con el consumo de azúcares, hábitos de comida compulsivos, etc. 45.
En la actualidad, esta es un área de especial desarrollo y de especial interés en nutrición de precisión. Sin embargo, una limitación es que los estudios que realizan tests de percepción del sabor suelen hacerse con pocos participantes, ya que la medida de la percepción del sabor requiere catar un número importante de sustancias a distintas concentraciones y la valoración de la percepción del sabor en escalas específicas, lo que dificulta su realización en los grandes estudios epidemiológicos. Para paliar esta limitación, y teniendo en cuenta que la percepción de los sabores se sabe que tiene un importante componente genético 40,41,46, están estudiándose polimorfismos en distintos genes como indicadores de la percepción del sabor a través de los denominados estudios de randomización mendeliana 41.
Los genes que mejor se conocen son los que determinan la percepción del sabor amargo 40. Para los otros sabores, todavía hay que investigar más, y nuestro grupo está realizando estudios de asociación de genoma completo para descubrir nuevos genes relacionados, ya que no existen prácticamente estudios de este tipo. En los próximos años, asistiremos a nuevas identificaciones y avances en la genética y epigenética del sabor.
Aunque no es el objetivo de esta revisión profundizar en los genes hasta ahora conocidos relacionados con la percepción de los distintos sabores, sí que nombraremos los más caracterizados. El gen TAS2R38 es el más importante explicando la variabilidad en la percepción del sabor amargo 40. Se han sido identificado tres polimorfismos del gen TAS2R38 localizados en los pares de bases 145 (C G), 785 (C T) y 886 (C T), dando como resultado sustituciones de 3 aminoácidos en los codones P49A (prolina alanina), A262V (alanina valina) y V296I (valina isoleucina). Estas 3 variaciones son heredadas, dando lugar a la versión catadora PAV (prolina, alanina, valina) o a la no catadora AVI (alanina, valina, isoleucina) del sabor amargo.
El sabor dulce tiene una genética más compleja y el porcentaje de variabilidad explicado todavía es bajo. Se sabe que el sabor dulce es mediado por un dímero formado por los genes TAS1R2 + TAS1R3. Uno de los polimorfismos más relevantes es el TAS1R2-rs35874116 (Ile191Val) 41. Para el sabor umami se han descrito varios polimorfismos relevantes en los genes TAS1R1 y TAS1R3 46. Los genes que determinan la percepción de los sabores salado y ácido son los menos conocidos 40.
La importancia de la percepción del sabor radica en que puede actuarse sobre ella y modificar los platos para conseguir aceptación de determinados alimentos. Así, se ha comprobado que puede reducirse el consumo de carne roja (y, por tanto, aumentar el nivel de adherencia a la dieta mediterránea) añadiendo una cantidad importante de champiñones al plato, ya que estos vegetales son ricos en sabor umami, que es el sabor típico que también se percibe en la carne 47.
Paralelamente, mediante la combinación de técnicas de cocinado y de la utilización de las especias más adecuadas, puede disminuirse la percepción del sabor amargo de algunas verduras (como espinacas, acelgas, brócoli, endivias...), favoreciendo su mayor aceptación y consumo, tal como ha concluido un reciente estudio realizado en Estados Unidos 48, en el que testaban la aceptación de distintas verduras sin sazonar y sazonadas con las especias adecuadas para mejorar su sabor.
Conociendo mejor las bases genéticas de la percepción de los distintos sabores podremos entender mejor las preferencias alimentarias y el rechazo a comer distintos tipos de alimentos. Por su parte, la gastronomía puede ayudar a mejorar el consumo de los alimentos más saludables haciéndolos más apetecibles para cada persona según su percepción del sabor, e incluso del olor y de las texturas. Un ejemplo de estas actuaciones basadas en el sabor es la corriente que existe actualmente en Estados Unidos denominada Flexitarian Flip(tm) 49, que consiste en intentar que la población consuma más verduras pasando de una alimentación muy rica en productos cárnicos a otra alimentación más rica en verduras. Para ello tienen en cuenta las preferencias de sabor de las personas y adaptan los platos combinando carnes con gran cantidad de verduras con los sabores preferidos por el consumidor, mejorando así el consumo de estos platos combinados y personalizados para cada persona, que, a su vez, contribuyen a aumentar el consumo de verduras y a disminuir el consumo de carnes, consiguiendo una alimentación un poco más saludable.
CONCLUSIONES
La nutrigenética y la nutrigenómica han contribuido al conocimiento de las diferencias interindividuales a la respuesta a la dieta, así como a conocer que la dieta en general y la dieta mediterránea en particular pueden contrarrestar la susceptibilidad genética al mayor riesgo de enfermedad. En general, una mayor adherencia a la dieta mediterránea se ha mostrado positiva para disminuir el riesgo de obesidad, dislipemias, diabetes y otros factores cardiovasculares de riesgo en los estudios iniciales. Sin embargo, todavía son necesarios más estudios en los que se integren varias ómicas para trasladar estos resultados de investigación a su aplicación en nutrición de precisión.
Teniendo en cuenta que las preferencias de la persona van a ser muy relevantes en la nutrición personalizada, y que la percepción del sabor condiciona mucho los alimentos consumidos, son necesarios más estudios sobre la genética de la percepción del sabor y sobre cómo la gastronomía, a través de distintas formas de cocinado, empleo de especias y otras tecnologías culinarias, puede mejorar la percepción del sabor de los alimentos, que se incremente el consumo de verduras y, en general, el de otros alimentos del patrón mediterráneo saludable en personas que lo precisen por sus particularidades características genéticas, contribuyendo también a aumentar el placer y el disfrute de la comida.














