Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.22 no.7 jul. 2005
| Manejo del paciente diabético hospitalizado M. C. CARREÑO HERNÁNDEZ, J. SABÁN RUIZ1, A. FERNÁNDEZ BALLESTEROS2, Hospital Puerta de Hierro. 1Hospital Ramón y Cajal. 2Hospital Severo Ochoa. Leganés (Madrid).
|
Carreño Hernández MC, Bustamante Fermosel A, Fernández Ballesteros A, García Polo I, Guillén Camargo V, López Rodríguez M, Sabán Ruiz J, Sánchez Ramos JA. Manejo del paciente diabético hospitalizado. An Med Interna (Madrid) 2005; 22: 339-348.
Trabajo aceptado: 4 de abril de 2005
Correspondencia: María Cruz Carreño Hernández. Hospital Puerta de Hierro. C/ San Martín de Porres, 4. 28035 Madrid
INTRODUCCIÓN
El paciente diabético representa un 30-40% de los pacientes atendidos en los Servicios de Urgencias Hospitalarios y un 25% de los hospitalizados, tanto en las áreas médicas como quirúrgicas. Un 50% de ellos no sabe que es diabético. De los que conocen su enfermedad sólo un 10-20% están en revisión periódica por la misma y dispone de al menos una hemoglobina glicosilada realizada en el último año, y una minoría (< 10%) ha recibido una educación diabetológica supervisada. En una mayoría de los casos, la causa del ingreso no es la diabetes sino otra enfermedad intercurrente y, frecuentemente, la diabetes es descompensada por el tratamiento de la misma. De esta forma, el paciente diabético que acude al hospital no llega en las mejores condiciones posibles y lo recibimos infradiagnosticado o con mal control previo, y en los infrecuentes casos en los que estaba bien, se ha descompensado por un proceso agudo y/o por la medicación del mismo.
La problemática del paciente diabético ingresado en un gran hospital no se parece en nada a la de hace 20 años. Ha cambiado la enfermedad, el enfermo y se diría que hasta ha cambiado el médico. Los criterios diagnósticos han sido reiteradamente modificados (1-3) (Tabla I) y el tratamiento ha adquirido tal complejidad que sólo una minoría de médicos se siente cómodo en el manejo de todos los grupos de antidiabéticos orales, insulinas, o su combinación (4); el enfermo es más mayor y con más peso; en un porcentaje muy alto cumple los criterios de síndrome metabólico y además con frecuencia es portador de una enfermedad crónica, relacionada o no con la diabetes. Ingresa por un episodio agudo, generalmente infección, insuficiencia cardiaca o ambos, y para mayor dificultad en su manejo "no come", ¿se puede pedir más? En relación con el tipo de médico, el médico internista de un hospital, ya sea grande o pequeño, ha sido injustamente postergado por las otras especialidades médicas durante años, pero en este campo se siente cada vez más útil por tratarse de un enfermo complejo en el cual, la diabetes y las otras enfermedades del paciente se interfieren recíprocamente y el éxito del control metabólico va a depender del manejo integral del mismo. Por otra parte, sólo un buen control garantizará la evolución satisfactoria de una neumonía, insuficiencia cardiaca, sepsis urinaria, infarto de miocardio, etc., por no hablar del éxito quirúrgico.
En referencia a la práctica diabetológica en los pacientes ingresados ¿se están haciendo bien las cosas? ¿Los valoramos correctamente? ¿Estamos aplicando en nuestros enfermos las novedades farmacológicas? ¿Nos preocupamos del seguimiento a su alta, bien por nosotros mismos o remitiéndolos al médico de atención primaria con las recomendaciones más actuales sobre su manejo?
¿Por qué una guía realizada por médicos internistas aquí y ahora?: muchas son las razones que han llevado a este grupo de trabajo, integrado por profesionales de todos los hospitales de Madrid, a desarrollar una nueva guía sin renunciar a su esencia, el enfermo como un todo y la preocupación por una medicina integral que gradúa los problemas y los resuelve en su globalidad. Tras unas jornadas de autocrítica el grupo de trabajo ha entendido que se daban las razones necesarias para su desarrollo y puesta en marcha. Entre dichas razones destacamos la falta de una guía práctica pensada para el enfermo hospitalizado, en su mayoría perfiladas para situaciones de Urgencias o para el seguimiento ambulatorio, la necesidad de unificar estrategias terapéuticas, la falta de incorporación de los nuevos tratamientos al manejo del enfermo en guías previas, la posibilidad de colaborar en protocolos específicos que mejoren la asistencia al paciente diabético. Finalmente, entendemos que el principal beneficiado de la guía va a ser el propio paciente diabético, que sin duda, va a estar a partir de ahora mejor tratado y de una forma colegiada y consensuada.
MOTIVOS DE INGRESO Y EVALUACIÓN GLOBAL DEL PACIENTE DIABÉTICO
Es difícil contemplar todos los posibles escenarios del paciente diabético que ingresa en un hospital. De entrada, nos podemos encontrar con un paciente que no sabía que era diabético en el momento de ingresar y que durante su ingreso se llega a confirmar el diagnóstico. O bien recibir a un enfermo, que ya conocía que era diabético, tipo 1 ó 2, y recibía o no tratamiento para esta enfermedad.
A grandes rasgos, las causas de ingreso pueden estar relacionadas con la propia enfermedad, por otras enfermedades médicas y por patología quirúrgica, electiva o de urgencia (Tabla II). En ese momento del ingreso, es imprescindible realizar una valoración adecuada de la diabetes del paciente tanto del control metabólico de la misma como de la repercusión en órganos diana. En ocasiones parte de esta evaluación se realiza en urgencias, pero, en función de la causa del ingreso del paciente, se puede realizar con más tiempo una vez que el paciente ya ha sido ingresado en planta.
En el momento del ingreso el paciente diabético se puede encontrar fundamentalmente en dos situaciones: con su diabetes descompensada o compensada. Si está descompensada hay que averiguar la causa desencadenante de la descompensación, siendo las infecciones al ingreso la causa más frecuente seguida del incumplimiento u omisión del tratamiento, ausencia del mismo (debut diabético), situaciones de estrés (infarto de miocardio, pancreatitis aguda, cirugía, traumatismo, accidente cerebro-vascular, etc.), ingesta de tóxicos (etanol), uso de fármacos como esteroides, diuréticos, etc. Por otra parte, el paciente con un adecuado control clínico-metabólico suele ingresar por otro motivo como una intervención quirúrgica programada o realización de pruebas diagnósticas.
Es importante conocer el tiempo de evolución de la enfermedad y el tipo de diabetes que padece el enfermo, que fundamentalmente pueden ser la diabetes tipo 1, la diabetes tipo 2, otros tipos de diabetes específicas (síndrome de Cushing, la inducida por fármacos o productos químicos, etc.) y la diabetes gestacional. Hay que evaluar el tratamiento que el paciente recibía y su grado de cumplimiento en cuanto al conocimiento de su enfermedad (educación diabetológica), control dietético, práctica de ejercicio físico y el tipo de medicación o combinación de los mismos.
En primer lugar se ha de tener en cuenta la presencia de complicaciones metabólicas agudas como: cetoacidosis diabética, estado hiperosmolar no cetósico, hipoglucemias y acidosis láctica. En ausencia de las mismas, se debe analizar el grado de control y/o compensación del paciente diabético teniendo en cuenta la valoración de su estado físico y psíquico. Es importante reseñar la presencia de síntomas o signos que indiquen un mal control de la diabetes. Hay que interrogar sobre el hábito tabáquico, alcohólico y tipo de actividad física, así como los antecedentes de factores de riesgo cardiovascular conocidos, como la hipertensión arterial, dislipemia, obesidad, e historia familiar de enfermedad cardiovascular prematura. En la exploración hay que reseñar la talla, el peso, el IMC, el perímetro de cintura, presión arterial, frecuencia cardiaca, frecuencia respiratoria y temperatura. Dentro de las determinaciones analíticas es imprescindible realizar el perfil glucémico, fundamentalmente glucemia basal y glucemia post-prandial a distintas horas, el perfil lipídico, evaluación de la función renal con iones, creatinina, aclaramiento de creatinina y elemental de orina (proteinuria, cetonuria, glucosuria, nitritos, alteraciones del sedimento), microalbuminuria y el valor de hemoglobina glicada (HbA1c). Ocasionalmente hay que realizar una gasometría basal arterial si el paciente está descompensado (valoración acidosis) o presenta patología cardio-respiratoria. Además de los factores de riesgo cardiovascular ya mencionados, hay que evaluar la repercusión orgánica de la diabetes. El paciente diabético puede presentar complicaciones crónicas vasculares y neurológicas que afectan a muchos sistemas orgánicos. Las complicaciones crónicas se pueden clasificar en vasculares y no vasculares. A su vez las complicaciones vasculares se subdividen en microvasculares y macrovasculares. Al primer grupo pertenece la retinopatía, que es la primera causa de ceguera en EE.UU., consecuencia de la retinopatía progresiva y del edema macular clínicamente importante, por lo que el examen del fondo de ojo es necesario. La nefropatía diabética es la primera causa de insuficiencia renal terminal, y una de las primeras causas de morbimortalidad relacionada con la diabetes mellitus. Es muy importante detectar precozmente la microalbuminuria, análisis obligado en la valoración de un paciente diabético. La neuropatía puede afectar al sistema nervioso somático y autónomo. Se manifiesta en forma de polineuropatía o mononeuropatía somática, así como neuropatía autonómica. Dentro de las complicaciones macrovasculares (ateroesclerosis) hay que evaluar la posible repercusión cardiaca, especialmente en las coronarias con datos de cardiopatía isquémica o insuficiencia cardiaca. Por ello siempre se debe realizar un electrocardiograma y una Rx de tórax y, en casos seleccionados, determinación de CPK o troponina o ecocardiograma. En el territorio vascular periférico (fundamentalmente en miembros inferiores) puede producir arteriopatía con dolor, claudicación intermitente y necrosis o gangrena. El índice de tobillo-brazo es útil para evaluar la presencia de lesión periférica en ausencia de síntomas (≥ a 0,9). En el sistema carotídeo y basilar puede producir cuadros isquémicos cerebrales agudos y crónicos. No está indicado hacer ningún tipo de estudio, salvo que existan síntomas o se incluya en algún tipo de estudio.
TRATAMIENTO INICIAL DEL DIABÉTICO INGRESADO EN MEDICINA INTERNA
Con respecto al control de la glucemia el objetivo es de sobra conocido: mantener una glucemia que evite la cetosis, con la intención de obtener una glucemia preprandial de 110 mg/dl o postprandial de 180 mg/dl, evitando la aparición de hipoglucemias (5).
Uno de los pilares del tratamiento del diabético es un control dietético adecuado, pero en el momento del ingreso nos podemos encontrar ante 2 situaciones distintas. La primera es cuando el paciente se puede alimentar. En este caso hay que recordar que se debe prescribir una dieta con horario de diabético, que contenga un 55 a 60% de hidratos de carbono, preferiblemente de absorción lenta y un 10-15% de grasas (ácidos grasos monoinsaturados). Las calorías deben adecuarse a las condiciones del paciente, con un mínimo de 15 kcal/kg/día si el paciente va a estar en reposo y no tiene enfermedad inflamatoria severa; 25 kcal/kg/día si tiene un cuadro de inflamación severa (sepsis, neumonía, enfermedad que requiera cirugía, etc.); y hasta 40 kcal/kg/día si tiene un cuadro de desnutricion severa (IMC < 19). En el segundo caso y quizá una de las situaciones más habituales es cuando el paciente no tolera por vía oral.
Los antidiabéticos orales no son útiles en situaciones clínicas en las que las necesidades de insulina y el aporte de glucosa varían rápidamente (6,7). Podrían tener un papel en diabéticos tipo 2, previamente controlados, ingresados de forma programada y en los que no exista una enfermedad o alteraciones dietéticas que faciliten su descontrol. Hay que evitar las sulfonilureas por el alto riesgo de hipoglucemia prolongada, la metformina si hay insuficiencia renal o cardiaca por riesgo de acidosis, y las tiazolidindionas (glitazonas) por la retención de líquido si hay insuficiencia cardiaca, renal, hepatopatía, etc.
El control ideal y aconsejable del paciente diabético ingresado se debe llevar a cabo con insulina. Dentro de este manejo se pueden barajar distintas opciones, tanto en el tipo de insulina como en su forma de administración. Conviene, por tanto, conocer los principales tipos de insulina empleados en la actualidad, y las ventajas e inconvenientes de cada uno de ellos.
-Insulina ultrarrápida (insulina Lispro, insulina Aspart)
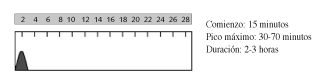
Entre sus ventajas, destacan la reducción del aumento postprandial de glucemia y la menor frecuencia de hipoglucemias. No se necesita intervalo de tiempo entre inyección e ingesta (lo que facilita la vida del paciente) y hay una menor diferencia en su absorción según punto de inyección) (10,11). Precisa administración de otras insulinas que aporten ritmo insulinémico basal.
-Insulina regular
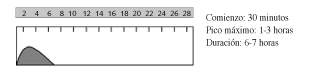
Es la única insulina que puede administrarse no sólo por vía subcutánea, sino también intravenosa, intramuscular e intraperitoneal; es la de elección en embarazadas y gestantes. Precisa la administración de otras insulinas que aporten ritmo insulinémico basal y debe administrarse 30 minutos antes de las comidas.
-Insulina intermedia (NPH)
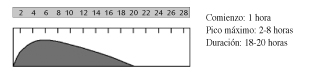
La principal ventaja de este tipo de insulina es la amplia experiencia de uso con ella y que consigue mantener niveles sanguíneos de insulina durante más tiempo que las insulinas rápidas. Sin embargo, desde la aparición de insulina glargina, se han hecho evidentes sus principales desventajas (5), como el riesgo de hipoglucemia y la ausencia de una insulinemia basal uniforme. No suele proporcionar por sí sola niveles adecuados de glucemia, sino que se debe administrar de forma conjunta con otras insulinas rápidas, o bien con antidiabéticos orales.
-Mezclas de insulina (NPH + insulina rápida o ultrarrápida)
Desde la comercialización de la insulina glargina, el uso de las mezclas de insulinas para el tratamiento intensivo de la diabetes es cada vez menor. Prácticamente, la única presentación que continúa en el mercado es la 70/30 (70% de NPH y 30% de insulina rápida). También se dispone de mezclas de NPL con el análogo Lispro o la de NPA con el análogo Aspart. Su principal ventaja es que permite en inyección única, la infusión de dos tipos de insulina. Pero, no es flexible a la hora de variar estas proporciones.
-Insulina ultralenta
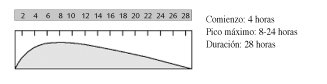
Sus características son similares a la insulina NPH, pero con una duración de acción mayor. El principal inconveniente de su uso es el riesgo de hipoglucemias. Actualmente, ha sido desplazada casi totalmente en sus indicaciones por la insulina glargina.
-Insulina glargina
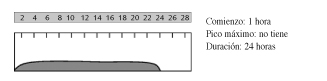
Su principal ventaja y que la distingue del resto de insulinas es que proporciona niveles basales constantes de insulina, sin causar picos de acción. Se administra cada 24 horas, a cualquier hora del día pero de forma regular, e independientemente de la ingesta. Consigue eficaz reducción de la HbA1c con mínimo riesgo de hipoglucemias. Sin embargo, al ser una insulina basal, suele ser necesaria la administración conjunta con otras insulinas rápidas, o bien, antidiabéticos orales al no cubrir de forma aislada las necesidades prandiales.
-Bombas de insulina
Se ha extendido su uso en la última década en los pacientes con diabetes tipo 1 (12). Sus puntos positivos fundamentales son que proporciona un ritmo insulínico basal uniforme, posibilidad de uso de ritmos insulínicos suplementarios, pudiendo liberalizar los horarios de las comidas y facilita un control glucémico estricto. No obstante, los problemas locales de colocación de la bomba, la dificultad del manejo por parte del paciente y la carestía del mecanismo dificultan su uso.
FORMAS DE INSULINIZACIÓN DEL PACIENTE HOSPITALIZADO
1. La insulina rápida en infusión continua (14,15): es una forma de administrar la insulina infrautilizada en la mayor parte de la plantas de Medicina Interna. Permite un excelente control, con una acción rápida y segura. Hay una serie de condiciones en la que es obligado su uso (Tabla III) y otras en las que podría ser aconsejable. Se deben utilizar siempre con suero glucosado en infusión continua. Para realizar el cálculo de las necesidades de las necesidades básales de insulina se puede considerar que es necesario 1 UI/hora o 0,02 UI/kg/hora. Si el paciente estaba previamente tratado y controlado con insulina subcutánea, se debe calcular la dosis total utilizada en las 24 horas previas al ingreso y pautar el 50% de ella en forma de infusión continua. Si el paciente estaba en dieta absoluta, con infusión de sueros, se puede calcular la dosis necesaria utilizando 1 unidad por cada 5 g de glucosa (aproximadamente 5 unidades con cada suero glucosado al 5%). Es conveniente monitorizar la glucemia cada 4 horas. En el caso en el que la glucemia no descienda hay que aumentar la infusión en un 50%. Si por el contrario la glucemia desciende por debajo de 100 mg/dL., hay que reducir la infusión un 50%. Todo ello se debe realizar con una serie de órdenes o protocolos muy sencillos para que el personal de enfermería no tenga dudas en la forma de actuar.
2. Administración de insulina subcutánea (lenta más rápida), en paciente ya controlado en casa con insulina. Tras lo comentado previamente sobre la dieta, se puede mantener la pauta de insulina que el paciente traía de casa, disminuyendo ligeramente la dosis de insulina lenta, aproximadamente un 10 a 30%, y menos o nada la insulina rápida (6,15). En esta situación es aconsejable dejar prevista una pauta de insulina rápida "de rescate o pauta deslizante", para controlar las hiperglucemias en función de los resultados de la glucemia capilar realizados.
3. Administración de insulina prolongada o intermedia más rápida (7,14-16) en pacientes que no utilizaban previamente insulina en casa. Esta es la pauta recomendada actualmente para los pacientes que ingresan y la única posible para los enfermos con diabetes tipo 1 que no sufran una descompensación insulínica o que no lleven una bomba de insulina. La insulina lenta, bien la insulina glargina o NPH proporciona la cantidad necesaria para cubrir las necesidades básales de insulina. La insulina rápida o Lispro o Aspart proporciona la necesaria para cubrir las necesidades prandiales (10,11). Para calcular las dosis de insulina requeridas el rango aconsejado es amplio es función del peso. En el caso de diabetes tipo 1 iniciaríamos la administración con 0,5-1 UI/kg/día en diabetes tipo 1 y 0,3-0,4 UI/kg/día en diabetes tipo 2 o el 80% de la cantidad de insulina en infusión que estuviese precisando o el 75% de la insulina rápida subcutánea que precisase. Una vez calculada la dosis requerida diaria de insulina hay que dividir la administración entre los dos tipos de insulina para cubrir los distintos requerimientos de insulina basal e insulina prandial. La insulina "basal" constituye el 60% de la cantidad total calculada, en forma prolongada (glargina) o en forma de insulina lenta (NPH), administradas una vez al día la glargina y 1 ó 2 veces la NPH. La insulina relacionada con la ingesta constituye el 40% de la misma. En forma de insulina rápida, preferiblemente Lispro o Aspart se administra antes de las tres comidas principales (desayuno, comida y cena).
En el caso de la insulina NPH suelen ser necesarios 2 dosis, 2/3 de la misma administrados antes del desayuno, y 1/3 antes de la cena. En los diabéticos tipo 2 también se puede intentar administrar una dosis única en el momento de acostarse. La insulina glargina, que tiene un menor riesgo de hipoglucemias que NPH, sólo requiere una sola dosis, a cualquier hora del día, manteniendo ese horario y variando la dosis en función de la glucemia basal. Si se administra insulina rápida se debe inyectar 30 minutos antes de las comidas, mientras que los análogos de insulina se pueden administrar inmediatamente antes de la ingesta.
Si el paciente estaba con insulina i.v. en perfusión: calcular la dosis diaria de las últimas 24 horas y administrar el 80% de dicha dosis.
4. Administración exclusiva de insulina rápida subcutánea (15,17). Esta pauta no es aconsejable como tratamiento exclusivo, pero su uso en el momento del ingreso es una práctica habitual en aquellos pacientes diabéticos que ingresan por cualquier otra patología y en los que es preciso ajustar el tratamiento de su diabetes. No hay evidencia de cómo iniciar la insulinizacion de novo en el paciente ingresado, pero sí muchas "fórmulas". De entrada, se puede calcular una dosis de 0,2 UI/kg/día, repartidas en tres inyecciones subcutáneas antes de desayuno, comida y cena. Si la cantidad es divisible por tres aplicar tres dosis iguales. Si no lo es inyectar algo más en la dosis de la comida más rica en calorías (en general el almuerzo). Esta pauta no se debe mantener durante más de 48 horas. La dosis orientativa figura en la tabla IV. No controlan al paciente. Tratan la hiperglucemia después de que se produce pero no la previenen. Han demostrado una incidencia de 40% de hiperglucemias y de 23% de hipoglucemias (total 63% de episodios de mal control). El riesgo de hiperglucemia se multiplica por tres, en relación con pacientes no controlados. Sólo se debe utilizar exclusivamente para el tratamiento del diabético, en la urgencia o durante la guardia, durante las primeras horas del ingreso, sabiendo que no es la pauta adecuada para el control. Así para un paciente de 70 kilos de peso que ingresa por una sepsis de origen urinario, se le puede administrar una dieta de 25 x 70 = 1.750 calorías, la cantidad de insulina rápida (0,2 x 70 = 14) es de 14 unidades/día, divididas en 4-5-5 unidades subcutáneas. La pauta de insulina rápida se debe iniciar siempre con una glucemia "elevada", habitualmente a partir de 150 mg/dl y por cada aumento de la glucemia de 50 mg/dl hay que subir 2 unidades de insulina en cada dosis.
5. Transición de insulina rápida a insulina lenta (15,18): Para calcular la dosis de NPH que requiere una paciente hay que conocer la dosis de insulina rápida diaria que precisa el paciente para su control y calcular entre un 50 y 75% (o dos tercios o 66%) y aplicarla en dos dosis. Dos tercios de la dosis total antes del desayuno y un tercio antes de la cena. Si un paciente precisa 30 unidades de insulina rápida, necesitará unas 20 unidades de NPH o lo que es lo mismo 14 unidades antes del desayuno y 6 antes de la cena. Si por el contrario decidimos utilizar insulina glargina se calcula un 50% de la dosis de insulina rápida precisa para el control del paciente en una sola dosis, a cualquier hora del día, manteniendo ese horario y variando la dosis en función de la glucemia basal. En el caso anterior necesitaría 15 unidades de insulina glargina.
6. Control inicial con insulina lenta (15,18). En pacientes en los que se prevea que no van a necesitar la insulina a largo plazo, se puede intentar un control con una dosis única de insulina. Es probable que se precise insulina de acción corta como suplemento, para controlar las oscilaciones postprandiales, por lo que estaríamos en el punto 3. Los diabéticos tipo 2, con buena "reserva insulínica", podrían controlarse con esta pauta. Los diabéticos tipo 1 y los tipo 2 con mala reserva insulínica necesitan cubrir sus necesidades de insulina basal y además las prandiales, porque no son candidatos a esta pauta. Por ejemplo, ante un paciente descompensado por tratamiento con esteroides se puede intentar el control inicial con una única dosis de glargina, calculando 0,2-0,3 UI/kg a cualquier hora del día, manteniendo ese horario y variando la dosis en función de la glucemia basal. La administración por la mañana se acompaña de menos episodios de hipoglucemia nocturna (18). También se puede intentar con insulina NPH en dosis única, calculando 0,3 UI/kg/día y administrarla en la cena o después de la misma, o dividirla en 2 dosis. En ambos casos hay que dejar prevista una insulina rápida de rescate para controlar la necesidad de insulina asociada a las comidas o "prandial".
MANEJO DE SITUACIONES ESPECIALES
PACIENTE QUIRÚRGICO
Existe evidencia que un mejor control de la glucemia en los pacientes sometidos a cirugía condiciona una menor morbi-mortalidad en estos enfermos (19). Es recomendable una evaluación previa a la cirugía, evitando el día de la misma el uso de antidiabéticos orales. Si es posible se debe intentar realizar la cirugía por la mañana, cuanto antes. Para aquellos enfermos sometidos a cirugía cardiovascular (20-27) o aquellos que van a ir a la UCI (28,29) existe una indicación clara de administración intravenosa continua de insulina. Esta pauta origina un beneficio que va más allá del control estricto de la glucemia en la que se implica una acción de la insulina como modulador de la reactividad vascular, citocinas inflamatorias, y liberación de ácidos grasos. Se asocia a un aumento de hipoglucemias (5,2 frente a 0,8%) sin trascendencia clínica. Esta pauta, que figura en la tabla V, podría estar indicada igualmente en aquellas cirugías mayores programadas en la que los pacientes estén recibiendo ya insulina o estén con antidiabéticos orales.
En aquellos casos en los que no se paute insulina en la pauta descrita previamente no es correcta la pauta de insulina rápida según glucemia capilar de forma exclusiva. Hay que evaluar las necesidades de insulina basal, y además, los requerimientos prandiales. Si no estaba recibiendo insulina previamente se puede empezar con una dosis de 0,3-0,8 UI/kg/día. De esta dosis aproximadamente el 50-60% como insulina basal y el resto como insulina relacionada con las comidas con ajuste según escala de glucemia capilar. Como orientación en una cirugía no complicada los requerimientos de insulina serían de 0,3-0,4; en enfermedad hepática de 0,4-0,6; en obesidad severa de 0,4-0,6; en infecciones o sepsis de 0,6-0,8, y con tratamiento esteroideo de 0,5-0,8 UI/kg/día.
Para cambiar de la infusión de insulina a insulina subcutánea se deben superponer ambos tratamientos durante 1 ó 3 horas, según la insulina basal que se prescriba (glargina o NPH respectivamente). La cantidad de insulina necesaria se calcula en función de la insulina recibida. Si estaba en ayunas con suero glucosado, la insulina basal necesaria supone el 80% de la recibida con ajuste posterior. Si ya estaba comiendo, la dosis de insulina basal será entre el 50 y 60% de la dosis recibida y el resto como insulina rápida en 3 dosis.
En cirugías ambulatorias o técnicas diagnósticas en los que se prescriba ayunas, pero en las que posteriormente se vaya a reanudar la alimentación de forma inmediata, se puede utilizar la misma dosis de insulina glargina, 1 ó 2 tercios de insulina NPH por la mañana, con uso de insulina rápida cada 4 ó 6 horas según glucemia capilar. Si el paciente estaba recibiendo antidiabéticos orales, con buen control de la glucemia, se puede posponer la toma a la reanudación de la ingesta.
Cuando se inicia tolerancia con dieta líquida es preferible continuar con la perfusión intravenosa de insulina. Las modificaciones de insulina rápida según glucemia capilar se sugieren en la tabla V.
PACIENTE INGRESADO EN LA UNIDAD DE CUIDADOS INTENSIVOS
En esta situación la práctica habitual y lo recomendado en los diferentes trabajos es la insulina intravenosa en infusión con el objetivo terapéutico de una glucemia menor de 110 mg/dl. Con ello se produce una reducción de la mortalidad del 42% en la propia UCI y del 34% en el hospital, reducción en la incidencia de sepsis, días de ventilador y requerimientos de diálisis (27,28). Las necesidades de insulina pueden variar mucho en cada caso dependiendo de la reserva para producir insulina, la sensibilidad previa a la misma, el aporte calórico y la naturaleza y severidad del cuadro que motivó el ingreso. Cualquier algoritmo de tratamiento se debe adaptar a la situación concreta y a las intervenciones terapéuticas que se lleven a cabo.
PACIENTE CON INFARTO AGUDO DE MIOCARDIO
El estudio DIGAMI (Diabetes Insulin Glucosa in Acute Myocardial Infarction) mostró una mejoría en la supervivencia global de los pacientes con infarto agudo de miocardio (IMA) en los que se realizaba un buen control de la glucemia desde el ingreso hasta los 3 meses posteriores al IAM (29,30). En los diabéticos conocidos, esta se lleva a cabo mediante una infusión continua de insulina según la pauta descrita previamente para los pacientes en UCI o sometidos a cirugía.
PACIENTES CON ACCIDENTE CEREBROVASCULAR (ACVA)
Parece que existe un cierto grado de correlación entre el nivel de glucosa y la situación final de los enfermos con ACVA. Hay un metanálisis que estudia 26 trabajos publicados entre 1996 y el año 2000, en los que niveles de glucemia superiores a 110 mg/dL se asocian con un peor desenlace, tanto en la mortalidad, como en la capacidad de recuperación. No hay trabajos que evalúen de forma específica y controlada el impacto del control de la glucemia en este subgrupo de pacientes (31,32).
URGENCIAS DIABETOLÓGICAS
Tanto en la cetoacidosis diabética como en el coma hiperosmolar se recomienda la infusión continua de insulina.
En la cetoacidosis diabética lo primero es confirmar el diagnóstico, ingresando al paciente el la UCI si el paciente está en coma o tiene una acidosis extrema con un pH < 7. Hay que determinar los valores de electrolitos (Na, K, Mg, Cl, bicarbonato, fosfato), la situación ácido-base y la función renal para poder hacer el aporte de líquidos de forma adecuada. Es necesaria la administración de 2-3 l de salino al 0,9% en las primeras 1 a 3 horas (5-10 ml/kg/h) sustituyéndolo por suero salino al 0,45% a 150-300 ml/h posteriormente. Cuando la glucemia disminuya por debajo de 250 mg/dl se debe sustituir el suero salino por suero glucosado al 5% más salino a 0,45%, a 100-200 ml/h. Hay que administrar insulina regular 0,1 UI/kg inicialmente; después 0,1 UI/kg/hora en infusión continua. Si no hay respuesta en 2 a 4 horas se debe aumentar de 2 a 10 veces la dosis. No hay que administrar insulina hasta que la cifra de K sea superior a 3,3 mEq/L. Por supuesto, es imprescindible iniciar el tratamiento de la causa desencadenante de la cetoacidosis. Es necesario realizar controles de glucemia capilar cada 1-2 horas y electrolitos cada 4 (especialmente K, bicarbonato y fosfato). Es muy importante el control del K. Si el electrocardiograma es normal, el K es menor de 5,5 mEq/L y la creatinina y la diuresis son normales hay que administrar 10 mEq/h. Si K es menor de 3,5 mEq/L o si se administra bicarbonato administrar 40-80 mEq/h. Hay que continuar con esta pauta hasta que el paciente esté estable, la glucemia se sitúe entre 150 y 250 mg/dl y no exista acidosis. Entonces se puede reducir la perfusión de insulina a 0,05-0,1 UI/kg/h. Cuando el paciente inicie tolerancia oral, se debe reinstaurar la administración de insulina basal, NPH o glargina, además de la insulina prandial, insulina rápida.
La situación hiperosomolar es más frecuente. En esta situación es necesaria la administración de salino al 0,9% en las 2-3 primeras horas. Si la concentración de Na es superior a 150 mEq/L se debe utilizar suero salino al 0,45%. Tras lograr la estabilidad hemodinámica se inicia la administración de suero hiposalino con dextrosa al 5%. El déficit calculado de agua (que suele ser de 9 a 10 l de media) se debe corregir en los siguientes 2 días, con un ritmo de infusión de 200-300 mL/h. En esta situación se debe infundir K en función de las determinaciones del mismo. Se administra insulina rápida en bolus, entre 5 y 10 UI seguida de una infusión continua entre 3-7 U/h. Cuando la determinación de glucemia sea inferior a 250 mg/dL se puede añadir glucosa a la infusión de suero hiposalino, reduciendo la dosis de insulina a 1-2 UI/h.
PARTO
Se recomienda la administración de insulina intravenosa como la previamente descrita en la diabetes tipo I. En la cesárea electiva se puede utilizar lo mismo (33). Hay que recordar que, tras el parto, la resistencia a la insulina del tercer trimestre desaparece al expulsar la placenta, por lo que es necesario la reducción de la dosis de insulina a la situación previa al embarazo.
NUTRICIÓN PARENTERAL
Produce un aumento de las necesidades diarias de insulina. Es aconsejable la infusión continua de insulina para su mejor control. Se puede realizar administrando la insulina directamente en la nutrición parenteral o bien de forma separada.
USO DE ESTEROIDES
En aquellos casos en los esteroides induzcan un aumento de glucemia menor de 200 mg/dl el uso de antidiabéticos orales puede ser suficiente para controlar la situación. Si la cifra de glucemia en ayunas es superior se debe iniciar tratamiento con insulina, tanto insulina basal con insulina glargina o NPH, como insulina de acción rápida para ajustar la dosis relacionada con las comidas. Aun así, dada la inestabilidad del paciente que requiere esteroides, el uso de insulina, tanto en perfusión continua como la mezcla de rápida y basal, es una pauta más adecuada para el manejo de esta situación.
TRATAMIENTO AL ALTA
Una vez estabilizado al paciente y alcanzados los objetivos planteados, nuestros esfuerzos deben estar centrados en ajustar el tratamiento de cara al alta. Sin pasar por alto la importancia de la educación diabetológica, pilar básico en el tratamiento de estos pacientes: el ejercicio físico y la dieta, lo que será necesario será el ajuste farmacológico (34).
Podríamos considerar que el paciente está estable cuando se alcanzan los objetivos marcados en el capítulo de "tratamiento inicial": durante 2-3 días, glucemias prepandriales de 110 mg/dl y postprandiales de 180 mg/dl. En este momento planteamos un tratamiento que sirva de puente entre el realizado en el hospital y el definitivo, que deberá ser ajustado por su médico de atención primaria o por el médico que ha atendido al paciente en el hospital en su consulta externa.
Fundamentalmente nos encontraremos con pacientes que durante el ingreso habrán recibido: insulina rápida en infusión, insulina rápida subcutánea o insulina basal (glargina o NPH) más insulina rápida subcutánea. Las dos primeras fórmulas son insuficientes como el tratamiento definitivo del diabético, sin embargo la última constituye una pauta de tratamiento definitiva. Valoraremos qué pacientes son candidatos a seguir con ella. Si durante el ingreso se ha iniciado algún tratamiento que pudiera ser definitivo y concluimos que está indicado, no habría que realizar ningún cambio antes del alta. Si por el contrario no fuera así se suspendería o se añadiría lo que considerásemos oportuno.
Un escenario posible es aquel en el que el paciente no sabía que era diabético antes de ingresar y que durante su ingreso ha tenido hiperglucemias. En un principio, la hiperglucemia en ayunas que no tiene una explicación razonable, es virtualmente diagnóstica de diabetes mellitus. Sin embargo para establecer de una forma razonable el diagnóstico se deben excluir otras causas de hiperglucemia no diabéticas que figuran en la tabla VI. Una vez descartadas estas causas los criterios de diabetes quedan bien establecidos. En este sentido la edad nos puede resultar orientativa: pacientes jóvenes, por debajo de 40 años, suelen tratarse de diabetes mellitus tipo 1, los pacientes mayores, en general por encima de 40 años, diabéticos tipo 2, salvo en la diabetes tipo LADA (latente autoinmune del adulto).
El diabético tipo 1, por definición, se va a ir de alta con insulina (35). Tanto las bombas de insulina, mediante la administración de insulina basal más bolos de insulina, como las pautas multidosis ( MDI) con análogos de acción prolongada (glargina o NPH) y acción rápida, constituyen en la actualidad formas adecuadas de continuar el tratamiento insulínico en diabéticos tipo 1. Una vez asegurado que el paciente cumple criterios para tratamiento intensivo así como una buena tolerancia al mismo, debe ser remitido al especialista para continuar control.
Cuando ya se ha conseguido estabilizar al paciente con diabetes tipo 2, tras haberle tratado con insulina durante su ingreso, hay que plantear cuál es el mejor tratamiento con el que darle el alta (32). Los estudios epidemiológicos han demostrado que un buen control glucémico (HbA1c < 7%) reduce notablemente la incidencia de complicaciones vasculares, lo que representa para el paciente una mejor calidad y esperanza de vida (estudio UKPDS). Debe exigirse una corresponsabilidad del paciente basada en una educación adecuada que garantice una monitorización frecuente del tratamiento por parte del propio paciente. El abordaje terapéutico de estos enfermos no se tiene que centrar de forma exclusiva en el control de la glucemia. Es igualmente importante controlar la tensión arterial, con unas cifras tensionales menores de 130/80 mmHg, un control lipídico adecuado con cifras de LDL < 100 en prevención primaria y < 70 en prevención secundaria (4,36), uso de ácido acetil-salicílico a dosis bajas, si no existe contraindicación e insistencia en factores no farmacológicos como mantener el peso adecuado, hacer ejercicio continuado y abstenerse del consumo de alcohol y tabaco. La dieta es uno de los pilares básicos porque contribuye a reducir el peso, a un buen control de la tensión arterial, mantener un perfil lipídico óptimo y la normalización de la glucemia. El aporte calórico, la composición y distribución de los hidratos de carbono deberán ajustarse individualmente.
Con respecto al tratamiento hipoglucemiante, este debe ser escalonado, sin que el tratamiento con insulina sea obligatoriamente el último escalón.
La insulina glargina puede plantearse como primera línea de tratamiento en distintas situaciones. En primer lugar en aquellos pacientes diabéticos que necesitan ayuda de otra persona, que estén ingresados en instituciones y en quienes la administración de una sola dosis de insulina pueda facilitar su control. También se puede plantear en aquellos diabéticos con muchas hipoglucemias sintomáticas o en aquellos pacientes que además de agentes orales necesitaban antes de su ingreso el tratamiento con insulina (39).
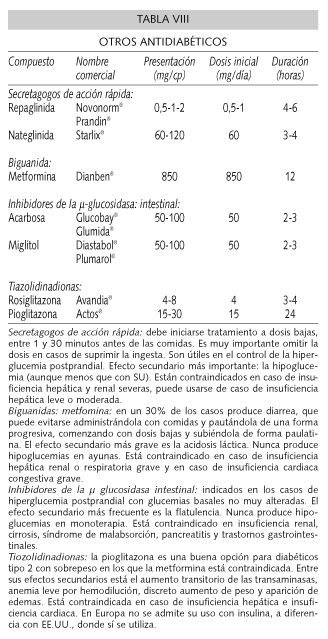
Si el paciente durante su ingreso ha requerido menos de 0,3-0,4 UI/kg/día de insulina se puede plantear el control del mismo con antidiabéticos orales. El orden lógico en la mayoría de los pacientes diabéticos tipo 2 que inician tratamiento sería el uso de antidiabéticos orales (38). Se pueden utilizar en monoterapia y dentro de las posibilidades terapéuticas hay que recordar que en aquellos pacientes obesos se debe iniciar el tratamiento con metformina o glitazonas, en pacientes no obesos u obesos que no se controlan con dieta o metformina se debe plantear el tratamiento con secretagogos, sulfonilureas (Tabla VII) o glinidas (40,41) (Tabla VIII). Un segundo escalón es la asociación de antidiabéticos orales. Las posibilidades que se pueden llevar a cabo figuran en la tabla IX.
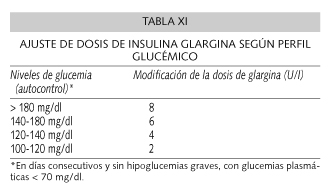
Cuando se produzca una "inadecuación" (concepto introducido por Lebovitz) del tratamiento con los ADO (40), se debe, primero asociar insulina (glargina o NPH) a la terapia oral que tenga el paciente y si posteriormente no se consigue el control con la asociación de ADO + insulina, se pasará una insulinización total del paciente, mediante el uso de glargina o NPH como insulinas basales y el uso de insulinas pre-prandiales rápidas o análogos rápidos (Lispro o Aspart) (38) (Tabla X). La administración de NPH en única dosis noscturna se puede utilizar en pacientes con reserva insulínica y glucemias basales elevadas. La administración de NPH por la mañana es poco fisiológica aunque puede ser útil en la insuficiencia renal crónica o en las hiperglucemias inducidas por otro tratamiento. La forma más habitual es la administración de dos dosis de NPH. A veces, aun cuando se objetiva buen control con 2 dosis de insulina NPH, se puede plantear el cambio a glargina, que requiere sólo una dosis pinchada, con menor riesgo de hipoglucemias. Si venía recibiendo una sola dosis de insulina NPH, la decisión de cambio a glargina debe individualizarse. En este caso el cambio de NPH en una única dosis a glargina la dosis total se mantiene. Si, por el contrario, estaba recibiendo dos dosis de NPH, la dosis de glargina se debe reducir en un 20-30%. Si la insulina es premezclada, la dosis de glargina también debe reducirse en un 20-30% menos, añadiendo insulina prandial regular o análogo corto. Los ajustes de la insulina glargina en función de la glucemia capilar figuran en la tabla XI.
CONSIDERACIONES FINALES
-La hiperglucemia en los pacientes hospitalizados es un problema médico importante con consecuencias serias en cuanto a morbilidad, mortalidad y coste.
-Cada vez existe mayor evidencia que asocia un control mejor de la glucemia con la evolución, no sólo intrahospitalaria sino a medio plazo, de diferentes situaciones clínicas como la cirugía, el ingreso en UCI, el IMA, etc.
-El control de la glucemia durante el ingreso hospitalario se consigue de forma más eficaz con el uso de insulina, bien como infusión continua o de forma subcutánea, asociando distintas insulinas para cubrir las necesidades basales y prandiales.
-Durante el ingreso del paciente diabético es aconsejable evaluar el control de la diabetes y la repercusión de la misma, con objeto de abordar el tratamiento en el momento del alta de forma adecuada, tanto en el control de la glucemia, como de la tensión arterial y los lípidos.
Bibliografía
1. Follow up Report on the diagnosis of the diabetes mellitus. The expert committe on the diagnosis and classification of the Diabetes mellitus. Diabetes Care 2003; 26: 3160-7. [ Links ]
2. Glucose tolerance and mortality: comparison of WHO and ADA diagnosis criteria: The Decode Study Group. [ Links ]
3. European Diabetes Epidemiology group. Diabetes Epidemiology Collaborative Analysis of Diagnostic Criteria in Europe. Lancet 1999; 354: 617-221. [ Links ]
4. American Diabetes Association. Clinical Practice Recommendations. Diabetes Care 2005; 28 (Supl. 1): 2005. [ Links ]
5. American College of Endocrinology. Position statement on inpatient diabetes and metabolic control. Endocr Pract 2004; 10: 77-82 . [ Links ]
6. Alvin C. Powers. Diabetes Mellitus. En: Braunwald, Fauci, Kasper, Hauser, Longo y Jameson, ed. Principios de Medicina Interna. 15ª ed. McGraw Hill Interamericana, 2001. [ Links ]
7. Ahmann AJ. Inpatient management of hospitalized patients with type 2 diabetes. Curr Diabetes Rep 2004, 4: 346-51. [ Links ]
8. Dean J, Sharp P. Intensive insulin therapy in type 1 and type 2 diabetes. Hosp Med 2004; 65: 288-92. [ Links ]
9. Davis T, Edelman SV. Insulin therapy in type 2 diabetes. Med Clin North Am 2004; 88: 865-95. [ Links ]
10. Holleman F, Hoekstra JBL. Insulin Lispro. N Engl J Med 1997; 337: 176-83. [ Links ]
11. Simpson KL, Spencer CM. Insulin Aspart Drugs 1999; 57: 759-65. [ Links ]
12. Radermecker RP, Scheen AJ. Continuous subcutaneous insulin infusion with short-acting insulin analogues or human regular insulin: efficacy, safety, quality of life, and cost-effectiveness. Diabetes Metab Res Rev 2004; 20: 178-88. [ Links ]
13. Ratner R. Insulin glargine versus NPH insulin in patients with type 1 diabetes. Drugs Today (Barc) 2003; 39: 867-76. [ Links ]
14. Metchick LN, et al. Inpatient management of diabetes mellitus. Am J Med 2002; 113: 317-23. [ Links ]
15. Hirsch IB, Farkas-Hirsch R. Sliding scale or sliding scare: it's all sliding nonsense. Diabetes Spectrum 2001; 14: 79-81. [ Links ]
16. Clement S Braithwaite SS, Magee MF, et al. Management of diabetes and hyperglycemia in hospitals. Diabetes Care 27: 535-91. [ Links ]
17. Queale WS Seidler AJ, Brancati FL, et al. Glycemic control and sliding scale insulin use in medical inpatients with diabetes mellitus. Arch Intern Med 1997; 157: 545-52. [ Links ]
18. Hamman A, et al. A randomized clinical trial comparing breakfast, dinner or bedtime administration of insulin glargine in patients with type 1 diabetes. Diabetes Care 2003; 26: 1738-44. [ Links ]
19. Umpierrez GE, Isaacs SD, Bazargan H, You X, Thaler LM, Kitabchi AE. Hyperglycemia: an independent marker of in-hospital mortality in patients with undiagnosed diabetes. J Clin Endocrinol Metab 2002; 87: 978-82. [ Links ]
20. Furnary AP, Zerr KJ, Grunkemeier GL, Heller AC. Hyperglycemia: a predictor of mortality following CABG in diabetics. Circulation 1999; 100 (#18): I-591. [ Links ]
21. Zerr KJ, Furnary AP, Grunkemeier GL, Bookin S, Kanhere V, Starr A. Glucose control lowers the risk of wound infection in diabetics after open heart operations. Ann Thorac Surg 1997; 63: 356-361. [ Links ]
22. Furnary AP, Gao G, Grunkemeier GL, et al. Continuous insulin infusion reduces mortality in patients with diabetes undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg 2003; 125: 1007-21. [ Links ]
23. Furnary AP, Zerr K, Grunkemeier GL, Starr A. Continuous intravenous insulin infusion reduces the incidence of deep sternal wound infection in diabetic patients after cardiac surgical procedures [with discussion]. Ann Thorac Surg 1999; 67: 352-62. [ Links ]
24. Furnary AP, Chaugle H, Zerr KJ, Grunkemeier GL. Postoperative hyperglycemia prolongs length of stay in diabetic CABG patients. Circulation 2000; 102 (#18): II-556. [ Links ]
25. Lazar HL, Chipkin SR, Fitzgerald CA, Bao Y, Cabral H, Apstein CS. Tight glycemic control in diabetic coronary artery bypass graft patients improves perioperative outcomes and decreases recurrent ischemic events. Circulation 2004; 109: 1497-502. [ Links ]
26. Markovitz L, Wiechmann R, Harris N, et al. Description and evaluation of a glycemic management protocol for diabetic patients undergoing heart surgery. Endocr Pract 2002; 8: 10-18. [ Links ]
27. Van den Berghe G, Wouters P, Weekers F, et al. Intensive insulin therapy in the critically ill patients. N Engl J Med 2001; 345: 1359-67. [ Links ]
28. Krinsley JS. Association between hyperglycemia and increased hospital mortality in a heterogeneous population of critically ill patients. Mayo Clinics Proc 2003; 78: 1471-8. [ Links ]
29. Malmberg K, Norhammar A, Wedel H, Ryden L. Glycometabolic state at admission: important risk marker of mortality in conventionally treated patients with diabetes mellitus and acute myocardial infarction: long-term results from the Diabetes and Insulin-Glucose Infusion in Acute Myocardial Infarction (DIGAMI) study. Circulation 1999; 99: 2626-32. [ Links ]
30. Capes SE, Hunt D, Malmberg K, Gerste in HC. Stress hyperglycaemia and increased risk of death after myocardial infarction in patients with and without diabetes: a systematic overview. Lancet 2000; 355: 773-8. [ Links ]
31. Capes SE, Hunt D, Malmberg K, Pathak P, Gerstein HC. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients: a systematic overview. Stroke 2001; 32: 2426-32. [ Links ]
32. Kiers I, Davis SM, Larkins R, et al. Stroke topography and outcome in relation to hyperglycaemia and diabetes. J Neurol Neurosurg Psychiatry 1992; 55: 263-70. [ Links ]
33. Jovanovic L, Peterson CM. Insulin and glucose requirements during the first stage of labor in insulin-dependent diabetic women. Am J Med 1983; 75: 607-12. [ Links ]
34. Dewitt DRE, Hirsch IB. Outpatient therapy for type 1 and type 2 diabetes: scientific review. JAMA 2003; 289: 2254-64. [ Links ]
35. Nuevos abordajes terapéuticos de la diabetes Mellitus tipo1. Endocrinología y Nutrición 2004; 5: 277-86. [ Links ]
36. Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, Pasternak RC, Smith SC Jr, Stone NJ, National Heart, Lung and Blood Institute, American College of Cardiology Foundation, American Heart Associaton Implications of recent trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation 2004; 110: 227-39. Review. [ Links ]
37. Criterios y pautas de terapia combinada en la diabetes mellitus tipo2: Documento de consenso d la Sociedad Española de Diabetes y la Sociedad Española de Medicina de Familia y Comunitaria. Endocrinología y Nutrición 2001; 48: 82-97. [ Links ]
38. Cabezas-Cerrato J, Cabezas Agrícola JM. Protocolo de tratamiento con insulina. Medicina 2004; 16: 1016-17. [ Links ]
39. Dunn CJ, Plsker GL, Keatiuf GM, Mc Keage K. Insulina Glargina. An update Review of its use in management of biabetes mellitus drug 2003; 63: 1743-78. [ Links ]
40. Levovitz HE. Oral antidiabetic agents: 2004. Med Clin N Am 2004; 88: 847-63. [ Links ]
41. Gaede P, Vedel P, Larsen N, Jensen GV, Parving HH, Pedersen O. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med 2003; 348: 383-93. [ Links ]