Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.38 no.3 Madrid jul./sep. 2012
https://dx.doi.org/10.4321/S0376-78922012000300007
Cobertura de grandes quemados con cultivo de queratinocitos: casuística de nuestra Unidad y protocolo de tratamiento
Massive burn coverage with keratinocytes cultured: our casuistry and treatment protocol
González Alaña, I.*, Aguilar Barrón, P.**, Torrero López J.V.*, Ferreiro González, I.***, Gabilondo Zubizarreta, F.J.****
* Médico Adjunto
** Médico Interno Residente
*** Médico Adjunto. Subdirección de Servicios Quirúrgicos
**** Jefe del Servicio
Servicio de Cirugía Plástica del Hospital Universitario de Cruces, Baracaldo, Vizcaya, España.
Dirección para correspondencia
RESUMEN
El paciente gran quemado sigue siendo hoy en día un difícil reto al que se enfrentan múltiples profesionales sanitarios. La elevada mortalidad de estos pacientes se justifica por la severa alteración del estado general que sufren, las múltiples complicaciones que se asocian y por la ausencia de piel válida para cubrir las quemaduras, como sucede en el caso de los quemados de gran extensión. Este último inconveniente se solventa de diferentes maneras, siendo una de las más importantes el cultivo de queratinocitos. En la Unidad de Quemados del Hospital Universitario de Cruces en Baracaldo (Vizcaya), España, iniciamos la aplicación de esta técnica en 2001, con una experiencia acumulada en esta década de 14 pacientes.
El objetivo de este artículo es mostrar nuestro protocolo de aplicación del procedimiento para la cobertura de quemados extensos, los criterios de inclusión y la terapéutica pre y postaplicación de las láminas de queratinocitos que empleamos en nuestra Unidad. Así mismo, presentamos las características de los pacientes tratados y nuestra propia experiencia en la aplicación de esta técnica que, a pesar de lograr resultados cada vez más satisfactorios y ser en ocasiones la única alternativa para un paciente extensamente quemado, tiene todavía hoy en día tantos detractores.
Palabras clave: Quemaduras, Grandes quemados, Cultivo de queratinocitos.
Código numérico: 154-1541-158487.
ABSTRACT
The severe burn patient continues being nowadays a difficult challenge which multiple sanitary professionals face. The high mortality of these patients justifies itself by the severe alteration of the general condition, the multiple complications that they suffer and the absence of skin for their coverage, as is the case of extensive burns. This last disadvantage is settled in different ways, being one of the most important the treatment with keratinocytes culture.
In the Cruces Universitary Hospital Burn Unit in Baracaldo (Vizcaya), Spain, we began the clinical application of this technique in 2001, with a 14 patients accumulated experience in this period of time.
The aim of this article is to show our treatment protocol for the coverage of massive burns, the inclusion criteria and the therapeutics pre and postapplication of keratinocytes. Likewise, we expose the characteristics of the treated patients and our own experience in the application of this technique that, although achieving increasingly satisfactory results, even being sometimes the unique alternative for severe burn patients, still has nowadays many detractors.
Key words: Burns, Severe burns, Keratinocytes Culture.
Numeral Code 154-1541-158487.
Introducción
La mortalidad del gran quemado sigue siendo en la actualidad uno de los importantes retos a los que se enfrentan los profesionales sanitarios. Dicha mortalidad se justifica durante la primera semana por el shock hipovolémico y la inhalación de humos que sufren estos pacientes y a partir de entonces, por el shock séptico, las patologías directamente relacionadas con la extensión de las quemaduras y por la ausencia proporcional de zonas donantes para la cobertura de extensas superficies corporales expuestas (1-6).
Durante décadas, estos pacientes grandes quemados eran cubiertos con autoinjertos mallados a escalas superiores al 1:3, con resultados variables. La escasez de zonas donantes obligaba a continuas retomas de piel, con la consecuencia evidente del progresivo deterioro de los pacientes y del largo intervalo que se debía establecer entre una y otra operación de cobertura para permitir la reepitelización de estas sobre-explotadas zonas donantes (3,5,7).
Cuando Rheinwald & Green, en la década de los 70, aplicaron la técnica del cultivo celular a la producción de equivalentes cutáneos para la cobertura de lesiones extensas, estos procedimientos fueron entusiásticamente recibidos por los médicos dedicados al paciente gran quemado. Su aplicación se popularizó durante la década de los 80, y la primera publicación científica de aplicación y resultados se presentó en 1990 (4,8).
Las láminas de queratinocitos no son piel cultivada ni piel artificial, aunque éstas son comunes denominaciones que se les aplican. Son un equivalente cutáneo autólogo y bicapa. La capa interna, equivalente a la dermis, está compuesta por plasma y plaquetas autólogas gelidificadas en presencia de cloruro cálcico, compuesto al que se le adicionan fibroblastos del propio paciente (combinación que mejora el prendimiento y las características biomecánicas finales) (2,7,8-10). Sobre esta capa, simulando la epidermis, se siembran queratinocitos autólogos en distinto grado de maduración.
Muchos autores llevan décadas estudiando diferentes alternativas de medios de cultivo y de transporte celular para mejorar los resultados de crecimiento y de prendimiento tisular (2,5,7,8-12). Respecto al medio de transporte, la mayoría se decanta finalmente por el plasma humano de donantes sanos, debido a su riqueza en fibrina y factores de crecimiento, factores que numerosos estudios han demostrado que aumentan el prendimiento de esta piel bioingerierizada. Por último, la transferencia de este tejido desde el laboratorio al paciente se realiza por lo general sobre tules, empleando adhesivos biocompatibles tipo Histoacryl® (2,5,7,9-12).
Tras esta breve exposición de la técnica de cultivo celular, resulta evidente para el lector que se trata de un procedimiento caro y laborioso. Por esto y por la baja tasa de prendimiento que se vió al inició de su aplicación, diversos autores se mostraron en un principio reticentes en cuanto a su uso (3,4,8,10,13). Sin embargo, revisando la bibliografía, observamos un claro cambio de opinión en la última década, con tasas de prendimiento paulatinamente superiores que en algunas series alcanzan medias del 90 % (6). Estas tasas de prendimiento, aunque inferiores a las habituales del autoinjerto, justifican la aplicación de esta cara y laboriosa técnica, pues la experiencia ha demostrado que el cultivo de queratinocitos permite la cobertura de quemados de gran extensión que en ausencia de este procedimiento, fallecerían por falta de zonas donantes viables (7,8,9,10,12). La extensión de superficie quemada a partir de la cual se considera al paciente tributario de cobertura con autoinjertos está todavía a debate, oscilando entre el 50 % y el 90 % de superficie corporal total.
Material y método
La Unidad de Quemados del Hospital Universitario de Cruces en Baracaldo (Vizcaya), España, inició la aplicación del cultivo de queratinocitos en el año 2001, con un primer caso de cobertura de una gran pérdida de sustancia cutánea tras la resección de un nevus congénito gigante en un niño. En aquella ocasión, los queratinocitos fueron suministrados por un banco de tejidos extranjero y el prendimiento fue prácticamente nulo. Analizando posteriormente el método utilizado, dedujimos que se había debido a un fallo en el transporte del equivalente cutáneo ya que éste llegó desprendido de los tules. A partir de ese momento, nos pusimos en contacto con el Centro Comunitario de Sangre y Tejidos de Asturias, en Oviedo, España, geográficamente más cercano a nuestro hospital, e iniciamos un protocolo que mantenemos en la actualidad con buenos resultados.
Los criterios que deben cumplir los pacientes tributarios de esta técnica en nuestra Unidad no son estrictos, como no lo son para ninguno de los autores estudiados. En la actualidad incluimos en el protocolo:
- Quemaduras de extensión superior al 60 % de superficie corporal total (SCT) de tercer grado: es decir, pacientes cuya extensión de superficie sana no es suficiente para proporcionar cobertura de las quemaduras con autoinjertos.
- Edad inferior a 70 años: por el pronóstico infausto de las quemaduras de gran extensión entre la población de edad avanzada, estos pacientes no se considerarían a priori tributarios de cobertura con queratinocitos dada la carestía del procedimiento.
- Ausencia de patología de base grave: basándonos en las mismas consideraciones mencionadas para los pacientes de edad avanzada.
- Pronóstico de mortalidad sobrepasado: en pacientes ancianos y con severos antecedentes patológicos. En el caso de grandes quemados jóvenes no se contraindica en principio ninguna técnica terapéutica, dado que la experiencia demuestra una supervivencia real muy superior a la esperada.
Durante la última década, la Unidad de Grandes Quemados del Hospital de Cruces ha ingresado 586 pacientes, 50 de los cuales presentaban quemaduras de extensión superior al 50 %. De ellos, 14 cumplían criterios de cobertura con queratinocitos (edad inferior a 65 años y extensión de quemadura entre el 50 y el 97 % , presentando 4 de ellos extensiones superiores al 80 %). De ellos, 2 tenían edad superior a 60 años y 1 era un joven con quemaduras del 90 % de SCT, y fallecieron durante el tratamiento. La tasa media de prendimiento fue del 65 %, con un rango del 45 al 90 % (Tabla I).
Analizando estos datos, coincidimos con la mayoría de los autores en que esta técnica, a pesar de sus inconvenientes, permite la supervivencia de pacientes que de otro modo serían difícilmente viables. Por esto y con el objetivo de estimular la aplicación de este procedimiento a los profesionales que aún no se hayan iniciado, describimos el sencillo protocolo de trabajo estandarizado por el que se rige nuestra Unidad de Quemados en cuanto a la aplicación del cultivo de queratinocitos.
Protocolo de actuación
1. Recepción
El estándar de actuación con estos pacientes no varía respecto al de cualquier gran quemado y es común a todas las Unidades (reconocimiento, rehidratación y tratamiento local y general según precise el paciente) (Fig.1).
2. Desbridamiento
- El 3o-4a día, tras estabilizar al paciente, se desbridan bajo manguito de isquemia las cuatro extremidades y se cubren con homoinjertos criopreservados procedentes del Banco de Tejidos del Servicio Vasco de Salud, salvo las manos, que cubrimos con apósito de Biobrane®. Estos homoinjertos se extraen de donantes multiorgánicos por el propio personal del Servicio de Cirugía Plástica y se remiten a través de la Coordinación de Trasplantes al mencionado banco de tejidos para su procesado. La piel criopreservada se malla al 1:2 y se cubre con tul graso y compresas impregnadas en povidona yodada.
- En la misma intervención, se toma una muestra de tejido que se envía al Centro Comunitario de Sangre y Tejidos de Asturias para el cultivo de queratinocitos (explicaremos el proceso de extracción de la muestra más adelante).
- La primera cura se realiza el 4o día tras la intervención y posteriormente, a días alternos.
- Continuamos el desbridamiento cada 5-7 días, autoinjertando si es posible.
- En este tiempo los homoinjertos prenden o nos muestran zonas de desbridamiento insuficiente, lo que nos permite desbridar correctamente en la próxima intervención. En caso de rechazo, se sustituyen de nuevo por otros homoinjertos o por Biobrane ®. (Fig.2).
- A los 20 días del envío de la biopsia de piel, recibimos las láminas de queratinocitos para su siembra.
3. Protocolo de toma de biopsia
- En piel sana.
- Sin uso de vasoconstrictor.
- Lavado exhaustivo con dos antisépticos diferentes (aniónico y catiónico) y aclarado abundante.
- Tamaño de la biopsia: 8x1 cm. para permitir el cultivo no sólo de queratinocitos sino también de fibroblastos.
- Inclusión de tejido celular subcutáneo para proteger la dermis.
- Introducción de la muestra en el kit de transporte y entrega a Coordinación de Transplantes del Hospital de Cruces, quienes se encargan de su trasporte en condiciones y tiempo adecuados hasta el Banco de Tejidos de Asturias.
- Para la solicitud de queratinocitos se utiliza el cálculo de que 150 cm2 de piel equivalen a un 1 % de SCT.
4. Labores administrativas
- A efectos económicos, es necesaria la firma del responsable de Gerencia del Hospital de Cruces.
- El kit de transporte de la biopsia se solicita al Centro Comunitario de Sangre y Tejidos de Asturias. Teléfonos: 985232426-136 o 649462183. En su defecto, sería suficiente con un tubo de los empleados habitualmente para cultivo de virus.
- Se contacta con la Coordinación de Transplantes del Hospital, que realiza las labores administrativas previamente citadas.
- Se comunica al día siguiente con el Banco de Tejidos de Asturias para comprobar la idoneidad de la muestra.
5. Preparación del lecho/siembra
Condiciones:
- Colocamos las láminas únicamente en zonas de no apoyo.
- Las extremidades inferiores se suspenden mediante dos clavos de Steiman y dos estribos (Fig. 3).
- Se siembran con un intervalo de unos 10 días, lo que permite no tener colgadas las dos extremidades a la vez.
- Los cultivos de superficie deben ser negativos.
Método:
- Lavado con dos antisépticos diferentes y aclarado abundante.
- Si el lecho es de homoinjertos, se desbrida superficialmente dejando las mallas de dermis para obtener mejores resultados en cuanto a prendimiento y calidad de la cicatriz resultante.
- Si hay Biobrane®, se elimina y también todo el tejido fibrinoso subyacente.
- A continuación, se hace hemostasia únicamente con suero y electrocoagulación. No se usan vasoconstrictores.
- Se completa la hemostasia con Tissucol® y desde 2007, con fibrina autóloga con el sistema Vivostat® . La fibrina no sólo ejerce una labor hemostática sino que aumenta la adherencia de las láminas de queratinocitos al lecho (Fig. 4).
- En este acto quirúrgico transfundimos plasma para reponer los factores de la coagulación perdidos por la hemorragia.
- Retirada del tul graso antes de colocar las láminas o inmediatamente después de depositarlas (en un principio, colocábamos las láminas con el tul graso y al intentar retirarlo al cabo de los días se dañaba el epitelio conseguido. En algún caso, incluso se integró el tul en la piel resultante, siendo su retirada muy cruenta) (Fig. 5 y 6).
- Hacemos de nuevo profilaxis antibiótica con Teicoplanina y Ceftazidima durante al menos 8 días, o si el cultivo se vuelve positivo, según antibiograma.
- Se cubren las láminas de queratinocitos con material inerte exento de cualquier compuesto antiséptico, por ejemplo, un tul de silicona.
- Sobre la silicona no se aplica ningún tipo de pomada antiséptica. Únicamente se cubre con compresas empapadas en suero fisiológico.
- Toma de biopsia para Anatomía Patológica al 8o día, coincidiendo con la primera cura. Realizamos esta biopsia para comprobar histológicamente el prendimiento de los queratinocitos.
6. Cuidados de enfermería
- El paciente reposa en un lecho fluidificado de microesferas (cama Clinitron®).
- Las compresas empapadas en suero fisiológico se riegan en cada turno de trabajo de enfermería (cada 8 horas).
- Al 4o día de postoperatorio se procede al recambio de las compresas sin levantar la silicona y se toma cultivo de superficie.
- A partir de este momento se realiza el cambio de compresas y el cultivo de superficie cada 48 horas. Al 8o día se retiran la silicona y los tules de transporte que hayamos dejado. En este acto pueden verse ya zonas de prendimiento que aparecen como áreas brillantes de coloración rosácea (Fig. 7 y 8).
- La extremidad sembrada se mantiene suspendida durante 12-15 días.
- A partir del 10o día, si fuera necesario, es posible la cobertura con pomadas antisépticas, preferentemente sulfadiacina argéntica. La povidona yodada daña los fibroblastos de las láminas de queratinocitos.
- Las zonas cruentas entre islotes de piel se tratan de diversas formas, siempre dependiendo de su extensión. Hemos obtenido buenos resultados mediante su cobertura con homoinjertos, con la ventaja añadida de que podemos realizar dicha técnica sin desplazar al paciente al área quirúrgica.
- La aplicación de sulfadiacina argéntica durante varios días es útil no sólo en el caso de que el paciente presente sobreinfección por Pseudomona aeruginosa, sino que por su capacidad antiséptica, esta pomada produce un efecto de hipergranulación en las áreas cruentas que ayuda a la hora de determinar los límites de prendimiento de los queratinocitos con vistas a planificar futuras siembras.
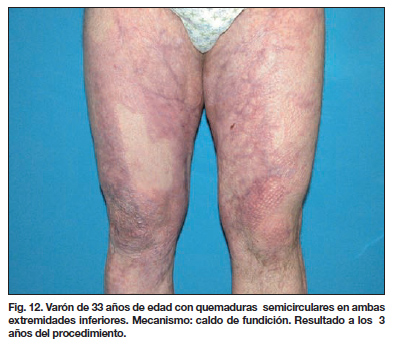
- En las curas siguientes se observa un progresivo aumento de las áreas epitelizadas. De hecho, no se puede asegurar la superficie total de prendimiento de los queratinocitos hasta pasados 15 días de su siembra (Fig. 9-13).
Discusión
Desde su primera aplicación hace más de 20 años, el cultivo de queratinocitos se ha convertido en una técnica cada vez más popular entre los profesionales que a diario se enfrentan a la difícil tarea de cubrir las pérdidas de sustancia de un gran quemado. Es sin duda un procedimiento caro, laborioso y que implica no sólo una curva de aprendizaje, sino también sobradas dosis de paciencia dado que los resultados no se observan hasta pasados unos 15 días desde la siembra de queratinocitos, para obtener finalmente una tasa de prendimiento inferior a la obtenida habitualmente con el autoinjerto. Y sin embargo, los profesionales que nos hemos habituado a su uso somos firmes y entusiastas partidarios de esta técnica; porque la experiencia nos ha demostrado, como al resto de los autores estudiados, que salva vidas y lo hace con un magnífico resultado estético y funcional, a pesar de la previsible fragilidad de un tejido bioingenierizado.
Las tasas de prendimiento de nuestra serie oscilan entre el 45 y el 90 %, con una tasa media del 65 %. El caso de menor prendimiento es el de mayor extensión de quemadura y mayor número de infecciones cutáneas sufridas. En el otro extremo tuvimos 1 paciente que no presentó ningún cultivo de superficie positivo. En este sentido hemos de señalar que la tasa de prendimiento entre nuestros pacientes ha aumentado con la curva de aprendizaje y el control de las infecciones.
Como se puede observar en la Tabla I, los pacientes presentaron preferentemente infección por Pseudomona aeruginosa y por diversas familias de Cándida, con 1 caso aislado de Acinetobacter baumanii, infecciones que fueron tratadas con cefalosporinas de tercera generación y carbapenemens. El prendimiento evolucionó peor en los casos de infección por Pseudomona frente a los de infección fúngica.
Así mismo, se observan diferencias significativas en la tasa de prendimiento en función de las áreas corporales sembradas de queratinocitos. En relación a la localización de la siembra, todos los pacientes recibieron queratinocitos en las extremidades inferiores; 6 en tórax y 2 en extremidades superiores. En los casos de mayor extensión de la quemadura fue preciso sembrar circularmente las extremidades inferiores, manteniendo éstas en alto mediante tracción al zénit con enclavado endomedular. Cuando la extensión de la quemadura lo permitió se sembraron únicamente las superficies anteriores de las extremidades, puesto que, a pesar de la tracción, observamos que el prendimiento era peor en las superficies posteriores y en las zonas de apoyo.
Es difícil establecer similitudes o diferencias con respecto a la bibliografía analizada, puesto que las tasas de prendimiento que encontramos son también muy variables, del 60 al 90 % de prendimiento según las series (1,6). En el aspecto en que sí coinciden nuestra experiencia y la de los autores consultados es en la necesidad de crear un compuesto bicapa, anexionando fibroblastos a los queratinocitos, y sembrar dicho tejido sobre la dermis resultante de la cobertura de las superficies desbridadas con homoinjertos para obtener mejores resultados biomecánicos y mayor tasa de prendimiento.
Mediante este artículo hemos querido mostrar nuestra casuística, el estándar de tratamiento utilizado en nuestra Unidad y las pequeñas aportaciones a la técnica que no hemos visto descritas en la bibliografía consultada, aunque deducimos que son de uso común entre los profesionales dedicados a este campo, como son la suspensión de los miembros sembrados y la aplicación de fibrina autóloga sobre el lecho antes de la siembra. Probablemente nuestro protocolo de actuación sea muy similar al de cualquier otra Unidad de Quemados habituada al uso de queratinocitos, e incluso que su experiencia superior haya dejado obsoleto nuestro procedimiento, pero se trata de mostrar una estandarización simple que anime y guíe al profesional no iniciado y que además sea una ventana abierta al debate y al intercambio de conocimientos.
Conclusiones
El cultivo de queratinocitos es una técnica descrita hace más de 20 años y que, a pesar de todos sus inconvenientes (complejidad y precio), se ha convertido en una poderosa arma en el tratamiento del paciente extensamente quemado, compensando la carestía del producto con la supervivencia del paciente, de otro modo difícilmente viable. Mediante este artículo hemos mostrado nuestra experiencia y un sencillo protocolo de aplicación de dicho procedimiento.
Agradecimientos
A los compañeros del Servicio de Cirugía Plástica y de la Unidad de Cuidados Intensivos del Hospital de Cruces, por su inestimable colaboración en el tratamiento de estos pacientes y a las enfermeras y auxiliares de la Unidad que son quienes están las 24 horas del día a la cabecera del paciente.
Bibliografía
1. Barret JP, Wolf SE, Desai MH, Herndon DN.: Cost-effficacy of cultured epidermal autografts in massive pediatric burns. Ann. of Surg. 2000; 231(6), 869:876. [ Links ]
2. Coulomb, B.; Friteau, L.; Baruch, J.; Guilbaud, J.; Chretien-Marquet, B; Glicenstein J.; Lebreton-Decoster, C; Bell, B.; Dubertret L.: Advantage of the Presence of Living Dermal Fibroblasts within in Vitro Reconstructed Skin for Grafting in Humans. Plast. Rec. Surg. 1998, 101(7):1891. [ Links ]
3. Still J.M. Jr, Orlet H.K, Law E.J.: Use of cultured epidermal autografts in the treatment of large burns. Burns 1994; 20:539. [ Links ]
4. Fish, J.S.: The Use of Cultured Autologous Keratinocytes with Integra in the Resurfacing of Acute Burns. Plast. Rec. Surg. 1998;102(3):829. [ Links ]
5. Theopold C, Hoeller D, Velander P, Demling R, Ericson E.: Graft site malignancy following treatment of full-thickness burn with cultured epidermal autograft. Plast Rec. Surg. 2004;114(5):1215. [ Links ]
6. Dvoránková, B.; Holíková Z.; Vacík, J.; Königovä R.; Kapounková, Z.; Michálek J.; Prádny, M.; Smetana, K.: Reconstruction of epidermis by grafting of Keratinocytes cultured on polymer support-clinical study. Int J Dermatol, 2003, 42(3):219. [ Links ]
7. Inoue. S.; Kijima, H.; Kidokoro N.; Tanaka M.; Suzuki Y.; Motojuku M.; Inokuchi S.: The Effectiveness of Basic Fibroblast Growth Factor in Fibrin-based Cultured Skin Substitute in Vivo. J. of Burn Care & Res. 30 (3):514. [ Links ]
8. Caruso DM, Schuh W H, Al-Kasspooles M F, Chen M C, Schiller W R.: Cultured composite autografts as coverage for an extensive body surface area burn: case report and review of the technology. Burns 1999; 25: 771. [ Links ]
9. Munster A.M.: Cultured Skin for Massive Burns: A prospective, Controlled Trial. Ann. of Surg. 1996, 224(3):372. [ Links ]
10. Chester, D.L.; Balderson D.S.; Papini R.P.G: A Review of Keratinocyte Delivery to the Wound. J. Burn Care Rehabil, 2004, 25(3): 266. [ Links ]
11. Mis B, Rolland E, Ronfard V.: Combined use of a collagen-based dermal substitute and a fibrin based cultured epithelium: a step toward a total replacement for acute wounds. Burns. 2004, 30(7):713. [ Links ]
12. Pellegrini, G.; Ranno R.; Stracuzzi G.; Bondanza S.; Guerra L.; Zambrano G.; Micali, G.; De Luca, M.: The Control of Epidermal Stem Cells (Holoclones) in the Treatment of Massive full-thickness Burns with Autologous Keratinocytes Cultured Fibrin. Transplantation. 1999, 68(6):868. [ Links ]
13. Serracanta J, Gómez P, Palao R.: Tratamiento integral de paciente con quemaduras de 2o GP-3a G en el 95 % de superficie corporal. Cultivo de Queratinocitos. Cir. plást. iberolatinoam 2005; 31(4): 251. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dra. Irene González Alaña
Servicio de Cirugía Plástica, Reparadora y Quemados
Hospital de Cruces
Plaza de Cruces s/n.
48903, Baracaldo (Vizcaya). España
e-mail: irene.gonzalezalana@osakidetza.net