Introducción
La principal característica de las úlceras crónicas de miembros inferiores, aquellas de más de 6 meses de evolución, es su dificultad para cicatrizar espontáneamente.(1-4) Estas úlceras refractarias al tratamiento no quirúrgico adecuado significan un gasto considerable en términos de cantidad de curaciones, antibióticos, analgesia y admisión hospitalaria en caso de complicaciones. Asimismo, los pacientes con úlceras crónicas presentan biofilm en sus heridas. El biofilm constituye un ecosistema organizado conformado por uno o varios microorganismos (bacterias, virus, hongos) embebidos en una matriz de exopolisacáridos y adheridos a una superficie inerte o un tejido vivo. Dentro del biofilm, las bacterias están protegidas de la acción de los anticuerpos, del ataque de las células fagocíticas y de los tratamientos antimicrobianos. El biofilm producen retraso en la curación de las heridas, inflamación crónica y disminuye la susceptibilidad a antibióticos y antisépticos. La terapia con antibióticos sistémicos no puede erradicar y eliminar el biofilm. Por esta razón las infecciones que involucran biofilms suelen mostrar síntomas recurrentes después de ciclos de tratamiento antibiótico.(5)
Los autoinjertos de piel parcial se consideran la mejor opción para reconstruir la piel. No obstante, cuando la dermis ha sido comprometida, basándonos en la escalera de la reconstrucción, dicho defecto debe ser cubierto por un tejido de similares características.(6-8) La dermis cuando ha sido extensamente dañada, al igual que muchos otros tejidos, no puede regenerarse espontáneamente y debe ser guiada para su reconstrucción.(9)
Dentro de la escalera de la reconstrucción, los sustitutos cutáneos juegan un rol importante. Son estructuras biológicas, sintéticas o mixtas, que incorporan en muchos casos elementos de la matriz extracelular de la dermis y de la epidermis. Tienen como función incrementar el componente dérmico de la herida, reducir o eliminar factores inhibitorios de la cicatrización, disminuir la respuesta inflamatoria y la consecuente contracción cicatricial, así como proveer una cobertura rápida y segura.(6,10) En base a su duración, pueden clasificarse en transitorios y/o definitivos y dependiendo del espesor en epidérmicos, dérmicos y dermoepidermicos.(10,11)) ( )
El aloinjerto es un sustituto cutáneo biológico obtenido de cadáveres humanos y, dependiendo del procesamiento que se le realice, puede ser transitorio o definitivo. Ha demostrado ser de gran utilidad en pacientes con distintos grados de quemadura. No obstante, hay pocas publicaciones que describan su utilización en úlceras crónicas, siendo una herramienta valiosa en la reconstrucción de este tipo de patología.
Basándonos en la amplia experiencia en la utilización de piel cadavérica en el tratamiento agudo de pacientes quemados, reportamos nuestra experiencia utilizando este sustituto cutáneo en úlceras crónicas de miembros inferiores con el objetivo de preparar el lecho receptor con autoinjerto y/o piel artificial.((1,6, 12-14))
Material y método
Presentamos una cohorte retrospectiva de 22 pacientes a los que se les realizó cirugía reconstructiva en úlceras crónicas vasculares o postraumáticas en miembros inferiores en el Hospital Alemán de Buenos Aires (Argentina) en el período comprendido entre febrero de 2017 y diciembre de 2019. Todos los pacientes recibieron consentimiento informado.
Incluimos pacientes de ambos sexos, sin restricciones de edad, afectados por úlceras de miembros inferiores de más de 10 cm2 de superficie y evolución superior a 6 meses, de espesor total, sin tendencia a la curación a pesar de un tratamiento no quirúrgico adecuado. Excluimos aquellas úlceras de etiología neoplásica.
Analizamos los datos clínicos con respecto a la edad, sexo, tamaño y localización de la úlcera, etiología, antecedentes médicos, infección previa de la herida y complicaciones. Aquellos casos con infección constatada por cultivo de herida realizaron tratamiento antibiótico por vía sistémica de forma simultánea al tratamiento local. La reconstrucción se realizó en un proceso de 2 etapas, una transitoria con colocación de piel cadavérica y una definitiva utilizando autoinjerto o piel artificial y autoinjerto. Analizamos también el intervalo entre estas etapas.
En primer término y bajo anestesia general, se realizó desbridamiento quirúrgico de la úlcera hasta tejido vital con cultivo de la herida. Tras el control de hemostasia, se utilizó en todos los pacientes injerto de piel cadavérica criopreservada fijada al lecho con agrafes de titanio. A continuación, se realizó curación con gasas con sulfadiazina de plata (Platsul A®, Souberian Chobet, Argentina) y vendaje, apósito de Brown o terapia de presión negativa. Medimos la duración de curación con estas técnicas. Todos los procedimientos se hicieron con internación y el alta se otorgó a los 2 días de no mediar complicaciones. Se realizaron curaciones cada 4 a 5 días. Durante las curaciones evaluamos el prendimiento de la piel cadavérica sobre el lecho de la úlcera valorando manualmente la adhesión firme de la misma y la epidermolisis al quinto o sexto día de evolución, el proceso inflamatorio lesional y perilesional, exudado, hematomas, seromas y dolor local. También evaluamos el tiempo de curación (en días), el dolor, mediante Escala Visual Analógica (EVA) (0 sin dolor, 10 con dolor muy fuerte); y el exudado, por puntaje Falanga(15) (1: mínimo, 2: moderado, 3 no controlado).
En el segundo tiempo quirúrgico se utilizó sobre el lecho previamente preparado con piel cadavérica, autoinjerto de piel parcial o piel artificial Integra® y autoinjerto en caso de requerir mayor espesor de cobertura cutánea.
Obtención de piel cadavérica
El banco de tejidos responsable de la procuración y almacenamiento de piel cadavérica en nuestra región es el Hospital de Pediatría "Prof. Dr. Juan Pedro Garrahan" de la Ciudad de Buenos Aires, (Argentina). El procesamiento primario de la piel incluye su obtención, corte, lavado e introducción en una solución combinada de 6 antibióticos. Concluido este paso, se lava 3 veces en recipientes con solución fisiológica fría estéril, cambiando de solución en cada lavado. Luego, se toman las muestras correspondientes para su cultivo microbiológico. Durante el procesamiento secundario, tras ser incubada, se lava e introduce durante unos minutos en el recipiente que contiene la solución de criopreservación. Finalmente, se coloca el tejido en congelador a -80ºC, en cuarentena. El último paso consiste en la irradiación con una dosis preestablecida de radiación gamma. Tras completar el correspondiente formulario de solicitud de piel cadavérica, la misma llega congelada a nuestro centro en un contenedor con hielo seco.
Piel artificial
Utilizamos Integra® (Lifesciences Corp., Plainsboro, NJ, EE.UU.). Se trata de una matriz dérmica biológica heteróloga que incluye colágeno tipo I bovino y glicosaminoglicano de cartílago de tiburón (condroitín 6 sulfato) y una cubierta temporal epidérmica de silicona de 0.5 mm (Silastic®). La estructura dérmica tridimensional con poros de 70 a 120 micrones promueve la migración celular del lecho receptor formando una neodermis o punto de partida de las células del propio paciente. Una vez que se obtiene la formación de neodermis, se retira la lámina de Silastic efectuando un autoinjerto delgado.
Resultados
Reclutamos en total 22 pacientes para injerto de piel cadavérica, 15 mujeres (68.18%) y 7 varones (31.81%). La edad promedio de la población fue 72.5 años (rango 15 - 97 años).
El promedio de la superficie de las úlceras crónicas fue de 111.76 cm2 (rango 10 - 220 cm2), con una mediana de compromiso de superficie corporal total del 2%. En 21 pacientes (95.45%), las úlceras eran en piernas, siendo solo en 2 casos (9.09%) bilaterales. En 1 paciente fue en el hallux del pie derecho. La etiología de las úlceras fue vascular en 12 pacientes (54.54%) y 10 de origen postraumático (45.45%). Con respecto al primer grupo, 1 fue por insuficiencia arterial y 11 por insuficiencia venosa, corroborados por ecodoppler color. Del grupo postraumático, 2 fueron posteriores a una artrodesis y los 8 restantes por injurias domésticas.
Dieciocho pacientes (81.81%) tenían más de una comorbilidad. Las afecciones más frecuentes fueron hipertensión e hipotiroidismo en 6 pacientes (27.27%) y diabetes y tabaquismo en 4 pacientes (18.18%).
El índice de masa corporal promedio fue de 29.36 (rango 24 - 40).
De los 22 pacientes, 13 (59.09%) cursaron preoperatoriamente con infección de la herida crónica, siendo el patógeno predominante Pseudomonas aeruginosa, seguido por Enterococcus faecalis.
El lecho receptor del aloinjerto fue en 18 pacientes (81.81%) tejido celular subcutáneo, 3 sobre hueso expuesto (13.36%) y 1 sobre tendón (4.52%).
Primera etapa quirúrgica
Los 22 pacientes fueron injertados con piel cadavérica criopreservada fijada con agrafes de titanio bajo anestesia general. La cantidad de desbridamientos quirúrgicos hasta lograr el lecho receptor apto para colocar el aloinjerto varió entre 1 a 3 sesiones. Catorce pacientes (63.63%) requirieron sólo 1 desbridamiento con la inmediata colocación de piel cadavérica, 6 pacientes requirieron 2 desbridamientos quirúrgicos y el resto, otros 2, necesitaron 3 intervenciones para lograr un lecho óptimo. En 18 de los 22 pacientes se obtuvo prendimiento del 100% del aloinjerto. En 2 pacientes se obtuvo un prendimiento del 50%. Los 2 pacientes restantes fracasaron en el prendimiento (Tabla I). Estos tenían como antecedentes obesidad mórbida y cardiopatía, 1 exposición ósea y el otro infección por Pseudomonas aeruginosa. En 12 pacientes se utilizó terapia de presión negativa continua (54.54%) con una mediana de utilización perioperatoria de 30 días (entre 8 a 60 días) y los restantes vendaje o apósito de Brown.
Segunda etapa quirúrgica
Los 22 pacientes iniciales, a los cuales se les colocó piel cadavérica, evolucionaron en esta etapa de la siguiente forma ordenandos en subgrupos: A) en 11 se logró prendimiento del 100% de la piel cadavérica y reconstrucción definitiva con autoinjerto de piel parcial, con prendimiento del 100% en 8 casos y del 25% en 3 pacientes con cierre final por segunda intención. B) Dos pacientes lograron 50% de prendimiento de piel cadavérica y 25% de prendimiento del autoinjerto con cierre por segunda intención. C) Dos pacientes no pudieron completar la segunda etapa debido a que 1 falleció por neumonía aspirativa a los 7 días y el otro requirió amputación suprapatelar por progresión de arteriopatía periférica; estos 2 pacientes habían tenido un 100% de prendimiento de la piel cadavérica. D) Un paciente no obtuvo prendimiento de piel cadavérica y fue tratado con autoinjerto y terapia de presión negativa prolongada. En los 6 restantes se utilizó piel artificial Integra® de la siguiente forma: E) Dos evolucionaron con prendimiento del 100% de la piel cadavérica, de Integra® y del autoinjerto. F) Cuatro pacientes (de los cuales 3 tuvieron un prendimiento del 100% de piel cadavérica) tuvieron un prendimiento del 70% de Integra® y del autoinjerto; el 30% restante cicatrizó por segunda intención. En este último subgrupo se encuentra el paciente sin prendimiento de la piel cadavérica en la primera etapa, el cual fue tratado solo con piel artificial y autoinjerto (Tabla II).
Tabla II. Segunda etapa quirúrgica: evaluación del prendimiento de piel cadavérica, piel artificial y autoinjerto
| Subgrupo | N ° de pacientes (Total = 22) | % prendimiento piel cadavérica (N ° ) | % prendimiento piel artificial | % prendimiento autoinjerto de piel (N ° ) |
|---|---|---|---|---|
| A | 11 | 100% | N/A | 100% (8) |
| 25% (3) | ||||
| B | 2 | 50% | N/A | 25% |
| C | 2 | 100% | N/A | N/A |
| D | 1 | 0% | N/A | N/A |
| E | 2 | 100% | 100% | 100% |
| F | 4 | 100% (3) | 70% | 70% |
| 0% (1) | 70% | 70% |
* N/A: no ap
La mediana de tiempo de los 18 pacientes (excluyendo los 2 que no obtuvieron prendimiento en la primera etapa, el que falleció y el que se amputó, (en total 4) entre la colocación de piel cadavérica y el autoinjerto, fue de 35 días (entre 15 y 49 días). Para alcanzar un estadio 1 de Falanga (mínima secreción) se requirió una mediana de 72 días con terapia de vacío y 66 días con vendaje o apósito de Brown.
Los 10 pacientes que lograron completar las 2 etapas quirúrgicas, de los cuales en 8 se utilizó piel cadavérica y autoinjerto y en 2 piel cadavérica, Integra® y autoinjerto, cicatrizaron en 69 días (entre 38 y 122 días) y los 8 restantes (separando los 10 previamente mencionados, el que falleció, el que se amputó y los 2 que no prendieron en la primera etapa), que completaron la primera o segunda etapa de forma subóptima, en 85 días (entre 27 y 500 días).
Durante el seguimiento, todos los pacientes obtuvieron una significativa disminución del dolor, con una mediana de EVA de 6 preoperatoria (rango de 5 a 9) y una EVA posoperatoria de 1 (rango de 0 a 4). El exudado medido con la escala de Falanga(15) se redujo de una mediana preoperatoria de 3 (rango de 3 a 2) a un valor posoperatorio de 1 (rango de 2 a 1) (Tabla III) (Fig. 1-4).
Tabla III. Características demográficas, etiología, tratamiento, evolución de los pacientes del grupo de estudio.
| Paciente | Sexo | Edad | Localización | IMC | TBQ | Tamaño lesión (cm2) | Etiología | Antecedentes | Infección preoperatoria | Lecho receptor |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 70 | Pierna | - | No | - | Postraumática | Obesidad, HTA | No | Hueso |
| 2 | F | 72 | Pierna | - | No | - | Postraumática | No | No | Tejido blando |
| 3 | F | 70 | Pierna | - | No | - | Postraumática | No | Sí | Tejido blando |
| 4 | F | 89 | Pierna | - | No | 160 | Postraumática | No | No | Tejido blando |
| 5 | F | 42 | Pierna | 30 | No | 50 | Postraumática | No | No | Tejido blando |
| 6 | M | 55 | Pierna | - | Sí | - | Postraumática | DBT, hipotiroidismo | Sí | Tejido blando |
| 7 | F | 72 | Pierna | - | No | 150 | Venoso | AR, hipotiroidismo | Sí | Tejido blando |
| 8 | M | 80 | Pierna | 32 | Sí | 90 | Postraumática | Asma, HTA | Sí | Hueso |
| 9 | M | 86 | Pierna | 25 | No | - | Postraumática | IAM, HTA | Sí | Tendón |
| 10 | F | 78 | Pierna | - | No | 60 | Venoso | Insuf. Venosa | No | Tejido blando |
| 11 | M | 80 | Pierna | - | Sí | 219 | Venoso | IRC | No | Tejido blando |
| 12 | M | 56 | Pierna | 40 | No | - | Venoso | HTA, DBT, DLP, obesidad | Sí | Tejido blando |
| 13 | M | 90 | Pierna | 25 | Sí | 219 | Venoso | IRC | Sí | Tejido blando |
| 14 | F | 97 | Pierna | - | No | 75 | Venoso | IRC, hipotiroidismo | Sí | Tejido blando |
| 15 | F | 80 | Pierna | 35 | No | - | Venoso | Asma, IAM, HTA | Sí | Tejido blando |
| 16 | F | 73 | Pierna | - | No | - | Venoso | Linfedema | Sí | Tejido blando |
| 17 | F | 85 | Pierna | 24 | No | - | Venoso | Anemia hemolitica, HTA | Sí | Tejido blando |
| 18 | F | 88 | Pierna | 24 | No | 100 | Venoso | Hipotiroidismo | Sí | Tejido blando |
| 19 | F | 67 | Pierna | 32 | No | 220 | Arterial | DBT, bypass | No | Tejido blando |
| 20 | F | 88 | Pierna | - | No | 80 | Venoso | HTA, hipotiroidismo | No | Tejido blando |
| 21 | F | 62 | Hallux | 26 | No | 10 | Postraumática | DBT, hipotiroidismo | Sí | Tejido blando |
| 22 | M | 15 | Pierna | 30 | No | 20 | Postraumática | Sarcoma de Ewing | No | Hueso |
| Primera etapa | Prendimiento piel cadavérica | 2do injerto | Intervalo 1era y 2da etapa (días) | Tiempo de cicatrización (días) | Falanga* pre/postop. | Dolor** pre/ postop. | Evolución | |||
| Piel cadavérica | 0 | Integra/Autoinjerto | - | 72 | 3/2 | 7/2 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | Integra/Autoinjerto | - | 30 | 2/1 | 6/0 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | 17 | 38 | 3/2 | 7/2 | Infección | |||
| Piel cadavérica | 100 | Autoinjerto | 35 | 42 | 3/1 | 5/0 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 50 | Integra/Autoinjerto | 35 | 60 | 3/2 | 6/1 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | Integra/Autoinjerto | 15 | 36 | 3/2 | 6/3 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | 40 | 90 | 3/1 | 5/1 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | Integra/Autoinjerto | 41 | 66 | 3/1 | 6/0 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | 45 | 72 | 3/1 | 7/2 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | - | - | 2/1 | 7/0 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | 26 | 90 | 3/2 | 5/0 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | Integra/Autoinjerto | 48 | 122 | 2/2 | 6/2 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 50 | Autoinjerto | 26 | 90 | 3/2 | 6/1 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | - | 27 | 2/1 | 7/0 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 0 | Autoinjerto | - | 500 | 2/2 | 6/1 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | - | - | 2/1 | 7/4 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 100 | No | - | - | 3/1 | 9/3 | Falleció | |||
| Piel cadavérica | 100 | Autoinjerto | 24 | 78 | 3/1 | 6/1 | Prendimiento parcial autoinjerto | |||
| Piel cadavérica | 100 | No | - | - | 3/1 | 7/3 | Amputación suprapatelar | |||
| Piel cadavérica | 100 | Autoinjerto | - | 150 | 2/1 | 5/1 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | - | 99 | 2/1 | 7/0 | Prendimiento total autoinjerto | |||
| Piel cadavérica | 100 | Autoinjerto | 49 | 58 | 2/1 | 8/0 | Prendimiento total autoinjerto | |||
IRC: insuficiencia renal crónica; IMC: índice de masa corporal; TBQ: tabaquismo; DLP: dislipemia; IAM: infarto agudo de miocardio; DBT: diabetes; HTA: hipertensión arterial;
*: Score de exudado de herida: 1 (exudado mínimo), 2 (moderado), 3 (severo);
**: escala visual numérica del dolor.
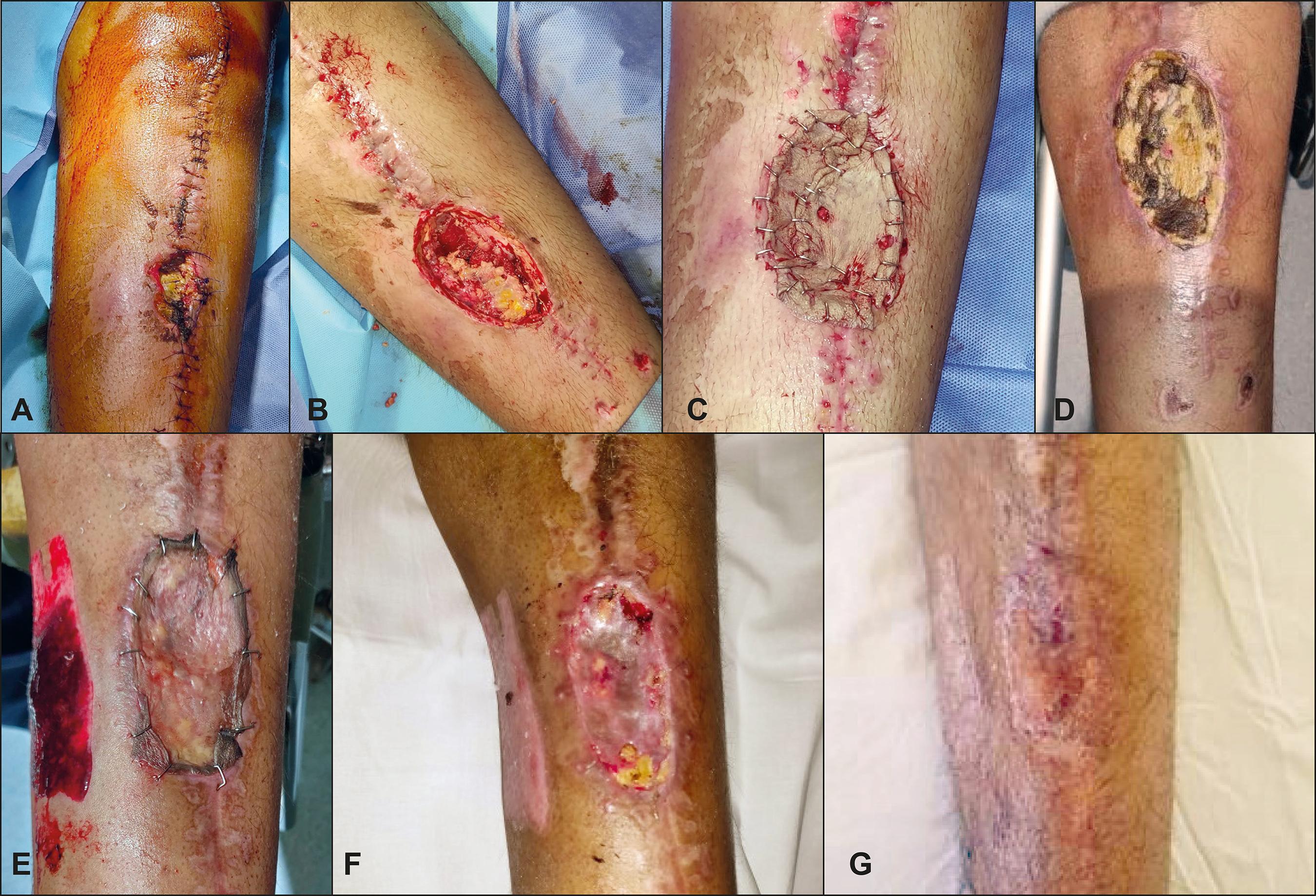
Fig. 1 A. Preoperatorio: varón de 15 años de edad con úlcera postraumática en cara anterior de pierna izquierda con exposición de tibia. B Intraoperatorio: limpieza quirúrgica hasta tejido vital. C. Intraoperatorio: injerto de piel cadavérica criopreservada e irradiada. D. Posoperatorio a los 20 días con prendimiento completo del aloinjerto. E. Autoinjerto de piel parcial a los 35 días del aloinjerto. F. Posoperatorio a los 3 meses. G. Posoperatorio al año.
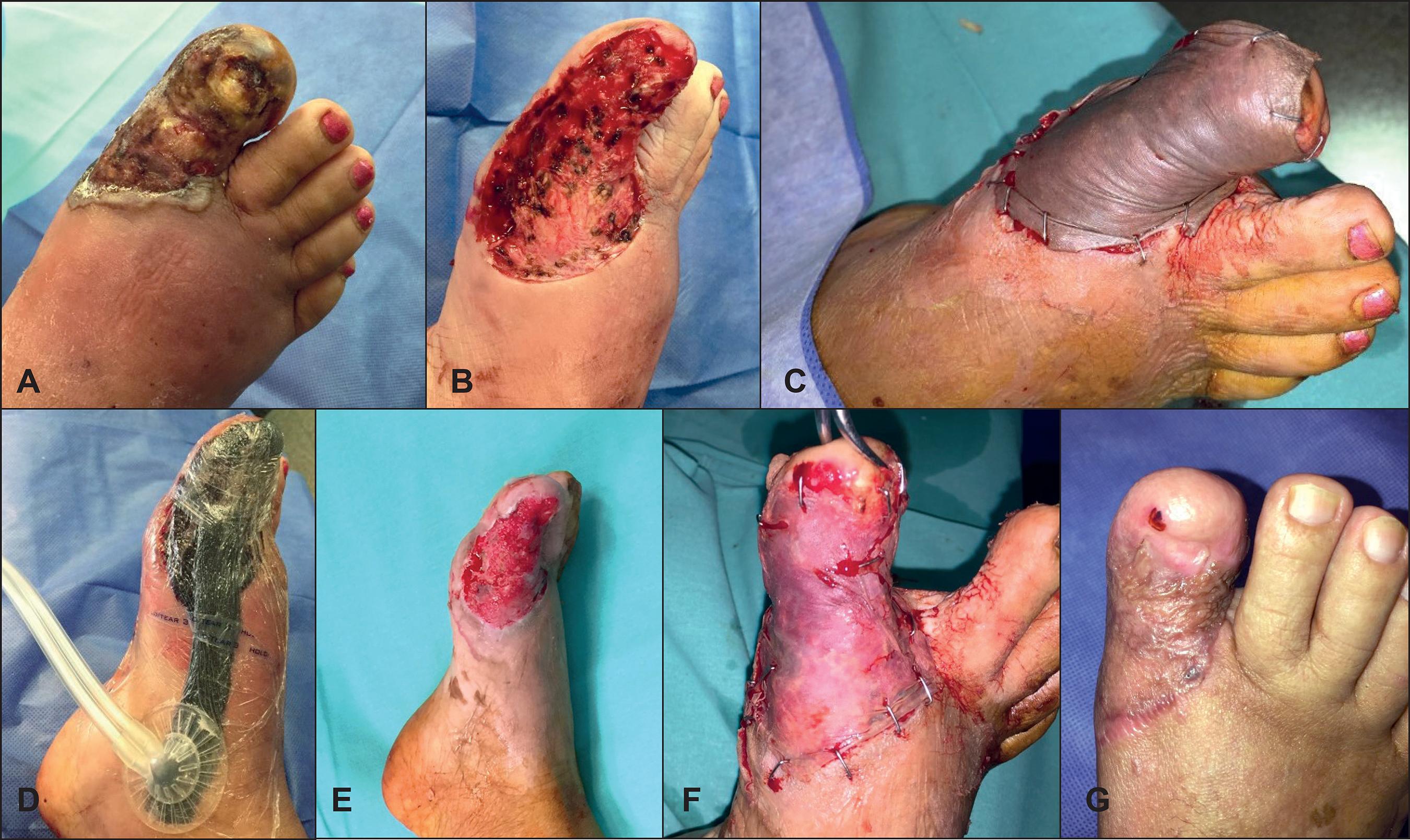
Fig. 2 A. Preoperatorio: úlcera crónica postraumática de 6 meses de evolución en hallux derecho. B. Intraoperatorio: desbridamiento quirúrgico. C. Intraoperatorio: injerto de piel cadavérica inmediato. D. Intraoperatorio: colocación de sistema de vacío continúo. E. Intraoperatorio: lecho granulante tras la retirada del injerto de piel cadavérica a las 3 semanas. F. Intraoperatorio: autoinjerto de piel parcial sobre lecho granulante. G. Posoperatorio: cicatrización completa a los 3 meses.
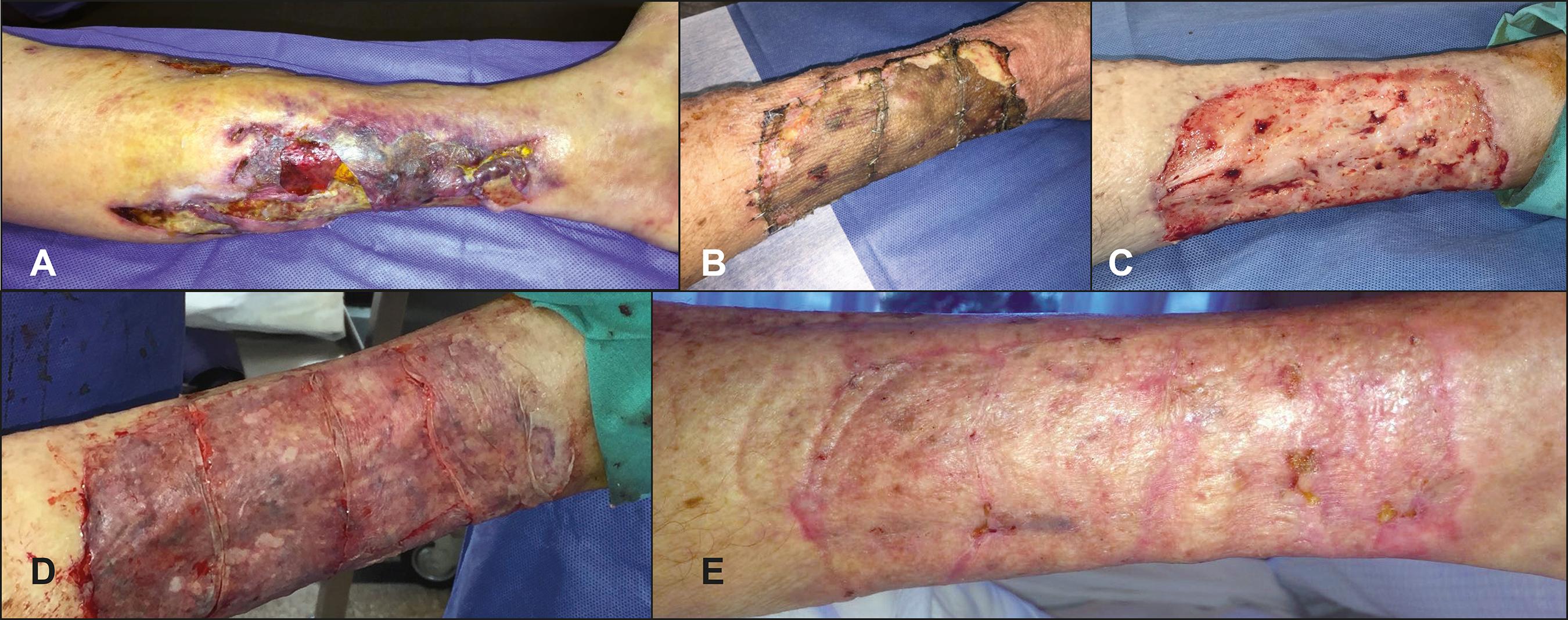
Fig. 3 A. Preoperatorio: mujer de 89 años con úlcera crónica en pierna derecha. B. Posoperatorio: injerto de piel cadavérica prendido totalmente a los 20 días de la limpieza quirúrgica, C. Intraoperatorio: lecho receptor tras la retirada de la piel cadavérica a los 35 días de la limpieza quirúrgica. D. Intraoperatorio: autoinjerto de piel parcial después de retirar el aloinjerto. E, Posoperatorio a los 6 meses.
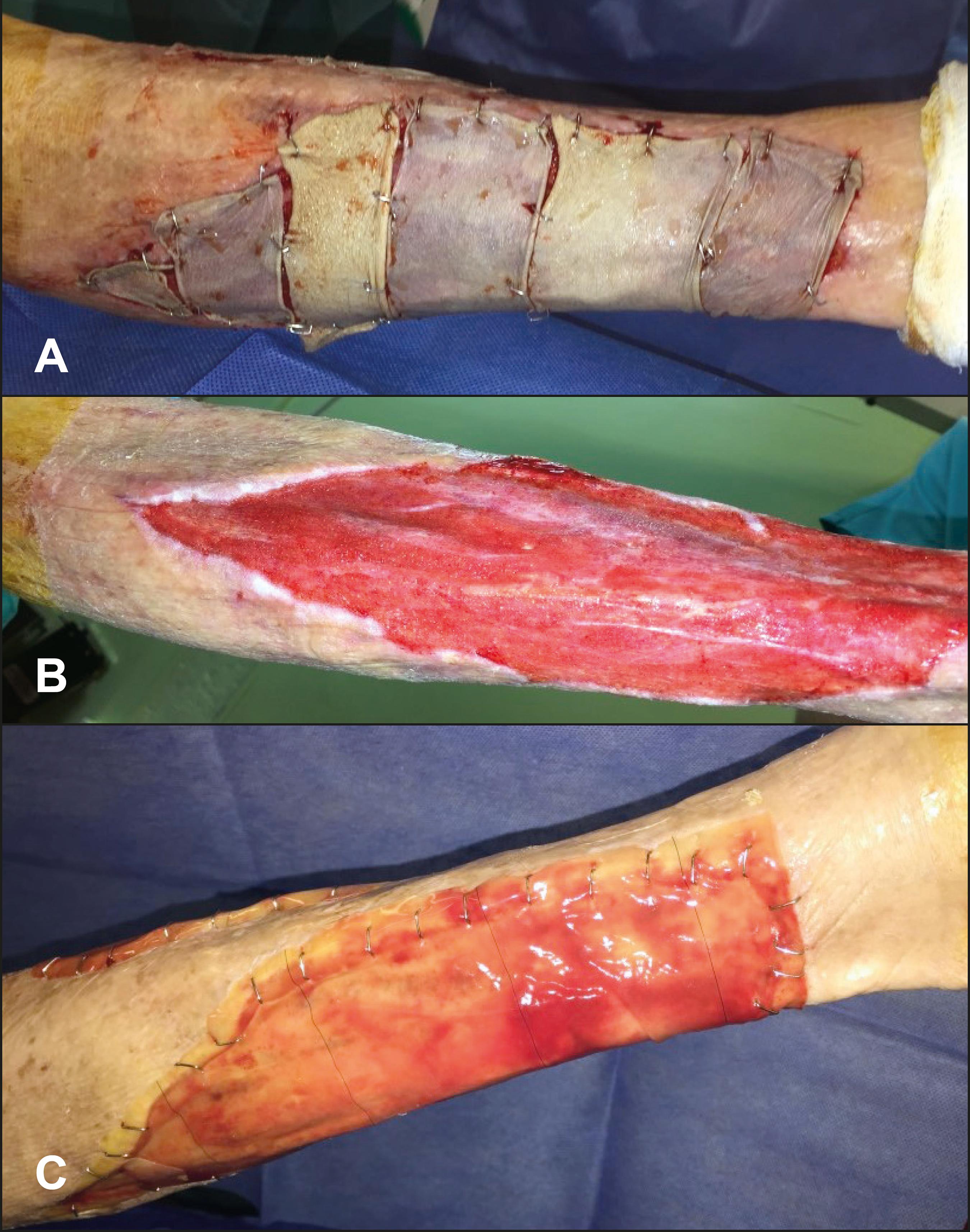
Fig. 4 A. Intraoperatorio: utilización de piel cadavérica como sustituto cutáneo transitorio en úlcera de pierna izquierda postraumática en mujer de 72 años. B. Intraoperatorio: lecho receptor después de retirar el aloinjerto. C. Intraoperatorio: prendimiento completo de Integra® sobre lecho de piel cadavérica apto para recibir autoinjerto de piel parcial.
Discusión
Desde la organización del primer banco de piel por Brown James en la década de los 50 y el establecimiento de los primeros protocolos de funcionamiento por May y De Clement en el año 1982,(13) la indicación de piel cadavérica tuvo en sus inicios como objetivo la cobertura transitoria en pacientes con quemaduras extensas. Dependiendo de los diferentes tipos de procesamiento de la piel cadavérica, la indicación actual se extendió hacia otras patologías.
Actualmente, dentro de la escalera de la reconstrucción(8), los sustitutos cutáneos son una herramienta valorada. El aloinjerto (piel cadavérica) es un sustituto cutáneo que puede utilizarse en forma transitoria o definitiva según el proceso que se le efectúe y la indicación que se requiera. En nuestra serie, la piel cadavérica fue irradiada y conservada a -80ºC. Nuestro servicio se encuentra habilitado en el país por el Instituto Nacional Central Único Coordinador de Ablación e Implante (INCUCAI) para realizar trasplante de piel cadavérica.
En grandes pérdidas de superficie cutánea con presencia de infección, mala calidad de tejidos o de vascularización, el proceso de cicatrización por segunda intención es lento y problemático, incrementándose la morbilidad y la estadía hospitalaria.(5) Frente a este tipo de patología de úlceras crónicas con presencia de biofilm en su evolución, con un proceso inflamatorio crónico per se, realizamos tratamiento con desbridamiento mecánico en una o varias etapas hasta lograr un lecho de aspecto vital, donde inmediatamente se hizo cobertura en su totalidad con piel cadavérica para posteriormente, en una segunda etapa, realizar la reconstrucción definitiva. El tratamiento habitual de este tipo de patología incluye el desbridamiento y la reconstrucción en una sola etapa con autoinjerto de piel parcial. Se asocia con un bajo prendimiento del autoinjerto. A su vez, el resultado puede ser propenso a la contracción y a una apariencia estética subóptima, ya que la dermis juega un rol fundamental en la regeneración cutánea.(9,16,17) Existen otros tratamientos en la literatura, como la utilización de láser Erbium YAG o la aplicación en la úlcera de plasma rico en plaquetas, ambos con buenos resultados.(18,19)
Nosotros proponemos un cambio en la estrategia quirúrgica de este tipo de patología crónica, incluyendo una primera etapa en la que utilizamos piel cadavérica como sustituto cutáneo transitorio con el objetivo de recrear un ambiente fisiológico que favorezca las etapas de cicatrización normal, disminuyendo el proceso inflamatorio lesional y perilesional, acotando la pérdida de líquidos y electrolitos y cumpliendo un rol de cobertura biológica integral para evitar así el ingreso de gérmenes y la formación de biofilm y lograr un ambiente biológico similar al autoinjerto. Además, nos permite evaluar el prendimiento, considerando que si el aloinjerto prende, el autoinjerto podría prender también.
La decisión en la segunda etapa quirúrgica de utilizar autoinjerto de medio espesor o combinar piel artificial y autoinjerto de mínimo espesor, se tomó en aquellas úlceras más profundas con el objetivo de disminuir el escalón del defecto, o en aquellas que involucraban áreas articulares, como el tobillo, brindando una neodermis con mayor elasticidad y flexibilidad con menor retracción cicatricial y mejorando así el resultado estético y funcional.(8,20)
Algunas de las características de un sustituto cutáneo ideal son: capacidad de resistir infecciones e hipoxia, bajo costo, facilidad para su preparación, almacenamiento y uso, flexibilidad en espesor, falta de antigenicidad y cobertura permanente.(6)
La piel cadavérica irradiada tiene algunas características específicas: baja antigenicidad y una tasa de absorción retardada (más de 4 semanas).(1,14) Luego de un prendimiento exitoso, sus fibras de colágeno y elásticas permanecen íntegras y forman un armazón que es infiltrado por las células del huésped, en particular, por fibroblastos, macrófagos, linfocitos y capilares del paciente, remedando un proceso fisiológico normal, interactuando con citoquinas y factores de crecimiento.(6,7,21)
Los sustitutos cutáneos desarrollados por bioingeniería han demostrado ser efectivos, no obstante, son más costosos. La reconstrucción mediante colgajos no suele ser una buena indicación, ya que generalmente, debido al defecto a cubrir, implicaría una gran morbilidad de la zona donante, tiempo operatorio y estancia hospitalaria prolongada en pacientes de edad avanzada.(1,16)
La piel cadavérica es una alternativa válida para el tratamiento de úlceras crónicas. Ofrece una menor contracción de la herida, mayor elasticidad y grosor de la piel en relación con los autoinjertos.(22) En nuestra serie presentamos un 90% de prendimiento del aloinjerto. De nuestro grupo inicial de 22 pacientes, 2 no tuvieron prendimiento de piel cadavérica. Ambos tenían hipertensión arterial, obesidad mórbida y úlceras de larga duración; a su vez 1 presentaba exposición ósea y otro infección crónica por Pseudomonas aeruginosa. Uno de ellos continuó la escalera reconstructiva con piel artificial y el otro con autoinjerto y terapia de presión negativa.
Con respecto a las comorbilidades, es sabido que el tabaquismo y la diabetes mellitus tienen una mayor tasa de complicaciones quirúrgicas. De los 4 pacientes tabaquistas, todos tuvieron éxito en la primera etapa quirúrgica con la piel cadavérica, pero 3 tuvieron un prendimiento parcial con el autoinjerto, posiblemente por la hipoxia o microtrombosis capilar. En los 4 pacientes diabéticos resultó exitosa la piel cadavérica. En 6 pacientes se utilizó, tras retirar la piel cadavérica, Integra® con el objetivo de disminuir la profundidad del defecto de la zona de la úlcera y logrando un prendimiento del 100% en 2 pacientes y del 70% en los 4 restantes.
Al igual que afirman Mosti y col.,(1) en nuestra serie de casos el aloinjerto fue efectivo para reducir significativamente el dolor en la primera etapa evaluado por la EVA y el exudado por putuación de Falanga,(15) mejorando la calidad de vida de los pacientes. A su vez, observamos que los pacientes que fueron autoinjertados con piel parcial en un segundo tiempo quirúrgico, cicatrizaron más rápidamente que aquellos que no completaron la segunda etapa. Coincidiendo con este trabajo, nuestro paciente con evolución tórpida, que era de etiología arterial, requirió amputación del miembro inferior. Al igual que muestra el trabajo de Campagnari y col,(16) en nuestra serie los que utilizaron terapia de vacío tardaron más tiempo en cicatrizar que aquellos que utilizaron vendaje o apósitos de Brown, posiblemente debido a que los del primer grupo correspondían a úlceras más grandes y profundas.
En conjunto, nuestro estudio presenta información acorde a la publicada en la literatura. Las limitantes de este trabajo son el tamaño muestral, su modalidad retrospectiva y la ausencia de grupo control. Sería necesario un trabajo prospectivo randomizado para validar la información presentada.
Conclusiones
La piel cadavérica, indicada en épocas anteriores para grandes quemados, hoy tiene otras indicaciones dependiendo del tipo de procesamiento al que es sometida.
Considerando el tipo de patología y la muestra, observamos en nuestro estudio una disminución significativa del dolor y exudado local, promoviendo un mayor confort en los pacientes. A su vez, aquellos que presentaban comorbilidades, lograron un prendimiento del aloinjerto del 100%.
Proponemos la utilización de la piel cadavérica como una herramienta útil y de bajo costo dentro de la escalera de la reconstrucción, con el objetivo de crear un ambiente más fisiológico en este tipo de patología, favoreciendo la preparación óptima del lecho receptor para la reconstrucción final.














