Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.97 no.3 Madrid mar. 2005
|
CONFERENCIA CLINICOPATOLÓGICA |
Dolor abdominal en paciente con infección por VIH
A. Cosme, E. Pardo1, F. Felipo2 y J. A. Iribarren3
Servicios de Aparato Digestivo , 1Radiología y 2Anatomía Patológica.
3Unidad de Enfermedades Infecciosas. Hospital Donostia. San Sebastián, Guipúzkoa
PRESENTACIÓN DEL CASO CLÍNICO
Varón de 25 años que ingresa en la unidad de enfermedades infecciosas por dolor abdominal. Se trata de un paciente colombiano que lleva 6 meses residiendo en España. Cuatro meses antes del actual ingreso, consulta en otro centro hospitalario por presunta lúes. Refería haber mantenido relaciones no protegidas con un varón afecto de lúes. Presentaba lesiones papulares pruriginosas en tronco, palmas y plantas. En las pruebas de laboratorio realizadas entonces destacaban: VDRL (+); TPHA (+), VHC y VHB negativos y VIH positivo. Fue tratado con penicilina benzatina semanal durante tres semanas y, al cambiar de residencia, le recomiendan acudir a un Servicio de Enfermedades Infecciosas para estudio y control de la infección por VIH, sin que inicien tratamiento antirretroviral. Ingresa en diciembre de 2002 por presentar durante una semana dolor abdominal de localización periumbilical, que aumenta con la ingesta, febrícula que en ocasiones llega a 38 ºC, náuseas, vómitos, deposiciones blandas sin productos patológicos (2-3 al día) y tos no productiva sin disnea. La exploración física puso de manifiesto: presión arterial de 110/60 mmHg, frecuencia cardiaca rítmica a 100 lat/min y temperatura axilar de 37,3 ºC. El estado general estaba afectado y presentaba palidez moderada sin adenopatías palpables ni rigidez de nuca ni signos meníngeos. La auscultación cardiopulmonar era normal y el abdomen doloroso de forma difusa, sin defensa.
En los análisis practicados la Hb era de 11,7 g/dl, VCM 85 fL, HCM 28,9 pg, CHCM 34 g/dl, leucocitos 4910/mm3; neutrófilos, 3150/mm3; linfocitos, 1250/mm3; monocitos, 412/mm3; eosinófilos, 60/mm3; basófilos, 28/mm3; plaquetas: 186000/mm3; VSG: 56 mm/hora, bilirrubina total 1,29 mg/dl, colesterol 147 mg/dl; GGTP 155 U/l, linfocitos CD4: 63 cel/ml; CD4%: 6%; linfocitos CD8: 687 cel/ml y CD8%: 64%. Creatinina, glucosa, ácido úrico, urea, proteínas totales, iones, transaminasas y fosfatasa alcalina, normales. Mantoux, negativo a las 48 y 72 horas. Radiografía de tórax normal. En la radiografía de abdomen se apreciaba dilatación de asas de intestino delgado con escasa aireación de colon. En la ecografía abdominal, hecha al 5º día, se objetivó líquido libre intraperitoneal en saco de Douglas y dilatación de asas del intestino delgado con peristaltismo escaso. La TAC abdómino-pélvica, realizada a la semana de su ingreso, mostró adenopatías en espacio porto-cava, retroperitoneo y engrosamiento de la pared de asas yeyunales. A las dos semanas, la ecografía abdominal puso de manifiesto un engrosamiento importante de la pared de asas intestinales, probablemente yeyuno, sin líquido peritoneal libre. Datos microbiológicos: hemocultivo positivo a S. epidermidis, cultivo de micobacterias en sangre, negativo; detección de antígeno y cultivo de CMV en sangre, negativos; coprocultivo positivo a Candida sp (1 de 3), investigación de parásitos en heces (3 muestras) incluyendo coccidios, negativa; baciloscopias de orina, negativas; carga viral VIH: 130.000 copias/ml, serologías: RPR (+), FTA-ABS (+), TPHA (+), VDRL cuantitativo 1/8,serología para toxoplasma: IgG (+) e IgM (-) y antígeno criptocócico (-). A su ingreso se instauró tratamiento con fluidoterapia y sonda nasogástrica con aspiración. Se practicó una colonoscopia (Dra. Montalvo) que evidenció una lesión sobreelevada y ulcerada en colon ascendente con lesiones eritematosas inespecíficas en ciego y hemorroides internas. La biopsia de ciego fue informada como mucosa de colon con cambios inflamatorios crónicos inespecíficos y la de colon ascendente, como mucosa ulcerada con denso infiltrado inflamatorio linfohistiocitario de tendencia granulomatosa sugestivo de colitis infecciosa, sin que se evidencien cambios de infección viral. Tinción de Ziehl y para hongos, negativas. Los cultivos de la biopsia de colon fueron negativos para CMV y M. tuberculosis.
Tras leve mejoría inicial, se instaura nutrición parenteral. Ante los hallazgos de TAC y colonoscopia se añade de forma empírica, por vía parenteral, tratamiento con rifampicina, isoniacida, claritromicina y etambutol. Experimenta una mejoría aunque persiste fiebre prácticamente diaria de 38-39 ºC desde la segunda semana de su ingreso. Tras esta leve mejoría inicial, a las tres semanas del tratamiento reseñado comienza con dieta líquida, con mala tolerancia y aumento del dolor abdominal, observándose un abdomen más distendido aunque con peristaltismo conservado. Una nueva TAC abdominal demuestra que persisten las adenopatías retroperitoneales y sigue visualizándose una zona de yeyunitis importante con estenosis de la luz intestinal. En este momento, se planifica un procedimiento, que finalmente se llevará a cabo 13 días después. Mientras tanto, se le mantienen a dieta absoluta y con nutrición parenteral. Persiste la fiebre elevada. En cuanto a la evolución analítica, cabe reseñar que a la tercera semana del tratamiento comentado, presenta como datos significativos: bilirrubina 1,88 mg/dl, amilasa 296 U/l, lipasa 471 U/l, fosfatasa alcalina 308 U/l, GGTP 557 U/l, GOT 69 U/l, GPT 216 U/l, Hb 10,3 g/dl (volúmenes normales), albúmina 2,79 g/dl y coagulación normal. Ante estos resultados, se suspende rifampicina e isoniacida, quedando con claritromicina y etambutol. A pesar de ello, dos semanas después, sigue con bilirrubina de 3,1 mg/dl, GOT 75 U/l, GPT 141 U/l, fosfatasa alcalina 732 U/l y GGTP 992 U/l. En espera del procedimiento, y dado que a la fiebre se añade tos seca, se procede a nueva radiografía de tórax, en la que se aprecia un patrón intersticial, de nódulo pequeño, que se sugería levemente en la TAC previa, pero no en la radiografía de tórax previa. Por ello, se inicia tratamiento empírico anti-PCP, y se procede a la realización de broncoscopia (Dr. Aldama), en la que se evidencia una hipervascularización localizada en las divisiones segmentarias, tanto derechas como izquierdas, siendo el cultivo de BAS y BAL positivo para CMV y negativo para gérmenes habituales, con Bk e investigación de PCP negativos. La biopsia transbronquial es "material insuficiente para diagnóstico". Se realizan las siguientes pruebas: fondo de ojo, antigenemia de CMV, cultivo de CMV en sangre y orina, urocultivo, antígeno criptocócico, serología de yersinia, brucella, salmonella, leishmania, siendo todas ellas negativas o normales. Finalmente, estando en tratamiento con claritromicina, etambutol y cotrimoxazol, se realiza el procedimiento.
DIAGNÓSTICO DIFERENCIAL
Dr. Ángel Cosme: Se trata de un paciente que refiere dolor periumbilical que empeora con la ingesta y se asocia a vómitos, náuseas y fiebre con tos. Es un dolor de una semana de evolución. No tiene ictericia, hepatoesplenomegalia ni adenopatías palpables. Todo ello en un colombiano, con infección por VIH no tratado, con antecedentes de haber padecido lúes por contagio homosexual, tratada adecuadamente con antibióticos y sin molestias digestivas previas. Presenta además una anemia moderada, normocítica y normocroma. Fórmula leucocitaria sin desviación izquierda ni eosinofilia pero sí linfopenia. La VSG está elevada. Está inmunodeprimido con CD4 63 y cociente CD4/CD8: 0,09. Hay alteración discreta de las pruebas hepáticas. Antes de continuar agradecería a la radióloga que comentase los hallazgos radiológicos.
Dra. Edurne Pardo: La radiografía de tórax del ingreso no muestra patología. En la de abdomen se aprecia dilatación de asas de intestino delgado con escasa aireación de colon, así como niveles hidroaéreos en bipedestación, compatible con suboclusión. Con la sonda nasogástrica desaparecen los niveles y los signos radiológicos de oclusión intestinal. En la ecografía abdominal destacaba un engrosamiento de pared de las asas intestinales, probablemente correspondientes a yeyuno. Se realiza una TAC abdominal en la que se aprecian adenopatías en el espacio porto-cava, así como engrosamiento de la pared de asas yeyunales (Fig. 1). Teniendo en cuenta los antecedentes del paciente, la evolución clínica y los hallazgos de la TAC pienso que el diagnóstico más probable sería una tuberculosis intestinal aunque se trataría de un caso atípico por no estar afectada el área íleo-cecal.
Menos frecuente sería un linfoma intestinal que podría cursar con signos radiológicos similares pero la evolución suele ser más larga. Tras reiniciar alimentación oral, el paciente empeora mostrando de nuevo dilatación intestinal en la radiografía de abdomen con signos de obstrucción. En la radiografía de tórax se aprecia un patrón intersticial dudoso que se confirma por la TAC torácica en la que se observa además un patrón micronodular diseminado en ambos campos pulmonares que pudiera sugerir una TBC miliar. En la segunda TAC abdominal (Fig. 2) se confirman las adenopatías retroperitoneales y dilatación de las asas de intestino delgado con "stop" brusco en un asa yeyunal. Se pone de manifiesto cómo ha aumentado claramente el grosor de dicha asa, sugestivo de yeyunitis. En este contexto, el diagnóstico más probable sería el de una tuberculosis diseminada con afectación pulmonar y yeyunal.
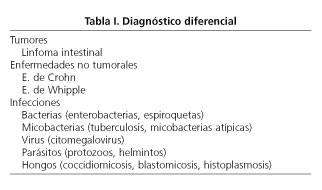
Dr. A. Cosme: Ante este paciente VIH (+), inmunodeprimido, con un proceso que compromete el tránsito yeyunal, la existencia de adenopatías intraabdominales y, probablemente, la participación del hígado, ante la historia clínica y el país de procedencia del enfermo, el diagnostico diferencial, antes de conocer los datos microbiológicos y endoscópicos, sería el siguiente (Tabla I).
Linfoma intestinal
Los linfomas más frecuentes en los pacientes con sida son los siguientes: linfoma inmunoblástico de células B (alto grado), linfoma de Burkitt, linfoma de células T y linfoma de Hodgkin. Los lugares más habituales de localización del linfoma B, que es el más común, son el SNC, medula ósea, tracto digestivo e hígado. Los del intestino delgado asientan sobre todo en íleon terminal y, en menor grado, en la región gastroduodenal. La localización yeyunal es rara. El síntoma predominante es el dolor abdominal y el hallazgo más frecuente la palpación de una masa abdominal. Se acompañan de otras manifestaciones sistémicas. El aspecto endoscópico adopta tres patrones: forma difusa (pliegues gruesos y rígidos con erosiones), ulcerada (úlceras anfractuosas de bordes sobreelevados e infiltrados) y polipoidea. El diagnóstico se basa en las biopsias de las lesiones (1). En este caso, las pruebas de imagen y analítica no permiten descartar el linfoma intestinal.
Enfermedad de Crohn
La afectación del yeyuno de forma aislada en la enfermedad de Crohn es rara. Cuando el tramo digestivo alto se afecta suele haber una ileocolitis granulomatosa de manera simultánea. De 500 casos de Crohn estudiados en la Clínica Mayo durante 14 años (1950-1964), en ocho se encontró una afectación duodenal y en ninguno estaba aislada y circunscrita a este territorio (2). Ni la clínica ni la exploración del paciente ni los hallazgos por técnicas de imagen sugieren una enfermedad de Crohn.
Enfermedad de Whipple
La presencia de adenopatías intraabdominales, dolor, fiebre y tos seca podrían hacer pensar en esta enfermedad pero los hallazgos radiológicos digestivos no lo sugieren.
Infecciones por enterobacterias
Otras enfermedades que pueden cursar con dolor abdominal, fiebre y adenopatías intraabdominales son la infección por Yersinia y la fiebre tifoidea. La infección por Y. enterocolitica, cuando afecta a pacientes inmunodeprimidos, provoca alteración del estado general, síndrome febril, hepatomegalia, dolor en hipocondrio derecho, a veces subictericia y durante su evolución puede presentarse neumonía. En la TAC abdominal se observan abscesos hepáticos múltiples. En íleon terminal aparecen úlceras (3). La infección por Salmonella typhi, tiene clínica similar con esplenomegalia, leucopenia con desviación izquierda y en un 60% de los enfermos tos seca. Por colonoscopia se pueden objetivar úlceras polimorfas de uno a varios centímetros, en íleon (cerca de la válvula íleo-cecal), ciego y colon ascendente. La infección por Shighella se manifiesta con dolor cólico, fiebre, tenesmo rectal y diarrea con moco, sangre y pus ("esputo rectal"). Suele ser frecuente en las proctitis de los homosexuales. Afecta al colon y recto. La clínica, los datos de laboratorio y pruebas de imagen no apoyan estas enfermedades.
Infección por espiroquetas
El antecedente de haber padecido una sífilis requiere que se descarte una lúes secundaria. Esta cursa con lesiones dérmicas, adenopatías intraabdominales, hepato-esplenomegalia, meningitis y otros síntomas. Durante la lúes secundaria hay participación gastrointestinal bien en forma de gastritis sifilítica hipertrófica o como proctitis ulcerosa o en placas (3). La clínica del enfermo no se corresponde con esta enfermedad
Infección por Mycobacterium tuberculosis
Hace más de 10 años, un tercio de los infectados por sida, sufrían una tuberculosis (TBC), de tal manera que la TBC era la infección oportunista mas común entre los pacientes VIH de muchos lugares del mundo (4). La infección primaria por TBC o reactivación de una tuberculosis latente en paciente con VIH es más frecuente en los que viven en zonas con alta prevalencia de tuberculosis. En los que tienen depresión importante de la inmunidad la diseminación de la TBC no se limita al pulmón si no que por vía hematógena se extiende al sistema mononuclerar fagocítico. El 45-75% de los pacientes con VIH tienen localizaciones extrapulmonares (ganglios linfáticos, hígado, peritoneo, tracto digestivo, etc.) (5). Las formas más habituales de presentación digestiva en la TBC, según Karawi (6), son: intestino delgado (íleon) 34%, peritoneo 31%, intestino grueso (colon derecho) 22%, tracto gastrointestinal superior 9% e hígado 4,6%. Actualmente, en la cuarta parte de los casos en que existe un foco pulmonar activo se encuentra afectado el tubo digestivo y en el 20% de los casos de TBC intestinal el pulmón se encuentra involucrado.
En los pacientes con sida la enfermedad se localiza en la región íleo-cecal en la mayoría de los casos. Los síntomas típicos son fiebre, dolor abdominal, pérdida de peso y cansancio. La diarrea y hematoquecia son menos comunes. Existen tres patrones endoscópicos de la enfermedad: ulcerativo, hiperplásico y estenótico. El ulcerativo es el más habitual y se localiza en íleon y yeyuno. En un 10% hay un patrón hiperplásico por reacción fibroblástica submucosa, y el menos frecuente es el tipo estenótico que puede afectar al íleon o al ciego-colon ascendente (5). La linfadenitis tuberculosa es uno de los hallazgos más comunes de la TBC abdominal. En algunos pacientes puede ser la única evidencia de localización intraabdominal. Es más común en los pacientes inmunodeprimidos. Los ganglios implicados son los mesentéricos, peripancreáticos e ileocecales, propios de la ruta por la que se produce la infección (7). Respecto a la afección hepatobiliar de la TBC existen tres formas clínicas de presentación: a) forma miliar, la más frecuente, en la que el hígado forma parte de una TBC miliar generalizada (lesiones en forma de tuberculomas o abscesos); b) forma local, poco frecuente. El hígado es el único órgano afectado (nódulos únicos o múltiples, abscesificados o no); y c) forma biliar, participan los conductos biliares (estenosis y compresión de la vía biliar). Es excepcional. Cuando se afecta el hígado por TBC suele existir hepatomegalia dolorosa y de superficie irregular. En la analítica hay colestasis disociada, fosfatasa alcalina muy elevada, bilirrubina normal o ligeramente alta, así como un discreto aumento de las transaminasas. La prueba de la tuberculina en los pacientes muy inmunodeprimidos o en los que han tenido contacto reciente con un paciente bacilífero puede ser negativa en presencia de infección, como le ocurría a este paciente, luego este dato ni confirma ni descarta una TBC activa. La sensibilidad de la tinción de Ziehl-Nielseen para identificar BAAR en muestras de origen digestivo es muy baja (3%). El cultivo en medio de Löwenstein llega al diagnóstico al cabo de 20-40 días en muchas ocasiones. La detección de ácidos nucleicos de micobacterias mediante PCR, permite acortar la espera diagnóstica (48-96 horas). Esta técnica parece que tiene igual o mayor sensibilidad que el cultivo de muestras pulmonares, aunque no está aprobado por la FDA para diagnósticos de otra localización. El estudio anatomopatológico de las biopsias de los órganos afectados puede aumentar las probabilidades diagnósticas si se evidencian granulomas caseificantes.
Micobacterias atípicas
La infección por Mycobacterium avium sucede aproximadamente en el 15-40% de los pacientes con sida y a diferencia de la tuberculosis aparece en las fases tardías de la enfermedad, cuando el recuento de CD4 es inferior a 50/ml (8). La clínica es anodina. Son comunes la fiebre, sudoración, escalofríos y pérdida de peso. Cuando hay diseminación existen adenopatías retroperitoneales, hepatoesplenomegalia y pancitopenia. El dolor abdominal y diarrea se explican por la afección intestinal o linfadenitis adyacente. Es infrecuente la presencia de sangre con las diarreas. Así como la participación digestiva es común, la pulmonar se ve en menos del 10% de los pacientes infectados por MAI (9). El aspecto endoscópico es variable y suele respetar el estómago y el bulbo duodenal. La forma más habitual son nódulos blanquecinos de 2-4 mm de diámetro con halo eritematoso, similar a la enfermedad de Whipple, aunque también se pueden encontrar úlceras duodenales superficiales o mucosa eritematosa con erosiones. Para el diagnóstico de infección diseminada, el hemocultivo en medios especiales para micobacterias, tiene una sensibilidad del 98% cuando se emplean dos muestras pero se necesitan de 15 a 40 días. Para acortar el tiempo se utilizan sondas de DNA. El cultivo de heces presenta una sensibilidad menor. La biopsia endoscópica es el mejor método para diagnosticar la afección del tubo digestivo.
Infección por citomegalovirus (CMV)
De las infecciones víricas en los pacientes VIH (+) inmunodeprimidos, la infección por CMV es la infección oportunista más frecuente. Afecta al tracto gastrointestinal en el 13-15% de los pacientes con sida (10). La afectación colónica (ciego y colon derecho) y la esofágica son las más habituales aunque también se han descrito localizaciones gastroduodenales que cursaron con clínica de dispepsia ulcerosa y/o hemorragia digestiva alta (11). En cambio la afectación del yeyuno es rara. No existen lesiones endoscópicas patognomónicas. La endoscopia permite visualizar imágenes de congestión, edema de la mucosa, úlceras de pequeño tamaño, engrosamiento de pliegues y/o estrechamiento de la luz intestinal. Las lesiones pseudotumorales son las menos reseñadas en las publicaciones, por eso cuando esto ocurre hay que hacer el diagnóstico diferencial con otras infecciones, linfomas, carcinomas y EII. Además de las manifestaciones gastrointestinales agudas o recurrentes existen las respiratorias (una de las vías de entrada del virus). Presentan diversos patrones pulmonares (intersticial, nodular, a veces con cavitaciones) dependiendo de la evolución de la enfermedad y de su asociación a otras infecciones como Pneumocystis carinii (PCP), en cuyo caso puede existir un patrón alveolar importante. Suele haber disociación clínico-radiológica. Otros hallazgos, propios de la enfermedad diseminada por CMV, son la afección hepática (hepatomegalia, bilirrubina no muy alta, transaminasas (inferior a 800 U/l) y ocular (coriorretinitis). El examen histológico de las biopsias de las lesiones digestivas permite hacer el diagnóstico de infección por CMV. Cuando el número de células con cuerpos de inclusión es escaso, el examen inmunohistoquímico o la hibridación in situ pueden facilitar el diagnóstico, pero no está reconocida la superioridad de estas técnicas comparada con el examen histológico exhaustivo.
Infecciones por protozoos
La amebiasis es común en los trópicos y en los homosexuales con sida. La infección por E. histolytica produce en la mayoría de los pacientes manifestaciones intestinales (dolor abdominal, tenesmo, diarreas sanguinolentas y fiebre) por afectación del colon y en una minoría (1% de los enfermos), síntomas extraintestinales sobre todo en hígado y pulmón (abscesos hepáticos, derrame pleural, fístulas hepato-pulmonares). Los hallazgos endoscópicos de las lesiones del colon, que afectan al colon izquierdo pudiendo llegar hasta el derecho, son semejantes a los de la colitis ulcerosa, Balantidium coli y otros procesos. Balantidium coli produce un cuadro semejante al de la amebiasis. La infección sólo afecta al colon y, ocasionalmente, al íleon terminal. Cuando la infección se disemina o agrava suelen presentarse manifestaciones extraintestinales como pleuritis, abscesos hepáticos y peritonitis (3). La leishmaniasis cursa con fiebre, hepatoesplenomegalia, pancitopenia e hipergammaglobulinemia. La leishmaniasis visceral es una infección oportunista en pacientes infectados por VIH en áreas endémicas. Si bien el parásito tiende a infectar el sistema mononuclear fagocítico, en los últimos años se han descrito casos de afectación gastrointestinal (cualquier tramo digestivo) (12). La localización principal es el colon y produce diarrea y rectorragia. Las lesiones endoscópicas (ulceraciones y pólipos erosionados) son inespecíficas.
Infección por protozoos esporulados
En los pacientes con sida el cuadro autolimitado de diarrea acuosa explosiva, de una a dos semanas de duración, dolor abdominal y febrícula producido por Cryptosporidium sp evoluciona hacia un cuadro crónico y refractario de gran severidad y morbimortalidad. La localización preferente es el intestino delgado proximal, y en menor grado, el colon (13). Isospora belli produce un cuadro idéntico. La localización del protozoo se hace en yeyuno-duodeno (3). El caso en discusión no sugiere ninguna de estas enfermedades por protozoos.
Infección por helmintos
La esquistosomiasis es endémica en algunas zonas de América del Sur. Es causa de lesiones granulomatosas en el intestino e hígado. Las lesiones intestinales (úlceras y pseudopólipos) producen fiebre y dolor abdominal y se localizan en recto, sigma e intestino delgado (14). En el hígado los granulomas pueden llevar secundariamente a la instauración de hipertensión portal. Se descarta mediante la búsqueda de huevos del parásito en heces o tejidos. Las pruebas serológicas actualmente utilizadas tienen una sensibilidad superior al 90%. Cuando son positivas indican que existe una infección presente o ya pasada (3). Esta opción se descarta por la clínica del paciente.
Infecciones por hongos
La infección primaria por coccidiomicosis en pacientes con sida es más habitual si el enfermo reside en áreas endémicas (continente americano). Es, a menudo, el resultado de una reactivación o infección latente. Predominan las manifestaciones pulmonares con síntomas respiratorios que van en aumento. Al comienzo existe un patrón reticulonodular difuso y posteriormente nódulos, cavitaciones, adenopatías hiliares y derrame pleural. En los casos de diseminación se observan adenopatías extratorácicas, lesiones cutáneas, artritis y meningitis. No he encontrado trabajos sobre la participación del tracto digestivo en esta infección (15). El diagnóstico se hace por cultivo y/o tomas biópsicas de las lesiones. La blastomicosis, prevalente en Sudamérica, cursa en su forma visceral con ganglios regionales (en hilio hepático, hilio esplénico y mesenterio) y lesiones nodulares en bazo, pulmón e hígado (3). Los síntomas del paciente no se explican por estas micosis.
Otra de las micosis a incluir en el diagnóstico diferencial es la histoplasmosis, enfermedad endémica en América y África. Histoplasma capsulatum produce en los pacientes inmunocompetentes una enfermedad respiratoria subclínica y autolimitada, en general. En el 95% de los infectados por VIH, se manifiesta como enfermedad diseminada. Se ha descrito una incidencia del 0,5% en los pacientes con sida de áreas no endémicas y del 25% en los de zonas endémicas (16). En la primoinfeccion pulmonar pueden observarse infiltrados pulmonares o linfadenopatías hiliares en la radiografía de tórax. La enfermedad se complica cuando los ganglios se caseifican o la fibrosis perilesional daña las estructuras vecinas. Aparecen síntomas obstructivos en tráquea, bronquios, esófago, pericarditis, granulomas mediastínicos o fibrosis con compresión de las estructuras adyacentes y formación de fístulas, siendo las más comunes las broncoesofágicas.
Histoplasma capsulatum en los VIH imunodeprimidos se localiza en los macrófagos de las adenopatías viscerales, hígado, bazo y médula ósea. El 70-80% de los pacientes con histoplasmosis diseminada tiene afectación gastrointestinal comprobada por estudios anatomopatológicos, pero menos del 10% presentan sintomatología por la misma. La forma de presentación más común de la histoplasmosis diseminada son los infiltrados difusos en pulmones, linfadenopatías viscerales, hepatoesplenomegalia y pancitopenia. Los síntomas gastrotintestinales más frecuentes son la diarrea y hematoquecia. Todo el tubo digestivo puede afectarse pero con mayor frecuencia lo hacen el intestino delgado (25% de los casos) y colon (80%). Hasta el año 2000, se habían recogido 30 casos de histoplasmosis gastrointestinal en la literatura anglosajona (17). Los hallazgos endoscópicos son de tres tipos: a) en forma de masa o estenosis "en corazón de manzana" que simulan tumores malignos, la más común; b) ulceraciones solitarias o múltiples que recuerdan a la enfermedad de Crohn, en un tercio de los casos; y c) edema, eritema, o pseudopólipos múltiples, en casos aislados. Hasta el año 2001 se habían reseñado 14 casos de histoplasmosis en sida en la literatura médica española, uno con afectación gastrointestinal (18,19). El diagnóstico se hace mediante el aislamiento del hongo en cultivos y la visualización en biopsias. Los cultivos a veces precisan semanas para dar un resultado. El rendimiento diagnóstico es aproximadamente el 50% para los hemocultivos, 60-70% para las muestras respiratorias, 50-75% para el examen histológico y 70-90% para los cultivos de médula ósea (18). Existe una técnica para la detección de un antígeno de tipo polisacárido, mediante radioinmunoanálisis en fase sólida que permite hacer el diagnóstico en 24 horas (sensibilidad 95% y especificidad 98%) (20).
De las diferentes enfermedades analizadas en el diagnóstico diferencial son cuatro las que podrían ser compatibles con la sintomatología del paciente: infección por CMV, MAI tuberculosis e histoplasmosis. Descarto la infección por CMV ante la antigenemia, hemocultivo y cultivo de la biopsia negativos. Tampoco se ven inclusiones por CMV en la mucosa colónica. La infección por MAI y M. tuberculosis aunque no explican la clínica en su totalidad ni los hallazgos radiológicos son propios de estas enfermedades, dada la demora diagnóstica de los cultivos no pueden ser excluidas. El diagnóstico de histoplasmosis, al ser una micosis no habitual en nuestro medio, tampoco puede excluirse aunque la búsqueda de hongos en la mucosa del colon fuese negativa. Las tres enfermedades cursan con granulomas infecciosos. El linfoma es menos probable pero no puede excluirse. El paciente fue tratado con cuatro tuberculostáticos, a pesar de lo cual no se apreció mejoría clínica, analítica ni radiológica. Al contrario, se acentuó la estenosis yeyunal e incluso se retiró el tratamiento específico por una supuesta toxicidad hepática que persistió, probablemente por la enfermedad subyacente. También se sospechó proceso pulmonar por PCP y fue tratado en ese sentido pero los cultivos y biopsias obtenidos por broncoscopia fueron negativos para CMV, PCP, TBC, criptococos y otros posibles agentes infecciosos.
Por todo esto descarto la infección por M. tuberculosis y MAI. La infección por Histoplasma capsulatum justificaría las manifestaciones sistémicas de este enfermo colombiano VIH e inmunodeprimido (adenopatías intraabdominales, daño hepático, afectación del colon, estenosis yeyunal y lesiones pulmonares).
DIAGNÓSTICO DEL DR. A. COSME
Histoplasmosis diseminada en paciente infectado por VIH e inmunodeprimido
Dr. Manuel Vaquero: Es importante considerar que, con relativa frecuencia, los pacientes con infección por VIH presentan más de una patología concomitante, por lo que no se puede descartar que, además de padecer alguno de los diagnósticos barajados como probables por el Dr. Cosme, no tenga también un linfoma añadido.
Dr. Gabriel Zubillaga: ¿Tenía el paciente algún trabajo o afición relacionada con cuevas? Lo pregunto por la epidemiología de la histoplasmosis.
Dr. José Antonio Iribarren: No, el paciente no trabajaba en cuevas ni era aficionado a la espeleología. Aunque los suelos de las cuevas y granjas pueden estar contaminados por Histoplasma capsulatum, este también suele encontrarse en la tierra procedente de excavaciones y construcciones de diferentes países. Se han descrito casos sin claro antecedente epidemiológico (16). En el presente caso, se pensó en tres posibilidades diagnósticas: enfermedad por micobacterias (tuberculosis o micobacteriosis atípica), linfoma y algunas micosis endémicas (histoplasmosis, coccidiomicosis, blastomicosis). Ante la dificultad inicial para llegar a un diagnóstico etiológico se puso tratamiento empírico frente a tuberculosis y micobacterias atípicas. Se planteó la realización de una biopsia de médula ósea y/o hígado con cultivo en medios adecuados para aislamiento de hongos y micobacterias. Dado que el paciente a las tres semanas persistía con obstrucción intestinal y que la cirugía era necesaria se pensó que la intervención podría esclarecer, sin necesidad de otros procedimientos, el diagnóstico. A continuación, el cirujano que intervino al paciente nos describirá los hallazgos quirúrgicos.
Dr. Javier Álvarez Caperochipi: Se planificó una laparotomía exploradora por obstrucción intestinal subaguda/crónica de manera programada, si el enfermo se mantenía estable. Así sucedió. Se procedió a la laparotomía encontrándose a 80 cm del ángulo duodeno-yeyunal una tumoración de aspecto inflamatorio que englobaba intestino delgado y meso sin datos orientativos respecto a su etiología. Se hizo resección de 40 cm de intestino delgado que correspondía a la zona afectada junto con el meso y se realizó anastomosis término-terminal.
Se enviaron muestras de la pieza y de las adenopatías a anatomía patológica y microbiología para la investigación, sobre todo, de micobacterias y hongos, además de los gérmenes habituales. El aspecto macroscópico del hígado era normal. El postoperatorio transcurrió sin incidencias con una recuperación buena del paciente.
DISCUSIÓN ANATOMOPATOLÓGICA
Dr. Francesc Felipo: Se recibió un segmento de intestino delgado de 32 cm de longitud en el que se identificaba una tumoración intramural que retraía la serosa. Su sección medía 2,5 cm e infiltraba todo el espesor de la pared así como el tejido adiposo del meso. Se identificaron numerosas adenopatías, la mayor de 2 cm. Histológicamente se trataba de un infiltrado linfohistiocitario difuso que ulceraba la mucosa y afectaba a la pared intestinal de forma transmural, observándose numerosas estructuras redondeadas de localización tanto intra como extracelular, positivas para las técnicas de PAS y plata metenamina, y negativas para Ziehl-Neelsen, Fontana-Masson y Giemsa. Los ganglios aislados mostraban una imagen similar a la del intestino con cierta tendencia a la formación de estructuras granulomatoides. (Figs. 3, 4 y 5). La imagen morfológica de las lesiones en el contexto clínico del paciente correspondía a una histoplasmosis. Histoplasma capsulatum tiene cada vez más importancia como agente patógeno en pacientes con sida, siendo actualmente la micosis endémica más común en estos sujetos (21). La incidencia de la infección en Europa es menor que la observada en el continente americano. La infección yeyunal aislada es rara, ya que en la mayoría de los pacientes inmunodeprimidos con histoplasmosis diseminada, las lesiones gastrointestinales son preferentemente de localización colónica (22,23). El espectro de las lesiones del tracto digestivo incluye úlceras (49% de los casos), nódulos (21%), hemorragia (13%), masas obstructivas (6%) y mucosa normal (23%). Los hallazgos histológicos que se pueden observar son infiltrados linfohistiocitarios difusos (83%), ulceraciones (45%), nódulos linfohistiocitarios (25%) o mínima reacción inflamatoria (15%), y es poco frecuente el hallazgo de granulomas bien definidos (8,5%) (24). El diagnóstico diferencial se debe hacer con otras micosis y con las micobacterias. El uso de diferentes tinciones histoquímicas, fundamentalmente PAS, plata metenamina de Gomori y Fontana-Masson, facilita el diagnóstico diferencial al identificar las hifas y levaduras del hongo. Aunque la detección del patógeno mediante PCR es el método más sensible, no es superior al de las tinciones histoquímicas (25).
El caso en discusión tiene como característica excepcional la afección intestinal predominante y su presentación como lesión inflamatoria estenosante que hizo sospechar neoplasia maligna.
DIAGNÓSTICO ANATOMOPATOLÓGICO
Histoplasmosis intestinal
Dra. P. López: ¿Se revisó con posterioridad la biopsia de colon que se realizó al inicio del ingreso mediante colonoscopia?
Dr. F. Felipo: Se volvieron a revisar las muestras sin que se observaran cambios sugestivos de histoplasmosis.
Dr. M. Vaquero: Dadas las manifestaciones proteiformes de muchas entidades, es esencial, para un correcto diagnóstico, disponer de los datos clínicos de la forma más completa posible.
Dr. A. Cosme: En estos momentos existen varios tipos de procedimientos diagnósticos basados en la endoscopia (punción aspirativa con aguja fina guiada por ecoendoscopia o ecolaparoscopia, enteroscopia por pulsión, cápsula endoscópica trazadora), algunos de los cuales no están disponibles en nuestro hospital, que podrían haber ayudado al diagnóstico. En este sentido, la detección de antígeno de Histoplasma sp en orina es un método sensible y específico que permite un diagnóstico rápido.
Dr. J. A. Iribarren: La detección del antígeno de Histoplasma sp en orina y en otros fluidos corporales es un método diagnóstico no comercializado que, lamentablemente, sólo está disponible en un hospital de referencia de una zona endémica de EE.UU. (Indianápolis).
Respecto a este caso, los cultivos de la pieza y de las adenopatías fueron negativos. Tras la cirugía, el paciente mejoró de manera espectacular. Después de conocer el diagnóstico anatomopatológico, se planteó el tratamiento con anfotericina B. Sin embargo, el paciente toleraba mal la hospitalización y preguntó por otras alternativas terapéuticas. Por ello, se optó por itraconazol oral, con buena evolución clínica, incluyendo la normalización del patrón de colestasis que tenía el paciente. A la espera del procedimiento quirúrgico apareció el patrón intersticial/micronodular en la radiografía de tórax. Los síntomas respiratorios mejoraron con cotrimoxazol pero no se hallaron patógenos en el estudio broncoscópico.
En resumen, se trata de un enfermo con histoplasmosis de localización intestinal y hepática, y neumonitis por el propio Histoplasma sp. o por Pneumocystis carinii. Para finalizar conviene resaltar que con la llegada masiva de inmigrantes, además de las enfermedades habituales, surgirán otras propias de sus países de origen, circunstancia a tener en cuenta cuando se hagan los diagnósticos diferenciales en esta población.
BIBLIOGRAFÍA
1. Feldman M, Friedman LS, Sleisenger MH. Gastrointestinal and liver disease. 7th ed. Philadelphia: WB Saunders-Elsevier Science Ed, 2002. [ Links ]
2. Jones GW Jr, Dooley MR, Schoenfield LJ. Regional enteritis with involvement of the duodenum. Gastroenterology 1966; 51: 1018-22. [ Links ]
3. Mandell GL, Bennet JE, Dolin R, et al. Principles and practice of infectious diseases. 5th ed. Philadelphia: Churchill Livingstone, 2000. [ Links ]
4. Frieden TR, Sterling T, Pablos-Méndez A, Kilburn JO, Cauthen GM, Dooley SW. The emergence of drug-resistant tuberculosis in New York City. N Engl J Med 1993, 328: 521-6. [ Links ]
5. Maroto N, Ponce M. Tuberculosis y aparato digestivo. Gastroenterol Hepatol 2003, 26: 34-41. [ Links ]
6. al Karawi MA, Mohamed AE, Yasawy MI, Graham DY, Shariq S, Ahmed AM, et al. Protean manifestation of gastrointestinal tuberculosis: report on 130 patients. J Clin Gastroenterol 1995; 20: 225-32. [ Links ]
7. Falcó V, Colomo LL, Ayuso JR. Varón de 27 años con fiebre de 10 días de evolución y adenopatías mesentéricas y retroperitoneales. Med Clin (Barc) 2003; 121: 270-5. [ Links ]
8. Havlik JA Jr, Horsburgh CR Jr, Metchock B, Williams PP, Fann SA, Thompson SE III. Disseminated Mycobacterium avium complex infection: clinical identification and epidemiologic trends. J Infect Dis 1992; 165: 577-80. [ Links ]
9. Basgoz N, Mattia AR. Weekly clinicopathological exercises: Case 4-1994: A 38- year old man with AIDS and the recent onset of diarrea, hematochezia, fever, and pulmonary infiltrates. N Engl J Med 1994; 330: 273-80. [ Links ]
10. Smith PD, Quinn TC, Strober W, Janoff EN, Masur H. NIH conference. Gastrointestinal infections in AIDS. Ann Intern Med 1992; 116: 63-77. [ Links ]
11. Wilcox CM, Schwartz DA. Symtomatic CMV duodenitis. An important clinical problem in AIDS. J Clin Gastroenterol 1992; 14: 293-7. [ Links ]
12. Laguna F, García-Samaniego J, Soriano V, Valencia E, Redondo C, Alonso González-Lahoz JM. Gastrointestinal leishmaniasis in human immunodeficiency virus infected patients: Report of five cases and review. Clin Infect Dis 1994; 19: 48-53. [ Links ]
13. Clayton F, Heller T, Kotler DP. Variation in the enteric distribution of criptosporidia in AIDS. Am J Clin Pathol 1994; 102: 420-5. [ Links ]
14. Madácsy L, Molnár T, Nagy I, Tiszlavicz L, Lonovics J. Recurrent nonvariceal upper gastrointestinal bleeding in a patient with gastroduodenal schistosomiasis. Endoscopy 2003; 35: 230-3. [ Links ]
15. Fish DG, Ampel NM, Galgiani JN, Dols CL, Kelly PC, Johnson CH, et al. Coccidiodomycosis during human immunodeficiency virus infection. A review of 77 patients. Medicine (Baltimore) 1990; 69: 384-91. [ Links ]
16. Wheat LJ, Connolly-Stringfield PA, Baker RL, Curfman MF, Eads ME, Israel KS, et al. Disseminated histoplasmosis in the acquired immune deficiency syndrome: clinical findings, diagnosis and treatment, and review of the literature Medicine (Baltimore) 1990; 69: 361-74. [ Links ]
17. Halline AG, Maldonado-Lutomirsky M, Ryoo JW, Pau A, Pursell K. Colonic histoplasmosis in AIDS: unusual endoscopic findings in two cases. Gastrointest Endosc 1997, 45: 199-204. [ Links ]
18. Benito N, García Vázquez E, Blanco A, de Górgolas M, Gadea I, Escalonilla P, et al. Histoplasmosis diseminada en pacientes con sida. Estudio de dos casos y revisión de la bibliografia española. Enferm Infecc Microbiol Clin 1998; 16: 316-21. [ Links ]
19. Martín Relloso MJ, Sánchez-Fayos P, González Guirado A, Calvo R, Polo B, Bosch O, et al. Aspecto endoscópico de histoplasmosis colónica en paciente HIV. En: XXIII Jornada Nacional de Endoscopia Digestiva, La Coruña, 30 de noviembre y 1 de diciembre de 2001, Ediciones Ergon, S.A, 2002. p. 66-7. [ Links ]
20. Wheat LJ, Wheat H, Connolly P, Kleiman M, Supparatpinyo K, Neloson K, et al. Cross-reactivity in Histoplasma capsulatum variety capsulatum antigen assays of urine samples from patients with endemic mycoses. Clin Infect Dis 1997; 24: 1169-71. [ Links ]
21. Suh KN, Anekthananon T, Mariuz PR. Gastrointestinal histoplasmosis in patients with AIDS: case report and review. Clin Infect Dis 2001; 32: 483-91. [ Links ]
22. Hofman P, Mainguené C, Huerre M, Michiels JF, Galibert A, Caroli FX, et al. Pseudotumeur colique a Histoplasma capsulatum au cours du SIDA. Diagnostic morphologique et immunohistochimique d'une lésion isolée. Arch Anat Cytol Pathol 1995; 43: 140-6. [ Links ]
23. Hertan H, Nair S, Arguello P. Progressive gastrointestinal histoplasmosis leading to colonic obstruction two years after initial presentation. Am J Gastroenterol 2001; 96: 221-2. [ Links ]
24. Lamps LW, Molina CP, West AB, Haggitt RC, Scott MA. The pathologic spectrum of gastrointestinal and hepatic histoplasmosis. Am J Clin Pathol 2000; 113: 64-72. [ Links ]
25. Bialek R, Ernst F, Dietz K, Najvar LK, Knobloch J, Graybill JR, et al. Comparison of staining methods and a nested PCR assay to detect Histoplasma capsulatum in tissue sections. Am J Clin Pathol 2002; 117: 597-603. [ Links ]











 texto en
texto en