Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 no.3 Madrid mar. 2010
Valor pronóstico de las micrometástasis linfoganglionares en pacientes con cáncer colorrectal en estadios A y B de Dukes (T1-T4, N0, M0)
Prognostic value of lymph node micrometastases in patients with colorectal cancer in Dukes stages A and B (T1-T4, N0, M0)
R. Uribarrena-Amezaga1, J. Ortego2, J. Fuentes1, N. Raventós3, P. Parra2 y R. Uribarrena Echevarría1
1 Servicio de Digestivo. Hospital Miguel Servet.
2 Departamento de Anatomía Patológica. Hospital Clínico Universitario Lozano Blesa.
3 Servicio de Urgencias. Hospital Miguel Servet. Zaragoza
Dirección para correspondencia
RESUMEN
Introducción: un 30% de los pacientes con cáncer colorrectal (CCR) en estadios A y B de Dukes (T1-T4, N0, M0) presentan recidiva tumoral y/o fallecen a los 5 años. Esta inesperada mala evolución, en casos presumiblemente curados podría deberse, entre otras causas, a la presencia de micrometástasis linfoganglionares no detectadas en el estudio de rutina: hematoxilina-eosina (H&E).
Objetivo: determinar si la presencia de micrometástasis linfoganglionares detectadas mediante inmunohistoquímica con anticuerpos anticitoqueratina AE1/AE3, influyen en la evolución del CCR.
Pacientes y métodos: se han estudiado los ganglios linfáticos locorregionales de 85 pacientes con CCR en estadios A y B de Dukes (T1-T4, N0, M0), mediante técnicas de inmunohistoquímica con anticuerpos anticitoqueratinas AE1/AE3, para poner de manifiesto la presencia de micrometástasis. Se ha realizado un estudio descriptivo, inferencial bivariante y de supervivencia, según distintos factores de riesgo, centrado en la presencia o no de micrometástasis.
Resultados: hemos observado que el estadio de Dukes y la angioinvasión neoplásica son factores que influyen en el pronóstico de estos pacientes. Sin embargo, no se ha demostrado que la presencia de micrometástasis linfoganglionares se asocie a una peor evolución en el CCR.
Conclusiones: las micrometástasis linfoganglionares locorregionales detectadas mediante anticuerpos anticitoqueratina AE1/AE3, en pacientes con CCR en estadios A y B de Dukes, no se asocian a una menor supervivencia.
Palabras clave: Adenocarcinoma colorrectal. Pronóstico. Micrometástasis.
ABSTRACT
Background: 30% of patients with colorectal cancer (CRC) in Dukes stages A and B (T1-T4, N0, M0) present tumor recurrence and die after 5 years follow up. This unexpectedly poor evolution might be attributable to the presence of lymph node micrometastasis undetected in routine examination with haematoxilin-eosine (H&E).
Objective: to assess the presence of undetected micrometastasis.
Patients and methods: we conducted a retrospective study of the locoregional lymph nodes in 85 patients operated for CRC in Dukes stages A and B (T1-T4, N0, M0), using immunohistochemistry with anticytokeratin antibodies AE1/AE3. In this descriptive, inferential bivariant and survival study, we analyzed different risk factors, including local infiltration T1/T4, Dukes A/B, number of dissected lymph nodes, vascular invasion, micrometastasis, tumor recurrence and death in the context of the presence or absence of micrometastases.
Results: Dukes stage and neoplastic angioinvasion are influential in patient prognosis; however, lymph node micrometastases were not associated with a poorer outcome of CRC.
Conclusions: locorregional lymph node micrometastases detected with anticytokeratine antibodies AE1/AE3 in Dukes A and B CRC patients are not associated with reduced survival.
Key words: Colorectal adenocarcinoma. Prognosis. Micrometastases.
Introducción
La supervivencia global en el cáncer colorrectal (CCR) se sitúa en torno al 50% a los 5 años y no ha mejorado de forma sustancial en los últimos años, a pesar del avance en los métodos diagnósticos y terapéuticos (1). Oscila entre el 80-90% del Dukes A, 60-80% en el Dukes B, 30-35% en el Dukes C y 5-25% en el D (2-5). El principal factor pronóstico en el CCR es la presencia o no de metástasis en los ganglios linfáticos regionales (1,6).
Paradójicamente, entre el 20 y el 33% de los pacientes diagnosticados de CCR, con ganglios linfáticos negativos (N0) estudiados mediante técnicas histológicas convencionales, sufrirán una recidiva/muerte tumoral antes de 5 años (4,5). Esto nos lleva a pensar que una proporción importante de los tumores Dukes A y B podrían estar infraestadificados.
La técnica habitual de disección de los ganglios, corte de los mismos en dos o más partes y selección de una de ellas para inclusión en parafina y tinción mediante hematoxilina-eosina (H&E), plantea dos problemas: por una parte, únicamente examinamos una porción del tejido ganglionar, y por otra, la tinción rutinaria con H&E puede no conseguir ver pequeños cúmulos de células tumorales (7,8). Por lo tanto, esta supuesta infraestadificación podría deberse a la falta de sensibilidad del estudio histológico convencional para detectar las micrometástasis ganglionares.
Las micrometástasis se definen como pequeños depósitos linfoganglionares de células tumorales, inferiores a 2 mm de diámetro, alejados de la lesión original. Se distinguen de las macrometástasis porque no tienen una fuente propia de aporte sanguíneo y se alimentan a través de la difusión pasiva de nutrientes y oxígeno, lo que limita su crecimiento. Estos pequeños grupos de células tumorales podrían permanecer quiescentes durante largos periodos, hasta que el sistema inmune las eliminara o hasta que se produjeran fenómenos de angiogénesis, con formación de nuevos vasos sanguíneos que permitieran el crecimiento de las micrometástasis (8).
Para detectar las micrometástasis son necesarias otras técnicas diagnósticas más sensibles que la H&E, como la inmunohistoquímica o la PCR (8,9). La mayor parte de las técnicas de inmunohistoquímica para la detección de micrometástasis del CCR utilizan anticuerpos monoclonales anticitoqueratinas que revelan la presencia de células epiteliales en el ganglio, lo que por tanto indicaría su naturaleza neoplásica metastásica (8,10). También se pueden detectar con anticuerpos anti-CEA, proteína sobreexpresada en un 96% de los CCR y no presente en células normales (11), y con anticuerpos anti β-HCG, muy aumentada en células tumorales del tracto gastrointestinal (12). En el 19-32% de los CCR con ganglios linfáticos negativos en el estudio con H&E, se pueden detectar micrometástasis mediante un estudio inmunohistoquímico (13-16).
El hecho anteriormente mencionado de que tumores N0 presenten recidivas sistémicas, hace que nos preguntemos si las micrometástasis podrían jugar algún papel en la evolución de la enfermedad.
Pacientes y métodos
Pacientes
Se han estudiado de forma retrospectiva 85 pacientes diagnosticados y operados de CCR estadios A y B de Dukes (N0, M0) en el Hospital Clínico Universitario Lozano Blesa de Zaragoza (HCU) y en Hospital Provincial de Zaragoza (HPZ) entre los años 1995-2000.
Se establecieron como criterios de exclusión: a) la administración de radioterapia y quimioterapia adyuvante; b) la existencia de metástasis linfoganglionares detectables mediante el estudio histológico convencional (H&E); c) la existencia de metástasis a distancia en el momento de la cirugía; y d) la asociación, dentro de los 5 años anteriores y posteriores al diagnóstico del CCR, de otras neoplasias distintas al CCR que pudieran interferir en la evolución de los pacientes.
Estudio inmunohistoquímico
De los bloques de tejido fijado en formalina neutra al 10% e incluido en parafina, de cada caso de CCR se seleccionaron todos los bloques correspondientes a los ganglios linfáticos, y se hicieron nuevos cortes de 5 μ de espesor. Se volvieron a revisar mediante técnicas de H&E todos los ganglios linfáticos para descartar falsos N0. Posteriormente, los cortes sucesivos se desparafinaron, hidrataron e introdujeron en tampón buffer citrato (pH6). Después, se realizó el bloqueo de la actividad de la peroxidasa endógena mediante incubación en H2O2 al 5% en metanol. A continuación, se realizó desenmascaramiento antigénico mediante cocción en olla a presión durante 10 minutos en citrato (Target Retrieval Solution, Dakocytomation), para después pasar los cortes por suero de bloqueo (suero de caballo) y Ac anti-citoqueratinas de amplio espectro (AE1/AE3, Dakocytomation, Glostrup, Denmark), a una dilución 1/500, para intentar poner de manifiesto la presencia de células epiteliales en los ganglios linfáticos, es decir, la existencia de metástasis que quedaron ocultas en el estudio convencional con las técnicas de rutina (H&E).
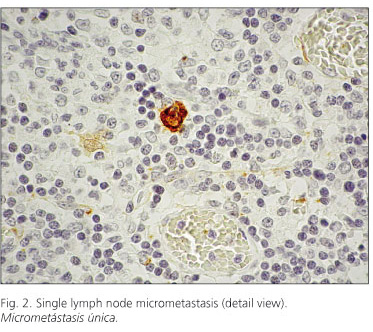
El método de detección utilizado fue el EnVisión kit (de Dakocytomation, Glostrup, Denmark), con diaminobenzidina como revelador y tinción de contraste nuclear con hematoxilina, como cromógeno (Figs. 1, 2 y 3).
Estudio estadístico
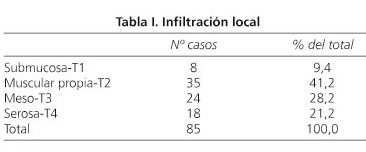
En el estudio descriptivo se exponen las distintas características tumorales analizadas en nuestro trabajo: infiltración local: sumbucosa (T1), muscular (T2), meso (T3), serosa (T4); estadio de Dukes: A o B (se excluyen C y D); localización del tumor: recto, sigma, resto del colon; edad y sexo de los pacientes; número de ganglios linfáticos resecados; invasión vascular (sí o no); existencia de micrometástasis (sí o no); recidiva tumoral (sí o no) y mes en que recidiva; exitus (sí, no) y mes en que fallece.
También hemos hecho un estudio inferencial bivariante para ver si existen diferencias entre los pacientes con micrometástasis y los que no las presentan, en cuanto a una serie de variables recogidas en el estudio. Para ello hemos aplicado el test de Chi cuadrado de Pearson, con la corrección de Yates o la prueba exacta de Fisher, si fuera necesario. También hemos utilizado el test de la t de Student, el análisis de varianza, las técnicas no paramétricas de la U de Mann-Whitney o el test de Kruskal-Wallis. En aquellos casos en donde el ANOVA o el test de Kruskal-Wallis es significativo, se han realizado comparaciones múltiples entre los grupos para ver cuáles de ellos son significativamente diferentes entre sí. Esto se ha hecho aplicando el coeficiente de correlación de Pearson y el coeficiente de rangos de Spearman. El nivel de confianza escogido para los test es del 95%.
Finalmente, hemos analizado la supervivencia mediante el test de Mantel-Henzel.
Resultados
De los 85 casos estudiados, 42 eran Dukes A y 43 Dukes B. Según su infiltración local, 8 de los pacientes eran T1, 35 T2, 24 T3 y 18 eran T4 (Tabla I). En cuanto a la localización, 23 (27,05%) se asentaban en el recto, 54 (63,52%) en el colon sigmoide y 8 (9,41%) en el resto del colon. El grado de malignidad fue bajo en 11 casos (12,9%), medio en 71 (83,5%) y alto en 3 (3,5%). La distribución por sexos fue 49 hombres (57,6%) y 36 mujeres (42,4%). La edad media fue de 67,32 años con un rango que oscilaba entre 29 y 88 años (desviación típica 10,71, intervalo de confianza de la media 65,01-69,63).
Se disecó una media de 10,75 ganglios linfáticos por paciente (desviación típica 6,72, intervalo de confianza para la media de 9,3-12,2). En 54 casos (63,5%) no se detectaron micrometástasis, por 31 casos (36,5%) en los que sí se evidenciaron.
Se produjo recidiva de la enfermedad y posterior fallecimiento por el tumor en 22 casos (26,9%). La recidiva se produjo, como media, en el mes 23,73 de seguimiento, con un rango que osciló entre 2 y 82 meses (desviación típica 20,24, intervalo de confianza para la media de 14,75-32,7).
En el estudio inferencial bivariante se dividieron los pacientes en dos grupos: a) micrometástasis No y b) micrometástasis Sí.
De los 54 pacientes en los que no se detectaron micrometástasis (grupo micrometástasis No), 28 (51,9%) eran Dukes A y 26 (48,1%) Dukes B. Los 31 pacientes con micrometástasis linfoganglionares (micrometástasis Sí), 14 (45,2%) pertenecían al grupo de Dukes A y 17 Dukes B (54,8%). Calculando una Chi cuadrado de Pearson de 0,712 (> 0,05), se establece que no existe asociación estadística entre la presencia de micrometástasis linfoganglionares y el estadio de Dukes (Tabla II).
Existe correlación entre la presencia de micrometástasis y el número de ganglios resecados. En el grupo de micrometástasis Sí se disecó una media de 15 ganglios frente a los 8,31 del grupo de micrometástasis No. Viendo el p-valor = 0,000 (< 0,05) de la prueba U de Mann-Whitney se observa que presentan un significativo mayor número de ganglios resecados los de micrometástasis Sí. Dicho de otro modo, a mayor número de ganglios linfáticos aislados, mayor probabilidad de detectar micrometástasis.
Se han comparado también ambos grupos con la recidiva y fallecimiento por el CCR. En el grupo micrometástasis No, padecieron recidiva y posterior fallecimiento por el tumor 12 pacientes (22,2%), frente a 10 pacientes (32,3%), del grupo micrometástasis Sí. Sin embargo, esta diferencia, con un p-valor de la prueba de Chi cuadrado de Pearson de 0,477, no alcanza la significación estadística, por lo que no existe asociación entre la presencia de micrometástasis y la recidiva y exitus por el tumor (Tabla III).
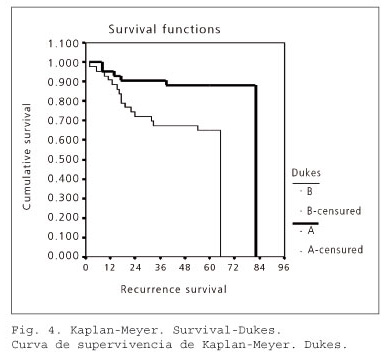
Por último, hemos realizado un estudio de supervivencia de Kaplan-Meier para determinar los factores pronósticos en el CCR. Primero hemos estudiado el estadio de Dukes. En el grupo Dukes A (42 casos), 6 fallecieron por una recidiva de la enfermedad (14,29%). En el grupo Dukes B (43 casos), 16 pacientes sufrieron una recidiva tumoral y fallecieron a consecuencia de ello (37,21%).
En el gráfico de las curvas de supervivencia según la estimación producto-límite de Kaplan-Meier para Dukes (A, B) se aprecia descriptivamente que entre los grupos sí existen diferencias en la recidiva. Mediante el contraste de Mantel-Haenszel (log-rank), se concluye que los individuos con Dukes B presentan un riesgo significativamente mayor de recidiva del CCR (estadístico = 6,78; p-valor = 0,0092) (Fig. 4).
También se ha analizado como factor pronóstico la invasión vascular por parte de células neoplásicas. Solamente en 3 de los 85 pacientes estudiados se detectó invasión vascular, en 2 de los cuales recidivó el CCR (66,6%). En los 82 casos restantes se observó recidiva de la enfermedad en 20 sujetos (24,39%).
En el estudio de supervivencia según la estimación producto-límite de Kaplan-Meier para invasión vascular (No, Sí), se aprecia que entre los grupos sí existen diferencias en la recidiva. Para extrapolar esta conclusión a nivel poblacional se ha utilizado el contraste de Mantel-Haenszel (log-rank), y se concluye que los individuos con invasión vascular presentan un riesgo significativamente mayor de recidiva y el éxitus por el tumor (estadístico = 4,94; p-valor = 0,0262). Hay que resaltar que el bajo número de casos con invasión vascular resta valor a esta afirmación.
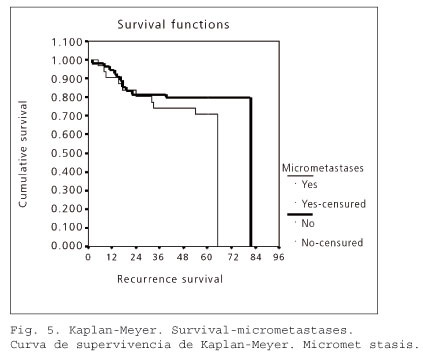
Finalmente, se ha analizado el impacto pronóstico de las micrometástasis linfoganglionares. En el grupo de micrometástasis No (54 casos), el cáncer recidivó en 12 (22,22%). En el grupo de micrometástasis Sí (31 pacientes), la enfermedad recidivó en 10 (32,26%).
En el gráfico de las curvas de supervivencia según la estimación producto-límite de Kaplan-Meier para micrometástasis (No, Sí) se aprecia descriptivamente que entre los grupos no existen diferencias en la recidiva. Mediante el contraste de Mantel-Haenszel (log-rank), se observa que, pese a las diferencias porcentuales en la recidiva tumoral, no hay diferencias significativas entre los dos grupos (estadístico = 1,11; p-valor = 0,2916), y que, por lo tanto, la presencia de micrometástasis no se asocia a un peor pronóstico en el CCR (Fig. 5).
Discusión
Como ya han descrito otros autores, el principal factor pronóstico en el CCR es la presencia o no de metástasis en los ganglios regionales (1,6). La principal caída en la supervivencia se observa entre los estadios B (N0) y C (N1) de Dukes, con unas supervivencias en torno al 60-80 y 30-35%, respectivamente (2,3).
Es especialmente significativo que aproximadamente el 30% de los pacientes con CCR sin afectación linfoganglionar en el estudio histológico rutinario mediante H&E, fallecerá por recidiva de la enfermedad (2-5). En nuestro estudio, el 12,5% de los pacientes con CCR Dukes A y el 37,8% de los Dukes B padecerá una recidiva tumoral y fallecerán debido a ello. Esto supone un 25,8% global para los grupos A y B de Dukes.
El estadio de Dukes y el crecimiento local del tumor son factores pronósticos contrastados y ampliamente aceptados en el CCR (2-5,17,18). Como era de esperar, en el análisis de supervivencia se observa una frecuencia en la recidiva y en el fallecimiento por el tumor significativamente mayor (p < 0,05) en los casos clasificados como Dukes B (37%) en comparación con los Dukes A (12,5%).
También alcanza significación estadística en nuestro estudio la evolución de los pacientes según la existencia o no de invasión vascular. El hallazgo de pequeños cúmulos aislados de células tumorales en los vasos sanguíneos, se asocia a un importante aumento de la recidiva tumoral, con la consiguiente disminución de la supervivencia (p = 0,02). No en vano, la invasión del torrente sanguíneo por parte del tumor es uno de los pasos necesarios para la formación de metástasis a distancia. Este hallazgo coincide con la mayor parte de los estudios sobre factores pronósticos revisados (19-22), aunque somos conscientes de que el bajo número de pacientes con invasión vascular en nuestro trabajo resta valor a este hallazgo.
La influencia de las micrometástasis linfoganglionares en el pronóstico del CCR, visibles únicamente mediante inmunohistoquímica, es un tema controvertido. Existen diversos estudios, mencionados con anterioridad, con resultados dispares (8,9). Como ya hemos comprobado, la mayor caída en la supervivencia del CCR se observa desde el Dukes B al C, esto es, desde N0 a N1. Por lo tanto, si la existencia de micrometástasis tuviera una significación similar a la de las metástasis linfoganglionares convencionales, la diferencia en el pronóstico entre los pacientes con y sin micrometástasis debería de ser evidente.
En los pacientes revisados, se resecó una media de 10,75 ganglios por cada caso. En primer lugar, volvimos a cortar los ganglios y a teñirlos con H&E para asegurarnos de que no se detectaban metástasis linfoganglionares mediante el estudio histológico convencional. Los siguientes cortes de los niveles adyacentes se estudiaron mediante técnicas de inmunohistoquímica. Una de las ventajas de la inmunohistoquímica es la posibilidad de utilizar muestras de tejido conservadas en parafina, lo que permite realizar estudios retrospectivos, como en nuestro caso (23).
Hemos encontrado micrometástasis en el 36,5% de los casos clasificados como no afectados mediante H&E (31 pacientes). En la bibliografía revisada se detectaron micrometástasis hasta en el 32% de los casos diagnosticados N0 con H&E (24), por lo que el porcentaje de detección de micrometástasis es discretamente mayor en nuestro trabajo. El estudio de Tschmelitsch y cols. (25) supone un caso extremo en este punto, ya que detectan micrometástasis en el 76% de los ganglios linfáticos negativos mediante H&E, y explican esta discrepancia por el elevado número de ganglios linfáticos estudiados en cada caso (una media de 16). Sin embargo, no es significativamente mayor al nuestro o al de otros trabajos, y no justificaría una diferencia tan notable. Quizá la ausencia de estandarización a la hora de realizar las técnicas inmunohistoquímicas, explique las diferencias observadas en el grado de detección de micrometástasis. Otros autores han utilizado anticuerpos monoclonales frente a distintas proteínas, como el antígeno carcinoembrionario (CEA), citoqueratina 20 (CK 20), citoqueratina AE1/AE3, etc. (11,14,25-29) lo que podría suponer una variabilidad en la sensibilidad para detectar las células tumorales. En una amplia revisión realizada por Nicastri y cols. (9), se apunta a la diferente sensibilidad para detectar micrometástasis según el anticuerpo utilizado y a la ausencia de un "patrón oro". El marcador inmunohistoquímico más habitual en los artículos revisados en ese trabajo es el anticuerpo anticitoqueratina AE1/AE3, el mismo utilizado por nosotros. En este sentido, Kong y cols., en su estudio retrospectivo, utilizan PCR cuantitativa a tiempo real con distintos marcadores como el CEA, CK20 y guanilil ciclasa C (GCC) para detectar las micrometástasis en ganglios congelados o conservados en parafina. Concluyen que existen diferencias en la detección de micrometástasis según el tipo de marcador o método de conservación ganglionar utilizado, por lo que recomiendan combinar varios marcadores para mejorar la sensibilidad de detección de las micrometástasis (30).
En el estudio bivariante se ha comprobado que existen diferencias significativas entre la existencia de micrometástasis y el número de ganglios resecados en la pieza quirúrgica. Hemos observado que en los casos con micrometástasis se ha obtenido un mayor número de ganglios linfáticos de media (15 ganglios), en comparación con los tumores sin micrometástasis (8,3). Esto podría estar causado por una estimulación inmunológica por parte del tumor y las micrometástasis que podría inducir a la formación de más ganglios linfáticos (31).
En 12 (22,2%) de los 54 pacientes en los que no se hallaron micrometástasis se produjo una recidiva tumoral y fallecieron por el tumor. De los 31 casos con micrometástasis linfoganglionares, el éxitus por recidiva tumoral se dio en 10 (32,25%). Sin embargo este 10% de aumento de la recidiva y la mortalidad, en el grupo de las micrometástasis, no alcanza la significación estadística (p = 0,2787). Por tanto, aunque sí se observan diferencias en la supervivencia, no podemos afirmar que las micrometástasis linfoganglionares supongan un factor predictivo de recidiva tumoral, ni de mayor riesgo de fallecimiento por el CCR. Este resultado concuerda con el de dos recientes estudios publicados por Steinert y cols. (32) y Fleming y cols. (33). En la revisión mencionada antes de Nicastri y cols. (9), también concluyen que la presencia de micrometástasis linfoganglionares detectadas mediante técnicas de inmunohistoquímica, no tiene una clara influencia en la evolución del CCR. En sólo 3 de los 11 estudios revisados se observaron diferencias pronósticas significativas (p < 0,05). En uno de ellos incluso se apreció una tendencia no significativa a una peor evolución en los pacientes sin micrometástasis. Atribuyen la disparidad de los resultados a importantes diferencias metodológicas, de tamaño muestral y de tipo de anticuerpos utilizados en los distintos artículos. Sin embargo, en este mismo trabajo, indican que en la mayor parte de los estudios en los que utilizan RT-PCR para detectar las micrometástasis, la presencia de las mismas se asocia a un peor pronóstico. Por lo tanto, es posible que la utilización de técnicas moleculares más sensibles que la inmunohistoquímica podría establecer diferencias pronósticas significativas.
Como principal conclusión de nuestro trabajo, se puede afirmar que la presencia de micrometástasis linfoganglionares locorregionales detectadas mediante anticuerpos anticitoqueratina AE1/AE3, en pacientes con CCR en estadios A y B de Dukes, no se asocia a una menor supervivencia.
Agradecimientos
Los autores agradecen a Lidia Floria, Pilar Pina, Sara Serrano y Carolina Villalba, Técnicos Superiores de Anatomía Patológica, su colaboración en la realización de la parte técnica de este trabajo, y al Dr. Javier Mateos, del Servicio de Anatomía Patológica del Hospital Provincial de Zaragoza, la aportación de varios casos.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rafael Uribarrena Amezaga.
Servicio de Enfermedades Digestivas.
Hospital Miguel Servet.
Paseo Isabel la Católica, 1-3. 50009 Zaragoza.
e-mail: uribarrenaa@hotmail.com
Recibido: 21-09-09.
Aceptado: 11-11-09.
Bibliografía
1. Fielding P. Staging Systems. In: Cohen A, Vimawer S, editors. Cancer of the colon, rectum and anus. New York: McGraw-Hill; 1995. p. 207. [ Links ]
2. Itzkowitz SH. Cáncer gastrointestinal: cáncer de colon y recto. In: Wilcox CM, editor. Digestive diseases self education program. Barcelona: Medical Trends; 2001. p. 25. [ Links ]
3. Hermanek P. pTNM and residual tumor classifications: problems of assesment and prognostic significance. World J Surg 1995; 19: 180-90. [ Links ]
4. Bilchik AJ, Saha S, Wiese D, Stonecypher JA, Wood TF, Sostrin S, et al. Molecular staging of early colon cancer on the basis of sentinel node analysis: a multicenter phase II trial. J Clin Oncol 2001; 19(4): 1128-36. [ Links ]
5. Ovaska J, Järvinen H, Kujari H, Pertilä I, Mecklin JP. Follow up of patients operated on for colorectal carcinoma. Am J Surg 1990; 159: 593-6. [ Links ]
6. Newland RC, Chapuis PH, Pheils MT, MacPherson JG. The relationships of survival to staging and grading colorectal carcinoma: a prospective study of 503 cases. Cancer 1981; 47: 1424-9. [ Links ]
7. Bilchik AJ, Nora D, Tollenar RAEM, Van de Velde CJH, Wood T, Turner R, et al. Ultrastaging of early colon cancer using lymphatic mapping and molecular analysis. Eur J Cancer 2002; 38(7): 977-85. [ Links ]
8. Kell MR, Winter DC, O'Sullivan GC, Shanahan F, Redmond HP. Biological behaviour and clinical implications of micrometastases. Br J Surg 2000; 87(12): 1629-39. [ Links ]
9. Nicastri DJ, Doucette JT, Godfrey TE, Hugues SJ. Is occult lymph node disease in colorectal cancer clinically significant? A review of the relevant literature. J Mol Diagn 2007; 9(5): 563-71. [ Links ]
10. Moll R, Franke WW, Schiller DI, Geiger B, Krepler R. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells. Cell 1982; 31: 11-24. [ Links ]
11. Cutait R, Alves VA, Cámara L, Cutait DE, Borges JL, Singer J, et al. Restaging colorectal cancer based on the identification of lymph node micrometastases through immunoperoxidase staining of CEA and cytokeratins. Dis Colon Rectum 1991; 34: 917-20. [ Links ]
12. Wong JH, Steineman S, Caldería C, Bowles J, Namiki T. Ex vivo sentinel node mapping in carcinoma of the colon and rectum. An Surg 2001; 233(4): 515-21. [ Links ]
13. Greeson JK, Isenhart CE, Rice R, Mojzisik C, Houchens D, Martin EW. Identification of occult micrometastases in pericolic lymph nodes of Dukes'B colorrectal cancer patients using monoclonal antibodies against cytokeratin and CC49. Cancer 1994; 73(3): 563-9. [ Links ]
14. Liefers GJ, Cleton-Jansen AM, Van de Velde CJ, Hermans J, Van Krieken HJM, Cees J, et al. Micrometastases and survival in stage II colorectal cancer. N Eng J Med 1998; 339(4): 223-8. [ Links ]
15. Bendavid Y, Latulippe JF, Younan RJ, Leclerc YE, Dube S, Heyen F, et al. Phase I on sentynel lymph node mapping in colon cancer: A preliminary report. J Surg Oncol 2002; 79(2): 81-4. [ Links ]
16. Shimoyama M, Yamazaki T, Suda T, Hatakeyama K. Prognostic significance of lateral lymph node micrometastases in lower rectal cancer: an immunohistochemical study with CAM5.2. Dis Colon Rectum 2003; 46(3): 333-9. [ Links ]
17. Bouvet M, Milas M, Giacco GG, Cleary KR. Janjan NA, Skibber JM. Predictors of recurrence after local excision and postoperative chemoradiation therapy of adenocarcinoma of the rectum. An Surg Oncol 1999; 6(1): 26-32. [ Links ]
18. Di Gregorio C, Benati P, Losi L, Roncucci L, Pedroni M, Scarselli A, et al. Incidence and survival of patients with Dukes A (Stage T1 and T2) in colorrectal carcinoma: A 15-year population based study. Int Colorectal Dis 2005; 20(2): 147-54. [ Links ]
19. Offerhaus GJ, Giardiello FM, Bruijn JA, Stijnen T, Molyvas EN, Fleuren GJ. The value of immunohistochemistry for collagen IV expression in colorectal carcinoma. Cancer 1991; 67(1): 99-105. [ Links ]
20. Celen O, Yildrim E, Berberoglu U. Factors influencing outcome of surgery for stage I rectal cancer. Neoplasma 2004; 51(6): 487-90. [ Links ]
21. Hassan C, Zullo A, Risio M, Rossini FP, Morini S. Histologic risk factors and clinical outcome in colorectal malignant polyp: a pooled data analysis. Dis Colon Rectum 2005; 48(8): 1588-96. [ Links ]
22. Meguerditchian AN, Bairati I, Lagace R, Harel F, Kibrite A. Prognostic significance of limphovascular invasion in surgically cured rectal carcinoma. Am J Surg 2005; 189(6): 707-13. [ Links ]
23. Goldenberg DM, Sharkey RM, Primus FJ, Carcinoembryonic antigen in histopathology immunoperoxidase staining of conventional tissue sections. J Natl Cancer Inst 1976; 57: 11-22. [ Links ]
24. Oberg A, Stenling N, Tavelin B, Lindmark G. Are lymph node micrometastases of any clinical significance in Dukes A and B colorectal cancer? Dis Colon Rectum 1988; 41(10): 1244-9. [ Links ]
25. Tschmelitsch J, Klimstra DS, Cohen AM. Lymph node micrometastases do not predict relapse in stage II colon cancer. Ann Surg Oncol 2000; 7: 601-8. [ Links ]
26. Rosemberg R, Hoos A, Mueller J, Baier P, Stricker D, Werner M. Prognostic significance of cytokeratin-20 reverse trancriptase polymerase chain reaction in lymph nodes of node-negative colorectal cancer patients. J Clin Oncol 2002; 20(4): 1049-55. [ Links ]
27. Greeson JK, Isenhart CE, Rice R, Mojzisik C, Houchens D, Martin EW. Identification of occult micrometastases in pericolic lymph nodes of Dukes' B colorrectal cancer patients using monoclonal antibodies against cytokeratin and CC49. Cancer 1994; 73(3): 563-9. [ Links ]
28. Bilchik AJ, Hoon DS, Saha S, Turner RR, Wiese D, Di Niome M, et al. Prognostic impact of micrometastases in colon cancer: Inerim results of a prospective multicenter trial. Ann Surg 2007; 246: 568-75. [ Links ]
29. Park SJ, Lee KY, Kim SY. Clinical significance of lymph node micormetastases in stage I an II colorectal cancer. Cancer Res Treat 2008; 40(2): 75-80. [ Links ]
30. Kong SL, Salto-Téllez M, Leong AP, Chan YH, Koay ES. Discordant quantitative detection of putative biomarkers in nodal micrometastases of colorectal cancer: Biological and clinical implications. J Clin Pathol 2005; 58(8): 839-44. [ Links ]
31. Takeuchi H, Kitajima M, Kitagawa Y. Sentinel lymph node as a target of molecular diagnosis of lymphatic micrometastasis and local immunoresponse to malignant cells. Cancer Sci 2008; 99(3): 441-50. [ Links ]
32. Steinert R, Hantschick M, Vieth M, Gastinger I, Khünel F, Lieperth H, et al. Influence of subclinical tumor spreading on survival, after curative surgery for colorectal cancer. Arch Surg 2008; 143: 122-8. [ Links ]
33. Flemming FJ, Hayanga AJ, Glynn F, Thakore H, Kay E, Gillen P. Incidence and prognostic influence of lymph node micrometastases in rectal cancer. Eur J Surg Oncol 2007; 33: 998-1002. [ Links ]











 texto en
texto en