Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Neurocirugía
versión impresa ISSN 1130-1473
Neurocirugía vol.16 no.4 ago. 2005
Existencia de hipoperfusión oculta sistémica en el traumatismo craneoencefálico. Estudio preliminar
F. Murillo-Cabezas; R. Amaya-Villar; Mª.D. Rincón-Ferrari; J.M. Flores-Cordero; J. Valencia-Anguita*; S. García-Gómez y Mª.A. Muñoz-Sánchez
Servicio de Cuidados Críticos y Urgencias. *Servicio de Neurocirugía. Hospitales Universitarios Virgen del Rocío. Sevilla.
Resumen
Objetivos. Investigar en pacientes con traumatismo craneoencefálico grave y moderado (TCE), hemodinámicamente estables, la relación entre los valores arteriales de ácido láctico (AL) en las primeras 48 horas con la evolución y complicaciones del TCE, y conocer qué factores de riesgo se relacionan con valores anormales de AL.
Material y métodos. Estudio observacional, prospectivo, de cohorte, de 210 pacientes adultos con TCE grave y moderado. Conseguida la estabilización hemodinámica del paciente, se realizó una determinación basal de AL, que se repitió cada 12 horas durante las primeras 48 horas y, posteriormente, cada 24 horas hasta la normalización de los valores de AL. Los pacientes se clasificaron en dos grupos: Grupo 1 (AL < 2,2 mmol/L) sin hipoperfusión oculta (HO), y grupo 2 (AL ≥ 2,2 mmol/L) con HO.
Resultados. 115 pacientes (57,76%) se catalogaron como grupo 1, y 95 pacientes (45,24%) como grupo 2. En el análisis univariante de los factores de riesgo para AL ≥ 2,2 mmol/L mostraron significación estadística todos los índices generales de gravedad del TCE [Glasgow Coma Scale (GCS), Injury Severity Score (ISS), Trauma Score Revisado (TSR) y Acute Physiology and Chronic Health Evaluation (APACHE) II], la hipotensión arterial, hipoxemia, anemia, hiper-glucemia, hipotermia y la mayor incidencia de administración de noradrenalina. Asimismo, en el grupo 1 se objetivó un mayor porcentaje en la TAC de ingreso de lesiones tipo II (53,91% vs. 38,94%) (p < 0,03). En el análisis multivariante de regresión logística, sólo dos factores se asociaron de forma independiente a valores elevados de AL: APACHE II en las primeras 24 horas: OR 1,12 (IC 95% 1,06-1,196; p < 0,0001) y volumen de líquidos total infundido en las primeras 48 horas: OR 1,09 (IC 95% 1,02-1,16; p < 0,0001). El grupo 2 se asoció, con significación estadística, a una mayor tasa de infecciones (63,2% vs 47,8%, p=0,026), y al aumento de la estancia en UCI. [mediana (percentil 25-75)] [13,29 (7,11-21,22) días vs. 8,78 (4,40-16,72) días; p < 0,018]. Aunque fue más alto el porcentaje de hipertensión intracraneal y mortalidad en el grupo 2, no se constató significación estadística. El aumento de AL, en el análisis multivariante, no se comportó como factor independiente de riesgo para las complicaciones estudiadas.
Conclusiones. La existencia de HO en pacientes con TCE graves y moderados, con valores de presión arterial postreanimación según las recomendaciones actuales, se asocia a una mayor gravedad del TCE manifestada por el APACHE II y por el volumen de líquidos administrado en las primeras 48 horas. La HO en el TCE conlleva un aumento de la tasa de infecciones y de la estancia en UCI.
PALABRAS CLAVE: Traumatismo craneoencefálico. Acido láctico. Hipoperfusión oculta. Deuda de oxígeno.
Evidence of occult systemic hypoperfussion in head injured patients. Preliminary study
Summary
Objectives. To determine the correlation between blood lactic acid levels in the first48 hours and outcome, in hemodynamically stable patients, with moderate or severe head injury (HI), and to investigate the risk factors associated with abnormal lactate levels.
Material and methods. A prospective observational study, in 210 adults patients with moderate or severe head injury. When the patients were hemodynamically stable, blood lactate concentrations were measured once on admission, twice daily during the first 2 days and once daily until lactate levels were normalized. The whole group 210 patients were divided into 2 groups. Group 1: (LA < 2,2 mmol/L) patients without occult hypoperfussion (OH), and group 2: (LA ≥ 2,2 mmol/L) patients with OH.
Results. One hundred and fifteen patients (57,76%) were categorized as group 1, and 95 patients (45,24%) as group 2. In the univariate analysis of risk factors for blood lactate ≥ 2,2 mmol/L the following variables showed statistical significance: severity of the head injury measured by several scales [Glasgow Coma Scale (GCS), Injury Severity Score (ISS), Revised Trauma Score (RTS) and Acute Physiology and Chronic Health Evaluation (APACHE) II], arterial hypotension, hypoxemia, anaemia, hyperglucemia, hypothermia, a greater incidence of norepinephrine infusion, and the higher percentage of type II lesions in the head computerized tomography at admission showed in the group 1 (53,91% vs. 38,94%) (p < 0,03). In the multiple logistic regression analysis only two variables were risk independently associated with elevated blood lactate concentration: APACHE II in the first 24 hours: OR 1,12 (95% IC 1,06-1,196; p < 0,0001) and the first 48-hours total fluid infusion volumes: OR 1,09 (95% IC 1,021,16; p < 0,0001). The infection rate (63,2% vs 47,8%, p=0,026), and length of ICU stay [mediana (percentil 25-75)] [13,29 (7,11-21,22) days vs. 8,78 (4,40-16,72) days; p < 0,018] were significantly higher in patients with blood lactate ≥ 2,2 mmol/L (group 2). Although, the percentage of intracranial hypertension and mortality was higher in the group 2, there was no significant difference. In the multivariate analysis, the increase of blood lactate concentration, was not independently associated as a risk factor with studied complications.
Conclusions. The presence of OH in patients with moderate or severe head injury, with postres uscitation arterial pressure, according to present recommendations, is associated with a more severe head injury, showed by APACHE II and the total fluid infusion volumes in the first 48 hours. OH in head injury increases the infection rate and length of ICU stay.
KEYWORDS: Head Injury. Lactic Acid.; Occult hypoperfussion. Oxygen Debt.
Recibido: 3-09-04. Aceptado: 29-11-04
Abreviaturas. AIS: abbreviated injury scale. AL: ácido láctico. APACHE II: acute physioly and chronic health evaluation II. GCS: Glasgow coma scale. HO: hipoperfusión oculta. ICU: intensive care unit. ISS: injury severity score. LA: lactic acid. OH: occult hypoperfussion. RTS; revised coma score. SDRA: síndrome de distrés respiratorio del adulto. TAC: tomografia axial computarizada. TCE: traumatismo craneoencefálico. TSR: trauma score revisado. UCI: unidad de cuidados intensivos.
Introducción
Las alteraciones en cualquiera de los elementos implicados en la cadena de la oxigenación celular, sobre todo, los relacionados con el transporte de oxígeno como la presión arterial y saturación de oxígeno de la hemoglobina, se han reconocido como origen de lesiones secundarias que afectan negativamente el pronóstico del TCE. Por ello, actualmente se recomienda una rápida estabilización hemodinámica que garantice una presión de perfusión cerebral correcta y evite las consecuencias de una perfusión inadecuada de los órganos1. Sin embargo, en la práctica clínica, la estabilización hemodinámica se define, habitualmente, por parámetros que solamente informan de la situación macrohemodinámica (presión arterial, diuresis, gases arteriales, etc.), sin poder asegurar que no exista hipoxia tisular.
La hipoxia tisular, o deuda de oxígeno, se objetiva en la clínica por un incremento de los valores de AL, reflejo, a su vez, de metabolismo anaeróbico sistémico, sobre todo en pacientes con traumatismos graves13. La posibilidad de hipoxia tisular oculta ha propiciado múltiples estudios en pacientes politraumatizados, con hemodinámica estable o inestable, resultando, en la mayoría, que el incremento de las cifras de AL se relaciona con la severidad del traumatismo, con aumento de la mortalidad y morbilidad expresada, ésta última, por mayor porcentaje de infecciones, shock séptico y disfunción multiorgánica6,10.
En el TCE se han estudiado profusamente los valores de AL en líquido cefalorraquídeo, en sangre venosa yugular, con o sin relación con el lactato arterial, así como en muestras de fluido extracelular obtenidas por microdiálisis cerebral con el objetivo de conocer la existencia de metabolismo cerebral anaeróbico y sus implicaciones en el manejo y pronóstico del paciente9,25. Por el contrario, las consecuencias clínicas de los valores elevados de lactato arterial en el TCE, como expresión de hipoxia tisular sistémica, no han sido suficientemente examinadas. El propósito del presente estudio es investigar en pacientes con TCE, hemodinámicamente estables, por un lado, la relación entre los valores arteriales de AL en las primeras 48 horas con la evolución y complicaciones del TCE, y por otro, conocer qué factores de riesgo se relacionan con valores anormales de AL.
Material y métodos
Estudio observacional, prospectivo, de cohorte, realizado en la Unidad de Cuidados Intensivos (UCI) de Neurotraumatología de los Hospitales Universitarios Virgen del Rocío de Sevilla, hospital de tercer nivel, durante un período de 30 meses (1 de Mayo de 2001 a 30 de Noviembre de 2003).
Pacientes
Se incluyeron todos los pacientes adultos (16 a 65 años de edad, ambos inclusive) ingresados con TCE moderado y grave. Se consideró TCE grave cuando el paciente presentaba, según la GCS26 un nivel de conciencia entre 4 y 8 puntos tras reanimación médica adecuada prehospitalaria o en el área de emergencias, y TCE moderado cuando, en las mismas circunstancias de reanimación, la puntuación de la GCS se situaba entre 9 y 13 puntos.
Fueron excluidos del estudio los pacientes con edad inferior a 16 años o superior a 65 años; TCE con GCS de 3 puntos o presencia de midriasis bilateral arreactiva tras reanimación médica y quirúrgica, cuando esta última se consideró oportuna; TCE con lesiones traumáticas asociadas en otras áreas del organismo cuya gravedad fuera superior a 2 puntos de la Abbreviated Injury Scale (AIS); los pacientes con signos de shock (hipoperfusión manifiesta); los pacientes en tratamiento con corticoides o citostáticos; los infectados por el virus de la inmunodeficiencia humana y mujeres embarazadas. Como criterios de gravedad se emplearon la GCS tras reanimación médica; TSR prehospitalario7, ISS2, una vez diagnosticada todas las lesiones de las distintas áreas corporales; y el APACHE II16 peor de las primeras 24 horas de ingreso en la UCI. El manejo hemodinámico de los TCE se realizó de acuerdo al protocolo general de la unidad y criterio del médico responsable, y la prevención y tratamiento de la hipertensión intracraneal, segun un protocolo previamente publicado20. Los pacientes fueron seguidos hasta su fallecimiento o alta hospitalaria.
Diseño del estudio
Una vez conseguida la estabilización de la macrohemodinamia (presión arterial sistólica > 100 mmHg, frecuencia cardíaca < 120 latidos/min, diuresis > 0,5 mL/Kg/h, etc.) se realizó la determinación basal de AL que coincidió con las seis primeras horas de ingreso en UCI; posteriormente se extrajeron muestras para AL cada 12 horas durante las primeras 48 horas y luego cada 24 horas hasta que los valores retornaron a la normalidad. Las muestras de sangre arterial, extraídas en jeringas específicas para tal prueba, se procesaron inmediatamente en la propia UCI en un analizador marca Radiometer ABL 735, (Copenhagen, Dinamarca). El valor de AL normal es < 1,5 mmol/L; sin embargo, para asignar significado clínico a la determinación de AL se estableció el punto de corte en 2,2 mmol/L. Según los valores de AL en las primeras 48 horas, los pacientes se dividieron en dos grupos: Grupo 1 (AL < 2,2 mmol/L en todo el periodo de observación) que hemos denominado sin HO, y grupo 2 (AL ≥ 2,2 mmol/L) con HO.
Además de los datos demográficos, GCS, ISS, TSR, APACHE II y hallazgos en la tomografía computarizada craneal (inicial y peor), categorizados de acuerdo a la clasificación propuesta por Marshall et al.18, se recogieron las siguientes variables agrupadas en tres fases: l. Prehospitalaria: hipoxemia (saturación de oxígeno (Sat02) capilar por pulsioximetría < 90%) e hipotensión (presión arterial sistólica < 90 mmHg); 2. Primeras 24 horas de hospitalización en UCI: hipoxemia definida por PaO2/FiO2 < 250 mmHg; hipotensión arterial cuando se constató algún episodio de presión arterial sistólica < 90 mmHg que no precisó de administración extra de volumen o fármacos vasoactivos; shock expresado por presión arterial sistólica < 90 mmHg que requirió la administración extra de volumen o fármacos vasoactivos para su corrección; hiperglucemia (glucemia > 180 mg/dL); anemia (hemoglobina < 10 g/dL.); hipertemia (temperatura central ≥ 38°C); Hipotermia (temperatura central ≥ 36°C); 3. Complicaciones evolutivas: hipertensión endocraneal considerada cuando el paciente presentaba, al menos en 24 horas, dos o más registros de presión intracraneal (valores > 20 mmHg durante más de 20 minutos); empleo de drogas vasoactivos (dopamina o noradrenalina) para mantener una presión de perfusión cerebral ≥ 65 mmHg; volumen de líquidos total administrado en las primeras 48 horas; infecciones nosocomiales según los criterios propuestos por el CDC14 (neumonía nosocomial, bacteriemia primaria, infección por catéter o cualquier otra infección que provocara situación de sepsis grave); Desarrollo de síndrome de distrés respiratorio del adulto (SDRA) o síndrome de disfunción multiorgánica según los criterios de Moore et al.19; tiempo de estancia en UCI; fallecimiento o supervivencia del paciente en el hospital.
Análisis estadístico
Los resultados de todas las variables estudiadas, cualitativas y cuantitativas, se compararon entre los dos grupos establecidos y fueron recogidas y analizadas con el paquete estadístico SPSS 12.0. El análisis univariante se efectuó mediante el test de la t de Student de dos colas para variables continuas paramétricas, tras comprobar igualdad de varianza en el test de Levene. La prueba de U-Mann Whitney se empleó para variables continuas no paramétricas y el test de chi-square, Pearson o test exacto de Fisher para variables categóricas. Se consideró un valor estadísticamente significativo cuando la p fue < 0,05. El análisis multivariante de regresión logística se realizó para evaluar la contribución independiente de las variables, incluyendo aquellas con significación de p < 0,10 en el análisis univariante, y otras con relevancia clínica. La Odds Ratio (OR) y el intervalo de confianza del 95% también se calcularon para cada variable.
Resultados
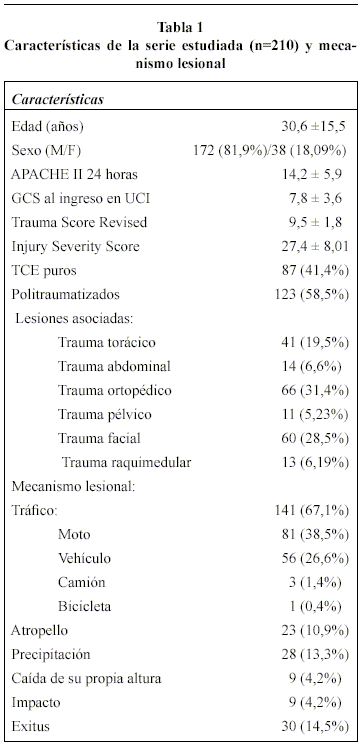
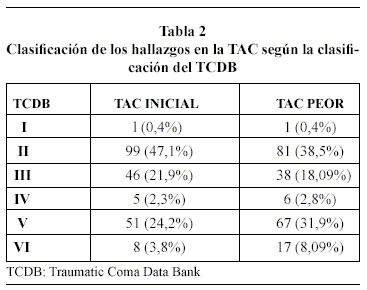
Doscientos diez pacientes, 136 TCE graves (64,7%) y 74 TCE moderados (35,3%) fueron incluidos en el estudio, cuyas características demográficas, clínicas, mecanismo lesional y hallazgos tomográficos se exponen en las tablas 1 y 2. Ciento quince enfermos (57,76%) se catalogaron como grupo 1, y 95 TCE (45,24%) como grupo 2. El valor medio de AL del grupo 1 fue de 1,17 ± 0,42 (rango de 0,3-2,1), mientras que el del grupo 2 fue de 3,05 ± 0,96 (rango de 2,2-8,4).
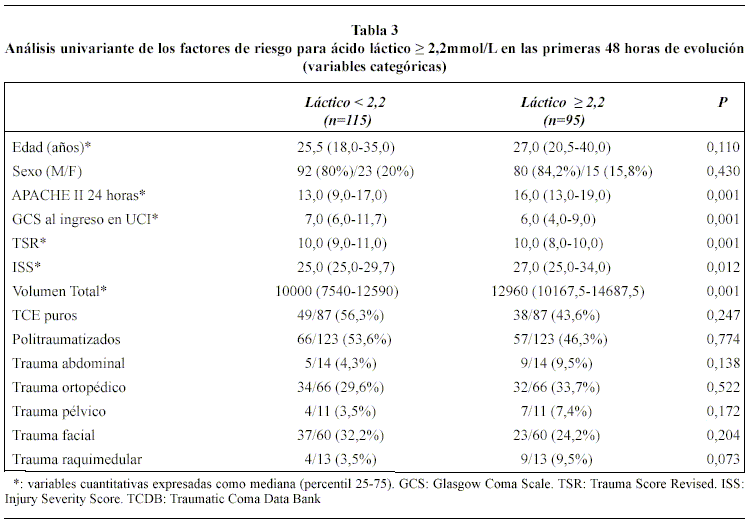
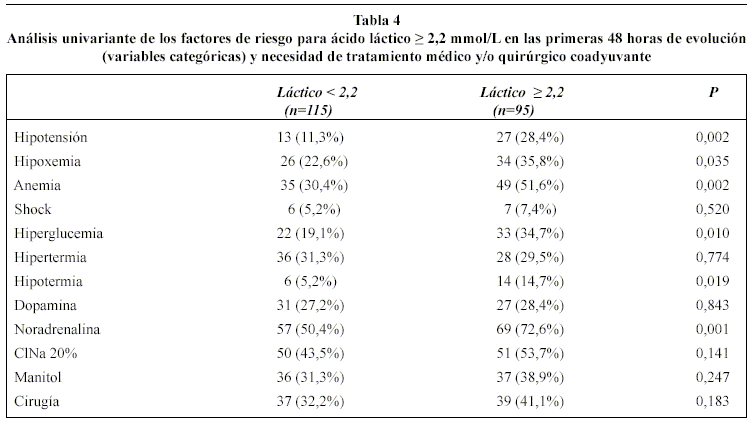
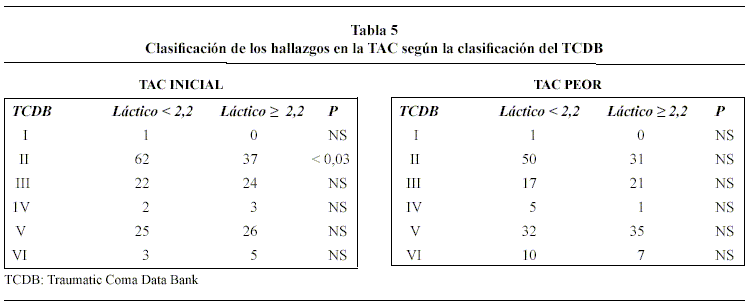
En la tablas 3 y 4, se muestran los resultados del análisis univariante de los factores de riesgo para AL ≥ 2,2 mmol/L en las primeras 48 horas. Estos análisis revelaron que todos los índices generales de gravedad del TCE (GCS, TSR, ISS y APACHE II) y la presencia de hipotensión arterial, hipoxemia, anemia, hiperglucemia, hipotermia y la mayor incidencia de administración de noradrenalina se asociaron, con significación estadística, al hallazgo de AL ≥ 2,2 mmol/L. Asimismo, el mayor porcentaje en la TAC de ingreso de lesiones tipo II, de menor severidad, en el grupo 1 (53,91% vs. 38,94%) obtuvo significación estadística (p < 0,03) Tabla 5. Sin embargo, en el análisis multivariante de regresión logística, únicamente dos factores se asociaron de forma independiente al hallazgo de valores elevados de AL: APACHE II en las primeras 24 horas (OR 1,12; IC 95% 1,06-1,196; p <0,0001) y volumen de líquidos total infundido en las primeras 48 horas (OR 1,09; IC 95% 1,02-1,16; p <0,0001).
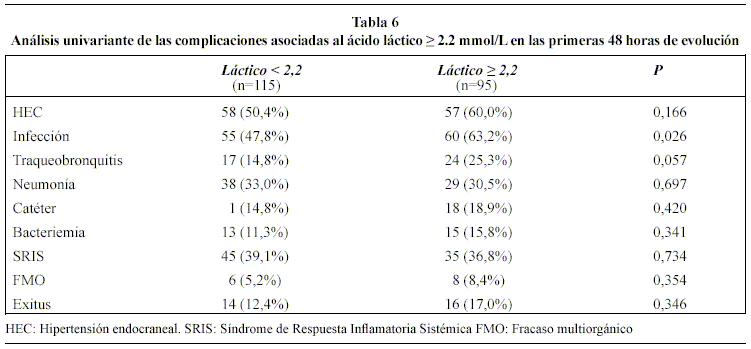
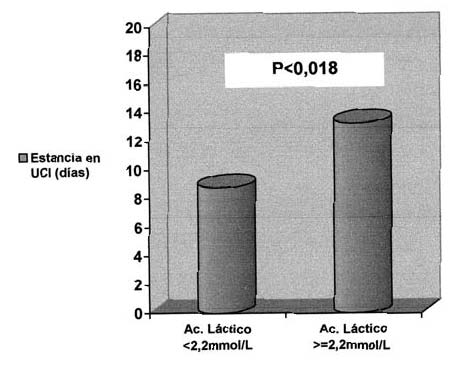
El grupo 2, como se observa en la tabla 6, se asoció, con significación estadística, a una mayor tasa de infecciones (63,2% vs 47,8%, p=0,026), fundamentalmente traqueobronquitis, y a un aumento de la estancia en UCI [mediana (percentil 25-75)] [13,29 (7,11-21,22) días vs. 8,78 (4,40-16,72) días; p<0,018]. (Figura 1). La mortalidad entre pacientes infectados y no infectados [14 (46,6%) versus 16 (53,4%), respectivamente] no mostró significación estadística (p=0,34) Aunque fue más alto el porcentaje de hipertensión intracraneal y mortalidad en el grupo 2, no se constató significación estadística. En el análisis multivariante, el aumento de AL no se comportó como factor independiente de riesgo para las complicaciones estudiadas.
Figura 1. Relación entre Hipoperfusión Oculta (HO) y estancia en UCI (días)
Discusión
La principal información que nuestros resultados aportan es que un alto porcentaje de TCE graves y moderados (45,24%), a pesar de conseguirse valores de presión arterial postreanimación acordes a las recomendaciones actuales, muestran valores de AL iniciales compatibles con HO. Es importante señalar que este hecho fue independiente de la coexistencia con el TCE de lesiones en otras áreas corporales y de la edad del paciente. Por el contrario, la existencia de deuda de oxígeno se asoció significativamente a dos circunstancias: mayor gravedad del TCE manifestada por la escala habitualmente empleada en pacientes críticos (APACHE II); y la necesidad de mayor cantidad de líquidos y drogas vasoactivas en las primeras 48 horas para mantener las variables hemodinámicas. Por otra parte, de nuestros resultados, también se deduce que las consecuencias negativas de la presencia de HO en el TCE son un aumento de la tasa de infecciones y de la estancia en UCI. No obstante, en la muestra estudiada, el aumento de mortalidad e incidencia de hipertensión intracraneal observada no alcanzó significación estadística.
Anteriormente, se había demostrado en el TCE la notable relación entre malos resultados e hipotensión arterial, postulándose diversos mecanismos fisiopatológicos como presión de perfusión cerebral inadecuada, hinchazón cerebral, etc.8,17. Sin embargo, estas publicaciones previas han correlacionado situaciones de hipoperfusión sistémica manifiesta, con el resultado final antes y en el curso de su evolución en UCI, ya que los valores de presión arterial estudiados (< 80 mmHg de presión arterial sistólica) así lo evidencian. En cambio, en nuestra serie se han excluido los pacientes con tales cifras de presión arterial o con signos clínicos positivos de hipoperfusión sistémica. Hasta donde nuestra información alcanza, es la primera vez que se indaga el papel que podría jugar un estado de HO en las primeras 48 horas con la supervivencia y complicaciones agudas del TCE.
A diferencia del TCE, en pacientes politraumatizados son muchos los trabajos dirigidos a analizar las consecuencias de la HO, empleando los valores elevados de AL como marcador de ésta. Los resultados demuestran de forma consistente que la HO, no corregida en las primeras 24 horas de UCI, se asocia a mayor gravedad del paciente e incrementa la morbi-mortalidad. El aumento de morbilidad se expresa en mayor número de infecciones; shock séptico; complicaciones respiratorias; fracaso multiorgánico y aumento de estancia en UCI4,6,10,11,24. Al igual que en el politraumatismo, en nuestros pacientes con TCE hemos comprobado la relación entre gravedad inicial de la lesión y presencia de HO al ingreso en UCI. Así en nuestra serie de TCE las diferentes escalas de gravedad mostraron significación estadística en el análisis univariante, no obstante, como otros autores han observado en pacientes politraumatizados, las escalas que miden el estado fisiológico como el APACHE II predicen mejor la situación de deuda de oxígeno que las escalas puramente anatómicas que por definición son estáticas6,21. La escala APACHE II incluye la GCS, atribuyéndole un alto peso en la puntuación final, además de un número significativo de variables biológicas y fisiológicas dinámicas. Al haber escogido la peor puntuación de dicha escala a las 24 horas, no extraña que sea la única escala que en el análisis multivariante mostró significación estadística.
Hemos observado una mayor mortalidad en el grupo con HO, aunque sin valor estadístico. Este hallazgo, en contradicción con otras poblaciones de pacientes politraumatizados, puede atribuirse a varios hechos. En primer lugar, que la muestra sea insuficiente por escaso número de pacientes con AL elevado, comparado con otras series de politraumatizados. En segundo lugar, al haber excluido los pacientes con signos evidentes de hipoperfusión sistémica, la deuda de oxígeno en el TCE no tenga el mismo alcance negativo que en el politraumatismo. Por otra parte, que el hecho, estadísticamente significativo, de haberse administrado mayor cantidad de fluidos y utilizado con mayor frecuencia drogas vasoactivas en el grupo con HO, haya impedido un mayor deterioro de la microhemodinamia y sus consecuencias24. Finalmente, y probablemente sea una explicación plausible, es que el peso de la infección, como responsable intermedio de la mortalidad, sea menor en el TCE que en politraumatizados. Como en otras series, hemos observado mayor número de infecciones, sobre todo de vías respiratorias, aunque éstas no han podido relacionarse con aumento de la mortalidad. De la misma forma, en otro grupo de pacientes con TCE grave, hemos demostrado que la neumonía nosocomial asociada no provoca un aumento de la mortalidad en el TCE, dependiendo ésta de la gravedad de la lesión traumática22.
Pensamos que nuestro trabajo tiene puntos fuertes a destacar. La novedad, ya comentada, del tema investigado y sus propios resultados. Así, hemos evidenciado la insuficiencia de los parámetros hemodinámicos rutinarios para garantizar un estado de normoperfusión tisular en el TCE. También, entre otros y aunque no sea el objetivo primario de nuestro trabajo, hemos mostrado dos hechos relacionados con la HO -incremento de la tasa de infecciones y mayor duración de la estancia en UCI- con importantes consecuencias económicas, dado que tanto una como otra son responsables directos del aumento del coste del proceso nosológico en cuestión.
Igualmente, tiene limitaciones que no queremos obviar. Aunque la serie total estudiada sea amplia, el número de pacientes con AL elevado puede ser insuficiente para demostrar diferencia en mortalidad y complicaciones mayores como las observadas en politraumatismos graves. Por ello, nuestros resultados deben considerarse preliminares. Por otra parte, puede cuestionarse el propio diseño del estudio en cuanto haber elegido el AL como marcador de HO en pacientes hemodinámicamente estables. Diferentes situaciones como procesos pulmonares inflamatorios difusos, sepsis en pacientes estables hemodinámicamente, estados de hiperglucolisis pueden elevar las cifras de AL sin hipoxia tisular12,13,15. Asimismo, los valores de AL no guardan una relación paralela con el grado de hipoxia, dado que al ser metabolizado el AL por el hígado y riñones, situaciones de bajo flujo en dichos órganos pueden magnificar las cifras de AL13. No obstante sus limitaciones, la mayoría de los autores consideran los valores elevados de AL como índice de deuda de oxígeno en los órganos4,13,27, recomendándose el reconocimiento y tratamiento precoz de la hiperlactacidemia como un objetivo para reducir la mortalidad en pacientes críticos, como los sépticos23.
Asimismo, en cuanto a valor pronóstico se ha señalado la superioridad de las cifras aisladas de lactato a las de piruvato o a la relación piruvato / lactato13. En nuestro caso, al haber estudiado los pacientes en la fase precoz del TCE donde las complicaciones sépticas son raras, y haber controlado la hiperglucemia como parte del protocolo de manejo, el aumento de AL solo puede explicarse por deuda de oxígeno.
Queda por contestar en futuras investigaciones dos preguntas: ¿Serán idénticos los resultados con una población mayor? ¿Será preciso guiar nuestras pautas de reanimación médica por parámetros que consigan en los pacientes más graves valores de transporte de oxígeno superiores a los considerados normales?3
Bibliografía
1. The Brain Trauma Foundation. The American Association of Neurological Surgeons. The Joint Section on Neurotrauma and Critical Care. Resuscitation of blood pressure and oxygenation. J Neurotrauma 2000; 17: 471-478. [ Links ]
2. Baker, S.P., O'Neill, B., Haddon, W., Long, W.B.: The Injury Severity Score: a method for describing patients with multiple injuries and evaluating emergency care. J Trauma 1974; 14: 187-196. [ Links ]
3. Bishop, M.H., Shoemaker, W.C., Appel, P.L., et al.: Relationship between supranormal circulatory values, time delays, and outcome in severely traumatized patients. Crit Care Med 1993; 21: 56-63. [ Links ]
4. Blow, O., Magliore, L., Claridge, J., Butler, K., Jeffrey, S.: The golden our and the silver day: detection and correction of occult hypoperfusion within 24 hours improves outcome from major trauma. J Trauma 1999; 47: 964-969. [ Links ]
5. Boto, G.R., Gómez, P.A., De la Cruz, J., Diez Lobato, R.: Factores pronósticos en el traumatismo craneoencefálico grave. Neurocirugía 2004; 15: 233-247. [ Links ]
6. Cerovi, O., Golubovi, V., pec-Marn, A., Krem, B., Vidmar, G.: Relationship between injury severity and lactate levels in severely injured patients. Intensive Care Med 2003; 29:1300-1305. [ Links ]
7. Champion, H.R., Sacco, W.J., Copes, W.S., Gann, D.S., Gennarelli, T.A., Flanagan, M.E.: A revision of the Trauma Score. J Trauma 1989; 29: 623-629. [ Links ]
8. Chesnut, R.M., Marshall, L.F., Klauber, M.R., et al.: The role of secondary brain injury in determining outcome from severe head injury. J Trauma 1993; 34: 216-222. [ Links ]
9. Chieregato, A., Marchi, M., Zoppellari, R., et al.: Detection of early ischemia in severe head injury by means of arteriovenous lactate differences and jugular bulb oxygen saturation. Relationship with CPP, severity indexes and outcome, Preliminary analysis. Acta Neurochir 2002 (Suppl); 81:289-293. [ Links ]
10. Cladrige, J.A., Crabtree, T.D., Pelletier, S.J., Butler, K., Sowyer, R.G., Young, J.S.: Persistent occult hypoperfusion is associated with a significant increase in infection rate and mortality in major trauma patients. J Trauma 2000; 48: 8-14. [ Links ]
11. Crowl, A.C., Young, J.S., Jeffrey, S., et al.: Occult hypoperfusion is associated with increased morbidity in patients undergoing early femur fracture fixation. J Trauma 2000; 48: 260-267. [ Links ]
12. De Backer, D., Creteur, J., Zhang, H., Norrenberg, M., Vincent, JL.: Lactate production by the lungs in acute lung injury. Am J Respir Crit Care Med 1997; 156: 1099-1104. [ Links ]
13. De Backer, D.: Lactic acidosis. Intensive Care Med 2003; 29: 699-702. [ Links ]
14. Garner, J.S., Jarvis, W.R., Emori, T.G., Horan, T.C., Hughes, J.M.: CDC definitions for nosocomial infections. Am J Infect Control 1988; 16: 128-140. [ Links ]
15. Gore, D.C., Jahoor, F., Hibbert, J.M., DeMaria, E.J.: Lactic acidosis during sepsis is related to increase pyruvate production, no deficits in tissue oxygen availability. Ann Surg 1996; 224: 97-102. [ Links ]
16. Knaus, W.A., Wagner, D.P., Draper, E.A., Zimmerman, J.E.: APACHE II. A severity of disease classification system. Crit Care Med 1985; 13: 818-829. [ Links ]
17. Marmarou, A., Anderson, R.L., Ward, J.D., et al.: Impact of ICP instability and hypotension on outcome in patients with severe head trauma. J Neurosurg 1991; 75 (Suppl) S28-S36. [ Links ]
18. Marshall, L.F., Marshall, S.B., Klauber, M.R.: A new classification of head injury based on computerized tomography. J Neurosurg 1991; 75 (Suppl): S59-S66. [ Links ]
19. Moore, F.A., Moore, E.E., Haenel, J.B.: Post-injury multiple organ failure. En: Feliciano, D.V., Moore, E.E., Matox, K.L., (eds). Trauma 3ª ed. Connecticut; Appleton and Lange, 1996; pp 1205-1218. [ Links ]
20. Murillo Cabezas, F., Arteta Arteta, D., Flores Cordero, J.M., et al.: Utilidad del doppler transcraneal en la fase precoz del traumatismo craneoencefálico. Neurocirugía 2002; 13:196-208. [ Links ]
21. Oppenheim, W.L.: Early biochemical changes and severity of injury on man. J Trauma 1980; 20: 135-140. [ Links ]
22. Rincón-Ferrari, M.D., Flores-Cordero, J.M., Leal-Noval, S.R., et al. Impact of ventilator-associated pneumoma in patients with severe head injury. J Trauma. (in press). [ Links ]
23. Rivers, E., Nguyen, B., Havstad, S., et al.: Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345: 1368-1377. [ Links ]
24. Rixen, D., Siegel, J.H.: Metabolic correlates of oxygen debt predict posttrauma early acute respiratory distress syndrome and the related cytokine response. J Trauma 2000; 49:392-403. [ Links ]
25. Robertson, C., Grossman, R.G., Goodman, J.C., Narayan, R.K.: The predictive value of cerebral anaerobic metabolism with cerebral infarction after head injury. J Neurosurg 1987; 67: 361-368. [ Links ]
26. Teasdale, G., Jennnet, B.: Assessment of coma and impaired consciousness: A practical Scale. Lancet 1974; 2: 81-84. [ Links ]
27. Vincent, J.L.: The value of blood lactate monitoring in clinical practice. En: Vincent, J.L., (ed). Updated in lntensive Care and Emergency Medicine. Berlin: Springer-Verlag; 1991; 260-272. [ Links ]
Murillo-Cabezas, F.; Amaya-Villar,R.; Rincón-Ferrari, Mª.D.; Flores-Cordero, J.M.; Valencia-Anguita, J.; García-Gómez, S.; Muñoz-Sánchez, Mª.A.: Existencia de hipoperfusión oculta sistémica en el traumatismo craneoencefálico. Estudio Preliminar. Neurocirugía 2005; 16: 323-332.
Correspondencia postal: Francisco Murillo Cabezas. Pablo Ruiz Picasso, 4. 41909 Salteras. Sevilla
Este trabajo ha sido financiado parcialmente por Beca 93/03 de la Consejería de Salud de la Junta de Andalucía.
Comentario al trabajo: Existencia de hipoperfusión oculta sistémica en el traumatismo craneoencefálico. Estudio preliminar de Murillo-Cabezas y cols.
Murillo-Cabezas y cols. presentan los resultados preliminares de un estudio prospectivo realizado en 210 pacientes con un traumatismo craneoencefálico (TCE) grave o moderado, hemodinámicamente estables, en los que estudian la prevalencia de hiperlactacidemia en las primeras 48 horas del traumatismo, los factores de riesgo asociados a esta situación y su influencia pronóstica. Los autores hacen énfasis en que una situación de estabilidad hemodinámica, con valores de presión arterial adecuados a las recomendaciones de las guías de práctica clínica actuales para el manejo de los pacientes con un TCE7, no garantizan siempre una correcta percusión tisular. Esta situación (hipoperfusión oculta) podría condicionar una hipoxia tisular sistémica, con exacerbación del metabolismo anaerobio e incremento de los valores arteriales de ácido láctico. Al igual que en otros estudios, los autores relacionan las cifras elevadas de ácido láctico arterial con una mayor gravedad del traumatismo1,2, con un aumento en la tasa de infecciones y una mayor estancia en UCI. Se trata de un estudio bien diseñado, en el que se han valorado múltiples factores clínicos y radiológicos, con influencia conocida en la evolución de los pacientes neurotraumáticos. Entre los aspectos más relevantes del estudio se encuentra la detección de un elevado porcentaje (45%) de pacientes hemodinámicamente estables, que ya en una fase precoz del traumatismo presentan una situación de hiperlactacidemia. No obstante, la cuantificación simultánea de la cifras de piruvato y el cálculo del índice lactato/piruvato podrían orientarnos mejor sobre el mecanismo productor del incremento del lactato que presentan estos pacientes.
La mayor parte de las funciones celulares requieren un consumo energético, energía que se obtiene fundamentalmente a partir de la metabolización de la glucosa en presencia de oxígeno. La glucólisis se inicia en condiciones anaeróbicas en el citoplasma celular, con una serie de reacciones enzimáticas a partir de las cuales 1 molécula de glucosa se convierte en 2 moléculas de piruvato, generando 2 moléculas netas de ATP.
El piruvato puede convertirse en lactato o derivar hacia un segundo conjunto de reacciones enzimáticas en la mitocondria (ciclo de Krebs) que requieren la presencia de oxígeno. Por cada molécula de piruvato que se oxida, se producen 18 moléculas de ATP. Algunas células, como los glóbulos rojos, carecen de mitocondrias y son generadoras primarias de lactato, cuya producción acaba accediendo, en parte, al plasma sanguíneo. El hígado y los riñones constituyen los puntos fundamentales de eliminación del lactato. Esta eliminación, junto con el consumo que se produce por parte de las células del músculo estriado, consiguen que los niveles de lactato en sangre arterial oscilen entre 0,5 y 1 mmol/L3. En ausencia de oxígeno, el piruvato no puede introducirse en el ciclo de Krebs, por lo que va trasformándose en lactato. El resultado final es un incremento neto del lactato y un aumento del índice lactato/piruvato (ILP). No obstante, como ya indican los autores, una exacerbación del metabolismo anaerobio no es la única causa de hiperlactacidemia3-5,8. Situaciones sépticas, en pacientes hemodinámicamente estables, pueden generar incrementos paralelos de lactato y piruvato, como resultado de un incremento en el metabolismo de la glucosa4. Backer considera que en estos pacientes las situaciones de hiperlactacidemia moderada (2-4 mmol/L) probablemente no se deben a una hipoxia tisular3. Puede existir también una hiperproducción regional de lactatos, como ocurre en algunas lesiones pulmonares agudas o en situaciones de "hiperactividad" de los glóbulos blancos o una disfunción en la acción de la enzima piruvato deshidrogenasa, que impida la degradación mitocondrial de esta molécula3. Los estados hipermetabólicos que aparecen en el contexto de un paciente politraumático, generados por una liberación masiva de catecolaminas, también pueden incrementar los niveles de lactato arterial. Por último, una hiperlactacidemia puede ser simplemente el resultado de un problema en la eliminación de lactatos, ya sea por un problema de funcionamiento hepático o una disminución del flujo sanguíneo de este órgano.
La incorporación de las técnicas de microdiálisis cerebral ha aportado nueva y muy importante información relacionada con el significado de los aumentos cerebrales de lactato. En un estudio reciente efectuado por nuestro grupo6 objetivamos que más de un 80% de las determinaciones horarias de los niveles de lactato en el espacio extracelular del parénquima encefálico mostraban valores de lactato > 2 mmol/L. Sin embargo, al analizar de forma simultánea los valores de piruvato y el ILP, sólo el 57% de las ocasiones el incremento de lactato correspondía a un incremento del metabolismo anaerobio (ILP > 20). En los casos restantes el incremento de lactato podía orientarse a una situación de hipermetabolismo celular, ya que el aumento del lactato aparecía en el contexto de un incremento paralelo del piruvato. A pesar de que en el estudio de Murillo-Cabezas y col se presentan argumentos razonables para indicar que probablemente la hiperlactacidemia detectada en sus pacientes se debe fundamentalmente a una situación de hipoxia tisular por hipoperfusión oculta, la implantación de un catéter de microdiálisis a nivel sistémico, que permite el análisis a cabecera del paciente de lactato y piruvato, aportaría una información definitiva en este sentido.
Bibliografía
1. Claridge, J.A., Crabtree, T.D., Pelletier, S.I., Butler, K., Sawyer, R.G., Young, J.S.: Persistent occult hypoperfusion is associated with a significant increase in infection rate and mortality in major trauma patients. J.Trauma. 2000; 48: 8-14.
2. Crowl, A.C., Young, J.S., Kahler, D.M., Claridge, J.A., Chrzanowski, D.S., Pomphrey, M.: Occult hypoperfusion is associated with increased morbidity in patients undergoing early femur fracture fixation. J.Trauma. 2000; 48: 260-267.
3. De Backer, D.: Lactic acidosis. Intentsive Care Med. 2003; 29: 699-702.
4. Gore, D.C., Jahoor, F., Hibbert, J.M., DeMaria, E.J.: Lactic acidosis during sepsis is related to increased pyruvate production, not deficits in tissue oxygen availability. Ann.Surg. 1996; 224: 97-102.
5. Mizock, B.A.: Lactic acidosis. Dis. Mon. 1989; 35: 233-300.
6. Poca, M.A., Sahuquillo, J., Mena, M.P., Vilalta, A., Ibañez, J., Garnacho, A.: Arterio-jugular differences of lactate (AVDL) and the lactate-oxygen index are not reliable indicators of increased brain anaerobic metabolism in traumatic brain injury. J.Neurotrauma (en prensa).
7. The Brain Trauma Foundation. The American Association of Neurological Surgeons. The Joint Section on Neurotrauma and Critical Care. Management and prognosis of severe traumatic brain injury. Part 1: Guidelines for the management of severe traumatic brain injury. J.Neurotrauma. 2000; 17: 451-627.
8. Vincent, J.L., De Backer, D.: Oxygen transport-the oxygen delivery controversy. Intensive Care Med. 2004; 30: 1990-1996.
M.A.Poca
Barcelona