Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.12 no.3 Madrid abr. 2005
REVISIÓN
Pregabalina en el tratamiento del dolor neuropático periférico
J. R. González-Escalada
| González-Escalada JR. Pregabalin for the management of peripheral neuropathic pain. Rev Soc Esp Dolor 2005; 12: 169-180.
| ||
| ABSTRACT The availability of pregabalin (PGBB), a new drug belonging to the group of neuromodulators with a better pharmacokinetic profile compared to its predecessors and effective for the management of peripheral neuropathic pain, opens up new horizons for the management of these patients. PGBB is a GABA analogue, although it does not bind to its receptors nor it shows gabaergic actions. Analgesic effects of PGBB are due to its binding to the proteic alpha-2-delta subunit of the voltage-dependant calcium channels at the CNS with greater affinity than gabapentin. In several animal pain models, PGBB has shown antihyperalgesic effectiveness and a better antiallodynia profile compared to morphine and amitriptilin; it is quickly absorbed when orally administered, with a 90% bioavailability, a highly predictable and linear pharmacokinetics with low interindividual variability and a long half life. Consequently, it can be administered in two daily doses. PGBB does not bind to plasma proteins and is mainly excreted unaltered in the urine, so its interaction with other drugs is rare. In this review, the results of five studies of postherpetic neuralgia (PHN) were assessed, with a total of 1,034 patients and other six studies in painful diabetic neuropathy (PDN) that included 1,628 patients. In all of them, PGBB administered in doses of at least 150 mg.day-1 was effective versus placebo in a dose-dependant way in terms of pain relief, improved sleep and improved parameters of quality of life. The most effective dose was 600 mg (p < 0.001 vs. placebo) and, with a flexible dosage, a mean dose of 457 mg.day-1 was also highly effective (p = 0.002 vs. placebo). Therapeutic doses of PGBB also showed high safety levels, with a low incidence of slight reversible adverse effects. The presence of severe adverse effects was the same as with placebo. In conclusion, PCBB was an effective and safe drug for the management of neuropathic pain in patients with PHN and DNP. © 2005 Sociedad Española del Dolor. Published by Arán Ediciones, S. L. Key words: Neuromodulators. Antiepileptics. Neuropathic pain. Postherpetic neuralgia. Diabetic neuropathy.
| RESUMEN La aparición de pregabalina (PGBB), un nuevo fármaco del grupo de los neuromoduladores, con un perfil farmacocinético mejor al de sus predecesores y con indicación en dolor neuropático periférico abre nuevos horizontes en el tratamiento de estos enfermos. PGBB es un análogo del GABA aunque no se liga a su receptor ni es capaz de desarrollar acciones gabaérgicas. PGBB debe el efecto analgésico a su capacidad de ligarse a la subunidad proteica alfa-2-delta de los canales de calcio voltaje dependientes en el SNC, con una afinidad mayor a la de gabapentina. En varios modelos animales de dolor, PGBB ha demostrado eficacia antihiperalgésica y un perfil antialodínico superior a morfina y amitriptilina; se absorbe rápidamente por vía digestiva, con una biodisponibilidad del 90%, una farmacocinética altamente predecible y lineal con baja variabilidad interindividual y larga vida media, lo que permite su administración en dos dosis diarias. PGBB no se liga a las proteínas plasmáticas y se elimina inalterada por orina casi en su totalidad, por lo que presenta escasa interacción con otros fármacos. En esta revisión se evalúan los resultados de cinco estudios en neuralgia postherpética (NPH), en un total de 1.034 pacientes y otros seis en pacientes portadores de neuropatía diabética dolorosa (NDD) que incluyeron 1.628 pacientes. En todos ellos, PGBB en dosis de 150 mg.día-1 o superiores, ha demostrado eficacia frente a placebo de una forma dosis dependiente para controlar el dolor, mejorar el sueño y mejorar muchos de los parámetros de la calidad de vida de los pacientes. La dosis más eficaz demostró ser 600 mg (p < 0,001 vs. placebo) y en dosis flexible, con una dosis media de 457 mg.día-1 manifestó también alta eficacia (p = 0,002 vs. placebo). PGBB en dosis terapéuticas ha demostrado altos índices de seguridad, con efectos adversos leves, reversibles y con baja incidencia. La presencia de efectos adversos graves fue similar a la de placebo. En conclusión: PGBB demostró ser un fármaco eficaz y seguro en el tratamiento del dolor neuropático en pacientes portadores de NPH y NDD. © 2005 Sociedad Española del Dolor. Publicado por Arán Ediciones, S. L. Palabras clave: Neuromoduladores. Antiepilépticos. Dolor neuropático. Neuralgia postherpética. Neuropatía diabética.
|
Unidad del Dolor
Hospital Ramón y Cajal. Madrid
Recibido: 01-04-05.
Aceptado: 06-04-05.
1. INTRODUCCIÓN
Desde hace ya algunos años, el tratamiento del dolor neuropático y especialmente el dolor neuropático periférico, se ha convertido en la piedra angular de la actividad de las unidades del dolor. Esto ocurre no tanto por su frecuencia, que también, sino esencialmente por su resistencia a los tratamientos analgésicos comunes y al amplio desconocimiento del manejo de estas patologías que induce a recurrir frecuentemente a los especialistas en tratamiento del dolor.
Los médicos de familia y muchos especialistas tienen grandes problemas para entender el porqué algunos pacientes con dolor intenso y claramente orgánico, se muestran refractarios a todos los tratamientos analgésicos empleados, incluso a los opiáceos, manifestando su enorme dificultad para interpretar los síntomas y la evolución tan tórpida de este grupo de enfermos. Incluso antes de plantear una estrategia terapéutica los facultativos tienen grandes dudas diagnósticas, esencialmente por el desconocimiento de la clínica que induce a sospechar que el origen del dolor del paciente se encuentra en una lesión o disfunción del sistema nervioso periférico. Esto implica que gran número de enfermos portadores de este tipo de dolor, sean mal identificados y por tanto no sigan tratamientos adecuados hasta que son derivados a una unidad para el tratamiento del dolor.
Los tratamientos que actualmente se utilizan en las unidades del dolor para el control de estos pacientes son variados y se emplean estrategias y guías distintas a la escalera analgésica de la OMS que es la base del tratamiento del dolor nociceptivo, especialmente en pacientes oncológicos. En estos síndromes, el tratamiento tiende a ser más individualizado, según respuesta de cada paciente y se emplean fármacos que por su mecanismo de acción se muestran capaces de disminuir la excitabilidad del sistema nervioso, gravemente afectada por el proceso morboso. Estos fármacos son agrupados con el nombre de neuromoduladores (1) y pueden actuar según dos capacidades distintas: bien disminuyendo los mecanismos morbosos que amplían o desencadenan impulsos dolorosos o bien potenciando los mecanismos que inhiben la transmisión o percepción dolorosa; en suma, modulando en negativo o en positivo la actividad neuronal.
Recientemente aparece en el mercado farmacéutico un nuevo fármaco del grupo de los neuromoduladores, la pregabalina. Esta nueva molécula nace a partir de un predecesor que ya ha hecho historia en el tratamiento del dolor, la gabapentina, que en su día llegó para cubrir uno de los mayores vacíos terapéuticos de la medicina moderna. Podemos afirmar que en el tratamiento del dolor neuropático existe un antes y un después de la utilización de este fármaco. Antes, sólo se disponía de los tricíclicos y algún antiepiléptico (FAE) de corta indicación. Después, tras la llegada de este fármaco, se produce la gran oleada de FAE de segunda generación que han cubierto un campo terapéutico hasta entonces desolador (2). Estos nuevos fármacos con un perfil farmacocinético mucho más aceptable mejoran los perfiles de seguridad y tolerabilidad (3) de sus antecesores y permiten su utilización en dolor crónico.
Con la aparición de pregabalina se da un paso decisivo hacia el futuro, ya que es el primer FAE que se concibe, desarrolla y se comercializa desde su inicio con la indicación en dolor, específicamente en dolor neuropático periférico. Esto implica que su salida al mercado se acompaña de investigación y experiencia contrastada específica en dolor, que nos ayudará a comprender mejor su actividad y utilización y que mejorará, sin lugar a dudas, su indicación y su inclusión en protocolos de tratamiento para los distintos síndromes dolorosos.
2. PERFIL FARMACOLÓGICO DE PREGABALINA
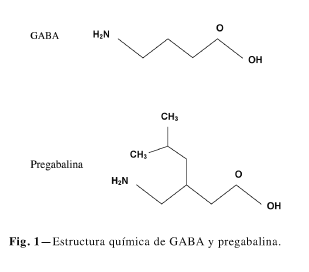
La pregabalina (PGBB), al igual que su predecesor gabapentina, es un análogo del ácido gamma-aminobutírico (GABA), el principal neurotransmisor con función inhibitoria del sistema nervioso central (SNC). Estructuralmente se trata de una modificación química del GABA, el (S)-3-isobultilgaba (Fig. 1). Existen dos isómeros de los que PGBB constituye el enantiómero S el único que es farmacológicamente activo (4).
Aunque se trata de un análogo GABA, PGB no se liga al receptor ni es capaz de desarrollar acciones gabaérgicas. Tampoco desarrolla metabolitos con propiedades agonistas GABA o con acciones gabaérgicas. El mecanismo de acción por el que desarrolla su acción farmacológica está basado en su capacidad de ligarse a la fracción subunidad proteica alfa-2-delta de los canales del calcio voltaje dependientes en el SNC (5). La unión a estos ligandos a nivel periférico (músculo cardiaco, hígado, bazo, pulmones y páncreas) es irrelevante a dosis terapéuticas (6) por lo que los efectos indeseables derivados de su acción sobre estas vísceras son clínicamente inapreciables. Sin embargo, a nivel del SNC su afinidad por la subunidad alfa-2-delta parece ser mayor que la que posee gabapentina (5).
El efecto analgésico está firmemente ligado a la unión del fármaco a esta subunidad, ya que produce una modulación de la entrada del ión calcio a través de estos canales y como consecuencia una disminución de la liberación de neurotransmisores excitadores como glutamato, noradrenalina y sustancia P que por ende se traduce en una disminución de la excitabilidad neuronal patológica o anómala en distintas áreas del sistema nervioso (SN) relacionadas con patologías como el dolor neuropático, la epilepsia o la ansiedad (7).
En varios modelos animales de dolor, PGBB ha demostrado eficacia con dosis de dos a cuatro veces más bajas que gabapentina, demostrando un perfil antialodínico superior a morfina y amitriptilina (8). Experimentalmente se ha demostrado que PGBB reduce la alodinia estática (9), la alodinia dinámica (10) y la hiperalgesia térmica (6).
-Farmacocinética. La PGBB se absorbe rápidamente por vía digestiva, con una Cmax de 1 h tras la administración oral, consiguiendo el estado de equilibrio en 24-48 h. La biodisponibilidad es del 90%. La semivida (t1/2) es de 6,3 h. Todos estos perfiles se mantienen estables aunque se varíen las dosis diarias y todos los estudios indican que su farmacocinética es altamente predecible y lineal, con baja variabilidad interindividual (6); además el perfil concentración/tiempo es el mismo si las dosis se administran dos o tres veces al día.
PGBB no se une a las proteínas plasmáticas y no se metaboliza en el hígado, por lo que no se producen interacciones farmacológicas a estos niveles. El 98% de la PGBB circulante se elimina inalterada por orina. Esto condiciona que las dosis administradas deben ser modificadas en caso de insuficiencia renal, adecuando el tratamiento a la función excretora del paciente (Tabla I). No se ha establecido la seguridad y eficacia de PGBB en niños menores de 12 años ni en embarazadas o lactantes, por lo que se desaconseja su empleo en estos grupos de población. En población anciana no son necesarias consideraciones especiales a no ser que haya asociada una insuficiencia renal.
3. PATOLOGÍAS MÁS FRECUENTES
3.1. Neuralgia postherpética
La neuralgia postherpética (NPH) es una patología frecuente en la población de edad avanzada y común en las clínicas del dolor. Constituye un buen modelo experimental para testar la efectividad de los fármacos frente al dolor patológico de tipo neuropático y por ello, junto con la neuropatía diabética, son los dos modelos obligatorios en los que la Agencia Europea del Medicamento (EMEA) exige que cualquier fármaco demuestre eficacia para obtener la indicación en el tratamiento del dolor neuropático de tipo periférico. La gran riqueza en síntomas neurogénicos, la uniformidad y localización precisa de sus principales manifestaciones, permite recoger mucha información sobre el comportamiento del producto farmacéutico que se pretende evaluar. Hasta ahora, los estudios de metanálisis demuestran una eficacia similar entre los antidepresivos y los FAE estipulando que de media son necesarios 2,5 tratamientos para encontrar un respondedor (11,12).
La NPH es un síndrome que se define como: la presencia de dolor neuropático persistente, localizado en el dermatoma donde se ha manifestado previamente un cuadro agudo de herpes zóster, y que dura más allá de tres meses después de haber desaparecido las lesiones dérmicas. El cuadro agudo del herpes zóster se debe a la reactivación del virus varicela-zóster, que ha permanecido latente en un ganglio dorsal desde la primoinfección infantil que cursó clínicamente como una varicela. En esta reactivación, el virus se extiende central y periféricamente desde el ganglio dorsal, produciendo una intensa inflamación de la piel, los nervios periféricos, la raíz nerviosa y ocasionalmente la médula espinal. La gran mayoría de los pacientes sufren intenso dolor neuropático como reflejo del daño neuronal (13) y mejoran en las primeras semanas. Sin embargo, por causas mal conocidas, un pequeño porcentaje de enfermos queda con dolor permanente que dura meses o años. Esta patología se presenta en el 40% de los pacientes con más de 50 años que sufre un cuadro de herpes zóster y en el 75% de los pacientes con más de 70 años. Estudios recientes han demostrado una reducción de en la incidencia de NPH cuando se emplean de forma precoz medicaciones antivirales en la fase aguda (14).
Estos pacientes manifiestan una clínica que se caracteriza por la presencia de cuatro tipos de dolor, algunos de ellos espontáneos y otros evocados. Entre los espontáneos se encuentran siempre: un dolor constante, profundo y quemante y un dolor intermitente, lancinante, intenso y paroxístico que recorre todo el área dolorosa en forma de sensación fulgurante dejando toda la zona hipersensible y dolorida durante minutos.
Los otros dos tipos de dolor son provocados por estimulación de la zona: el primero se trata de un dolor disestésico que se excita tras mínimos contactos táctiles (alodinia táctil) o tras contactos térmicos (alodinia térmica). La alodinia táctil se expresa de forma muy virulenta en muchos pacientes y es especialmente sensible a estímulos dinámicos; la alodinia térmica se expresa como percepción dañina a estímulos de calor o frío en rangos no nocivos o bien como percepciones paradójicas, es decir, sensación de calor tras exposición al frío o viceversa. La hiperpatía es el otro tipo de dolor provocado; se manifiesta como dolor persistente tras la consumición del estímulo nocivo o por su explosión tras estímulos no nocivos repetidos.
Unido al dolor, la NPH presenta toda una corte de síntomas sensoriales deficitarios, que conforman como resultado la percepción distorsionada de gran variedad de estímulos. Como estos estímulos son consecuencia de maniobras que se realizan comúnmente durante la actividad diaria, se produce gran interferencia en las tareas cotidianas.
La alodinia es la manifestación central. La presencia de alodinia dinámica a mínimos estímulos táctiles, como la maniobra de deslizamiento de un algodón, resulta positiva en el 65% de los pacientes con NPH. Con estímulos dinámicos más intensos la alodinia está presente en el 87% de los pacientes (15).
El efecto antialodínico de PGBB ha sido puesto de manifiesto desde los primeros ensayos experimentales en modelos animales (10,16,17), lo que unido a la inhibición de las descargas ectópicas en modelos de ligadura ciática de la rata (18), le identificaron como producto idóneo para el tratamiento de la NPH, donde ambas manifestaciones constituyen el núcleo del cuadro clínico (19).
Se han realizado varios estudios multicéntricos, aleatorizados, doble ciego y controlados con placebo, que demuestran que PGB es efectivo y seguro en la NPH. En total se han evaluado 1.034 pacientes en cinco estudios cuyos datos han sido tabulados recientemente (20,21). De estos estudios, ya se han publicados los resultados de tres, con un total de 776 pacientes (22).
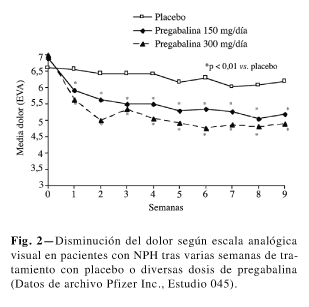
Los pacientes evaluados en estos estudios tenían una intensidad media de dolor de 6,6 (DS: 1.6) -medida por la escala visual analógica (EVA)-. En estos trabajos se utilizó pregabalina en dosis fijas de 75, 150, 300 y 600 mg.día-1, pautada en tres tomas diarias en tres estudios y en dos tomas al día en un estudio. La eficacia frente a placebo se mostró estadísticamente significativa a partir de 150 mg.día-1 de forma dosis dependiente (p < 0,01 para 150 y 300 mg.día-1) (Fig. 2) (p < 0,001 para 600 mg.día-1) (Fig. 3), no existiendo diferencia significativa con placebo en dosis de 75 mg.día-1. Destacan los autores la rapidez con la que aparece el efecto beneficioso, muy ostensible en los resultados de todos los estudios y con todas las dosis empleadas, lo que implica un periodo de latencia mucho menor que otros neuromoduladores, incluido gabapentina. PGB también mostró beneficio en el área del sueño con un perfil paralelo y a las mismas dosis.
El número de pacientes respondedores (beneficio superior al 50% de la situación basal) osciló entre el 38-50%, subiendo al 52-63% para respondedores al 30%, que según algunos autores (23) es un beneficio apreciable para el dolor neuropático dada su refractariedad a los tratamientos. En la impresión del enfermo al finalizar el estudio, también manifestaron mejoría de forma dosis dependiente, elevándose desde 52,2% cuando toman 150 mg.día-1, a 70,7% con 300 mg.día-1 y 82,3% con dosis de 600 mg.día-1.
En un trabajo reciente (24), los autores determinan: la tasa absoluta de reducción de dolor, el número necesario de tratamientos (NNT), 95% CI para NNT, y el número necesario para aparición de efectos secundarios (NNH) de varios fármacos en el tratamiento de la NPH, entre ellos la gabapentina y pregabalina, resultando ambos tratamientos efectivos para este proceso.
3.2. Neuropatía diabética dolorosa
La neuropatía diabética dolorosa (NDD) forma parte de la familia de desórdenes del sistema nervioso causados por la diabetes. Con el paso del tiempo, los diabéticos pueden padecer neuropatías mixtas que afectan tanto a la fase motora como sensorial y que se manifiestan por entumecimiento, dolor y debilidad en las extremidades. También puede verse afectado el corazón, el aparato digestivo y los órganos sexuales. El 50% de los enfermos con diabetes sufren algún grado de neuropatía, pero no en todos los casos es sintomática. El índice más alto de neuropatía aparece en pacientes mayores de 40 años que han padecido la enfermedad durante más de 25 años; se han descrito otros factores de riesgo prevenibles tales como la glucemia mal controlada (25), los altos niveles de colesterol LDL y triglicéridos, la presión arterial elevada, el exceso de peso y el tabaquismo (26,27).
Las causas son probablemente diferentes para los distintos tipos de neuropatía diabética (28). En la NDD, el daño del nervio es debido a una combinación de factores: a) factores metabólicos: glucosa alta en sangre, evolución larga de la diabetes, niveles bajos de insulina y niveles anormales de triglicéridos y colesterol LDL en sangre (29,30); b) factor vascular con afectación de vasa nervorum que condiciona la llegada de oxígeno y el correcto metabolismo de las neuronas; c) factores autoinmunes que causan la inflamación en nervios (31); d) factores hereditarios que aumentan susceptibilidad; y e) factores tóxicos, tales como fumar o uso del alcohol (32).
Los tipos sintomáticos de NDD son: a) neuropatía periférica; b) neuropatía autonómica; c) neuropatía proximal; y d) neuropatía focal (33).
Los síntomas dependen del tipo de neuropatía y de los nervios afectados. Algunos enfermos con neuropatía no tienen ningún síntoma. En otros, priman los síntomas sensoriales deficitarios o el dolor. Con menos frecuencia se afecta el sistema motor de forma selectiva, cursando con debilidad pero sin dolor. Lo habitual es que los enfermos tengan síntomas mixtos de cada tipo: debilidad, dolor y alteraciones de la sensibilidad. En el inicio del cuadro, los síntomas suelen ser de intensidad mínima y pasar inadvertidos, para desarrollarse paulatinamente durante mucho tiempo e implicar o no al sistema nervioso autónomo en algún momento de su evolución (34).
La neuropatía periférica, también llamada neuropatía simétrica distal, es la forma más común de NDD y afecta a las partes acras de brazos y las piernas. Los pies y las piernas suelen estar afectados antes de las manos y de los brazos. Los síntomas pueden incluir dolor y calambres agudos en los dedos del pie, planta del pie, piernas, manos, brazos y los dedos de la mano, además de debilidad, entumecimiento y alodinia mecánica. Estos síntomas son a menudo peores en la noche. Otros síntomas acompañantes son: atrofias musculares en pies o manos. Indigestión, náuseas y/o vómitos. Diarrea o estreñimiento. Vértigos o mareos e hipotensión postural. Problemas urinarios. Disfunción eréctil o sequedad vaginal. También pueden afectar a la inervación propioceptiva, que unida a la debilidad del músculo y la pérdida de reflejos, especialmente en el tobillo, llevan a cambios en la mecánica y estabilidad de la marcha. Pueden aparecer heridas en las áreas entumecidas del pie porque una presión dañina o la lesión puede pasar inadvertida. Si estas lesiones no se tratan precozmente, la infección puede afectar al hueso y llegar a la amputación. Algunos expertos estiman que la mitad de tales amputaciones son previsibles y prevenibles (35).
La neuropatía autonómica se manifiesta por alteraciones en la digestión y la función intestinal, así como trastornos en la vejiga, en la potencia sexual y en la transpiración. En algunos casos afecta a la inervación cardiaca y vascular que controlan la presión arterial, cursando con trastornos hemodinámicos posturales que pueden enmascarar las primeras señales incipientes de riesgo de hipoglucemia.
La neuropatía proximal es una forma poco común de manifestarse la NDD y cursa con dolor en los muslos, las caderas y las nalgas y así como debilidad muy manifiesta en las piernas.
La neuropatía focal es excepcional y es la manifestación clínica de la afectación de un nervio o un pequeño grupo de nervios (raíces o plexos), siendo causa de debilidad y/o dolor de los músculos inervados. En los pacientes que la NDD debuta con una mononeuropatía focal, el inicio del dolor puede ser repentino y muy severo.
En síntesis, la pluripatología y polisintomatología de estos pacientes afectan de forma grave su calidad de vida. El diagnóstico de la NDD se basa, fundamentalmente, en una fuerte sospecha por la clínica y la exploración. En el enfermo con NDD se observa que la vibración, la exposición al calor y la sensación del pinchazo están muy afectadas -en ese orden-. Suele acompañarse paradójicamente de alodinia y entumecimiento de la zona dolorosa. Los reflejos ósteo-tendinosos suelen afectarse de manera precoz, por lo que siempre deben ser explorados.
Los estudios de conducción del nervio dirigidos a la zona sintomática de los enfermos con NDD, permiten observar que los impulsos nerviosos son más lentos y de menor amplitud. La medición de la latencia de la onda F parece muy específica y sensible para identificar la existencia de NDD (36). De la misma forma, la electromiografía (EMG) y la prueba sensorial cuantitativa (QST), que utiliza la respuesta a ciertos estímulos, tales como presión, vibración y temperatura, suelen estar alteradas en la NDD. En casos de sospecha de disfunción autonómica, se debe investigar la variabilidad del ritmo cardiaco a la respiración y a los cambios en la presión arterial con la postura. También se debe realizar una ecografía de la vejiga para objetivar si la vejiga vacía totalmente después de la micción.
PGB se demostró efectiva en los modelos experimentales de rata con neuropatía diabética inducida por estreptozocina (17); en los que sobre todo demostró poseer un importante efecto antialodínico. En otros modelos de dolor inflamatorio (37) se ha demostrado que PGB constituye un nuevo agente antihiperalgésico, cuya efectividad en controlar el dolor continuo y evocado de los pacientes diabéticos está relacionado con esta propiedad, en la que probablemente puedan estar involucrados mecanismos neurogénicos centrales (38,39).
En pacientes con neuropatía diabética la PGB también ha demostrado efectividad. En el periodo de precomercialización se han realizado seis estudios multicéntricos, randomizados y controlados con placebo en pacientes portadores de neuropatía diabética dolorosa. En cinco de estos estudios se han utilizado dosis fijas de PGB y en uno se han utilizado dosis flexibles.
Se incluyeron 1.628 pacientes con NDD de uno a cinco años de evolución, de los que se excluían aquellos que superaban cifras de Hba1c del 11% durante el estudio. Se excluyeron los pacientes no respondedores previamente a gabapentina. En los estudios de dosis fija se retiró todo tipo de analgesia. Los resultados de eficacia se basaron en la población con intención de tratar mediante estudio de la intensidad del dolor según la escala VAS, el sueño según la escala MOS y el índice de utilidad EQ-5D. Los pacientes evaluados en estos estudios presentaban una intensidad basal media de dolor de 6,5 (DS: 1.5) según la EVA; el 66% de ellos marcaron una EVA superior a 7. En cinco de los estudios se utilizó pregabalina con dosis fijas diarias de 75, 150, 300 y 600 mg.día-1. En cuatro de estos ensayo, la dosis diaria se administró repartida en tres tomas, mientras que en uno se distribuyó en dos tomas. Un sexto trabajo utiliza PGB en dosis flexibles que fueron repartidas en dos tomas al día, entre 150 y 600 mg según respuesta individual de cada paciente.
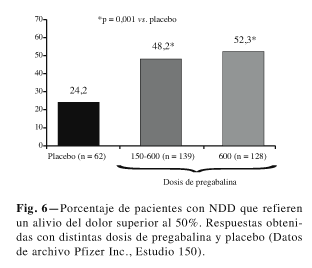
En todos estos trabajos, coincidiendo con los resultados obtenidos en NPH, se demostró eficacia estadísticamente significativa frente a placebo a partir de 150 mg.día-1. Al igual que en los enfermos con NPH, la eficacia de PGB mostró beneficio con diferencia estadísticamente significativa frente a placebo (p < 0,01) en todas las dosis estudiadas por encima de 150 mg.día-1, con un comportamiento dosis dependiente (Fig. 4). En la interferencia con el sueño, PGB mostró un beneficio similar al encontrado en el VAS (Fig. 5). El tanto por ciento de respondedores a PGB con beneficio superior al 50%, muestra diferencias significativas frente al grupo placebo con cualquiera de las dosis empleadas (Fig. 6).
En un estudio aleatorizado, doble ciego y controlado con placebo que se utilizaron dosis flexibles; estas se iniciaron en 150 mg.día-1 de PGB durante la primera semana y se empleó una pauta de aumento de 150 mg cada semana, según respuesta del paciente. Según el protocolo, los pacientes podían estar con 150, 300, 450 ó 600 mg.día-1 según el beneficio obtenido. Al finalizar este brazo, los pacientes sometidos a dosis flexibles habían recibido una dosis media de 457 mg.día-1, excluyendo para el cálculo las cuatro semanas iniciales de ascenso de dosis. Otro brazo del estudio tomaba 600 mg.día-1 de forma fija, salvo la semana de inicio que tomaron 300 mg.día-1. En los resultados obtenidos, ambos grupos manifestaron una eficacia significativamente superior a placebo (Fig. 7) siendo algo más eficaz la dosis fija de 600 mg (p < 0,001), que la dosis flexible (p = 0,002).
Otro parámetro evaluado en estos estudios fue el beneficio en la calidad de vida, demostrando diferencias estadísticamente significativas frente a placebo con dosis superiores a 150 mg.día-1 de PGB, en limitación por dolor, salud mental, relación social, limitación emocional, vitalidad y percepción de salud.
3.3. Otras neuropatías periféricas
En la clínica diaria se presentan múltiples patologías que cursan con dolor neuropático periférico: lesiones nerviosas que acompañan a las fracturas y que pueden afectar a plexos, raíces o nervios periféricos, como las que se producen en la extremidad superior (plexo braquial por grandes traumatismos -lesión del motorista-, lesión del mediano en la muñeca, el cubital en el codo, el radial en el húmero) y menos habituales en la extremidad inferior (ciático poplíteo externo en la cabeza del peroné, tibial posterior en el tobillo). En las unidades del dolor es más frecuente que nos enfrentemos a dolores neuropáticos procedentes de problemas compresivos a distintos niveles: radiculares por patología discal, problemas de espacio a nivel de los canales osterotendinosos del codo, carpo o tarso, en los que por diversos motivos se ha descartado la actitud quirúrgica. Algunos autores afirman los pocos resultados que cabe esperar con el tratamiento farmacológico de estos pacientes (40), mientras que otros demuestran claros beneficios del tratamiento con fármacos antiepilépticos (FAE) de última generación (41,42). Es muy posible que estos enfermos puedan ser subsidiarios de un tratamiento con PGB ya que se ha demostrado beneficio de la molécula en el modelo experimental de ligadura del ciático en la rata (18), que refleja un mecanismo similar al de las patologías señaladas (18). Serán necesarias experiencias clínicas en estas patologías para confirmar esta hipótesis.
Otras patologías que pueden cursar con neuropatía periférica son las ligadas al HIV, afortunadamente poco frecuentes, las neuropatías tóxicas alcohólicas y más frecuente las neuropatías por quimioterapia, cuya incidencia había disminuido por la menor indicación de los alcaloides de la vinca y que ha vuelto a aumentar con la aparición del taxol. Los modelos experimentales de dolor neuropático por quimioterapia en rata utilizan vincristina y en ellos los FAE carbamazepina, lamotrigina y gabapentina han sido testados con diferente éxito. Carbamazepina muestra leve actividad, mientras que lamotrigina y sobre todo gabapentina muestran un indudable beneficio en la alodinia mecánica y en la hiperalgesia producida en este modelo (43). Es muy posible, que al compartir el mismo mecanismo de acción que gabapentina, la PGB tenga una actividad similar en los procesos que cursan con alodinia, incluso de origen visceral (44).
4. SEGURIDAD Y TOLERABILIDAD
En todos los estudios clínicos en los que se ha utilizado PGB para el tratamiento del dolor neuropático se concluye que se trata de un fármaco seguro. Los efectos adversos que se han descrito con su uso son de carácter leve, aparecen de forma dosis dependiente y desaparecen sin dejar secuelas tras la suspensión del fármaco. Tomando como referencia los estudios controlados con placebo descritos en la presente revisión, en total diez ensayos con PGB en dosis fijas, los efectos adversos descritos con más frecuencia fueron: mareo (23,1%), somnolencia (14,6%), edema periférico (10,4%) y sequedad de boca (6%). Otros efectos adversos descritos, como cefaleas (7,2%) e infección concomitante (5,9%), son de incidencia baja y similar a placebo (Tabla II). Al observar la distribución de los efectos adversos según las dosis empleadas, se advierte un comportamiento dosis dependiente, por lo que es posible deducir que muchos pacientes puedan mejorar del efecto adverso con una disminución de dosis sin tener que abandonar la terapia.
El 11,66% de los pacientes que tomaron PGB y presentaron efectos adversos han tenido que abandonar el tratamiento por falta de tolerabilidad, en contraste con el 5,1% de los que presentaron efectos adversos con placebo.
Como ya se comentó más arriba, la ausencia de interacción con otros fármacos al no metabolizarse en el hígado y al no unirse a las proteínas plasmáticas lo hace especialmente seguro y cómodo en su utilización. Como única prevención, se ha observado que el uso concomitante de PGB con oxicodona y lorazepam, puede potenciar los efectos motores, cognitivos o sedantes de aquellos, así como potenciar los efectos del alcohol.
En los estudios realizados en otras indicaciones como la epilepsia se ha descrito que PGB puede provocar ganancia de peso moderada (7% del peso corporal) en un 5,1% de los pacientes tratados con todas las dosis de PGB, frente al 0,8% del grupo placebo. Este efecto se mostró también dependiente de las dosis, oscilando entre 3,5% para la dosis de 150 mg.día-1 y 8,2% para la dosis de 600 mg.día-1. Este dato se debe tener en cuenta en aquellos pacientes en los que la ganancia de peso sea problemática o pueda descompensar su enfermedad de base como la diabetes, requiriendo en este caso un ajuste del tratamiento hipoglucemiante.
La incidencia de efectos adversos severos fue similar en el grupo tratado con pregabalina y en el grupo placebo (2,3 vs. 2,1%) según de la base de datos de los 29 estudios controlados en todas las indicaciones. Los más comunes fueron: lesión accidental, dolor precordial, insuficiencia cardiaca congestiva, infarto de miocardio y neumonía.
En un estudio reciente se comparan varios fármacos para el tratamiento de la neuralgia postherpética y se concluye que gabapentina y PGB son los únicos FAE que muestran evidencia científica de efectividad en estos pacientes. Gabapentina a dosis de 2.400-3.600 mg diarias muestra un NNT de 2,8 y a dosis de 1.800-2.400 mg.día-1 un NNT: 5,3. La PGB a dosis de 600 mg.día-1 muestra un NNT: 3.3. Al mismo tiempo el NNH de gabapentina comparada con placebo para las dosis referidas fue de 10,3 y 11,2 respectivamente, mientras que PGB presentaba un NNH comparado con placebo de 3,7 (45). Según estos resultados, desde el punto de vista clínico pregabalina a dosis de 600 mg diarios obtendría unas respuestas terapéuticas similares a gabapentina utilizada por encima de 2.400 mg al día. A estas dosis parece que es mejor tolerada gabapentina que pregabalina.
5. PLAN CLÍNICO
De todo lo expuesto se deduce que PGB es un fármaco efectivo en dolor neuropático, con unos resultados esperables superiores al resto de los FAE. La rapidez de acción de la pregabalina es una de las grandes bazas de este fármaco y la dosificación de dos tomas únicas diarias mejorará el cumplimiento terapéutico y la comodidad para el paciente.
Las indicaciones de PGB son amplias. Su principal cliente debe ser indudablemente el paciente con dolor neuropático periférico. Las patologías diana son la neuralgia postherpética, la neuropatía diabética, las neuropatías tóxicas por fármacos y etílicas, las metabólicas y carenciales, las neuralgias funcionales, las compresiones nerviosas y las lesiones nerviosas periféricas. Muchos cuadros osteomusculares se acompañan de componentes neuropáticos susceptibles de beneficio con PGB. Otras patologías como la fibromialagia, en las que exista hiperalgesia generalizada y alteraciones del sueño pueden mejorar su calidad de vida con este tratamiento.
El tratamiento inicial debe cumplir el mínimo de 150 mg diarios (75 mg cada 12 h) para ser efectivo precozmente. Esta dosis puede instaurarse desde el primer día para subir a 300 mg al día (150 mg cada 12 h) en la primera semana, según respuesta. La empresa farmacéutica Pfizer, consciente de esta pauta, ha comercializado un envase económico de 14 comprimidos de 75 mg, para cubrir esta primera semana de tratamiento, ajustando la presentación al consumo y evitar la acumulación de comprimidos no utilizados.
Siempre según respuesta individual, la dosis se debe mantener durante algunos días para explorar su eficacia, pero debe considerarse que la dosis media efectiva en todos los estudios efectuados en estos pacientes se cifra en 450 mg. Por tanto, el rango entre 300 mg y 600 mg diarios, implican la efectividad óptima. Los efectos secundarios, si aparecen, marcarán el límite de las dosis recomendable y el balance beneficio/seguridad debe imperar para conseguir la mejor calidad de vida de los pacientes tratados con PGB.
Si aparecen efectos secundarios o mala tolerancia, se debería explorar una dosis inferior del fármaco, ya que en esta dosis inferior el efecto puede desaparecer conservando eficacia suficiente. En todo caso, la relación beneficio analgésico/tolerabilidad es un ejercicio individual para cada patología, para cada momento evolutivo y para cada paciente, por lo que las dosis señaladas más arriba deben considerarse sólo orientativas.
Los estudios clínicos de larga duración han demostrado que PGB se tolera bien durante largos periodos, por lo que si los efectos adversos no se instauran en las primeras semanas es difícil que aparezcan con el tiempo, a excepción de la ganancia de peso y el edema periférico. Por lo tanto, si el paciente lo precisa, como es el caso de la neuropatía diabética, el fármaco puede mantenerse durante meses sin que por ello presuponga un aumento del riesgo a la aparición de secundarismos. En otras patologías más evolutivas como la neuropatía por quimioterapia o la neuralgia postherpética, el facultativo debe decidir en el momento que conviene suspender la terapia. PGB no tiene propiedades aditivas ni precisa tratamientos sustitutivos tras su interrupción. Como todos los fármacos neuromoduladores se debe retirar de forma progresiva siguiendo la misma pauta de comienzo pero a la inversa. Con 150 mg al día de PGB se puede suspender sin problemas.
En experiencia del autor, la PGB se tolera bien y ha mantenido su eficacia durante un largo periodo. En un ensayo aleatorizado, doble ciego y controlado con placebo, que se continuó con un estudio abierto, la dosis utilizada en mis pacientes osciló entre los 300 y y los 600 mg al día. Ningún enfermo estuvo con dosis inferiores a 300 mg. La PGB se tolera bien, igual que la gabapentina. Algunos enfermos manifestaron aumento de somnolencia diurna pero en ningún caso interfirió con su vida. El mareo fue más limitante y posiblemente sea el efecto a tener más en más consideración. Afortunadamente sólo uno de mis enfermos presentó este problema, aunque no consintió que se le retirara o disminuyera el tratamiento ya que al hacerlo reaparecía su sintomatología dolorosa. En estos pacientes los dolores paroxísticos desaparecieron, el dolor continuo sobre el dermatoma herpético mejoró considerablemente, mientras que las disestesias y la alodinia fueron los parámetros menos modificados.
6. CONCLUSIONES
La aparición reciente de un nuevo FAE es un avance terapéutico importante para el tratamiento del dolor neuropático. PGB es el primer FAE que se ha estudiado desde el desarrollo de la molécula buscando su implicación en dolor. Su perfil farmacocinético, tanto por su rapidez de acción y su vida media prolongada, permiten mejorar el perfil de sus predecesores, que requerían largos periodos de titulación para conseguir los efectos terapéuticos, y en muchos casos precisaban la dosificación triple diaria.
PGB se ha mostrado efectivo en varios modelos de dolor neuropático experimental en animales y también en modelos clínicos de dolor neuropático en humanos. Tanto en la neuralgia postherpética como la neuropatía diabética PGB ha demostrado una eficacia superior a placebo a partir de dosis de 150 mg diarios. Este efecto es progresivo y dependiente de las dosis, de tal manera que dosis de 600 mg al día manifiestan un marcado efecto analgésico. Bien es cierto que los efectos secundarios siguen de forma paralela la misma curva, de tal forma que con dosis altas es mucho más frecuente la aparición de secundarismos. Sin embargo, en aquellos pacientes que toleran bien el fármaco, estas dosis no se manifiestan tóxicas, no interfieren con otros fármacos, se eliminan totalmente por orina sin secuelas ni residuos, lo que hace posible llegar a ellas sin asumir grandes riesgos. Otros pacientes pueden necesitar el ajuste en un rango de dosis más bajas; en cualquier caso, PGB se comporta como el resto de los neuromoduladores, en los que la respuesta de cada paciente es distinta y para los que se requiere una individualización y personalización de cada tratamiento. La analgesia y la mejoría del área del sueño producen en los pacientes una importante percepción de mejoría, tanto de su sintomatología como de su calidad de vida, hasta el punto de que hasta el 80% de los pacientes incluidos en todos los ensayos clínicos manifestaron algún tipo de mejoría con el tratamiento; este hecho concuerda con la alusión que se hace a la baja variabilidad interpaciente comparada con otros FAE (6,46).
En otras patologías más controvertidas como la fibromialgia, PGB se ha mostrado efectiva. Para conocer la respuesta terapéutica al fármaco en otras patologías es necesario esperar la experiencia de otros autores, pero es posible que sea una molécula útil para todos aquellos procesos en los que el sistema nervioso esté involucrado.
AGRADECIMIENTOS
Agradezco a la empresa farmacéutica Pfizer, en particular a Manuel Ruiz Román del departamento médico, su colaboración en la aportación de los datos que han servido de base para esta revisión.
| CORRESPONDENCIA: José Ramón González-Escalada Castellón Unidad del Dolor Hospital Ramón y Cajal Ctra. de Colmenar, km 9,900 28034 Madrid e-mail: jgonzalezcal.hrc@salud.madrid.org |
BIBLIOGRAFÍA
1. Backonja M. Neuromodulating drugs for the symptomatic treatment of neuropathic pain. Curr Pain Headache Rep 2004; 8: 212-6. [ Links ]
2. Tremont-Lukats IW, Megeff C, Backonja MM. Anticonvulsants for neuropathic pain syndromes: mechanisms of action and place in therapy. Drugs 2000; 60 (5): 1029-52. [ Links ]
3. Willmore LJ. Clinical pharmacology of new antiepileptic drugs. Neurology 2000; 55 (Supl. 3): S17-24. [ Links ]
4. Richard Huckle. Pregabalin Pfizer. Curr Opin Investig Drugs 2004; 5: 82-9. [ Links ]
5. Taylor CP, Vartanian MG, Yuen PW, Bigge C, Suman-Chauhan N, Hill DR. Potent and stereospecific anticonvulsant activity of 3-isobutyl GABA relates to in vitro binding at a novel site labeled by tritiated gabapentin. Epilepsy Res 1993; 14: 11-5. [ Links ]
6. Ben-Menachem E. Pregabalin pharmacology and its relevance to clinical practice. Epilepsia 2004; 45 (Supl. 6): 13-8. [ Links ]
7. Stahl S. Mechanism of action of a2d ligands: Voltage sensitive calcium channel (VSCC) modulators. J Clin Psychiatry 2004; 65: 1033-4. [ Links ]
8. Field MJ, Bramwell S, Hughes J, Singh L. Detection of static and dynamic components of mechanical allodynia in rat models of neuropathic pain: are they signalled by distinct primary sensory neurones? Pain 1999; 83: 303-11. [ Links ]
9. Nozaki-Taguchi N, Chaplan SR, Higuera ES, Ajakwe RC, Yaksh TL.Vincristine-induced allodynia in the rat. Pain 2001; 93 (1): 69-76. [ Links ]
10. Hong-Ju Y, He L, Wei-Guo S, et al. Effect of gabapentin derivates on mechanical allodynia-like behaviour in a rat model of chronic sciatic constriction injury. Bioorg Med Chem Lett 2004; 14: 2537-41. [ Links ]
11. Siddall PJ, Cousins MJ. Clinical aspects of present models of neuropathic pain. Pain Reviews 1998; 5: 101-23. [ Links ]
12. Collins SL, Moore RA, McQuayHJ, Wiffen P. Antidepressants and anticonvulsants for diabetic neuropathy and postherpetic neuralgia: a quantitative systematic review. J Pain Symptom Manage 2000; 20: 449-58. [ Links ]
13. Devor M. Pathophysiology of injuried nerve. En: Melzack R, Wall PD, eds. Textbook of Pain. 3ª ed. Edimburgh: Churchill Livingstone, 1994. p. 79-100. [ Links ]
14. Vander Straten M, Carrasco D, Lee P, Tyring SK. Reduction of postherpetic neuralgia in herpes zoster. J Cutan Med Surg 2001; 5: 409-16. [ Links ]
15. Nurmikko T. Sensory dysfunction in postherpetic neuralgia. En: Boivie J, Hansson P, Lindblom U, eds. Touch, temperature, and pain in health and disease: mechanisms and assessments. Progress in Pain Research and Management. Vol 3. Seattle: IASP Press, 1994. p. 1-10. [ Links ]
16. Wallin J, Cui JG, Yakhnitsa V, Schechtmann G, Meyerson BA, Linderoth B. Gabapentin and pregabalin suppress tactile allodynia and potentiate spinal cord stimulation in a model of neuropathy. Eur J Pain 2002; 6: 261-72. [ Links ]
17. Field MJ, McCleary S, Hughes J, Singh L. Gabapentin and pregabalin, but not morphine and amitriptyline, block both static and dynamic components of mechanical allodynia induced by streptozocin in the rat. Pain 1999; 80: 391-8. [ Links ]
18. Chen SR, Xu Z, Pan HL. Stereospecific effect of pregabalin on ectopic afferent discharges and neuropathic pain induced by sciatic nerve ligation in rats. Anesthesiology 2001; 95: 1473-9. [ Links ]
19. Frampton JE, Foster RH. Pregabalin: in the treatment of postherpetic neuralgia. Drugs 2005; 65: 111-20. [ Links ]
20. Dworkin RH, Corbin AE, Young JP Jr, Sharma U, LaMoreaux L, Bockbrader H, et al. Pregabalin for the treatment of postherpetic neuralgia: a randomized, placebo-controlled trial. Neurology 2003; 60: 1274-83. [ Links ]
21. Sabatowski R, Galvez R, Cherry DA, Jacquot F, Vincent E, Maisonobe P, et al, 1008-045 Study Group. Pregabalin reduces pain and improves sleep and mood disturbances in patients with post-herpetic neuralgia: results of a randomised, placebo-controlled clinical trial. Pain 2004; 109: 26-35. [ Links ]
22. Frampton JE, Foster RH. Pregabalin: in the treatment of postherpetic neuralgia. Drugs 2005; 65: 111-8. [ Links ]
23. Farrar JT, Young JP Jr, LaMoreaux L, Werth JL, Poole RM. Clinical importance of changes in chronic pain intensity measured on an 11-point numerical pain rating scale. Pain 2001; 94: 149-58. [ Links ]
24. Dubinsky RM, Kabbani H, El-Chami Z, Boutwell C, Ali H; Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: treatment of postherpetic neuralgia: an evidence-based report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2004; 63: 959-65. [ Links ]
25. Vincent AM, McLean LL, Backus C, Feldman EL. Short-term hyperglycemia produces oxidative damage and apoptosis in neurons. FASEB J 2005; 0: 425131-1111. [ Links ]
26. Tesfaye S, Chaturvedi N, Eaton SE, Ward JD, Manes C, Ionescu-Tirgoviste C, et al, EURODIAB Prospective Complications Study Group. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005; 352: 341-50. [ Links ]
27. Abbott CA, Vileikyte L, Williamson S, et al. Multicenter study of the incidence of and predictive risk factors for diabetic neuropathic foot ulceration. Diabetes Care 1998; 21: 1071-5. [ Links ]
28. Harati Y. Diabetes and the nervous system. Endocrinol Metab Clin North Am 1996; 25: 325-59. [ Links ]
29. Skyler JS. Diabetic complications. The importance of glucose control. Endocrinol Metab Clin North Am 1996; 25: 243-54. [ Links ]
30. Slovenkai MP. Foot problems in diabetes. Med Clin North Am 1998; 82: 949-71. [ Links ]
31. Krendel DA, Zacharias A, Younger DS. Autoimmune diabetic neuropathy. Neurol Clin 1997; 15: 959-71. [ Links ]
32. Sugimoto K, Murakawa Y, Sima AA. Diabetic neuropathy -a continuing enigma. Diabetes Metab Res Rev 2000; 16: 408-33. [ Links ]
33. Boulton AJ, Malik RA. Diabetic neuropathy. Med Clin North Am 1998; 82: 909-29. [ Links ]
34. Galer BS, Gianas A, Jensen MP. Painful diabetic polyneuropathy: epidemiology, pain description, and quality of life. Diabetes Res Clin Pract 2000; 47: 123-8. [ Links ]
35. O'Brien SP, Schwedler M, Kerstein MD. Peripheral neuropathies in diabetes. Surg Clin North Am 1998; 78: 393-408. [ Links ]
36. Islam MR, Bhowmik NB, Haque A, Haque S, Haque A, Rahman HR. F wave latency -a frequent and early involved nerve conduction parameter in young diabetic subjects. Mymensingh Med J 2005; 14: 46-9. [ Links ]
37. Field MJ, Oles RJ, Lewis AS, McCleary S, Hughes J, Singh L. Gabapentin (neurontin) and S-(+)-3-isobutylgaba represent a novel class of selective antihyperalgesic agents. Br J Pharmacol 1997; 121: 1513-22. [ Links ]
38. Houghton AK, Lu Y, Westlund KN. S-(+)-3-isobutylgaba and its stereoisomer reduces the amount of inflammation and hyperalgesia in an acute arthritis model in the rat. J Pharmacol Exp Ther 1998; 285: 533-8. [ Links ]
39. Jones DL, Sorkin LS. Systemic gabapentin and S(+)-3-isobutyl-gamma-aminobutyric acid block secondary hyperalgesia. Brain Res 1998; 810: 93-9. [ Links ]
40. Rasmussen PV, Sindrup SH, Jensen TS, Bach FW. Therapeutic outcome in neuropathic pain: relationship to evidence of nervous system lesion. Eur J Neurol 2004; 11: 545-53. [ Links ]
41. Rodrigues-Filho R, Campos MM, Ferreira J, Santos AR, Bertelli JA, Calixto JB. Pharmacological characterisation of the rat brachial plexus avulsion model of neuropathic pain. Brain Res 2004; 1018: 159-70. [ Links ]
42. Back SK, Won SY, Hong SK, Na HS. Gabapentin relieves mechanical, warm and cold allodynia in a rat model of peripheral neuropathy. Neurosci Lett 2004; 368: 341-4. [ Links ]
43. Lynch JJ 3rd, Wade CL, Zhong CM, Mikusa JP, Honore P. Attenuation of mechanical allodynia by clinically utilized drugs in a rat chemotherapy-induced neuropathic pain model. Pain 2004; 110: 56-63. [ Links ]
44. Diop L, Raymond F, Fargeau H, Petoux F, Chovet M, Doherty AM. Pregabalin (CI-1008) inhibits the trinitrobenzene sulfonic acid-induced chronic colonic allodynia in the rat. J Pharmacol Exp Ther 2002; 302: 1013-22. [ Links ]
45. Dubinsky RM, Kabbani H, El-Chami Z, Boutwell C, Ali H. Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: treatment of postherpetic neuralgia: an evidence-based report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2004; 63: 959-65. [ Links ]