Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.21 no.5 Madrid sep./oct. 2014
https://dx.doi.org/10.4321/S1134-80462014000500007
Epiduroscopia (interventional endoscopy spinal surgery). Procedimiento endoscópico quirúrgico espinal
Epiduroscopy (IESS). Interventional endoscopy spinal surgery
C. Nieto Iglesias1 e I. Andrés Nieto2
1Unidad de Dolor. Hospital Universitario Fundación Alcorcón. Madrid.
2Servicio de Traumatología y Ortopedia. Hospital General Universitario de Ciudad Real. Ciudad Real
Dirección para correspondencia
Introducción
La epiduroscopia, endoscopia espinal o también llamado IESS (interventional endoscopy spinal surgery - procedimiento endoscópico quirúrgico espinal) es un procedimiento de los llamados mínimamente invasivos, que permite visualizar el espacio epidural (en tiempo real) con fines diagnósticos y terapéuticos, en pacientes que padecen lumbalgia o lumbociatalgias crónicas refractarias a tratamientos convencionales, mediante la utilización de un epiduroscopio flexible, de pequeño tamaño, con una fibra óptica insertada y con la posibilidad de utilizar pequeños instrumentos para el tratamiento de los pacientes.
La lumbalgia o lumbociatalgia se ha transformado en un grave problema sanitario y social ya que la incidencia anual afecta, en un 45 %, a la población de entre 35 y 50 años, constituyendo el 13 % de las causas de absentismo laboral, cifras que van en aumento exponencial, dada nuestra larga esperanza de vida. Lo cierto es que el 80-90 % de la población general padecerá este tipo de dolor alguna vez en la vida. Afortunadamente, estos episodios (60-80 %) ceden en el plazo de pocas semanas, pero alrededor de un 7-10 % desarrollarán dolor crónico (aunque para algunos autores esta cifra puede alcanzar hasta el 33 %) (1), lo que les hace subsidiarios de múltiples tratamientos médicos y quirúrgicos, que pueden fracasar, con un impacto brutal sobre su calidad de vida y estado funcional, así como un tremendo coste social (2).
Según las diferentes publicaciones se considera que entre un 40 a un 80 % de los pacientes que han sufrido una intervención quirúrgica sobre la columna vertebral, mantendrán algún tipo de dolor e incluso empeorarán, o lo que es lo mismo, solo uno de cada cuatro experimentarán alguna mejoría. Este problema se denomina "síndrome de cirugía fallida de espalda" o en inglés "failed back surgery syndrome" (FBSS). Los peores resultados afectarán a aquellos pacientes que sufran más de una intervención (3). Este cuadro clínico, que consiste en la persistencia de dolor lumbar con o sin irradiación a miembros inferiores, constituye la mayor fuente de pacientes subsidiarios de esta técnica.
El IESS ofrece una serie de ventajas sobre otros procedimientos, siendo poco agresivo y con escasas complicaciones, tales como:
1. Visualización de tejidos normales y anormales (adherencias, inflamación...), tanto del espacio epidural posterior (espacio de trabajo habitual para la lisis de adherencias) como anterior.
2. Posibilidad de realización de biopsias.
3. Confirmación el diagnóstico del origen del dolor.
4. Lavado de sustancias proinflamatorias y algogénicas en el lugar de la lesión (mediante infusión de suero salino).
5. Depósito de sustancias terapéuticas en el lugar de la lesión (anestésicos locales, hialuronidasa, corticoides, ozono, clonidina...).
6. Lisis mecánica de adherencias (con balón o el propio epiduroscopio) y/o mediante la utilización de radiofrecuencia fría o coablativa (resonancia molecular cuántica).
7. Realización de técnicas de neuromodulación (radiofrecuencia pulsada) por vía epidural.
8. Permite la exploración de estructuras intradurales (en desarrollo).
9. Alternativa a procedimientos más agresivos como la estimulación de cordones posteriores o la perfusión de fármacos por vía intradural (bombas de infusión intratecal).
La epiduroscopia o IESS es un técnica que comenzó a partir de las publicaciones de Burman en los años 30 (4), donde utilizó un epiduroscopio rígido para explorar la anatomía del espacio intradural en cadáveres. Posteriormente, Ooi y cols. (5) en los años 60, desarrollaron un endoscopio con la adhesión de una fuente de luz, lo que dió lugar a varias publicaciones enfocadas fundamentalmente a la exploración del espacio epidural, tanto en animales, cadáveres o sobre pacientes vivos (6,7). Los años 90 marcan el inicio del IESS, tal como la conocemos actualmente, gracias al desarrollo de un fibroscopio flexible y de escaso diámetro que permite la visualización del espacio epidural e incluso identificar la raíz afectada, reproduciendo e identificando el origen del dolor mediante toques selectivos con el epiduroscopio, en pacientes bajo sedación superficial. Shimoji y cols. y Saberski y cols. (8,9) describen la aproximación por vía caudal, que minimiza la posibilidad de la punción dural y por tanto hace la técnica mucho más segura, y la irrigación con suero salino que facilita la visualización del espacio epidural. Es a partir de estas fechas, cuando comienza la publicación de estudios prospectivos, randomizados y revisiones sistemáticas que sientan las bases clínicas de la técnica, la eficacia, las complicaciones y la evidencia. En el año 2006 la FDA americana, admite la técnica como método diagnóstico y la empresa MRT desarrolla dos importantes avances: la utilización de un balón que facilita la destrucción de adherencias de forma mecánica y la posibilidad de lisis de las mismas mediante radiofrecuencia fría o co-ablativa (resonancia molecular cuántica). Actualmente también es posible la realización de técnicas de neuromodulación (radiofrecuencia pulsada) por vía epidural a través del epiduroscopio, radiofrecuencia pulsada bipolar (vía mixta intra-extra dural) y la utilización de otros métodos ablativos como el láser (10).
Indicaciones
El origen del dolor, tras una intervención quirúrgica sobre la columna vertebral, puede tener múltiples etiologías como: inestabilidad posquirúrgica, degeneración de segmento adyacente, hernia recurrente, hernia de novo, resección discal incompleta, síndrome facetario, espondilodiscitis, aracnoiditis, diagnóstico incompleto o incorrecto, insuficiente descompresión, lesión de una raíz nerviosa y fibrosis epidural. El riesgo de padecer un FBSS aumenta de forma considerable en aquellos pacientes con una selección inadecuada, en aquellos que han sufrido reintervenciones y en los que padecen alteraciones psicológicas importantes (depresión documentada) (3,11,12).
Actualmente se considera un factor muy importante para el desarrollo del FBSS, la fibrosis epidural (en un 24 % de los casos, en ausencia de patología discal u ósea que lo justifique), que prácticamente esta presente en el 100 % de los pacientes operados y cuya magnitud se haya en relación directa a la complejidad de la intervención (13-15).
La causa por la que la fibrosis epidural puede producir dolor aún no es clara, lo que parece cierto es que la simple compresión mecánica o el estiramiento de las raíces nerviosas no es suficiente, tiene que existir un compromiso de la microcirculación intraneural con edema, infiltrado de células y sustancias inflamatorias que a su vez pueden producir más fibrosis y un mayor compromiso de la circulación de la raíz nerviosa con disminución del aporte de oxígeno y de nutrientes, alteración del metabolismo de los neurotransmisores del nervio, por tanto, dolor y alteración de su función (16).
Los mecanismos por lo que el IESS produce analgesia son:
- Identificación de patología.
- Localización correcta del origen del dolor.
- Disminuir la concentración de sustancias inflamatorias locales (mediante lavado, por la infusión de suero salino) (17).
- Depósito de sustancias el lugar exacto del origen del dolor (anestésicos locales, corticoides...).
- Adhesiolisis (física mediante balón o resonancia molecular cuántica).
- Posibilidad de neuromodulación (radiofrecuencia intracanal) (18).
En resumen, el IESS puede estar indicado en aquellos pacientes con dolor radicular lumbosacro crónico, de moderada a alta intensidad, en los que ha fracasado el tratamiento conservador, entendido como: tratamiento médico adecuado, inclusión en programa de rehabilitación (incluida las escuelas de espalda), procedimientos mínimamente invasivos -infiltraciones epidurales interlaminares o transforaminales, epidurolisis bajo control fluoroscópico (técnica de Racz) o técnicas de neuromodulación como la radiofrecuencia pulsada sobre los ganglios de la raíz dorsal por vía intracanal o extacanal- en pacientes no subsidiarios de cirugía o con dolor posquirúrgico (FBSS). La principal indicación del IESS lo constituye actualmente el FBSS aunque publicaciones muestran buenos resultados en otras patologías como la estenosis de canal con afectación radicular de uno o dos segmentos (19). También podrían ser subsidiarios aquellos pacientes en los que se sospecha que la causa del dolor es secundaria a fibrosis no secundaria a cirugía, aunque no existe evidencia.
Existen otras indicaciones para la utilización de epiduroscopio como: asistencia para colocación de electrodos o catéteres epidurales, toma de biopsias, retirada de cuerpos extraños, y punción y aspiración de quistes epidurales, acceso a espacio epidural anterior fundamentalmente indicada en el tratamiento quirúrgico de disco intervertebral (20).
El IESS se presenta como una alternativa previa a procedimientos más agresivos como la estimulación de cordones posteriores o la perfusión de fármacos por vía intradural (bombas de infusión intratecal).
Indicación/selección de pacientes (Tabla I y Fig. 1):
1. Lumbociatalgia crónica con dolor fundamentalmente de uno o dos niveles (FBSS y estenosis de canal).
2. No "Red Flags".
3. No indicación quirúrgica.
4. Evolución > 3 meses.
5. EVA > 5.
6. No responde a tratamiento conservador.
7. RMN con tejido cicatricial evidente (en menos de 6 meses tras una intervención). La no existencia de fibrosis en RMN no contraindica la técnica.
Contraindicaciones
Las contraindicaciones del IESS son las mismas que nos podemos encontrar para cualquier técnica invasiva, por un lado, y por otro derivan del aumento de la presión dentro del espacio epidural, que se traduce en un aumento de la presión intracraneal, al utilizar suero fisiológico para la navegación del epiduroscopio.
La ausencia de consentimiento informado y aquellas situaciones en las que los pacientes no pueden colaborar, también justifican la no realización de la técnica. La obesidad o la imposibilidad de mantener una posición en decúbito prono durante una hora, puede ser una contraindicación relativa ya que puede optarse por una posición en decúbito lateral.
Hay que recordar que el paciente tiene que mantenerse vigil, aunque sedado, durante la intervención, teniendo que ser capaz de responder a nuestros requerimientos y/o molestias durante el procedimiento.
Contraindicaciones:
-No firma de consentimiento informado.
-Infección o sepsis general o en el lugar de punción.
-Enfermedad activa grave (insuficiencia hepática o renal grave).
-Obesidad con un índice de masa corporal (IMC) > 35 (contraindicación relativa).
-Imposibilidad de mantener posición en prono más de 60 minutos (contraindicación relativa).
-Alteraciones cognitivas importantes (falta de colaboración).
-Alteraciones psiquiátricas graves (falta de eficacia).
-Coagulopatía o tratamiento antiagregante o anticoagulante no modificado.
-Cirugía vascular cerebral previa.
-Vasculopatía cerebral (angiomas, aneurismas, etc.).
-Enfermedades oculares y retinianas.
-Estenosis de canal cervical con mielopatía.
-Quistes meníngeos o psuedomeningocele posquirúrgico.
-Epilepsia.
-Cefalea (excepto menstrual).
-Signos de alteración neurológica grave o progresiva ("Red Flags").
-Alergia a algunas de las sustancias utilizadas (anestésicos locales, corticoides, etc.).
-Embarazo.
Anatomía
El espacio epidural es el que rodea a la duramadre, limitado en su porción anterior por los cuerpos vertebrales, los discos intervertebrales y el ligamento longitudinal posterior; lateralmente, por los forámenes y los pedículos y la porción posterior por las láminas y el ligamento amarillo. Este espacio está delimitado, en su porción inferior, por el hiato sacro que se origina por la falta de fusión de las láminas de los segmentos S5 y parte de S4, de unos 4 a 5mm (diámetro antero-posterior) y cerrado por el ligamento sacrococcígeo, lugar de acceso habitual para el IESS. Este hiato puede tener alteraciones anatómicas importantes (10%), lo que dificulta el acceso, la interrupción de la técnica o incluso la elección de una vía de acceso interlaminar.
La duramadre en su parte inferior (saco dural) termina en el nivel S2 y desde aquí el espacio epidural solo contiene el filum terminal lo que hace muy poco frecuente la punción dural por vía sacra. La médula ósea termina a la altura de L2. La duramadre emite unos manguitos que envuelven las raíces anterior, posterior y el ganglio de la raíz dorsal. Estos manguitos se fusionan con el epineuro de las raíces nerviosas y en la parte posterior del foramen con el ligamento amarillo, que a su vez forma parte de la cápsula facetaria (21).
Este espacio epidural contiene (22):
-Tejido conectivo areolar (laxo). Este tejido conectivo forma septos uno dorsal medio que divide en dos el espacio posterior y restringe los movimientos de la duramadre, y uno anterior. Según algunos autores el espacio epidural posterior también esta dividido por otro plano transverso de tejido conectivo que vuelve a dividir este espacio epidural posterior en dos compartimentos (anterior y posterior), aunque estos hallazgos no están claros. También ha sido descritos el ligamento de Hofmann que delimitaría el espacio epidural lateral y por último ligamentos intraforaminales.
-Tejido graso más abundante en las porciones anterolateral (región foraminal cerca de la salida de las raíces nerviosas) y dorsomedial del espacio epidural (entre la duramadre y el ligamento amarillo). La función del tejido graso sería de amortiguación y lubricación para los movimientos del tejido nervioso.
-Vasos sanguíneos. El sistema venoso en el espacio epidural forma plexos (plexo de Batson) interconectados, uno anterior (entre el ligamento longitudinal posterior y el cuerpo vertebral) y otro posterior que conducen la sangre desde los cuerpos vertebrales sobre todo. Normalmente el plexo anterior es mayor que el posterior en la zona lumbar aunque esta relación se invierte a medida que se asciende hacia la región torácica.
Las arterias proceden de arterias segmentarias.
-Tejido nervioso (salida de las raíces nerviosas y los ganglios de la raíz dorsal (GRD) y el nervio sinuvertebral que penetra por los forámenes en situación anterior a las raíces nerviosas.
En estado normal, la duramadre tiene un aspecto blanquecino que puede pulsar y estar cubierta por una red de vasos; es depresible al tocarla con el epiduroscopio. Las raíces nerviosas son también de aspecto blanquecino con un vaso que los recorre longitudinalmente; también pueden pulsar por transmisión desde la duramadre. La grasa tiene aspecto de pompas de jabón amarillentas que son fácilmente identificables.
En una situación patológica nos podemos encontrar hiperemia con una coloración roja intensa, que habitualmente no pulsa, sobre la superficie de la dura o de las raíces. También podemos encontrar fibrosis en diferentes grados y organización espacial que algunos autores (23) han correlacionado con la clínica y con la respuesta a tratamientos. En resumen podremos ver (24,25):
1. Fibrosis de aspecto blanquecino, transparentes, que se adhieren de forma suave a la dura y se dirigen hacia el espacio epidural (en forma de panal o radiales), no dolorosas a la palpación o distensión pero que podrían ser capaces de producir parestesias distales.
2. Estructuras fibrosas de gran consistencia adheridas fuertemente a la dura con vascularización intrínseca y signos de estasis vascular. Se suelen organizar en el espacio epidural lateral ejerciendo tracción sobre la dura produciendo la llamada "inestabilidad dinámica". Pueden reducir de forma importante el espacio epidural (hasta 2/3 su diámetro). La distensión suele ser dolorosa (dolor de carácter neuropático).
3. Red fibrosa con múltiples bridas, formando una red cercana a los forámenes que frecuentemente se asocia a tejido inflamatorio. La distensión suele resultar muy dolorosa y puede producir un dolor a distancia (dolor de origen nociceptivo) en regiones sacras o lumbares y ser el origen de parestesias.
4. Completa estenosis del canal epidural por fibrosis.
La fibrosis adhesiva es más frecuente en el FBSS y los tejidos inflamados lo son, en la estenosis de canal, aunque pueden coexistir varios tipos de alteraciones.
La fibrosis compromete tanto la nutrición, el flujo sanguíneo y la estabilidad del tejido nervioso, todos ellos factores causantes del dolor.
Técnica
A continuación describimos la técnica con abordaje a través del hiato sacro, el más utilizado y según la técnica de Raffaelli (26-28).
Previo a la realización de la epiduroscopia, debe hacerse una historia clínica completa con exploración clínica exhaustiva para intentar localizar el origen de la lesión. Debemos disponer de una resonancia magnética nuclear (RMN) o tomografía axial computarizada (TAC) recientes y un electromiograma (EMG) de miembros inferiores. También obtendremos analítica completa (con estudio de coagulación) y, para el resto de pruebas, seguiremos los protocolos de preanestesia de cada centro.
Tiempo preoperatorio
- Consentimiento informado.
- Consulta de preanestesia positiva.
Tiempo prequirúrgico
- Realización de "check list".
- Profilaxis antibiótica: siguiendo los protocolos de cada hospital. En general se utiliza una cefalosporina de segunda generación (por ejemplo cefonicida) o en caso de alergia, vancomicina, en una sola dosis y en la hora previa a la intervención.
Tiempo quirúrgico
- Quirófano reglado con anestesiólogo de presencia, al menos dos cirujanos, dos enfermeras, auxiliar y técnico de radiodiagnóstico. Lo ideal sería que el personal de apoyo fuera siempre el mismo, lo que ahorra tiempo y evita errores.
- Colocación del paciente: sobre la mesa quirúrgica radiotransparente. La posición es en decúbito prono lo más confortable posible, con los brazos ligeramente flexionados y hacia arriba. Colocar una almohada en los tobillos y otra en las caderas para minimizar la lordosis lumbar. Si el acceso al hiato sacro es dificultoso, pueden girarse ambos pies hacia dentro para facilitar dicho acceso.
- Monitorización completa.
- Sedación no demasiado profunda. El paciente debe ser capaz de contestar a preguntas o de quejarse de molestias como dolor en el cuello o dolor de cabeza.
- Material inventariable: el material necesario para la realización de la técnica debe chequearse incluso antes de colocar al paciente sobre la mesa quirúrgica. Es preferible colocarlo siempre en las misma posición:
• Material de protección radiológica (delantales, protección tiroidea, gafas).
• Fluoroscopio y monitor.
• Torre de endoscopia que consta del monitor, cámara digital y la fuente de luz con cable esterilizable (Olympus, Linvatec, Storz...) con sistema de almacenamiento de imágenes para visualizar la técnica en tiempo posterior.
• Ocular estándar que se conecta a la cámara.
• Equipo de radiofrecuencia coablativa con placa para el paciente y pedal.
• Equipo de radiofrecuencia estándar con placa para paciente.
• Equipo de ozonoterapia.
-Material fungible (mesa quirúrgica-preparación):
• Sobre una mesa quirúrgica (grande) se colocarán: paños estériles para el campo quirúrgico, coberturas estériles para el fluoroscopio y el cable de la fuente de luz, un sistema de suero estéril, gasas/compresas, agujas de carga, subcutáneas e intramusculares, una aguja epidural (Touhy) de calibre 18G (para el acceso por hiato sacro), jeringuilla de insulina (para inflar el balón), jeringuilla de 20 ml (una o dos para la administración de suero salino en el espacio epidural), jeringuillas de 10 ml (para medicación) y jeringuilla de baja presión en caso de que se utilice ozono. Un bisturí de punta fina.
• Suero salino de 250 ml, calentado a 37 grados y conectado a un sistema estéril.
• Epiduroscopio flexible desechable. Aunque existen varios en el mercado, nosotros utilizamos el Resascope® con 3,3 mm de diámetro total con un canal de trabajo de 1,3 mm y otro para la óptica de 1,3 mm, que puede dirigirse en las 4 direcciones.
• Introductor de 11F desechable con dilatador y guía metálica.
• Fibra óptica de 150 cm re-esterilizable.
• Catéter tipo Fogarty o Resalon® de 3 French y de 80cm que se introducirá por una de las vías de acceso.
• Catéter para realizar radiofrecuencia coablativa (Resaflex®) de 0,8 mm de diámetro y 50 cm de longitud.
• Catéter para radiofrecuencia estándar intracanal.
• Medicación: contraste (admitido por vía intratecal), anestésicos locales, hialuronidasa, corticoides, etc.
• Sistema de medición de presión del espacio epidural (actualmente no disponible en muchos centros).
Una vez colocado el paciente y la mesa quirúrgica, se procede a la inserción de la aguja de Touhy (18G) en el hiato sacro (fase de inserción) (Fig. 2), previa inyección de anestésico local y ayudados por el fluoroscopio (visión A-P y lateral) a través del cual se introduce una guía metálica flexible que servirá para la introducción del dilatador y del tutor del epiduroscopio (8-9G). Antes de la retirada de la aguja de Touhy (con la guía en buena posición comprobada por fluoroscopia), se puede realizar un pequeño corte en la piel (en la zona donde se ha introducido la aguja) para facilitar la entrada del dilatador/tutor. El tutor no debe sobrepasar la cuarta vértebra sacra ya que podemos lesionar la duramadre y dificultar las maniobras del epiduroscopio. Posteriormente se introduce el epiduroscopio (una vez retirado el dilatador), al que previamente le hemos insertado el balón (comprobado siempre después de haberlo introducido en el epiduroscopio, no antes) por uno de los canales y la fibra óptica por otro que se conectará a la cámara y la fuente de luz, momento en el que se hace el balance de blancos y se enfoca. La fibra óptica debe sobresalir del extremo distal del epiduroscopio 1-1,5 mm para evitar una visión en telescopaje. Una vez insertado el epiduroscopio, se introduce contraste por uno de los accesos para realizar un epidurograma, donde podemos observar la ausencia de salida de contraste por los forámenes (denominado amputación), lo que indicaría fibrosis y obstrucción. Algunos autores prefieren inyectar contraste en el área inmediata al origen del dolor (cerca de la raíz o raíces afectadas), aduciendo que la imagen del epidurograma desde la región sacra depende de otros factores como la cantidad inyectada, la velocidad y presión de inyección, además de entorpecer la visión radioscópica posterior.
El siguiente paso consiste en la observación de los tejidos en el espacio epidural (fase de navegación-visualización) progresando el extremo del epiduroscopio en sentido cefálico y con control fluoroscópico. La visualización correcta se realiza inyectando pequeños bolos de suero salino de forma manual, infundiéndolo a través de uno de los accesos de epiduroscopio. En general el volumen total máximo de fluido no debe superar los 250-300 ml (algunos autores recomiendan no superar los 200 ml) y los bolos deben inyectarse de forma lenta y con pausas de unos 30 segundos cada 3 o 4 bolos con el fin de no producir un aumento de la presión en el espacio epidural, que se traducirá en un aumento de la presión del líquido cefalorraquídeo y de la presión intracraneal lo que puede comprometer estructuras vasculares y nerviosas. La presión del LCR no debe superar los 60 mmHg (la presión intracraneal normal oscila entre 5 y 10 mmHg y los incrementos no deben superar la presión arterial media que oscila entre 70 y 110mmHg). Si se sospecha un aumento de la presión (cefalea o dolor cervical), se debe detener la perfusión durante unos 5 minutos (tiempo en que la presión vuelve a niveles basales) antes de continuar con la intervención. El flujo de suero salino debe ser de 1 ml cada 2-3 segundos. Si el paciente refiere parestesias o dolor que no cede o de alta intensidad, el procedimiento debe ser suspendido inmediatamente. Puede ocurrir que los primeros bolos sean dolorosos para el paciente, este hecho traduce un estado de inflamación de las estructuras. Algunos autores recomiendan monitorizar la presión del espacio epidural conectando un transductor por uno de los canales del epiduroscopio.
Posteriormente se irá avanzando con el epiduroscopio hacia el lugar de la lesión (posible fuente de dolor, diagnosticada por exploración clínica y/o radiológica) abriéndonos paso con el balón que sobresale aproximadamente 1 mm del borde del epiduroscopio, inflándolo con 2-3 ml de contraste (para su localización con fluoroscopia) y realizando pequeñas maniobras de arrastre, lo que libera adherencias y remueve la grasa peridural, que nos permite llegar al lugar de la lesión y visualizar estructuras anormales como zonas de hiperemia y fibrosis. Si la clínica es unilateral se debe explorar el lado contralateral al lesionado. Una vez en el lugar de la lesión se confirma el diagnóstico clínico con pequeños toques con el extremo del epiduroscopio y preguntándole al paciente si se reproduce su dolor habitual, maniobra que es mucho más sensible para el diagnóstico del origen del dolor que la clínica y la resonancia magnética nuclear (14,29,30).
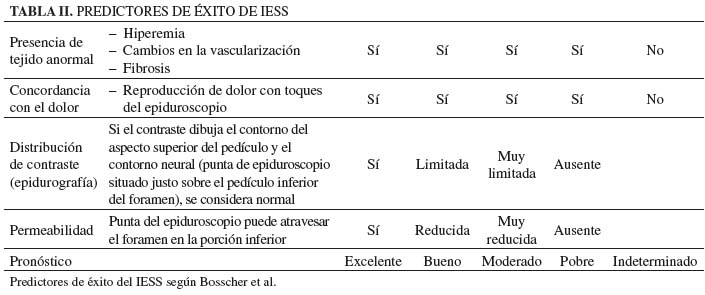
Bosscher en 2014 (31) publica un artículo en el que evalúa una serie de predictores del éxito de la epiduroscopia, valorando la presencia de tejido anormal, la concordancia del dolor inducido por el tacto de las estructuras sospechosas, la epidurografía sobre el receso lateral y la permeabilidad del foramen (Tabla II).
Takeshima y cols. (15) también refieren que la probabilidad de éxito de la técnica es mayor si se encuentra tejido fibroso en situación perirradicular.
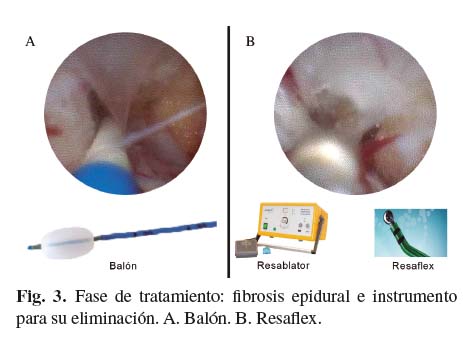
La siguiente fase es la de tratamiento donde podemos producir una vaporización del tejido fibroso, sin aumento de la temperatura, utilizando resonancia molecular cuántica, que hace que los enlaces de unión que conforman los tejidos se rompan al entrar en resonancia, produciendo una lesión muy circunscrita alrededor del extremo del catéter y con una temperatura que no excede los 50 oC. Introducimos el catéter de radiofrecuencia (Resaflex®) por uno de los canales del epiduroscopio previamente conectado al generador (Resablator®) y lo aplicamos sobre el tejido fibroso (preferiblemente en la base del septo) con una potencia de 25 W y con disparos accionados por un pedal de no más de 2-3 segundos de duración (32). Esta maniobra se puede repetir varias veces y siempre con el extremo del catéter a la vista. Con frecuencia se pueden observar fogonazos que no significan reacción térmica sino reacción química sin quemadura posterior y mayor incidencia de refibrosis. También se observan pequeñas burbujas de gas que impiden la visualización por lo que se lava después de cada sesión e incluso se puede volver a introducir el balón (Fig. 3).
Una vez concluida la sesión con el Resaflex®, se repite el epidurograma para comprobar la mejoría de la permeabilidad.
Posteriormente se puede realizar radiofrecuencia pulsada estándar, retirando el Resaflex® e introduciendo un catéter de radiofrecuencia y después de una estimulación sensitiva y motora a 0,5 mA, se procede a realizar un tratamiento con 2 Hz (2 ráfagas de alta frecuencia de 20milisegundos por segundo) a 45 V con una duración de 8 minutos por raíz.
Muchos autores inyectan sustancias en el lugar de la lesión aunque la evidencia es muy pobre y siempre teniendo en cuenta que podemos tener un desgarro dural inadvertido, lo que aumenta la toxicidad de estas sustancias. Han sido publicadas la administración de:
-Suero salino hipertónico, con evidencia moderadamente positiva, pero no recomendado por su posible toxicidad en caso de punción dural (33).
-Hialuronidasa 1.500 U con evidencia conflictiva (33).
-Corticoides metilprednisolona 80-120 mg o betametaxona 6 mg (se recomienda no utilizar corticoides particulados por su toxicidad neuronal).
-Anestésicos locales bupivacaína 0,125 %-0,00625 % o ropivacaína.
-Ozono 8 ml al 30 % (34).
-Clonidina 100-150 mcg.
-Ciprofloxacino 500 mg.
Está descrito otro abordaje (interlaminar) descrito y analizado por Avellanal y cols. (35-37) que puede utilizarse en caso de problemas de acceso por el hiato sacro. Para realizar este procedimiento se inserta una aguja epidural 14G (Tuohy, Coudé) en el espacio interlaminar L5-S1 con técnica de pérdida de resistencia y ayudados por fluoroscopia. Posteriormente se inyecta contraste para localizar el lugar de la lesión y se inserta un epiduroscopio flexible de 0,77mm de diámetro y 150 cm de longitud (Polyscope) introducido en un catéter de angiografía calibre 4F, conectado a un adaptador en Y, que permite la inyección de suero, medicación o conectar un transductor de presión. Los problemas de este abordaje son: la escasa movilidad del epiduroscopio, la necesidad de un segundo abordaje simultáneo para utilizar otras herramientas de tratamiento y la mayor probabilidad de realizar desgarros o punciones durales.
Tiempo posquirúrgico
Después de la intervención, el paciente debe pasar a una sala donde pueda monitorizarse el dolor, la función motora y de los esfínteres (posible hematoma epidural) durante unas 2 horas, tras las cuales puede pasar a una la zona de hospital de día para su posterior alta. Debemos recordar que el paciente puede sufrir molestias sobre todo en el lugar de la punción.
Recomendamos reposo domiciliario durante 2 días e incorporarse lentamente a su vida habitual tras 3-4 días.
Tiempo de seguimiento
Una vez dados de alta del centro, sería aconsejable realizar seguimiento de los mismos de forma reglada o protocolizada para poder valorar la eficacia de la técnica, por ejemplo: a los 15 días, al mes, a los 3 y a los 6 meses, el primer año y cada 6 meses los demás, midiendo: dolor, estado funcional/calidad de vida y exploración neurológica. Si los resultados no son lo suficientemente adecuados, la técnica puede repetirse 2-3 veces al año o considerar la estimulación de cordones posteriores si una nueva cirugía no está indicada.
Complicaciones/Efectos Secundarios
Las complicaciones de esta técnica son poco frecuentes y delimitadas en el tiempo. Oscilan en casi todos los estudios entre un 1-4 % aunque pueden aumentar hasta el 21% (punción dural por vía interlaminar).
Algunas de las complicaciones son comunes a otras técnicas intervencionistas y otras más específicas de la técnica que pueden derivar del aumento de la presión intracraneal.
-Punción dural: es, posiblemente, la complicación más frecuente (1,7-21 %) del IESS. La incidencia aumenta mucho cuando se utiliza la vía de abordaje interlaminar pudiendo llegar hasta un 21 %. Esta complicación puede llevar a una cefalea postpunción que curiosamente no es muy frecuente entre los pacientes. Es posible que la propia fibrosis impida la salida de líquido cefalorraquídeo. Si aparece (15 %) debe ser tratada como tal (38).
-Derivadas del aumento de la presión hidrostática epidural. Esta complicación está relacionada directamente con la utilización de altos volúmenes de fluido y sobre todo de la velocidad de inyección de los bolos, durante la navegación por el espacio epidural. Como ya hemos dicho, el aumento de la presión hidrostática en el espacio epidural se transmite hacia el LCR aumentando la presión intracraneal que puede comprometer la perfusión de porciones del sistema nervioso y llevar a daños permanentes (no frecuentes). Se han descrito: cefalea y dolor nucal (en el intraoperatorio), signos de irritación nerviosa (parestesias) y hemorragias retinianas (por colapso arterial central de la retina) con ceguera (39-41) que en el 80 % de los casos han sido transitorias, aunque se ha descrito un caso de ceguera bilateral permanente en un paciente con degeneración macular previa. Las hemorragias retinianas no son frecuentes pero sí pueden ser una de las más graves complicaciones.
-Efectos secundarios de la medicación. A mi modo de ver es posiblemente el efecto secundario más frecuente, pero puede pasar inadvertido. Estos pacientes han sufrido numerosas infiltraciones previas (conocidas o no) con corticoides y como consecuencia su sistema inmunitario, su capacidad de reacción al estrés, la capacidad de reconstrucción de tejidos, etc. pueden estar alterados, con una mayor tendencia a infecciones subcutáneas en el lugar de la inyección, aracnoiditis, meningitis e incluso abscesos epidurales con un síndrome de compresión medular posterior.
También hay que recordar que la medicación que se administra puede inyectarse por vía intravascular o intradural de forma accidental e incluso inadvertida, por lo que no es aconsejable la utilización de esteroides particulados, suero salino hipertónico por su neurotoxicidad (descrito un caso de vejiga neurógena postepiduroscopia), o altos volúmenes de anestésicos locales a altas concentraciones (para evitar un bloqueo exagerado). Se ha descrito un caso de encefalopatía y rabdomiolisis secundaria a la inyección de contraste no ionizado en el espacio subaracnoideo (Iotrolan®).
Tampoco hay que olvidar las reacciones alérgicas a los medicamentos.
-Otros efectos derivados de la técnica son: dolor persistente en la zona de punción, lesión vascular con hematoma epidural, lesión radicular o neural directa, debilidad muscular o parálisis de miembros inferiores y excesiva dosis de radiación acumulada (profesionales médicos) a lo largo del año.
Actuaciones que mejoran los resultados y reducen complicaciones (Tabla III)
-Fase preoperatoria:
• Comprobar las contraindicaciones.
• Comprobar la clínica previa (dolor) que refiere el paciente aunque no concuerde con las pruebas radiológicas. Ahorra tiempo y dudas en el intraoperatorio y permite fijar la diana de nuestro procedimiento.
• La profilaxis antibiótica debe ser administrada dentro de la hora previa a la intervención, lo que evita infecciones posteriores.
-Fase intraoperatoria:
• Si es posible, esta técnica debe realizarse con el mismo personal tanto quirúrgico como de apoyo. Al menos, siempre, dos médicos intervencionistas y anestesiólogo de presencia física.
• Es preferible colocar todo el material inventariable en la misma posición (torre, arco, generadores, mesa quirúrgica radiotransparente). Resulta más cómodo y evita incomodidad.
• La mesa de instrumental debe ser amplia ya que se utiliza una gran cantidad de elementos de gran tamaño y largos catéteres.
• La sedación debe ser superficial (el paciente deba poder responder en todo momento a nuestras preguntas y/o quejas).
• Cuando hacemos el balance de blancos y el enfoque, podemos utilizar una referencia (algo blanco con algo impreso) y giraremos la fibra óptica hasta que queden en la misma posición con la que vamos a insertar el epiduroscopio, es decir, sabremos lo que es superior, inferior, derecha e izquierda previo a la inserción. También podemos marcar las palancas del epiduroscopio con bolígrafo estéril (derecha, izquierda, arriba y abajo).
• No introducir el tutor del epiduroscopio por el hiato sacro más allá del nivel S3-S4 ya que dificulta las maniobras con el epiduroscopio y reduce la posibilidad de lesionar la dura.
• Según los protocolos, se recomienda realizar un epiduragrama cuando el epiduroscopio se encuentra en el nivel sacro (10 ml de contraste admitido por vía intratecal) para cerciorarnos de la posible amputación de las raíces secundaria a fibrosis en el inicio de procedimiento y repetirlo al terminar. Otros autores prefieren realizar un epidurograma selectivo sobre la zona de la lesión antes y después de la técnica. Pueden realizarse ambos procedimientos.
• Durante el procedimiento y debido a la infusión del suero fisiológico, el paciente puede quejarse de dolor nucal, cefalea, parestesias o dolor de tórax. Esto suele ser debido al aumento de la presión del espacio epidural con el consiguiente aumento de la presión del LCR e intracraneal. Por lo que se aconseja que el volumen total no debe sobrepasar los 250-300 ml (media de 200 ml) (algunos autores relacionan las complicaciones con un volumen superior a 100 ml) y la velocidad de infusión de los bolos debe ser 1 ml cada 2-3 segundos y pausas de unos 30 segundos cada 3-5 bolos. Si el paciente refiere estas molestias se debe parar la infusión durante unos 5 minutos (tiempo en el que la presión vuelve a su situación basal). Si persisten o aumentan debe suspenderse la técnica inmediatamente. Con el fin de ahorrar infusión, algunos profesionales prefieren navegar a ciegas (dirigidos con fluoroscopia) hasta la zona de lesión y después comenzar la infusión de suero fisiológico. Esto es cierto, pero tiene el inconveniente de una mayor probabilidad de perforar la dura.
• Es mejor inflar el balón con contraste para ser visible en fluoroscopia y recordar que se debe testar después de introducirlo en el epiduroscopio (si se hace antes puede haber dificultades para introducirlo, por dilatación del extremo). No debe introducirse el balón en el canal del epiduroscopio en las maniobras de retirada (se fractura) por lo que siempre debe ser visible la zona tintada del catéter en pantalla.
• Si se utiliza el Resaflex®, el extremo distal siempre debe ser visible y no realizar disparos de más de 2-3segundos seguidos.
• Cuando se perfora la duramadre con introducción del epiduroscopio, en el espacio intradural podemos ver una imagen parecida a los tubos de un órgano. Puede sospecharse la perforación aunque estemos en el espacio epidural por la buena visión de las estructuras sin necesidad de infusión de suero salino. No se deben inyectar medicamentos cuando existe una perforación.
• No se recomienda utilizar sustancias potencialmente neurotóxicas (suero salino hipertónico, corticoides particulados, contrastes no admitidos para inyección intradural).
- Fase postoperatoria:
• Los cuidados y monitorización postoperatorios dependen de los protocolos de cada centro, pero es aconsejable la monitorización durante varias horas (constantes, función motora, posible cefalea y función esfinteriana).
- Fase de seguimiento:
• Deben realizarse los seguimientos de forma protocolizada y estandarizada para valorar los resultados.
• Si los resultados son incompletos, puede repetirse la técnica 2 veces al año.
Evidencia
Desde que se inició el estudio de las estructuras internas del canal medular (Burman) en el año 1931, podemos decir que ha existido un amplio periodo de silencio o escaso interés de la comunidad científica hasta los años 90 donde comienzan las publicaciones de series de casos, estudios randomizados, protocolización de la técnica, complicaciones y revisiones (42). Este interés coincide con dos aspectos importantes: el aumento exponencial de la patología de la columna en la población general con un alto coste social, y el desarrollo de los epiduroscopios modernos (pequeños, flexibles y con sistemas ópticos con una resolución de imágenes cada vez mejores).
Por otro lado, el grado de evidencia posiblemente no ha sido paralelo al alto interés científico demostrado por esta técnica, posiblemente por la escasez de estudios metodológicamente correctos (difícil realizarlos con técnicas intervencionistas) y dada la, cada vez mayor, rigidez en las características que deben presentar los estudios para sentar una evidencia. También es cierto que se necesita una curva de aprendizaje más amplia que para otros procedimientos y que los costes en tiempo cero, son superiores a otras técnicas.
La mayoría de las revisiones sistemáticas con valoración de evidencia se refieren a la eficacia (junto a otros parámetros) del IESS en pacientes en el SCFE (43,44). Lentamente la evidencia y el grado de recomendación van mejorando sobre todo a partir de las fuertes críticas de las guías publicadas por la ASP (American Society of Pain) para técnicas intervencionistas en 2009 de Chou y Hofman. También las revisiones se van centrando en el IESS pues en muchas de estas se mezclan estudios basados en adhesiolisis guiada por fluoroscopia (técnica de Racz) y por extensión a la epiduroscopia
Helm y cols. publican en 2013 (45) una de las últimas revisiones sistemáticas, en la que los estudios deben tener al menos 50 pacientes, consideran que la eficacia es buena cuando los pacientes mejoran al menos un 50 % su dolor basal y también consideran corto plazo de seguimiento un periodo menor de 12 meses. Clasifican el nivel de evidencia en: bueno, moderado y limitado/pobre según la clasificación de evidencia de U.S Preventive Services Task Force (USPSTF). Helm y cols. llegan a la conclusión, después de examinar las publicaciones desde 1960 a 2012, que la evidencia del IESS es moderada para pacientes con SCFE a corto y largo plazo (más o menos de 12 meses de seguimiento), para lo que se basan en un estudio randomizado y controlado de alta calidad de Manchikantim y cols. (46) con estudio preliminar publicado en 2003 (47), un estudio observacional de alta calidad del mismo autor (48) y dos observacionales de moderada calidad de Manchikanti y cols. y Kim y cols. (28,49). El objetivo del estudio de Manchikanti y cols. del año 1999 fue la comparación de la efectividad de la epiduroscopia frente a la adhesiolisis guiada por fluoroscopia, mientras que Kim y cols. comparan la adhesiolisis con o sin utilización de láser como método descompresivo.
Kallewaard y cols. (22) publican una revisión sistemática y califican la evidencia en 2B+ (basadas en un estudio randomizado controlado, 9 prospectivos y 3 retrospectivos). En esta revisión sistemática se menciona a Raffaeli (utilizando Resablator) (26), a Ruett utilizando Holmium láser YAG, así como a Avellanal (35) con su abordaje interlaminar. Previamente la evidencia había sido valorada en el 2010 como 2 B+/- (50).
En el 2009 Chou y Hofman publicaron unas guías de la APS para técnicas intervencionistas en donde se evaluó el IESS con un grado de evidencia moderado a corto plazo y pobre a largo plazo (< o > 6 meses de evolución). Estas guías fueron ampliamente criticadas por Manchikanti (51) un año después, llegando a la conclusión de que la evidencia para esta técnica era buena a corto plazo y moderada a largo (por deficiencias en la revisión anterior). Posteriormente Manchikanti y cols. publican en 2013 las guías basadas en la evidencia para técnicas intervencionistas en el dolor crónico espinal, en donde valoran la evidencia de la adhesiolisis como moderada para el FBSS y para la estenosis de canal (52).
En resumen y haciendo un repaso de los distintas asociaciones:
-En 2014 la United Health Care Oxford (53) publica una revisión de las principales sociedades para tratamientos intervencionistas llegando a la siguiente conclusión de no recomendar esta técnica en su cartera de servicios.
-La Food and Drug Administration (FDA): en 1996 admite la epiduroscopia como método diagnóstico.
-El American College of Occupational and Enviromental Medicine (ACOEM) de 2007: no recomienda la epiduroscopia como tratamiento.
-The American Society of Interventional Pain Physician (ASIPF): en 2009 considera que el nivel de evidencia es II-1 o II-2 para la endoscopia en el FBSS. En 2013 considera que el grado de evidencia es moderado a corto y largo plazo con criterios de inclusión muy estrictos.
-El National Institute for Health and Clinical Excelence (NICE): en 2010 y revisada en 2013, considera que la evidencia es limitada a corto plazo (54).
-El World Institute of Pain (WIP): sitúa la evidencia en un nivel 2B+ solo para el FBSS y no lo recomienda para pacientes no intervenidos previamente (2B-).
-La American Society of Pain (APS): en 2009 considera que la epiduroscopia posee una evidencia moderada a corto plazo y pobre a largo plazo. Fue revisada y la evidencia llegó a ser buena a corto plazo y moderada a largo plazo.
En conclusión, existen pocos estudios publicados de calidad, los métodos de realización de la técnica no son homogéneos, por lo que es muy difícil valorar la efectividad. Por este motivo actualmente estamos desarrollando un estudio internacional de efectividad (amén de otros parámetros) del IESS con técnica y métodos homogéneos lo que servirá para sentar evidencia.
Bibliografía
1. Varrassi G, Raffaeli W, Marinangeli F, Ursini ML, Piroli A, Paladini A, et al. Epidemiology and treatment of pain in Italy: Part I. European Journal of Pain Supplements 2008;2(1):44-6. [ Links ]
2. Enthoven P, Skargren E, Oberg B. Clinical course in patients seeking primary care for back or neck pain: A prospective 5-year follow-up of outcome and health care consumption with subgroup analysis. Spine (Phila Pa 1976) 2004;29(21):2458-65. [ Links ]
3. Burton CV. Causes of failure of surgery on the lumbar spine: Ten-year follow-up. Mt Sinai J Med 1991;58(2):183-7. [ Links ]
4. Burman M. Myeloscopy or the direct visualisation of the spinal canal and its contents. J Bone Joint Surg 1931;13(4):695-6. [ Links ]
5. Ooi Y, Morisaki N. Intrathecal lumbar endoscope. Clin Orthop Surg 1969;4:295-7. [ Links ]
6. Blomberg RG, Olsson SS. The lumbar epidural space in patients examined with epiduroscopy. Anesth Analg 1989;68(2):157-60. [ Links ]
7. Heavner JE, Chokhavatia S, Kizelshteyn G. Percutaneous evaluation of the epidural and subarachnoid space with flexiblefiberscope. Reg Anesth 1991;16(1):85. [ Links ]
8. Shimoji K, Fujioka H, Onodera M, Hokari T, Fukuda S, Fujiwara N, et al. Observation of spinal canal and cisternae with the newly developed small-diameter, flexible fiberscopes. Anesthesiology 1991;75(2):341-4. [ Links ]
9. Saberski LR, Kitahata LM. Direct visualization of the lumbosacral epidural space through the sacral hiatus. Anesth Analg 1995;80(4):839-40. [ Links ]
10. Richter EO, Abramova MV, Cantu F, DeAndres J, Lierz P, Manchiaro P, et al. Anterior epiduroscopi neural descompression: Eight-center experience in 154 patients. Eur J Pain Supplements 2011;5:401. [ Links ]
11. Manchikanti L, Singh V, Datta S, Cohen SP, Hirsch JA, American Society of Interventional Pain Physicians. Comprehensive review of epidemiology, scope, and impact of spinal pain. Pain Physician 2009;12(4):E35-70. [ Links ]
12. Konstantinou K, Dunn KM. Sciatica: Review of epidemiological studies and prevalence estimates. Spine (Phila Pa 1976) 2008;33(22):2464-72. [ Links ]
13. Bosscher HA, Heavner JE. Incidence and severity of epidural fibrosis after back surgery: an endoscopic study. Pain Pract 2010;10(1):18-24. [ Links ]
14. Bosscher HA, Heavner JE. Diagnosis of the vertebral level from which low back or leg pain originates. A comparison of clinical evaluation, MRI and epiduroscopy. Pain Pract 2012;12(7):506-12. [ Links ]
15. Takeshima N, Miyakawa H, Okuda K, Hattori S, Hagiwara S, Takatani J, et al. Evaluation of the therapeutic results of epiduroscopic adhesiolysis for failed back surgery syndrome. Br J Anaesth 2009;102(3):400-7. [ Links ]
16. Racz GB, Flores JC. Lisis de adherencias epidurales (Parte I). Fisiopatología y clínca. Rev Soc Esp Dolor 2012;19(6):310. [ Links ]
17. Heavner JE, Bosscher HA, Wachtel MS. Cell types obtained from the epidural space of patients with low back pain/radiculopathy. Pain Pract 2009;9(3):167-72. [ Links ]
18. Insausti J. Radiofrecuencia de las raices lumbosacras por vía epidural. Rev Soc Esp Dolor 2010;17:122. [ Links ]
19. Igarashi T, Hirabayashi Y, Seo N, Saitoh K, Fukuda H, Suzuki H. Lysis of adhesions and epidural injection of steroid/local anaesthetic during epiduroscopy potentially alleviate low back and leg pain in elderly patients with lumbar spinal stenosis. Br J Anaesth 2004;93(2):181-7. [ Links ]
20. Lee S, Kim SK, Lee SH, Kim WJ, Choi WC, Choi G, et al. Percutaneous endoscopic lumbar disectomy for migrated disc herniation: Classification of disc migration and surgical approaches. Eur Spine J 2007;16:431-7. [ Links ]
21. Perez M, Sinagra A, Larrarte G, Acuña M, Conesa HA. Anatomía endoscópica del espacio epidural lumbar. Soc Neurocirugía de la provincia de Bs As 2002 XLIV Jornadas Anuales de Neurocirugía 2002. Neuropimar 2002:69. [ Links ]
22. Kallewaard JW, Vanelderen P, Richardson J, Van Zundert J, Heavner J, Groen GJ. Epiduroscopy for patients with lumbosacral radicular pain. Pain Pract 2014;14(4):365-77. [ Links ]
23. Raffaeli W, Righetti D, Andruccioli J, Sarti D. Periduroscopy: General review of clinical features and development of operative models. Acta Neurochir Suppl 2011;108:55-65. [ Links ]
24. Raffaeli W, Righetti D, Andruccioli J, Sarti D. How we can see and treat the epidural space: Epiduroscopy. Eur J Pain Supplements 2011;5:395. [ Links ]
25. Raffaeli W, Righetti D, Andruccioli J, Sarti D. Epidural space and chronic pain. European Journal of Pain Supplements 2010(S4):269. [ Links ]
26. Raffaeli W, Righetti D. Surgical radio-frequency epiduroscopy technique (R-ResAblator) and FBSS treatment: Preliminary evaluations. Acta Neurochir Suppl 2005;92:121-5. [ Links ]
27. Raffaeli W, Righetti D, Andruccioli J, Sarti D. Epiduroscopy and radiofrequency technique: the Raffaeli-Righetti technique. The Pain Clinic 2007;19(4):185-91. [ Links ]
28. Manchikanti L, Saini B, Singh V. Spinal endoscopy and lysis of epidural adhesions in the management of chronic low back pain. Pain Physician 2001;4(3):240-65. [ Links ]
29. Geurts JW, Kallewaard JW, Richardson J, Groen GJ. Targeted methylprednisolone acetate/hyaluronidase/clonidine injection after diagnostic epiduroscopy for chronic sciatica: A prospective, 1-year follow-up study. Reg Anesth Pain Med 2002;27(4):343-52. [ Links ]
30. Vanelderen P, Van Boxem K, Van Zundert J. Epiduroscopy: The missing link connecting diagnosis and treatment? Pain Pract 2012;12(7):499-501. [ Links ]
31. Bosscher HA, Heavner JE. Lumbosacral epiduroscopy findings predict treatment outcome. Pain Pract 2014;14(6): 506-14. [ Links ]
32. Ciliberto G, Simone AD, Mandara MT, Catini R, Di Pietro A, Luzi M, et al. Impiego di un resettore a "risonanza quantica molecolare" e valutazione degli effeti sulla giologia delle strutture nervose trattata. giornale italiano di Terapia del Dolore e Cure Palliative 2009;0:7. [ Links ]
33. Lee F, Jamison DE, Hurley RW, Cohen SP. Epidural lysis of adhesions. Korean J Pain 2014;27(1):3-15. [ Links ]
34. de Neuton F, Magalhaes O, Soares SC, Torres JM, Ungaretti A, Cacciacarro MF, et al. Effects of ozone applied by spinal endoscopy in patients with chronic pain related to failed back surgery syndrome: A pilot study. Neuropsychiatr Dis Treat 2013;9:1759-66. [ Links ]
35. Avellanal M, Diaz-Reganon G. Interlaminar approach for epiduroscopy in patients with failed back surgery syndrome. Br J Anaesth 2008;101(2):244-9. [ Links ]
36. Avellanal M. Epiduroscopy. Rev Esp Anestesiol Reanim 2011;58(7):426-33. [ Links ]
37. Avellanal M, Diaz-Reganon G, Orts A, Soto S. One-year results of an algorithmic approach for managing failed back surgery syndrome. Pain Res Manag 2014 Sep 15. [ Links ]
38. Shah RV, Heavner JE. Recognition of the subarachnoid and subdural compartments during epiduroscopy: two cases. Pain Pract 2003;3(4):321-5. [ Links ]
39. Gill JB, Heavner JE. Visual impairment following epidural fluid injections and epiduroscopy: A review. Pain Med 2005;6(5):367-74. [ Links ]
40. Heavner JE, Wyatt DE, Bosscher HA. Lumbosacral epiduroscopy complicated by intravascular injection. Anesthesiology 2007;107(2):347-50. [ Links ]
41. Moschos MM, Rouvas A, Papaspirou A, Apostolopoulos M. Acute visual loss and intraocular hemorrhages associated with endoscopic spinal surgery. Clin Ophthalmol 2008;2(4):937-9. [ Links ]
42. Donato AD, Fontana C, Pinto R, Beltrutti D, Pinto G. The effectiveness of endoscopic epidurolysis in treatment of degenerative chronic low back pain: A prospective analysis and follow-up at 48 months. Acta Neurochir Suppl 2011;108:67-73. [ Links ]
43. Boswell MV, Trescot AM, Datta S, Schultz DM, Hansen HC, Abdi S, et al. Interventional techniques: Evidence-based practice guidelines in the management of chronic spinal pain. Pain Physician 2007;10(1):7-111. [ Links ]
44. Trescot AM, Chopra P, Abdi S, Datta S, Schultz DM. Systematic review of effectiveness and complications of adhesiolysis in the management of chronic spinal pain: An update. Pain Physician 2007;10(1):129-46. [ Links ]
45. Helm S, Hayek SM, Colson J, Chopra P, Deer TR, Justiz R, et al. Spinal endoscopic adhesiolysis in post lumbar surgery syndrome: an update of assessment of the evidence. Pain Physician 2013;16(2 Supl.):SE125-50. [ Links ]
46. Manchikanti L, Boswell MV, Rivera JJ, Pampati VS, Damron KS, McManus CD, et al. ISRCTN 16558617: A randomized, controlled trial of spinal endoscopic adhesiolysis in chronic refractory low back and lower extremity pain. BMC Anesthesiol 2005;5:10. [ Links ]
47. Manchikanti L, Rivera JJ, Pampati V, Damron KS, Beyer CD, Brandon DE, et al. Spinal endoscopic adhesiolysis in the management of chronic low back pain: A preliminary report of a randomized, double-blind trial. Pain Physician 2003;6(3):259-67. [ Links ]
48. Manchikanti L, Pampati V, Bakhit CE, Pakanati RR. Non-endoscopic and endoscopic adhesiolysis in post-lumbar laminectomy syndrome: A one-year outcome study and cost effectiveness analysis. Pain Physician 1999;2(3):52-8. [ Links ]
49. Kim JD, Jung JH, Kim JI, Jang SL. Epiduroscopic laser disc and neural descompression. J Neurisurg Rev 2011;1:14-9. [ Links ]
50. Van Boxem K, Cheng J, Patijn J, van Kleef M, Lataster A, Mekhail N, et al. 11. Lumbosacral radicular pain. Pain Pract 2010;10(4):339-58. [ Links ]
51. Manchikanti L, Datta S, Gupta S, Munglani R, Bryce DA, Ward SP, et al. A critical review of the American Pain Society clinical practice guidelines for interventional techniques: part 2. Therapeutic interventions. Pain Physician 2010;13(4):E215-64. [ Links ]
52. Manchikanti L, Abdi S, Atluri S, Benyamin RM, Boswell MV, Buenaventura RM, et al. An update of comprehensive evidence-based guidelines for interventional techniques in chronic spinal pain. Part II: guidance and recommendations. Pain Physician 2013;16(2 Supl.):S49-283. [ Links ]
53. United Health Care Oxford. Clinical Polycy. Epiduroscopy, epidural lysis of adhesions and funtional anesthetic discography. United Healdh care Oxford Clinical Policy 2014;Pain 004.15T2:1-10. [ Links ]
54. National Institute for Healt And Clinical Excellence. Interventional Procedures Programme Onterventional procedure overview of therapeutic endoscopic division of epidural adhesions. Interventional Procedure Guiance. 2010; Available at: www.nice.org.uk/ipg 333. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Consuelo Nieto Iglesias
Unidad de Dolor
Hospital Universitario Fundación Alcorcón
C/ Budapest, 1
28922 Alcorcón. Madrid
Recibido: 01-06-14.
Aceptado: 15-09-14.