INTRODUCCIÓN
¿Todos los dolores son iguales? Es evidente que no, pero lo cierto es que muy frecuentemente las herramientas para tratarlos sí son las mismas. Las razones para explicar esta aparente contradicción son múltiples, y sería demasiado extenso entrar a discutirlo ahora, pero, básicamente, se podrían encontrar dos justificaciones: el (aún hoy) limitado conocimiento de las características fisiopatológicas de cada tipo de dolor, y la (aún hoy) limitada formación en el tratamiento del dolor por parte de (aún hoy) demasiados profesionales.
En el ámbito de la farmacología se sigue demasiado frecuentemente (aunque no entre los lectores de esta revista) el protocolo que estableció la OMS para el abordaje del dolor oncológico 1 como paradigma de tratamiento para cualquier tipo de dolor. Aunque es cierto que no se han producido grandes novedades en los últimos años en cuanto a nuevos principios activos para el tratamiento del dolor crónico (el último fue el tapentadol, hace ya más de 10 años), el pipeline (la "tubería" de la que deben salir los nuevos compuestos) está lejos de estar seco. Algunas están más avanzadas, otras menos, pero el mejor conocimiento de la fisiopatología del dolor va a significar, en un futuro no muy lejano, la llegada de varios NCE (New Chemical Entity, del inglés Nueva Entidad Química) que permitan mejorar el tratamiento del dolor crónico y de numerosas patologías que cursan con dolor crónico.
¿QUÉ HAY DE NUEVO EN LA FISIOPATOLOGÍA DEL DOLOR POR ARTROSIS?
Para mejorar el conocimiento de la fisiopatología de la artrosis es fundamental la existencia de modelos animales que imiten esta patología. Dado que este tema se trata detalladamente en otro artículo, aquí nos detendremos en estudiar la información que se ha obtenido de dichos modelos, centrándonos en aquellos aspectos que pueden estar directamente relacionados con el componente doloroso. Sin duda muchas estrategias farmacológicas, encaminadas a disminuir o incluso a revertir esta enfermedad, van a suponer un alivio significativo del dolor; tampoco esas dianas van a ser comentadas, puesto que escapan del objetivo de este artículo. Sin embargo, no podemos obviar que uno de los principales signos de la artrosis es el dolor, por lo que todos (o la mayoría) de los ensayos clínicos que buscan modificar la enfermedad tienen como una de las variables principales, si no la principal, el alivio del dolor.
DE LA MANO DE LA SINOVITIS
Probablemente uno de los grandes cambios de enfoque a la hora de afrontar el abordaje farmacológico de la artrosis vino de la mano de la evidencia de que la inflamación jugaba un papel mucho más importante de lo habitualmente aceptado.
La inflamación en la artrosis, una sinovitis "de grado bajo", significaba la implicación del sistema inmune, no solo en el desarrollo de la patología artrósica sino, evidentemente, en la respuesta nociceptiva asociada 2. Y no es que se liberen pocos factores proinflamatorios por parte del tejido sinovial: quimiocinas (CCL2, CXCL13) interleucinas (IL-1, IL-6, IL-8, TNF ∝,) leucotrienos, prostaglandinas, metaloproteasas, óxido nítrico, factores nerviosos (EGF, NGF, vEGF), son algunas de las sustancias implicadas en esta respuesta. Hay que decir que, evidentemente, también existen sustancias antinflamatorias (citocinas como IL-4, IL-13, IL-1Ra, inhibidores de metaloproteasas, etc.), pero es evidente que, si la inflamación persiste, es porque estas últimas no son capaces de contrarrestar el efecto de las primeras 2.
Recientemente se ha descrito cómo, a consecuencia de esta respuesta inflamatoria, los osteoblastos son capaces de inducir la síntesis de PGE2 3. La presencia de esta prostaglandina no solo incrementa la propia respuesta inflamatoria (un mecanismo bien conocido), sino que va a provocar cambios adaptativos en las neuronas aferentes nociceptivas (Figura 1). En efecto, este aumento de la señal provoca una sobreexpresión de canales de sodio Nav1.8 en el ganglio de la raíz dorsal, pero también a nivel del hueso subcondral y a lo largo del nervio ciático 3. Las corrientes activadas por estos canales Nav1.8 son de mayor amplitud debido a que estos canales permanecen más tiempo abiertos una vez iniciada la señal 4, lo que podría suponer una mayor facilidad para desencadenar el potencial de acción nociceptivo y transmitirlo a los centros superiores del sistema nervioso central, sirviendo de explicación a la alodinia mecánica presente en esta patología 5.
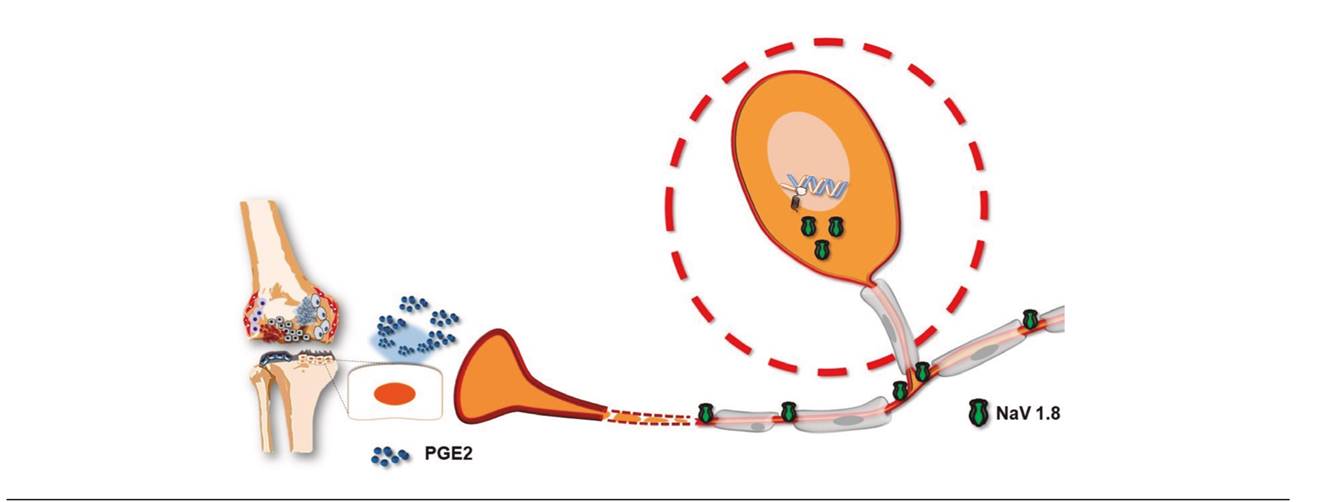
Fig. 1. Los osteoblastos articulares contribuyen a aumentar la información nociceptiva mediante dos mecanismos. En la articulación liberan prostaglandina E2, que contribuye a la sensibilización periférica articular, y esta señal provoca una señal ganglionar que aumenta la expresión de canales de sodio Nav1.8, un subtipo de canal de sodio que contribuye a la aparición de hiperalgesia, por sus características cinéticas.
Parece evidente que la sinovitis es una reacción secundaria al desarrollo de la artrosis. El daño causado por el estrés mecánico en la articulación da como resultado la liberación de patrones moleculares activados por daño (DAMPS, del inglés Danger Activated Molecular Patterns) que desencadenan una respuesta inmune innata 6. Estos DAMP son moléculas que aparecen en la articulación y pueden provenir del interior celular dañado, puede tratarse de proteínas plasmáticas (proteínas de shock térmico, proteínas fijadoras de calcio) fibrinógeno, depósitos de cristales, etc. Estas moléculas interactúan con los receptores de reconocimiento de patrones (PRR) y provocan el inicio de la respuesta inflamatoria. Los DAMP (también pueden ser denominados "alarminas") van a provocar una serie de respuestas tisulares, mediante la activación de distintos tipos de receptores. Entre estos receptores son muy relevantes los receptores TLR (del inglés, Toll Like Receptors), una familia de proteínas de membrana sensibles a la presencia de alarminas y presentes en distintos tipos de células en las del sistema inmune, por supuesto, pero también en neuronas y células gliales.
LOS RECEPTORES TLR Y LA ARTROSIS
Además de participar en los mecanismos de la defensa del huésped contra una infección, la activación de los receptores TLR se ha relacionado con la patogenia de muchas enfermedades inflamatorias y autoinmunes, como la sepsis, la artritis reumatoide, el lupus eritematoso sistémico, la enfermedad inflamatoria intestinal, la diabetes y la esclerosis múltiple 7.
Además de participar en la respuesta inflamatoria, juegan un papel muy relevante en la respuesta pronociceptiva, en la cronificación, en la sensibilización e incluso en la aparición de algunos efectos secundarios de los fármacos opioides. De hecho, la primera relación entre los receptores TLR (el subtipo TLR4 en este caso) y el dolor vino de la mano de los trabajos seminales de Linda Watkins y su grupo, estudiando la participación de las células gliales en la hiperalgesia opioide 8. Este efecto adverso y paradójico de los opioides parece estar mediado, precisamente, por la capacidad que tienen los agonistas opioides para activar el receptor TLR4 presente en la microglía espinal 9.
A partir de entonces, los receptores TLR se han relacionado con numerosos procesos de sensibilización y cronificación. Inicialmente, los receptores TLR espinales y gliales parecían ser los principales receptores implicados en fenómenos de cronificación, por su papel en la regulación espinal de la neuroinflamación 10. Posteriormente se ha comprobado que los TLR periféricos, presentes en las células del sistema inmune (pero no solo), juegan igualmente un papel en la regulación de la respuesta nociceptiva 11,12,13. Existen descritas incluso diferencias relacionadas con el sexo y la activación de TLR en el dolor (por artritis, por ejemplo) 13.
La presencia de receptores TLR4 en condrocitos, sinoviocitos, macrófagos y tejido óseo ha demostrado que estos receptores están implicados en la progresión de la enfermedad 14. En la respuesta inflamatoria que subyace en el dolor crónico de la artrosis participan tanto los receptores TLR como los del factor nuclear kappa B 15. Además, recientemente se ha demostrado que la modulación farmacológica de estos receptores, concretamente su bloqueo mediante el uso de antagonistas, es capaz de disminuir el dolor asociado a la artrosis, tanto la respuesta alodínica como la hiperalgesia asociada 16,17,18,19.
LOS miRNA: DE BASURA A BIOMARCADORES DEL DOLOR
Los microARN (miARN) son pequeños trozos de material genético que durante mucho tiempo pasaron casi desapercibidos, fundamentalmente porque no se podía justificar su utilidad en la célula 20; tanto es así que fueron denominados "ADN basura". Poco a poco se ha ido comprobando que estos restos de material genético son elementos tremendamente relevantes dentro de la vida celular y extracelular, ya que son capaces de actuar como auténticos mensajeros, biomarcadores, de la presencia de dolor tanto en animales como en humanos 21. Los miARN son moléculas cortas de ARN de cadena única, no codificantes (es decir no dan lugar, por ellas mismas, a la expresión de ninguna proteína), pero que pueden regular epigenéticamente el genoma de las células eucariotas. Estos miARN modulan la expresión génica uniéndose al ARNm diana, lo que da como resultado la inhibición de la traducción del ARNm, y así la expresión de la proteína codificada queda disminuida. Numerosos estudios sugieren la participación de los miARN en procesos biológicos clave, incluido el desarrollo y la homeostasis celular, y han demostrado que la expresión alterada de los miARN se asocia con diversas afecciones patológicas 22,23.
Existen abundantes miARN implicados en la patogénesis de la artrosis 24. Los miRNA pueden unirse directamente a los mRNA catabólicos y anabólicos. Estos miARN se dirigen a las vías de señalización o factores de transcripción. Se ha demostrado que, durante el desarrollo de la artrosis, son varias las vías de señalización que están moduladas por miARN en condrocitos, como la vía NFkB, la vía Wnt/beta-catenina, la vía SIRT1/p53 o la vía SDF1/CXCR4. Por otra parte, otros factores epigenéticos, como la activación de la histona desacetilasa-2 o la desacetilasa sirtuina-1 NAD- dependiente, también están reguladas por miARN del cartílago, lo que indica que la interacción entre diferentes mecanismos epigenéticos está involucrada en la patogénesis de la OA 25.
La implicación de los miARN en la artrosis no tiene solo que ver con el desarrollo de la patología. Estos biomarcadores están igualmente implicados en el dolor asociado a esta 26,27,28. Recientemente se ha publicado una relación de los distintos miARN que pueden servir como biomarcadores de dolor asociado a sinovitis en la artrosis 29.
LA UNIÓN HACE LA FUERZA
Uno de los resultados más sorprendentes de las primeras investigaciones con miARN fue que estos no solo servían de moduladores de la expresión génica, sino que eran capaces de ser liberados al espacio extracelular, protegidos en exosomas (pequeñas vesículas formadas por una bicapa lipídica) o unidos a complejos proteicos. Así, actuarían como marcadores de dolor, puesto que pueden ser detectados en plasma y líquido cefalorraquídeo pero, además, son capaces de alcanzar otras células y tejidos para propagar su información 30, actuando en realidad como auténticos neurotransmisores.
El mecanismo por el que los miARN son capaces de estimular otras neuronas está relacionado, al menos en parte, precisamente con los receptores TLR 31. Uno de los primeros descubrimientos en este sentido vino de la mano de uno de estos miARN, denominado let-7b, liberado por neuronas sensoriales del ganglio de la raíz dorsal y que se unía a receptores TLR7 de neuronas próximas, causando la despolarización neuronal y la transmisión de la señal. Se trató, además, de un efecto provocado en menos de un minuto, algo que no se esperaba que pudiera estar relacionado con un mecanismo mediado por ARN.
También en la artrosis se ha demostrado esta relación entre el receptor TLR7 y los microARN, en este caso con miR-21, uno de los miARN más estudiados 32. En este trabajo, la artrosis fue provocada por una sección transversal del ligamento cruzado anterior en la articulación de la rodilla de rata. Este modelo provoca la aparición de alteraciones tisulares e histológicas compatibles con la artrosis, la presencia de sinovitis, así como modificaciones conductuales características, como la hipersensibilidad a la presión mecánica. Se estudió el efecto en tres grupos; un grupo recibió, por vía intrarticular, el miARN miR-21, otro grupo un mutante miR-21 (el control inactivo del mir-21) y el tercero un inhibidor sintético del miR-21. Igualmente estaban disponibles antagonistas de los receptores TLR7 y TLR9. Lo primero que se comprobó fue que la inducción de la patología provocó un aumento de miR-21 en el líquido sinovial, probablemente procedente del tejido sinovial, y que este aumento estaba directamente relacionado con la presencia de artralgia. La comprobación de esta relación con miR-21 se demostró mediante la administración intrarticular de un inhibidor de miR-21 que, tras una única administración, fue capaz de producir una analgesia de larga duración. Igualmente, la administración de un antagonista del receptor TLR7 produjo una analgesia de largo plazo en este modelo de ratas con artrosis.
Es importante señalar que el receptor TLR7 está presente en las neuronas sensoriales primarias nociceptivas y también en las células sinoviales, tanto en los macrófago- sinoviales como en los fibroblasto-sinoviales (Figura 2). Por lo tanto, la hipótesis es que los miR-21, una vez liberados al espacio extracelular, pueden provocar un aumento de la señal nociceptiva a través de la activación de nociceptores y a través de la inflamación mediada por los propios sinoviocitos, puesto que es sabido que la activación, provocada por miARN, de las vías de señalización de TLR7 provoca la producción de TNF-α e interleucinas que, a su vez, sensibilizan a las neuronas nociceptivas 33.
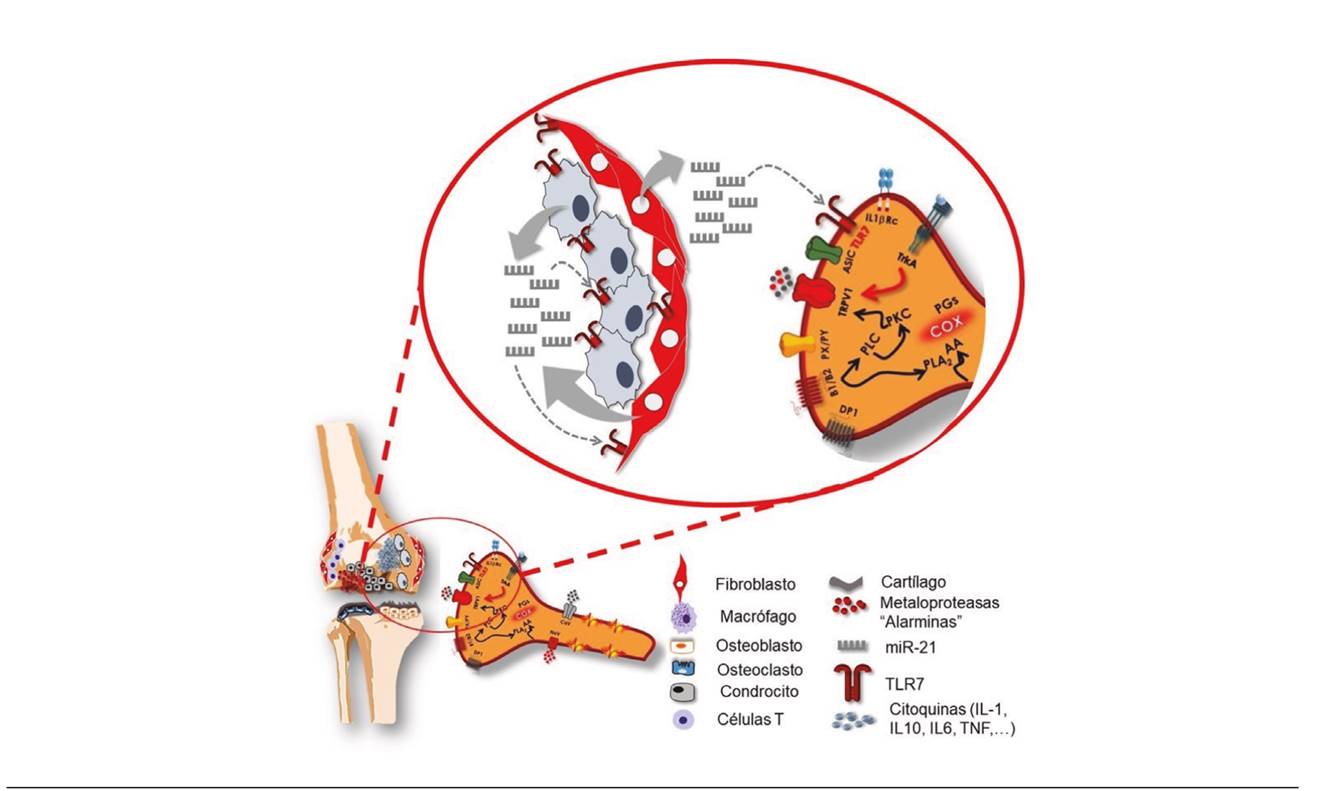
Fig. 2. Los fibroblastos y macrófagos sinoviocitos pueden liberan, en situaciones de artrosis, microRNA-21, un factor epigenético capaz de estimular receptores TLR7, unos receptores presentes tanto en los condrocitos como en los nociceptores. Estos receptores TLR7 (implicados en la activación de la respuesta temprana del sistema inmune), al activarse, aumentan la secreción de sustancias inflamatorias desde los condrocitos y despolarizan las neuronas, facilitando la transmisión de la señal nociceptiva hacia la médula espinal.
Este trabajo concreto propone a miR-21 como una interesante diana farmacológica para el dolor articular. Es posible que esta relación miR-TLR se pueda demostrar para varios miARN y varios TLR, abriendo una interesante puerta al desarrollo de nuevos fármacos analgésicos en la artrosis.
SAPERE AUDE1
A principio de los años 40 del siglo pasado, en Turín, en un laboratorio instalado en su propio dormitorio para evitar la persecución de la Italia fascista de Mussolini, una joven italiana judía, Rita Levi-Montalcini, investigaba sobre el crecimiento neuronal en embriones de pollo. Cuarenta y seis años más tarde recibiría el Premio Nobel de Fisiología por el descubrimiento del Factor de Crecimiento Nervioso, NGF (del inglés, Nerve Growth Factor) 34. La insaciable curiosidad de la profesora Levi-Montalcini, sus ganas de saber y su valentía permitieron profundizar en uno de los procesos más fascinantes de la biología, el crecimiento celular, al descubrir el primero de otros muchos factores tróficos.
Pero la trascendencia del descubrimiento de la Dra. Levi-Montalcini va más allá; NGF funciona como un mensajero químico de acción local, y así modula diferentes funciones celulares. Entre ellas, participa en la regulación de la respuesta inflamatoria y nociceptiva. En 2010, se identificó a NGF como una diana farmacológica para el tratamiento del dolor en un modelo animal de artrosis 35. Efectivamente, tras la aparición de la patología, se comprobó que se producía un aumento del ARNm de NGF, el gen codificador del NGF y que este incremento en la concentración de NGF era independiente de la respuesta inflamatoria 35.
La inyección intrarticular de NGF provoca una conducta nociceptiva en ratas artrósicas 36 mientras que el bloqueo del receptor TrkA (selectivo para NFG) inhibe dicha conducta 37. Una posible explicación a la relación de NGF con el dolor artrósico podría ser que los condrocitos articulares producirían NGF, lo que provocaría la formación de nuevos vasos que aportarían los nutrientes necesarios para el crecimiento axonal, la neo-inervación y con ellos la mayor actividad nociceptiva 38.
Pero además de este mecanismo, la implicación de NGF en el dolor artrósico se debe a su participación en otros procesos. Por ejemplo, en las articulaciones de ratas con artrosis, el NGF extracelular actúa a través de la activación del receptor TrkA en los mastocitos, lo que provoca un aumento en la activación de COX-2 y, con ello, la síntesis de PGD2. La unión de esta prostaglandina a su receptor específico puede sensibilizar a las neuronas sensoriales mediante la activación de los receptores selectivos DP1 39, lo que facilita el envío de información nociceptiva desde la rodilla hasta el asta dorsal de la médula espinal 40 (Figura 3).
Por otra parte, este aumento de la actividad del sistema NGF/TrkA provoca una sensibilización neuronal que facilita la actividad de las neuronas espinales, además de expandir el campo receptorial (el área que emite información nociceptiva hacia la médula espinal) de la articulación 41.

Fig. 3. La señal inflamatoria de la artrosis provoca la liberación de sustancias inflamatorias (citocinas, factores tróficos, prostaglandinas...). El factor de crecimiento nervioso (NGF) se une selectivamente a receptor TrkA. Este receptor, al activarse, es capaz de sensibilizar el receptor TRPV1, de forma que este canal de calcio permanece más tiempo abierto, contribuyendo a la despolarización del nociceptor. La unión del NGF a su receptor provoca la internalización del complejo NGF/TrkA, que se desplaza desde el terminal periférico hasta el ganglio de la raíz dorsal. Allí facilita la síntesis de los receptores TRPV1 (y de bradicinina y receptores ASIC), que migrarán hacia la periferia y contribuyen a la sensibilización periférica y así a la cronificación.
Otro de los mecanismos implicados en el efecto de NGF guarda relación con el aumento de la actividad del péptido relacionado con el gen de la calcitonina, (CGRP [del inglés Calcitonin Gene Related Peptide]), un mecanismo que parece ser responsable, al menos parcialmente, de la aparición de la sensibilización periférica 42.
Igualmente, NGF contribuye a la aparición de la sensibilización periférica, que se inicia con la formación del complejo NGF/trkA (Figura 3). Este complejo se integra en el citoplasma por endocitosis y, desde la periferia, va a transportarse anterógradamente hasta el ganglio de la raíz dorsal, allí donde se localizan los cuerpos de las neuronas, y allí modula la expresión de los receptores de bradicinina, los receptores ASIC2/3, canales de sodio voltaje-dependientes y, muy importante, el receptor TRPV1 (del inglés Transient Receptor Potential Vanilloid 1) 43. Este último receptor, un canal iónico que permite la entrada de calcio, provoca una despolarización de larga duración que es fundamental para iniciar el proceso de sensibilización, inicialmente periférica y, a largo plazo, central 44.
Como conclusión, podemos señalar que la aparición de nuevas dianas y, con ello, de nuevos fármacos para el abordaje del dolor asociado a la artrosis, parece estar garantizado. La modulación del sistema inmune, ya sea mediante factores epigenéticos (como los miARN) o actuando directamente sobre la inflación (como con el NGF), podría conllevar la consecución de tratamientos muy esperanzadores para los pacientes aquejados de artrosis, siempre y cuando, siguiendo el consejo de la Prof. Levi-Montalcini, sigamos atreviéndonos a saber, a pensar...














