Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.83 no.4 Madrid jul./ago. 2009
Prevalencia de tripanomiasis americana en mujeres gestantes de un área de salud. Valencia, 2005-2007 (*)
Prevalence of American Tripanosomiasis in Pregnant Women from a Health Area of Valencia, Spain. 2005-2007
Rafael Manuel Ortí Lucas y María Cristina Parada Barba
Servicio de Medicina Preventiva. Hospital Clínico Universitario de Valencia.
(*) Ayuda de Proyecto de Investigación (Orden 20 de julio): s - 030 Oficina de Investigación Sanitaria de la Dirección General de Ordenación, Evaluación e Investigación Sanitaria de la Consellería de Sanitat.
Dirección para correspondencia
RESUMEN
Fundamento: La enfermedad de Chagas es una patología emergente en nuestro medio debido principalmente al incremento de las migraciones. La prevalencia y el difícil manejo terapéutico hacen del Chagas un problema de salud pública creciente. Pretendemos analizar la prevalencia y perfil epidemiológico de mujeres gestantes latinoamericanas atendidas en el área de influencia del Hospital Clínico de Valencia (HCUV) y estimar el riego de transmisión vertical.
Métodos: Se estudió a 383 mujeres gestantes asistidas en el HCUV entre febrero de 2005 y julio de 2007. Utilizamos para el cribado la técnica de inmunoprecipitación ID-PaGIA- DiaMed, confirmada mediante Inmunofluorescencia Indirecta (IFI) - Inmunoflour Chagas-Inverness Medical. En hijos de mujeres positivas: Microhematocrito, PCR y detección de anticuerpos IgM por IFI, al nacer, e IgG, a los 6 y 12 meses.
Resultados: El 9,7% de las mujeres presentaban anticuerpos específicos del parásito. De ellas el 54,1% eran bolivianas, el 13,5% argentinas y 8,1 % colombianas. 81,1% vivieron en zonas rurales y casas de adobe, el 89,2% tenía antecedentes familiares y el 100% conocían la enfermedad y el vector. La seroconversión en un niño de 8 meses supuso una transmisión vertical del 2,7% y una incidencia en mujeres procedentes de zona endémica del 0,3%.
Conclusiones: La prevalencia de enfermedad de Chagas en mujeres gestantes latinoamericanas es elevada y supone un riesgo de transmisión vertical importante que obliga a detectar anticuerpos frente al parásito en los exámenes de salud de este colectivo. En el cribado son factores de riesgo los antecedentes familiares de tripanosomiasis y la residencia previa en hábitat rural.
Palabra clave: Salud pública. Enfermedad de Chagas. Transmisión vertical. Latinoamérica. Tripanosomiasis. Zoonosis.
ABSTRACT
Background: The Chagas disease, an endemic illness in Latin America, is an emerging pathology due mainly to the increment of human migration. Prevalence increase, difficult diagnosis and therapeutic management turn Chagas into an important public health problem. Our objectives are first to analyse the seroprevalence and epidemiologic profile of Latin American pregnant women who were taken charge of in the area of Hospital Clinical University of Valencia (HCUV), and second, to determine the risk of vertical transmission from infected women to their children.
Method: 400 Latin American pregnant women were analysed. They were assisted in HCUV from February 2005 to July 2007. The screening technique used was Immunoprecipitation ID-PaGIA_DiaMed, confirmed through Indirect Immunofluorescence (Immunofluor Chagas-Inverness Medical). For newborns whose mothers were seropositive, a microhematocrit and PCR was performed at birth, later IgG detection was performed at 6 and 12 months.
Results: 9.3% of pregnant women developed specific antibodies to the parasite. Trypanosomiasis illness in antecedents, living in rural areas and gastrointestinal symptomatology were the most outstanding risk markers among the epidemiological, sociodemographic and clinical variables analysed, especially when women were Bolivians. There was a case of seroconversion in an 8 months child with an incidence of 0.25%.
Conclusions: The high proportion of pregnant Latin American women with latent Chagas disease, the epidemiological history and the risk of vertical transmission made advisable to include the detection of parasite antibodies in the health screenings of this group.
Key word: Public health. Chagas disease. Vertical Pathogen Transmission. Latin America. Trypanosomiasis. Zoonoses.
Introducción
La Tripanosomiasis Americana o Enfermedad de Chagas es una patología endémica del continente americano, especialmente del centro y del sur. Es una zoonosis producida por el protozoo flagelado Trypanosoma cruzi (T. cruzi) cuyos principales vectores son los triatominos de la familia Reduvidae, subfamilia Triatominae. Tres géneros agrupan a los vectores principales: Triatomas, Rhodnius y Pastrongylus.1 El período de incubación es asintomático y dura entre cuatro y diez días. Las manifestaciones clínicas son diferentes según el estadio evolutivo1, 2. La fase aguda, de dos a tres meses, es generalmente asintomática o presenta signos muy leves como fiebre, fatiga, inflamación glandular y dolor de pecho. En esta fase suelen diagnosticarse el 1-2 % de los casos y el T. cruzi es detectable en sangre periférica en su forma tripomastigote, pero al transformarse en amastigote intracelular resulta casi indetectable, por lo que el diagnóstico parasitológico sólo es posible en la fase inicial. Entre las semanas 8 y 10 de la fase aguda se inicia la fase crónica asintomática, intermedia o latente que puede pasar desapercibida o paucisintomática durante varios años e incluso toda la vida en un individuo con serología positiva y parasitemia baja. La fase crónica sintomática se presenta generalmente a los 10-20 años de la primoinfección. A ella evolucionan aproximadamente el 30-40 % de las personas que se infectan y pueden presentar importantes alteraciones cardiacas, gastrointestinales y neurológicas, dando lugar a las diferentes formas de la enfermedad: la cardiaca es la más conocida y fácil de diagnosticar, con arritmias, miocarditis focales y diferente grado de insuficiencia cardiaca3. La digestiva puede conllevar anorexia, mareos, náuseas, vómitos y diarreas o estreñimientos prolongados y en fases más avanzadas con mega vísceras principalmente megaesófago y megacolon4. La neurológica cursa con cefalea intensa, afectación psicomotriz, letargia, agitación, ataxia, mialgia y afasia transitoria.5
La principal vía de transmisión en zonas endémicas es la vectorial, aunque también puede transmitirse por vía oral, parenteral por exposición accidental a material contaminado, transplante de órganos y tejidos o transfusión sanguínea y por vía vertical de madre infectada a su hijo recién nacido6, 7.
Según datos de la OMS/OPS, en la década de los 90 existían en Latinoamérica entre 15 y 18 millones de personas parasitadas y 80 millones en riesgo de estarlo, alrededor del 25% de la población referida, siendo un grave problema para la salud pública y el desarrollo socioeconómico de estos países8. Los esfuerzos realizados para controlar la enfermedad endémica en los últimos años han reducido el número de personas parasitadas a cerca de 8 millones, con un aumento relativo de la transmisión vertical y transfusional9. Sin embargo, la infestación no se limita sólo a esta región y se han identificado casos en Norte América y Europa, donde puede considerarse una enfermedad emergente10-12. Los movimientos migratorios actuales, determinados en gran medida por los lazos de cultura e idioma, han convertido a España en puerta de entrada a Europa para muchos inmigrantes latinoamericanos. Ello, junto con el hecho de que los países latinoamericanos son de los más visitados por los españoles, haría de nuestro país uno de los de mayor riesgo de presentar casos no endémicos13, 14.
Por otra parte, la enfermedad plantea problemas como la estandarización y correcto manejo de las pruebas diagnósticas, que no tienen un patrón de oro adecuado, la disponibilidad de un tratamiento con benznidazol15, de adquisición extranjera, cuya eficacia ha sido probada sólo en la fase aguda, siendo dudosa en las fases indeterminada y crónica, y con muchos efectos secundarios, la ausencia de marcadores de evolución de la enfermedad y la falta de un control epidemiológico efectivo.
La prevalencia en áreas no endémicas, como es el caso de nuestro país, depende fundamentalmente de la proporción de inmigrantes latinoamericanos y, en concreto, del país de procedencia que predomine ya que existe una variabilidad muy grande en zonas endémicas, desde el 1,2% en Ecuador, hasta el 50-60% en ciertas zonas de Bolivia o el Chaco Argentino16,17.
En países donde no existe el vector deben tenerse en cuenta dos aspectos fundamentales, la detección de casos importados que pueden presentar complicaciones de la enfermedad y la detección de casos nuevos autóctonos que puedan producirse como consecuencia de transfusiones, donaciones de órganos y tejidos o transmisión congénita. De hecho, se han detectado 4 casos de Chagas postransfusional en EEUU y 2 en Canadá18. La prevalencia observada en donantes españoles19-21 obligó a dictar el Real Decreto 1088/2005, que incorpora el cribado de la enfermedad de Chagas en donantes procedentes de zonas endémicas, para reducir el riesgo de transmisión transfusional22. Sin embargo, si bien existen técnicas de cribado disponibles en el mercado no existe un programa a nivel nacional de cribado para detectar el parásito en todas las maternidades del país, lo que junto con el mayor riesgo de transmisión vertical y la elevada prevalencia observada en mujeres gestantes latinoamericanas constituye el principal reto preventivo del Chagas en España.
Según dados del Instituto Nacional de Estadísticas (INE, marzo de 2008), la población española ha alcanzado 46,06 millones, de los que el 11,3% (5,22 millones) son personas extranjeras. En la Comunidad Valenciana representan el 14,9% del total de la población, de los cuales el 48% corresponde a latinoamericanos, con mayor proporción de mujeres (56%), la mayoría en edad fértil23.
En este contexto nos planteamos los objetivos de conocer la prevalencia de mujeres gestantes inmigrantes procedentes de zonas endémicas con infección por T. cruzi, estimar el riesgo potencial de transmisión a los recién nacidos y caracterizar un perfil de riesgo epidemiológico de las mujeres positivas que pueda facilitar la anamnesis diagnóstica en los centros asistenciales.
Sujetos y métodos
La población diana estaba formada por las mujeres gestantes inmigrantes de toda América Latina. Se estudió a 400 mujeres residentes en el área de influencia del Hospital Clínico Universitario de Valencia (Departamento 5) que fueron atendidas en este hospital entre febrero de 2005 y junio de 2007. Se excluyó a 5 mujeres gestantes de la República Dominicana y a 12 de Cuba por ser países no endémicos, en los que no existe el vector transmisor. La muestra se constituyó con 383 mujeres gestantes. Se estimó la prevalencia del Chagas y se describieron las variables sociodemográficas y epidemiológicas asociadas a las mujeres con serología positiva. Para estimar el riesgo de transmisión se realizó un estudio observacional cuyo seguimiento se prolongó hasta finales de 2007. Todas las mujeres aceptaron voluntariamente realizarse las pruebas y participar en el estudio.
Procedimientos: El estudio se iniciaba en la primera visita que realiza la mujer gestante al ginecólogo, generalmente en el primer trimestre del embarazo. La matrona, tras obtener el consentimiento informado para participar en el estudio, que incluye la realización de una serología específica para el diagnóstico del Chagas, entrevistaba a la mujer y cumplimentaba una encuesta con información sociodemográfica y sobre los antecedentes de riesgo epidemiológicos (anexo I). El diagnóstico de la enfermedad de Chagas en las mujeres embarazadas se realizaba mediante pruebas serológicas, las de mayor rentabilidad en fases crónicas de la enfermedad por existir una parasitemia escasa24. El ginecólogo solicitaba una prueba de cribado, la Immunoprecipitación particle gel immuno assay - Diamed (IP) (referencia BO20011-01.04), seguida de confirmación en los casos positivos mediante inmunofluorescencia indirecta (IFI), Immunoflour Chagas -Inverness Medical (referencia 20-03648). En los resultados serológicamente discordantes se realizaba la prueba de ELISA (enzimoinmunoensayo) - Dade Behering (referencia CHAG0560DB). Utilizamos técnicas serológicas cumpliendo las recomendaciones de la OMS/OPS porque además de ser más rentables en esta fase de la enfermedad tienen una sensibilidad y especificidad alrededor del 100%25-27. Para validar las técnicas utilizadas se realizaron estudios de comparación de técnicas28,29. Ante cualquier solicitud de determinación de Tripanosomiasis Americana el servicio de microbiología remitía al ginecólogo una copia del resultado de los análisis realizados a cada gestante. Los pediatras que atienden la maternidad detectaban en la historia clínica a las madres de origen latinoamericano y antes del alta comprobaban la realización del análisis y sus resultados. En caso de no estar realizado, el pediatra informaba a la madre y solicitaba el cribado para detección de anticuerpos frente a T. cruzi. Si el cribado era negativo se informaba y daba el alta. Cuando resultaba positivo se realizaban los análisis correspondientes al recién nacido: Microhematocrito, serología IgM por IFI y PCR (realizada en ISCIII Majadahonda)30-32. Si cualquiera de estos análisis era positivo se trataba al niño con benznidazol, por vía oral a la dosis de 5 a 10 mg/kilo/día, 2 veces al día, durante 30 a 60 días15. Las mujeres con pruebas positivas fueron remitidas por el ginecólogo a su médico de cabecera y al servicio de Medicina Interna (unidad de enfermedades infecciosas) para su revisión clínica.
Análisis estadístico: La información clínica, epidemiológica y serológica recogida fue registrada en una base de datos y analizada posteriormente mediante el programa SPSS versión 12 para Windows. Para estimar la seroprevalencia se calculó la proporción de mujeres que tenían anticuerpos positivos según las pruebas de cribado (IP e IFI). Para obtener el perfil epidemiológico de las mujeres con mayor riesgo se estimó la seroprevalencia según el país de origen y otros factores de riesgo asociados a la enfermedad en las mujeres portadoras. Se comparó la proporción de casos para cada variable cualitativa mediante la prueba chi2 y en el caso de las variables continuas se compararon las medias mediante la prueba t-Student. Tras el estudio descriptivo se realizó un análisis simple para establecer la relación entre las variables explicativas del riesgo seleccionadas y la positividad en la serología y un análisis de regresión logística que permitiría ajustar por los posibles factores de confusión. Se consideraron estadísticamente significativos los valores con p<0,05.
Resultados
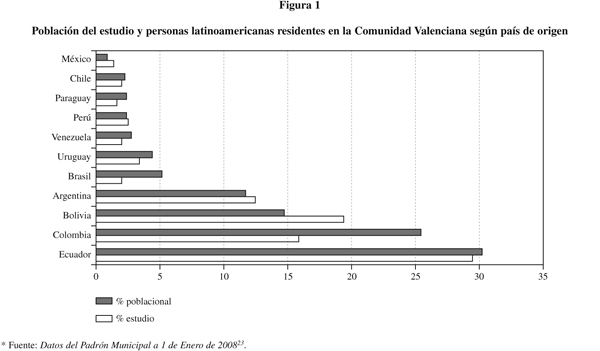
Características de la población estudiada: Las mujeres estudiadas tenían una edad media de 25,9 ± 5 años. Las mujeres gestantes nulíparas fueron el 12,4% frente al 87,6% observado en mujeres que habían tenido previamente al menos un hijo. Según la procedencia, 118 mujeres eran de Ecuador (30,8%), 77 de Bolivia (20,1%), 63 de Colombia (16,4%) y 50 de Argentina (13,1%), cifras que coinciden con los países con mayor porcentaje de latinoamericanos residentes en la Comunidad Valenciana23 (figura 1). Respecto de las características epidemiológicas de la población estudiada observamos que 188 mujeres (49,1%) refirieron que en su país de origen residían en zonas rurales, de las cuales, el 90,7% vivían en casas de adobe y techos de paja o similares, 195 residían en zonas urbanas (50,9%), de las que el 85,9% vivían en casas de ladrillo. Entre los países con predominio de población residente en zonas rurales cabe destacar Ecuador (82,2%), Brasil (71,4%), Perú (66,7%) y Nicaragua y Guatemala (100%) aunque son menos de 5 las mujeres procedentes de estos dos países.
El 19,3% del total tenían antecedentes familiares de enfermedad chagásica. El 64% de ellas procedían de zonas rurales. El 16,2% de las mujeres habían sido donantes de sangre. 26,4% habían sido transfundidas con anterioridad, siendo el porcentaje de transfusión estadísticamente mayor en las mujeres de zonas rurales (35,6%) que las procedentes de zonas urbanas (17,4%) (p=0,000). El 78,3% de las mujeres conocía la enfermedad de Chagas y el 77,3% conocía el vector. De los países con más mujeres estudiadas conocían el vector el 93,5% de las mujeres gestantes bolivianas y el 88% de las argentinas. De las 300 mujeres que conocían la enfermedad, 263 presentaron resultados negativos para la serología IFI (72,5% del total de seronegativas). Las 37 que presentaban serología positiva conocían la enfermedad, aunque en la mayoría de casos no sabían que la padecían por estar asintomáticas. Por otra parte 296 mujeres (74,5%) conocían el vector, incluyendo tanto las 37 positivas así como 259 (71,3%) de las negativas.
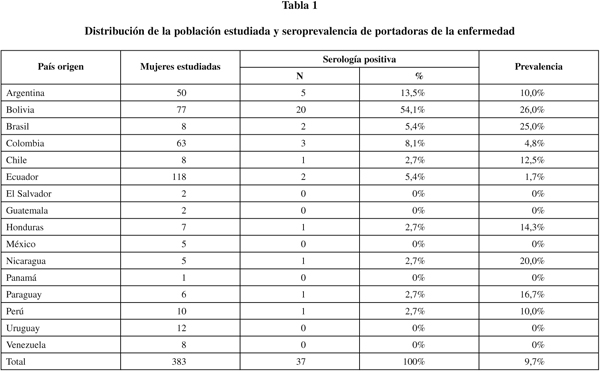
Seroprevalencia de portadoras de la enfermedad: En 40 mujeres (10% de las estudiadas) se obtuvo un resultado positivo en la serología de cribado con prueba de IP. De ellas se confirmaron 37 casos positivos con las pruebas de IFI, lo que significaba un 7,5% de falsos positivos; cabe destacar que aunque esta técnica nos ha dado falsos positivos, no hemos encontrado ningún falso negativo. Además, al comparar la prueba IP con el patrón de referencia de IFI, hallamos una sensibilidad del 100% y una especificidad del 99,2%, con un valor predictivo positivo del 92,5%. Con la aplicación de las citadas pruebas diagnósticas, la prevalencia de la infección por T. cruzi en inmigrantes latinoamericanas mujeres gestantes fue del 9,7%.
La edad media de las mujeres gestantes seropositivas (24,3 años) era ligeramente inferior a la edad de las mujeres seronegativas (26,0 años) aunque las diferencias no resultaron estadísticamente significativas (p=0,051). El 89,2% de los casos positivos tenían familiares que padecían o habían padecido la enfermedad. La prevalencia en mujeres con antecedentes familiares fue del 44%, superior al 1,2% observado en mujeres sin antecedentes familiares (p=0,000).
La seroprevalencia de portadoras de la enfermedad según el país de origen se muestra en la tabla 1. Como se observa, entre los países con más de 10 mujeres revisadas, destacan por orden de frecuencia Bolivia, Argentina y Colombia. La prevalencia de Brasil, Honduras, Nicaragua, Paraguay, Chile y Perú son elevadas pero se corresponden con un bajo número de mujeres estudiadas. La prevalencia era mayor en las mujeres procedentes de zonas rurales (15,7%) que en las de zonas urbanas (3,3%) (p=0,000). El tipo de vivienda donde residieron, también resultó una variable explicativa de gran interés ya que la mayor seroprevalencia (16,0%) se presentó en las casas de adobe y techo de paja, que es el lugar donde vive el vector, llamados también "ranchos chagásicos", mientras que en las mujeres que residían en casas de ladrillo la prevalencia fue sólo del 3,6% (p=0,002). De hecho, sólo el 19,9% de los casos positivos residieron en viviendas de este tipo. Por otra parte el 64,9% de las mujeres positivas habían sido transfundidas. De las mujeres gestantes que recibieron transfusión sanguínea en su país de origen fueron positivas el 23,8% mientras que la prevalencia de las no transfundidas fue del 4,6% (p=0,000). Finalmente, la prevalencia en las 48 mujeres gestantes nulíparas fue del 13,5% frente al 86,5% observado en las 335 mujeres que habían tenido previamente al menos un hijo. Estas diferencias no resultaron estadísticamente significativas.
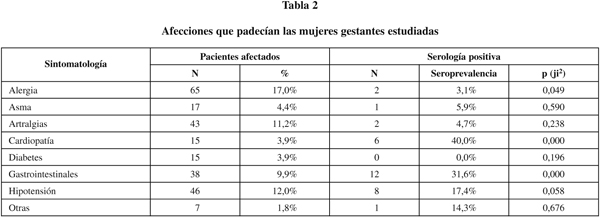
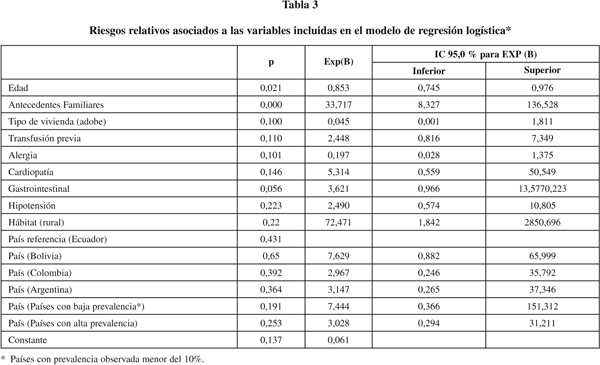
Situación clínica de las mujeres gestantes y datos de interés para la anamnesis: Las mujeres padecían diferentes afecciones reflejadas en la tabla 2. La sintomatología referida más frecuentemente fue la alergia, seguida de la hipotensión, artralgias y problemas gastrointestinales. Según el análisis simple, la clínica asociada positiva y significativamente a la seropositividad para el Chagas fue la cardiopatía, con un riesgo relativo de 7,25 (IC: 2,42-21.70) y las afecciones gastrointestinales con un riesgo relativo de 5,91 (IC: 2,66-13,09). Sin embargo, en el análisis multivariante, que incluía las variables epidemiológicas, sociodemográficas y clínicas, asociadas significativamente a la serología positiva para el Chagas en el análisis bivariante (también se incluyeron la alergia y la hipotensión que tenían valores de riesgo relativo con p<0,10), se observa que las principales variables a considerar como marcadores de riesgo son, junto a la edad y la presencia de antecedentes familiares, el haber vivido en un hábitat rural. Como se observa en la tabla 3 los antecedentes de transfusión y la residencia previa en casas de adobe, perdieron su significación estadística, sugiriendo su comportamiento como factores de confusión. Igualmente ocurrió con la presencia de sintomatología cardiaca y gastrointestinal, aunque en este último caso el riesgo relativo resultó próximo a la significación estadística (p=0,056).
Riesgo de transmisión a sus descendientes durante el parto. No se detectó ningún caso positivo en las pruebas de cribaje, tanto parasitológicas como serológicas realizadas al nacer. Sin embargo, en las pruebas de control realizadas a partir de los 6 meses, se detectó la seroconversión en un niño de 8 meses de vida, lo cual supondría una transmisión vertical del 2,7% y una incidencia en mujeres procedentes de zona endémica del 0,3%.
Discusión
Los resultados obtenidos muestran una prevalencia para la enfermedad de Chagas en mujeres gestantes procedentes de zonas endémicas del 9,7%. Las mujeres parasitadas se caracterizan principalmente por ser ligeramente más jóvenes que las que no lo están, haber residido en zonas rurales y tener antecedentes familiares de la enfermedad de Chagas.
La prevalencia observada es superior al 4,7% encontrado por Paricio et al. en un estudio de 3 maternidades de la Comunidad Valenciana33, y al 3,4% de Gascon et al. en dos maternidades de Barcelona34. Por sí mismas estas cifras justificarían la inclusión de la detección de anticuerpos anti T. cruzi como prueba rutinaria en el cribado serológico realizado en el primer trimestre del embarazo a todas las mujeres gestantes procedentes de zonas endémicas para la enfermedad, de modo que, en caso de resultar seropositivas, permitirían realizar los análisis correspondientes a sus recién nacidos. Así pues, la detección temprana de la infección, como es el caso de los neonatos, es de suma importancia, ya que con el tratamiento precoz se consigue una curación en casi el 100% de los casos15. En España ya se han publicado algunos casos de transmisión vertical. Dos niños atendidos en maternidades de Barcelona,35, un caso con desenlace fatal en Málaga36 y un caso diagnosticado a partir de la detección en el Banco de Cordón Umbilical de la Comunidad Valenciana en una donante de cordón37 cuyo hijo resultó infectado. A estos podemos añadir un reciente caso observado en el Hospital General de Valencia (comunicación personal) y el encontrado en nuestro estudio, un niño que positivizó a los ocho meses, hijo de mujer boliviana de 25 años que presentaba antecedentes familiares de Chagas (abuela materna), conocía el vector y la enfermedad y había vivido en un área rural.
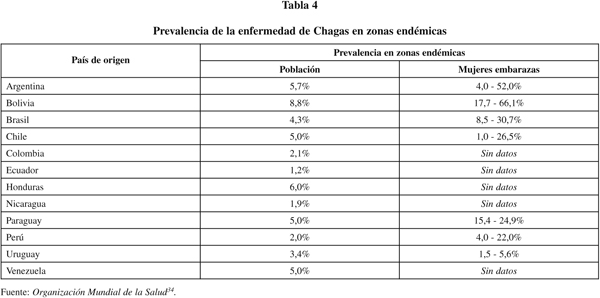
Aunque la mayoría de las mujeres conoce la enfermedad de Chagas y el vector que la transmite, el 24% desconoce la enfermedad y el 25,1% desconoce el vector, por lo que pueden ignorar su padecimiento y las medidas preventivas que deben tener en cuenta para evitar su transmisión. Por todo ello, la incorporación de los antecedentes epidemiológicos y sociodemográficos a la anamnesis podría facilitar el diagnóstico clínico, de por sí difícil por la inespecifidad de los síntomas. Entre los factores de riesgo a tener en cuenta cabe destacar el país de origen, con datos (54,1% de Bolivia, 13,5% de Argentina, 8,1% de Colombia, 5,4% de Brasil y Ecuador) comparables con la prevalencia encontrada en algunos países endémicos38. De hecho, en las mujeres embarazadas del Cono Sur Americano (INCOSUR)7 (tabla 4) la mayor seroprevalencia se encuentra en mujeres gestantes de Bolivia y Argentina, seguidos de Brasil.
Aunque no encontramos diferencias estadísticamente significativas, entre las mujeres seropositivas 32 tenían hijos (86,5%) y 5 eran nulíparas (13,5%). Se ha descrito que la infección congénita es más frecuente en recién nacidos de gestaciones múltiples. Sin embargo, aunque según Torrico F et al39 la paridad se asocia a la infección con mayor probabilidad que la nuliparidad, ello no implica un mayor riesgo de transmisión.
Lógicamente es fundamental tener en cuenta la sintomatología. Entre la patología padecida previa a la determinación serológica que resultó asociada significativamente con la enfermedad, en el análisis simple destacaban los síntomas cardiacos y gastrointestinales y en menor medida la alergia y la hipotensión, en sintonía con lo observado por Bar ME et al, que describen en Argentina40 los síntomas gastrointestinales y cardiacos asociados, y Parada H et al. que observó lo mismo en Venezuela41. En el análisis multivariante los síntomas gastrointestinales presentaban una asociación próxima a la significación estadística para un nivel de confianza del 95%, lo cual podría deberse a la disponibilidad de una muestra pequeña para el efecto analizado o a otros factores como la presencia de otras afecciones intestinales concomitantes.
En consonancia con los datos de Pinto Díaz JC42, que describe el área rural y el tipo de vivienda como factores de riesgo importantes en zonas endémicas, el riesgo de las mujeres gestantes que habían vivido en zonas rurales se multiplicaba por 7,4 (2,3-12,6) y si habían vivido en casas de adobe y techos de paja por 4 (1,72-9,42). Sin embargo, aunque en el análisis simple hemos encontrado asociación de diversas variables con la presencia de una serología positiva para la enfermedad de Chagas en las mujeres gestantes, al realizar el ajuste de riesgos mediante análisis multivariante sólo aparecen como factores estadísticamente significativos la edad, la existencia de antecedentes familiares de tripanosomiasis y la procedencia rural. Así pues, estos aspectos deberían tenerse especialmente en cuenta a la hora de establecer una sospecha de enfermedad de Chagas crónica.
Nuestro estudio, junto con el realizado en los hospitales comarcales de Denia, Gandia y Alcoi33, es pionero en España y Europa en cuanto a la determinación de la seroprevalencia de Chagas en mujeres gestantes inmigrantes de Latinoamérica y, además, aporta información que añadida a la de otros centros valencianos (Hospital General, La Fe y Alzira) ha servido de base a la circular de la Dirección General de Salud Pública de la Comunidad Valenciana de octubre de 2007 por la cual se introduce el cribado sistemático de Chagas en mujeres gestantes de origen latinoamericano43.
Dada la escasez de técnicas sencillas comercializadas disponibles al inicio de nuestro estudio, la elección de la técnica de cribado resultó difícil, por lo que se realizaron ensayos previos para seleccionar las técnicas adecuadas28,29. En la actualidad existe una mayor variedad de métodos diagnósticos altamente fiables que no dan tan elevado número de falsos positivos. Otras limitaciones se relacionan con el reducido tamaño de la muestra, la amplia variabilidad del riesgo de transmisión vertical publicado (0,7-12%)7,16 y con el hecho de que la transmisión congénita del parásito depende de la presencia de elevadas cargas parasitarias en la madre39,44. Por otra parte el alto porcentaje de mujeres que proceden de zonas donde la enfermedad no es tan prevalente, explicaría la incidencia de transmisión vertical del 2,7%, inferior al 7,3% encontrada por Gascón et al en Barcelona34.
En definitiva, el creciente número de inmigrantes procedentes de zonas endémicas para la enfermedad que residen en nuestro medio y la elevada seroprevalencia existente en dicha población plantea un reto importante para nuestra sanidad. Junto a ello, la existencia de una presentación de síntomas y antecedentes epidemiológicos de esta patología muy sugerentes, así como de medios diagnósticos y terapéuticos adecuados para evitar la transmisión vertical, nos empujan a adaptar nuestro sistema de salud en el sentido de mejorar la atención de esta enfermedad, incluyendo la formación para un manejo más adecuado de estos pacientes, la mejora del control epidemiológico y el desarrollo de tareas de vigilancia y medidas de detección y control de la enfermedad de Chagas.
Agradecimientos
Los autores desean agradecer a los servicios de Microbiología, Ginecología y Pediatría del Hospital Clínico Universitario de Valencia, así como a los Ginecólogos y Matronas del departamento de salud nº 5 de la Comunidad Valenciana, por su valiosa colaboración para realizar éste trabajo.
Bibliografía
1. Alfred. Cassab JR, Noireau F & Guillén G. Chagas, la Enfermedad en Bolivia. Conocimientos científicos al inicio del Programa de control (1998-2002). 1ª ed. La Paz: Ediciones Graficas " EEG"; 1999. [ Links ]
2. Ministerio de Salud y Acción Social, Secretaría de Programación de Salud, Instituto Dr. Carlos Malvarán, Instituto Nacional de Patología Dr. Mario Atala Caben. Manual para la atención del paciente infectado chagas hico. Buenos Aires: Ministerio de Salud y Acción Social- Argentina; 1998. [ Links ]
3. Higuchi ML. Chronic Chagasic cardiopathy: the product of a turbulent host-parasite relationship. Rev Inst Med Trop (Sao Paulo). 1997; 39: 53-60. [ Links ]
4. Rezende JM & Moreira H. Forma digestiva da doença de Chagas. In. Brener Z, Andrade ZA & Barral-Netto M (organ.) Trypanosoma cruzi e doença de Chagas, 2ª ed. Rio de Janeiro: Guanabara Koogan Ed; 2000.p. 297-343. [ Links ]
5. Pereyra Käfer J, Poch G, Monteverde D, Blanco E, Tarsia R. Las manifestaciones neurológicas en la forma crónica de la enfermedad de Chagas. Rev Neurol Arg (Buenos Aires). 1992; 17: 37. [ Links ]
6. Schmuñis GA, Riesgo de la enfermedad de Chagas a través de las transfusiones en las Américas. Medicina (Buenos Aires) 1999; 9: 125-134. En: Medicina 2003; 63: 125-129. [ Links ]
7. Freilij H, Altcheh J. Chagas congénito. En: Storino R, Milei J En: Enfermedad de Chagas.. Buenos Aires: Mosby Doyma; 1994.p. 267-78. [ Links ]
8. OPS-Organización Panamericana de la Salud ed 1998. La Salud en las Américas. Washington DC. Pub. Científica num 569. [ Links ]
9. WHO. Reporte sobre la enfermedad de Chagas. Grupo de trabajo científico 17-20 de abril de 2005, actualizado en julio de 2007. Buenos Aires, Argentina. Disponible en: http://www.who.int/tdr/publications/publications/pdf/swg_chagas.pdf. [ Links ]
10. Di Pentima MC, Hwang LY, Skeeter CM, Edwards MS. Prevalence of antibody to Trypanosoma cruzi in pregnant Hispanic women in Houston. Clin Infect Dis. 1999; 28:1281-5. [ Links ]
11. Navin TR, Roberto RR, Juranek DD, et al. Human and sylvatic Trypanosoma cruzi infection in California. Am J Public Health. 1985; 75:366-9. [ Links ]
12. Frank M, Hegenscheid B, Janitschke K, Weinke T. Prevalence and epidemiological significance of Trypanosoma cruzi infection among Latin American immigrants in Berlin, Germany. Infection. 1998; 25:355-8. [ Links ]
13. Muñoz J, Gascon J. Enfermedad de Chagas importada. Enf Emerg. 2005; 7(3)134 -138. [ Links ]
14. Parada MC, Larrea J. La Enfermedad de Chagas y embarazo ¡Ojo que viene! (Valencia) Rev Esp Obstet Ginecol. 2006; 1: 309-12. [ Links ]
15. Sosa S, Segura E. Tratamiento de la infección por Tripanosoma cruzi. Experiencia y normatización actual en la Argentina. Medicina. 1999; 59(2) 166-170. [ Links ]
16. Torrico F, Alonso-Vega C, Suárez E, et al. Endemic level of congenital Trypanosoma cruzi infection in the areas of maternal residence and the development of congenital Chagas disease in Bolivia. Rev Soc Bras Med Trop. 2005; 38 Supl. 2:17-20. [ Links ]
17. Biancardi MA, Conca Moreno M, Torres N, Pepe C, Altcheh J, Freilij H. Seroprevalence of Chagas disease in 17 rural communities of «Monte Impenetrable», Chaco Province. Medicina (B Aires). 2003; 63(2):125-9. [ Links ]
18. Leiby DA. Threats to blood safety posed by emerging protozoan pathogens. Vox Sanguinis. 2004; 87: 120-122. [ Links ]
19. Castro E. Transfusión sanguínea y enfermedad de Chagas: iniciativas en Centros de Transfusión de España. Enf Emerg. 2006; 8 (supl 1): 48-50. [ Links ]
20. Parada C. Villalba V, Puig N, Montoro J, Roig R. Enfermedad de Chagas en donantes de sangre procedentes de zonas endémicas. Resultados tras dos años de realización de las pruebas de cribado. Valencia: Sociedad Española de Transfusión Sanguínea (SETS); 2007; 19 (1): 17-19. [ Links ]
21. Piron M, Maymó RM, Hernández JM, Vergés M, Portús M, Casamitjana N, et al. Bancos de Sangre y enfermedad de Chagas: estado actual de la legislación española. Resultados preliminares del estudio de la infección por Trypanosoma cruzi en donantes del Banc de Sang i Teixits. Enf Emerg. 2006; 8 (supl 1):45-7. [ Links ]
22. Boletín Oficial del Estado. Real Decreto 1088/2005 por el que se establecen los requisitos técnicos y condiciones mínimas de la hemodonación y de centros y servicios de transfusión. BOE num 225 de 20/09/2005. [ Links ]
23. Instituto Nacional de Estadística. Datos del Padrón Municipal al 1 de Enero de 2008. Fuente página web del INE (www.ine.es). [ Links ]
24. Camargo ME, Takeda G. Diagnóstico de laboratorio. En: Brener Z, Andrade Z. Trypanosoma cruzi e doença de Chagas, Rio de Janeiro, Guanabara Koogan. 1979; 195-198. [ Links ]
25. Rabello A, Luquetti AO, Moreira E, Gadelha Md, Dos Santos JA, De Melo L, et al Serodiagnosis of Trypanosoma cruzi Infection Using the New Particle Gel Inmunoass-ID-PaGIA Chagas. Men Inst. Oswaldo Cruz. 1999; 94 (1):77-82. [ Links ]
26. Alvarez M, Cerisola JA, Rohwedder RW. Test de inmunofluorescencia para el diagnóstico de la enfermedad de Chagas. Bol Chilen Parasitol. 1968; 23: 4-9. [ Links ]
27. Kahn, T.; Corral, R.; Freilij, H.; Grinstein, S.: Detection o circulating immune complexes antigens and antibodies by enzime linked immunosorbent assay in human T. cruzi infection. IRCS Med. Sci. 1983; 11:670-674. [ Links ]
28. Parada MC, Alvarez M, Vila E, Ramada C, Calabuig M, Villalba J, Montoro J,. Roig R. Comparison study of two screening techniques for Chagas disease in Blood donors from the Valencia Regional Community. XVIIth Regional Congress of the ISBT. Europe. IBTS Science Series (Madrid). 2007; 2: 248. [ Links ]
29. Parada MC, Vaca VM, Fraile MT, E. Aznar E. Estudio comparativo de técnicas para detección de la enfermedad de chagas. Consorcio Hospital General Universitario de Valencia. Congreso SEMTSI 2008. Enferm Emerg. 2008; 10: 43. [ Links ]
30. Freilij H, Muller L, González Cappa SM. Direct micromethod for diagnosis of acute and congenital Chagas disease. J Clin Microbiol. 1983; 18: 327-30. [ Links ]
31. Lorca M, Veloso C, Munoz P, Bahamonde MI, Garcia A. Diagnostic value of detecting specific IgA and IgM with recombinant Trypanosoma cruzi antigens in congenital Chagas disease. Am J Trop Med Hyg. 1995; 52: 512-5. [ Links ]
32. Russomando G, de Tomassone MM, de Guillen I, et al. Treatment of congenital Chagas' disease diagnosed and followed up by the polymerase chain reaction. Am J Trop Med Hyg. 1998; 59: 487-91. [ Links ]
33. Paricio Talayero JM, Benlloch Muscharaz MJ, Collar del Castillo JI, Rubio Soriano A, Serrat Pérez C, Magraner Egea J et al. Vigilancia epidemiológica de la transmisión vertical de la enfermedad de Chagas en tres maternidades de la comunidad valenciana. Enferm Infecc Microbiol Clin. 2008; 26 (10): 609-13. [ Links ]
34. Gascon J, Pinazo MJ, Control de la transmisión vertical de Trypanosoma cruzi en España: principal reto de la patología importada. Enferm Infecc Microbiol Clin. 2008; 26(10): 607-8. [ Links ]
35. Riera C, Guarro A, Kassab HE, Jorba JM, Castro M, Angrill R, et al. Congenital transmission of Trypanosoma cruzi in Europe (Spain): a case report. Am J Trop Med Hyg. 2006; 75:1078-81. [ Links ]
36. Flores-Chávez M, Faez Y, Olalla M, Cruz I, Gárate T, Rodríguez M, Blanc P, Cañavate C. Fatal congenital Chagas disease in a non-endemic area: case report. Cases J. 2008; 1:302. [ Links ]
37. Parada MC, Torres A, Guillén M, Aznar I, Andrés A, León C et al. Enfermedad de Chagas, transmisión vertical, diagnosticada a través de sangre de cordón umbilical. Libro de ponencias del Congreso nacional de Bancos y tejidos Valencia; 2008. p.1:116-7. [ Links ]
38. Organización Mundial de la Salud. Control de la Enfermedad de Chagas. Segundo informe del Comité de Expertos de la OMS, Ginebra: 2002 Serie de Informes Técnicos 905. [ Links ]
39. Torrico F, Alonso-Vega C, Suarez E, Rodriguez P, Torrico MC, Le Dramaix M, et al. Maternal trypanosoma cruzi infection, pregnancy outcome, morbidity, and mortality of congenitally infected and non-infected newborns in Bolivia Am. J Trop Med Hyg. 2004; 70: 201-209. [ Links ]
40. Bar ME, Pozzer DL, Alvarez BM, Vallejos JA, Storino RA. Estudio transversal clínico y epidemiológico de la Enfermedad de Chagas en un área rural del Nordeste Argentino. Rev Soc Bras Med Trop. 1998; 31(2): 199-206. [ Links ]
41. Parada H, Carrasco H A, Añez N , Fuenmayor C, Arriaga, AD, Palacios E, Aguilera M. Enfermedad de Chagas Aguda. Características clínicas, parasitológicas e histopatológicas. Venezuela. Avances Cardiológicos. 1996; 16 (1): 10-17. [ Links ]
42. Pinto Dias JC, Borges Dias R. Las viviendas y la lucha contra los vectores de la enfermedad de Chagas en el hombre, en el Estado de Minas Gerais, Brasil. Bol Oficina Sanit Panam. 1982; 93:453-467. [ Links ]
43. Conselleria de Sanitat de la Comunidad valenciana. Circular 3/2007/8/1 de la Direcció General de Salut Pública sobre Regulación del control de las infecciones congénitas y perinatales en la Comunitat Valenciana. Valencia: Conselleria de Sanitat de la Comunidad valenciana; 2007. [ Links ]
44. Hermann E, Truyens C, Alonso-Vega C, Rodríguez P, Berthe A, Torrico F, Carlier Y. Congenital transmission of Trypanosoma cruzi is associated with maternal enhanced parasitemia and decreased production of interferon-gamma in response to parasite antigens. J Infect Dis. 2004; 189:1274-81. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rafael Manuel Ortí Lucas.
Servicio de Medicina Preventiva
Hospital Clínico Universitario de Valencia.
Avda. Blasco Ibáñez, 17.
46010 Valencia.
orti_raf@gva.es