Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.86 no.6 Madrid nov./dic. 2012
Situación epidemiológica y de los factores de riesgo de transmisión de Leishmania infantum en España
Review of the Current Situation and the Risk Factors of Leishmania Infantum in Spain
Berta Suárez Rodríguez (1), Beatriz Isidoro Fernández (1), Sara Santos Sanz (1), María José Sierra Moros (1), Ricardo Molina Moreno (2), Jenaro Astray Mochales (3) y Carmen Amela Heras (1)
(1) Centro de Coordinación de Alertas y Emergencias Sanitarias (CCAES). Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad, Servicios Sociales e Igualdad.
(2) Unidad de Entomología Médica. Servicio de Parasitología. Centro Nacional de Microbiología. Instituto de Salud Carlos III. Ministerio de Economía y Competitividad.
(3) Subdirección de Promoción de la Salud y Prevención. Dirección General de Atención Primaria. Consejería de Sanidad. Comunidad de Madrid.
Dirección para correspondencia
RESUMEN
En España la leishmaniasis es una zoonosis endémica presente en la mayor parte del territorio peninsular e Islas Baleares. El parásito que se detecta es la Leishmania infantum y el principal reservorio es el perro. Los vectores competentes para transmitir el parásito son los flebotomos, de los que existen dos especies distribuidas por todo el territorio peninsular e Islas Baleares.
En este artículo se revisa la situación actual y el comportamiento de la leishmaniasis en España. Se analiza y compara la información sobre la enfermedad procedente de las altas hospitalarias y de la Red Nacional de Vigilancia Epidemiológica así como los factores de riesgo identificados en estudios anteriores que facilitan la transmisión.
Desde 2009 está teniendo lugar un brote en el suroeste de la Comunidad de Madrid, destacando el elevado número de casos, cerca de 400 y la detección de un nuevo reservorio, la liebre. Las condiciones que pueden incrementar la incidencia de la leishmaniasis están asociadas al aumento del número de vectores infectados, al de la densidad del flebotomo, al de hospedadores o la aparición de nuevos reservorios en un área geográfica. Esta infección tiene una dinámica de transmisión compleja y para responder oportunamente a los brotes debe estar previamente desarrollado un plan de acción integral y multisectorial en el que participen todas las instituciones involucradas. Ante un brote, es importante estudiar los factores que condicionan la transmisión del lugar y adaptar el plan de acción a sus características específicas.
Palabras clave: Leishmania infantum. Enfermedades infecciosas emergentes. Ecosistemas. Cambio climático. Sistemas de información. Enfermedades transmitidas por vectores.
ABSTRACT
In Spain, leishmaniasis is an endemic zoonosis present in most of the Iberian Peninsula and the Balearic Islands. The parasite detected is Leishmania infantum and the main reservoir is the dog. Competent vectors to transmit the parasite are sandflies, of which there are two species distributed throughout the Iberian Peninsula and the Balearic Islands.
This article reviews the current situation and the behaviour of leishmaniasis in Spain. It analyzes and compares information about the disease from hospital discharges and from the National Epidemiological Surveillance Network. It also analyses the risk factors that facilitate transmission identified in previous studies.
Since 2009 an outbreak is occurring in the southwest part of the Community of Madrid, with a significant number of cases, about 400 and the detection of a new reservoir, the hare. The conditions that can increase the incidence of leishmaniasis are linked to the increase number of infected vectors, increase sandfly density, increase hosts or the appearance of new reservoirs in a geographic area. This infection has got a complex transmission dynamic. To timely respond to outbreaks a comprehensive and multisectoral action plan should be developed joined by all the institutions involved in the preparation and response. Before an outbreak occurs, it is important to study all the factors affecting the transmission in that place and to adapt the action plan to the specific characteristics.
Key words: Leishmania infantum. Communicable Diseases. Emerging. Ecosystems. Climate change. Information systems. Vector-borne disease.
Introducción
En España, la leishmaniasis es una zoonosis endémica presente en la mayor parte del territorio peninsular y en las Islas Baleares. El parásito que se detecta, tanto en las formas viscerales como cutáneas, es la Leishmania infantum y el principal reservorio encontrado hasta el momento es el perro.
La transmisión del parásito al ser humano se realiza mediante vectores y en España hay dos especies de flebotomos que han demostrado ser competentes: Phlebotomus perniciosus y Phlebotomus ariasi. Estos se encuentran distribuidos por todo el territorio peninsular, por lo que el riesgo de transmisión de L. infantum puede presentarse en cualquier área geográfica en la que se den las condiciones apropiadas para que circule el parásito.
Según la Organización Mundial de la Salud1 la enfermedad es endémica en 98 países, estimándose una incidencia mundial anual de 2 millones de casos (0,5 millones de leishmaniasis visceral y 1,5 millones de cutánea). La mayor carga de enfermedad se concentra en algunos grandes focos y España forma parte del localizado en la Cuenca Mediterránea, donde circula L. infantum. En estos focos se han observado grandes fluctuaciones en la incidencia de la enfermedad atribuibles a cambios medioambientales, desplazamientos de población o aspectos climáticos. Factores como la malnutrición, el estado de inmunodepresión o la coinfección con VIH predisponen a la enfermedad clínica.
La coinfección de L. infantum con el VIH se observó en España por primera vez en los años 80, en pacientes que desarrollaban leishmaniasis visceral. Esta forma en pacientes coinfectados tiende a la cronificación, manteniendo al sujeto en el estado de portador2.
En nuestro país la enfermedad sigue tres patrones de presentación: endémico, en el que los casos de enfermedad se presentan de forma esporádica y el perro actúa como principal reservorio; los casos asociados a la coinfección con el VIH o a situaciones de inmunodepresión y los brotes epidémicos.
Recientemente se ha detectado un brote de leishmaniasis humana que todavía permanece activo, con formas viscerales y cutáneas y que afecta a todos los grupos de edad en municipios del suroeste de la Comunidad de Madrid. En este brote se ha encontrado un nuevo reservorio del parásito, la liebre.
El primer objetivo de esta colaboración especial es revisar la situación actual y el comportamiento de la leishmaniasis en nuestro país a través de la información recogida en la Red Nacional de Vigilancia Epidemiológica (RENAVE) para el período 1996-2011 y el Registro de Altas Hospitalarias denominado Conjunto Mínimo Básico de Datos (CMBD) para el período disponible 2000-2010. El segundo objetivo del trabajo es describir y analizar los factores de riesgo identificados en estudios anteriores que podrían estar implicados en el aumento de la incidencia de esta enfermedad en una localización de nuestro territorio.
Situación de la enfermedad en España. Comparación de los datos de la Red Nacional de Vigilancia Epidemiológica (RENAVE) y del Conjunto Mínimo Básico de Datos (CMBD)
En España, el RD 2210/1995 por el que se crea la Red Nacional de Vigilancia Epidemiologica (RENAVE) describe el modo de vigilancia de las Enfermedades de Declaración Obligatoria (EDO). En él se considera la leishmaniasis como una EDO y respecto a la notificación se clasifica como enfermedad endémica de ámbito regional. Por ello, desde su entrada en vigor, la leishmaniasis dejó de ser de notificación obligatoria en aquellas Comunidades Autónomas (CCAA) en las que la enfermedad no se considera endémica. Desde 1996 a 2011 la RENAVE detectó 1.755 casos, con una incidencia media anual de 0,45 casos/100.000 hab. En este período las CCAA que notificaron casos fueron: Andalucía, Aragón, Baleares, Cantabria, Castilla-León, Cataluña, Comunidad Valenciana, Extremadura, Madrid, Murcia, Navarra y La Rioja. Las mayores cifras de incidencia se registraron en Baleares, Valencia, Madrid, Andalucía y Cataluña.
Los datos disponibles en el CMBD corresponden al período 2000-2010. Durante el mismo, este registro, que incluye hasta 14 posibles diagnósticos de ingreso hospitalario (uno principal y trece secundarios), recogió 2.739 hospitalizaciones en las que la leishmaniasis estaba codificada en el diagnóstico principal. Esto se traduce en una tasa media anual de hospitalización de 2,8/100.000 hab. 2.273 (83,6%) de ellos eran leishmaniasis viscerales, 98 (3,6%) cutáneas y en 368 (13,4%) no estaba especificadoel tipo de leishmaniasis. La mayor frecuencia de leishmaniasis viscerales encontradas en el CMBD se explica por el hecho de que esta forma de presentación de la enfermedad es la que requiere ingreso hospitalario, ya que las formas cutáneas se atienden y tratan, mayoritariamente, de forma ambulatoria. En este mismo período se notificaron 1.201 casos de leishmaniasis a la RENAVE.
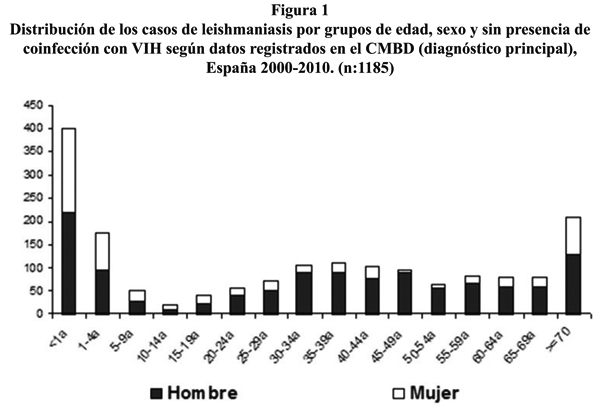
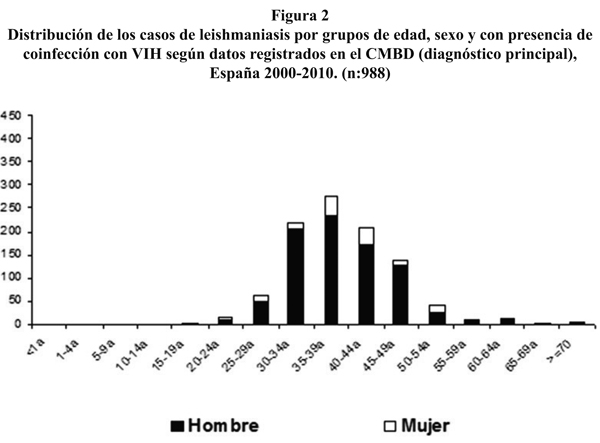
En las siguientes figuras se muestra la distribución de la enfermedad por grupos de edad. En la figura 1 se presentan los casos en los que no consta coinfección con VIH y se observa que el grupo de edad de menores de 5 años tiene la mayor incidencia. Esta distribución de la enfermedad representa el patrón endémico de la enfermedad. En la figura 2 se presentan los casos con coinfección con VIH y se observa que el grupo de edad más afectado es el de adultos de 30 a 49 años, que se relaciona con la mayor frecuencia de la infección con VIH. También se puede observar cómo varía la razón por sexo en función del patrón de presentación de la enfermedad. La razón hombre/mujer en menores de 10 años es de 1,2/1, mientras que entre los 30 y los 49 años, en los casos que presentan coinfección con VIH es de 7/1.
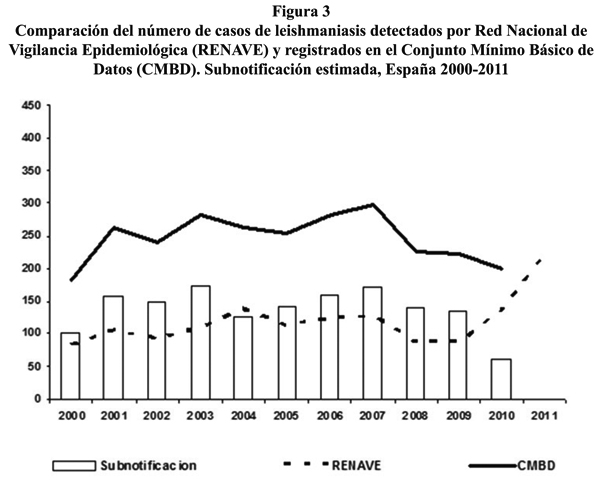
Según los últimos datos de la RENAVE, se ha producido un incremento significativo de la frecuencia de leishmaniasis en los años 2010-2011 a expensas de los casos notificados por la Comunidad de Madrid (figura 3), los cuales corresponden a un brote que comenzó en julio de 2009 en municipios del suroeste de la Comunidad. Hasta el 4 de septiembre de 2012 se han detectado 374 casos, lo que supone una tasa de incidencia del 21,54 por 100.000 habitantes. Las personas afectadas residen en Fuenlabrada (316 ; TI: 52,99), Leganés (36; TI: 6,42), Getafe (17; TI: 3,34) y Humanes de Madrid (5; TI: 7,08), municipios geográficamente cercanos entre sí. El 36,6% de los casos asociados al brote presentaron leishmaniasis visceral y el 63,4% restante cutánea. El 93,9% son casos confirmados, en los que se ha identificado L. infantum. (informe interno Comunidad de Madrid). En la investigación del brote no se ha encontrado un incremento de la prevalencia de leishmaniasis en perros. Según la investigación entomológica del brote llevada a cabo por la Comunidad de Madrid entre abril y octubre de 2011, el vector implicado ha sido Phlebotomus perniciosus, que se ha encontrado en densidad elevada (45,3 flebotomos/m2, frente a la media de la Comunidad de Madrid, en torno a 30 flebotomos/m2)3. Se ha investigado la presencia de otros reservorios y se ha encontrado que las liebres están actuando como reservorios activos. El estudio entomológico realizado en el área geográfica donde está ocurriendo el brote de leishmaniasis humana ha demostrado por primera vez que liebres aparentemente sanas, infectadas naturalmente con L. infantum pueden infectar a un vector competente (P. perniciosus)4.
Al comparar los casos notificados a la RENAVE (1.201) en el período 2000-2010, y los registrados para el mismo período por el CMBD (2.739), se pone de manifiesto la existencia de una importante subnotificación de casos al Sistema Nacional de Vigilancia que podemos estimar en aproximadamente el 50%. Es posible que esta diferencia en parte sea debida a que no es una enfermedad de declaración obligatoria en todas las CCAA, únicamente en aquellas que consideran que la enfermedad es endémica. En este sentido es importante destacar que el CMBD registra casos hospitalizados en todas las CCAA, por lo que el carácter de enfermedad endémica debería ser revisado (o el ámbito de la endemia).
La información recogida por la RENAVE sirve para identificar prioridades y configura la percepción de riesgo que se forman los profesionales y las autoridades sanitarias, que difícilmente van a estar sensibilizados ante un problema que no es detectado por el sistema de vigilancia. Por todo ello, es necesario reforzar la vigilancia epidemiológica de la enfermedad para detectar lo más temprano posible los nuevos casos de leishmaniasis y garantizar que se recoge la información necesaria para realizar una gestión del riesgo adecuada. Una forma de reforzarla debería consistir en complementar el análisis de la información epidemiológica con los datos registrados en el CMBD.
Factores de riesgo para la transmisión de la Leishmaniasis en España
La identificación de los factores de riesgo de la enfermedad en España se basa en la revisión de aquellos que han sido descritos como favorecedores de la transmisión de la enfermedad y de las condiciones que aumentan la vulnerabilidad de la población y que, consecuentemente, pueden generar un aumento de la incidencia de la enfermedad. Aumentan la vulnerabilidad el conjunto de condiciones y procesos físicos, sociales, económicos y ambientales que incrementan el porcentaje de población susceptible y la probabilidad de exposición al parásito.
Definición de los factores condicionantes de la transmisión
El principal factor de riesgo que causa el aumento de la incidencia de la leishmaniasis lo constituye la presencia de flebotomos infectados con L. infantum en nuestro entorno. La triada epidemiológica se completa cuando en un mismo espacio se encuentran estos flebotomos y un animal que actúe como reservorio del parásito. Cuando este ciclo de transmisión tiene lugar en las proximidades de un núcleo de población susceptible se pueden crear las condiciones para que tenga lugar la transmisión de la infección al hombre.
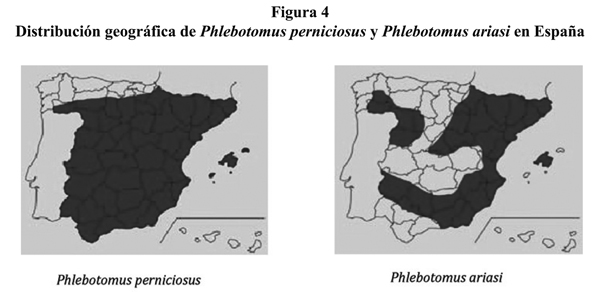
Respecto al vector, en España hay dos especies de flebotomos, Phlebotomus perniciosus y Phlebotomus ariasi, que han demostrado ser vectores competentes para transmitir L. infantum. El más abundante, P. perniciosus, se encuentra ampliamente distribuido por la mayoría de las zonas áridas de la península y archipiélago Balear, mientras que P. ariasi está ligado a ambientes más frescos y húmedos de la península, como algunas zonas de Cataluña, territorios limítrofes con el norte de Portugal o con el sur de Francia (figura 4)5.
Los factores meteorológicos, como la temperatura ambiente y la humedad, juegan un papel importante en la dinámica de transmisión de la enfermedad, ya que afectan a los parámetros que aumentan la probabilidad de transmisión de la infección actuando sobre la supervivencia del flebotomo, la duración del ciclo biológico del parásito en el flebotomo y los hábitos de alimentación de los flebotomos6. El P. perniciosus es una especie zooantropófila cuyo período de actividad varía con la latitud y la altitud. En el sur de España, este flebotomo entra en actividad a finales de febrero y termina a principios de diciembre, mientras que en el norte comienza en mayo y acaba a principios de noviembre. Las épocas de máximo riesgo de transmisión del parásito son finales de junio y principios de julio y sobre todo finales de septiembre y principios de octubre5.
El riesgo de transmisión también varía a lo largo del día, desarrollando su actividad fundamentalmente al anochecer y durante la noche, cuando la temperatura disminuye y la humedad ambiental aumenta.
En España, las tasas de infección de los flebotomos obtenidas a partir de la disección del insecto y aislamiento del parásito oscilan entre un 0,4 y un 4,6 %7-12. Sin embargo, en estudios más recientes, en los que se utilizan herramientas moleculares, se encuentran porcentajes más elevados, que en promedio se sitúan en torno al 39% en investigaciones realizadas en áreas con alta prevalencia de leishmaniasis canina13.
Otro de los factores que afecta a la transmisión es la probabilidad de exposición del vector a un reservorio infectado. En España, el principal reservorio de L. infantum es el perro doméstico14, que actúa como amplificador del ciclo de transmisión, ya que más de un 50% de todos los perros infectados son portadores asintomáticos con una capacidad similar a los sintomáticos de transmitir el parásito a los flebotomos15.
Los perros con serología positiva a L. infantum se encuentran distribuidos por toda la geografía española. Los estudios de seroprevalencia realizados en perros indican que en áreas en donde se ha demostrado que el parásito está circulando, la seroprevalencia está aumentando en los últimos años13,16-19 y, por lo tanto, también es previsible que tenga un ritmo creciente la probabilidad de exposición del vector a un reservorio infectado.
La transmisión es generalmente periurbana y rural, las condiciones son más favorables en zonas residenciales de viviendas unifamiliares, con jardín, en cuyos alrededores abundan perros y que reúnen las condiciones propicias para que el flebotomo cierre su ciclo biológico (material orgánico en descomposición o escombros)20.
Está descrito que uno de los factores responsables de la reemergencia de una enfermedad infecciosa es la introducción del agente infeccioso en un nuevo reservorio y, posteriormente, su establecimiento y diseminación21. Este proceso ha ocurrido en la Comunidad de Madrid, ya que por primera vez se ha demostrado que un nuevo reservorio de L. infantum, la liebre, está implicado en el ciclo de transmisión de este parásito, lo que junto a las condiciones ambientales ha facilitado la magnitud del brote. Estudios de xenodiagnóstico han demostrado que estas liebres pueden transmitir el parásito a los flebotomos4. Además, en la misma zona se han encontrado liebres y flebotomos infectados por L. infantum.
La aparición de este nuevo reservorio en un entorno libre de depredadores, junto con unas condiciones climatológicas y ecológicas idóneas para el crecimiento del vector en un espacio próximo y muy accesible a zonas residenciales habitadas por personas susceptibles, ha creado las condiciones idóneas para la aparición del brote.
La susceptibilidad de la población española es alta, aunque en los lugares con circulación del parásito puede ser menor, ya que un porcentaje de la población puede tener inmunidad por haber padecido infecciones asintomáticas22.
Análisis de la vulnerabilidad
La vulnerabilidad viene dada por las condiciones o procesos físicos, sociales, económicos y ambientales que aumentan el porcentaje de población susceptible y la probabilidad de exposición al parásito.
Los factores meteorológicos como la temperatura y la humedad van a condicionar el período de actividad del flebotomo, su abundancia y la duración del ciclo biológico de la L. infantum en el flebotomo. Este encuentra las condiciones ideales para sobrevivir en la isoterma de 20oC, aunque puede mantenerse activo hasta los 16oC23. La península ibérica se encuentra entre las isotermas 10oC y la 20oC, quedando el norte y las regiones centrales entre la 10oC y la 15oC. Las regiones del sur se encontrarían por encima de la isoterma 15oC. El cambio climático, en la medida en que predice un aumento en la temperatura global, puede favorecer la presencia de vectores en todo el territorio peninsular24.
La vulnerabilidad de la población se ha visto afectada por cambios demográficos, como son el nuevo modelo de desarrollo urbanístico que ha tenido lugar en España con la construcción de un gran número de viviendas unifamiliares en los alrededores de las grandes ciudades, la mayoría de ellas con un pequeño jardín, lo que ha permitido que se den las condiciones propicias para que el flebotomo se desarrolle y contacte con el reservorio principal, el perro infectado, cerrando así el ciclo de transmisión. La rápida transformación de zonas rurales y agrícolas en urbanas, donde las practicas agrícolas y el consiguiente cuidado de la tierra ha dado paso a terrenos ecológicamente degradados y la conversión de espacios naturales en espacios urbanos o artificialmente modificados han contribuido a la reducción en la diversidad de las especies existentes pudiendo provocar la proliferación de vectores y/o reservorios zoonóticos13,18,25-27.
Los cambios en el sistema ecológico pueden modificar la dinámica entre el hospedador y el patógeno. Cuando aumenta la densidad de vectores y de reservorios simultáneamente en un mismo espacio es muy probable que aumente la circulación del parásito entre ellos y, por tanto, el riesgo de que tenga lugar la transmisión al hombre. Además, cuando se intensifica la transmisión del parásito se facilita el intercambio de material genético entre patógenos, pudiendo ocurrir que el parásito se adapte y aparezcan nuevas variantes. Algunas pueden ser más virulentas e infectivas y capaces de reforzar la transmisión contribuyendo a la reemergencia de la enfermedad27.
Otros factores con repercusión en la vulnerabilidad de las poblaciones son los programas de control vectorial que se desarrollan dentro de las estrategias de prevención de las administraciones, tanto locales como nacional. En general, estos programas constituyen una estrategia muy eficaz para reducir la vulnerabilidad, al reducir o interrumpir la transmisión de la infección. Sin embargo, en el caso concreto de los flebotomos se muestran poco eficaces. En cualquier caso, en España, tras el éxito logrado en el control de enfermedades con una incidencia importante en algunas zonas del país, como el paludismo, no se han implementado estas estrategias en el marco de un programa de control integrado dirigido a otras enfermedades vectoriales como la leishmaniasis.
Conclusiones y recomendaciones
La transmisión de L. infantum constituye un sistema biológico complejo en el que están involucrados el huésped humano, el parasito, el vector, y el animal reservorio. Como se ha visto previamente, para que ocurra la transmisión del parásito entre el vector competente, el reservorio y el ser humano, deben coincidir en la misma localización geográfica varios de los factores descritos: climatológicos (temperatura y humedad), medioambientales y ecológicos, cuya coexistencia puede favorecer el aumento de la transmisión y dar lugar a un brote de leishmaniasis en la población. Un ejemplo de ello se está produciendo en la Comunidad de Madrid, donde desde mediados del año 2009 está teniendo lugar un brote en municipios del suroeste de la comunidad3. El principal foco de transmisión está situado en el municipio de Fuenlabrada, el cual ha pasado de ser un núcleo rural en los años 70, con poco más de 7.000 habitantes, rodeado de terrenos dedicados a actividades agrícolas, a ser un núcleo urbano que en el año 2011 tenía censados más de 190.000 habitantes. Las tierras de uso agrícola, donde se encuentran entre otros animales las liebres, han sido convertidas en zonas verdes protegidas y parques públicos que son espacios próximos y muy accesibles a zonas residenciales, con viviendas unifamiliares, habitadas por personas susceptibles. En este brote ha sido identificada la presencia de un nuevo reservorio en la zona afectada, la liebre, que se mueve en un ecosistema idóneo para la abundancia de flebotomos. Los municipios donde han aparecido la mayoría de los casos están rodeados de una zona verde muy frecuentada donde la población susceptible puede tener mayor exposición a flebotomos infectados.
Otro de los factores que puede afectar a la distribución y frecuencia de la enfermedad en España es el cambio climático. Las previsiones de calentamiento global pueden favorecer el desplazamiento hacia el norte de los vectores competentes para la transmisión de esta infección y con ello ampliar los límites de distribución actuales de la enfermedad por todo el territorio peninsular. En la medida en que la leishmaniasis es una enfermedad que tiene escasa repercusión clínica en la población inmunocompetente, no se esperan consecuencias graves para la salud, aunque hay que tener en cuenta que el grupo de edad de menos de cinco años presenta la mayor incidencia junto con la población inmunodeprimida. La información relacionada con la enfermedad debe estar disponible de manera exhaustiva y oportuna. Por esto, es necesario que la enfermedad se incluya en la Red Nacional de Vigilancia Epidemiológica como una enfermedad de declaración obligatoria en todas las CCAA para así reducir la subnotificación. A su vez, sería necesario que la vigilancia de la enfermedad utilice también como fuente de información el registro de altas hospitalarias, ya que habrá casos que solo se detecten en él.
Estamos, por tanto, ante una enfermedad con una dinámica muy compleja en la que son muchos los actores implicados, por lo que para garantizar el control de los brotes es necesario elaborar un plan de acción integral y multisectorial en el que participen todas las instituciones involucradas en la preparación y en la respuesta, de los sectores de salud humana, animal y ambiental y desde el nivel local al nacional.
Agradecimientos
Queremos agradecer la ayuda prestada para la realización de este artículo a Ma Ángeles Lopaz de la Dirección General de Atención Primaria de la Consejería de Sanidad de la Comunidad de Madrid, a Javier Lucientes del Departamento de Patología Animal de la Facultad de Veterinaria de la Universidad de Zaragoza, a Luisa Pilar Sánchez del Centro Nacional de Epidemiología, y al Área de información y estadísticas asistenciales de la Subdirección General de Información Sanitaria e Innovación, por facilitarnos el acceso a los datos del CMBD.
Bibliografía
1. World Health Organization. Control of the leishmaniases: report of a meeting of the WHO Expert Committee on the Control of Leishmaniases. Geneve: World Health Organization; 2010. [ Links ]
2. Montalban C, Calleja JL, Erice A, Laguna F, Clotet B, Podzamczer D, et al. Visceral leishmaniasis in patients infected with human immunodeficiency virus. Co-operative Group for the Study of Leishmaniasis in AIDS. J Infect. 1990; 21:261-270. [ Links ]
3. Brote comunitario de leishmaniasis en la zona suroeste de la Comunidad de Madrid, 2009-2012. Madrid: Consejeria de Sanidad y Medio Ambiente. Boletín epidemiológico de la Comunidad de Madrid; 2011;17(2). (citado 01 de Oct. 2012). Disponible en: http://www.madrid.org/cs/Satellite?c=Page&cid=1265618561630&pagename=PortalSalud/Page/PTSA_servicioPrincipal. [ Links ]
4. Molina R, Jimenez MI, Cruz I, Iriso A, Martin-Martin I, Sevillano O, et al. The hare (Lepus granatensis) as potential sylvatic reservoir of Leishmania infantum in Spain. Vet Parasitol. 2012; 190(1-2):268-271. [ Links ]
5. Lucientes J, Castillo JA, Gracia MJ, Peribañez MA. Flebotomos, de la biología al control (citado 01 de Oct. 2012). Disponible en: Revista Electrónica de Veterinaria REDVET (R). Disponible en: www.veterinaria.org/revistas/redvet [ Links ]
6. Gubler DJ. Resurgent vector-borne diseases as a global health problem. Emerg Infect Dis. 1998; 4(3):442-450. [ Links ]
7. Gallego M, De Colmenares M, Castillejos S, Valls D, Riera C, Fisa R, et al. Estudio del parasitismo y de la edad fisiológica de los flebotomos del Priorato. Acta del VIII Congreso Nacional de Parasitología; Lisboa; 1993. [ Links ]
8. Lucientes Curdi J, Sánchez Acedo C, Castillo Hernández JA, Estrada Peña A. Sobre la infección natural por Leishmania en Phlebotomus perniciosus Newstead, 1911 y Phlebotomus ariasi Tonnoir, 1921, en el foco de leishmaniosis de Zaragoza. Rev Iber Parasitol. 1998; 48:7-8. [ Links ]
9. Martin-Sanchez J, Guilvard E, Cedo-Sanchez C, Wolf-Echeverri M, Sanchiz-Marin MC, Morillas-Marquez F. Phlebotomus perniciosus Newstead, 1911, infection by various zymodemes of the Leishmania infantum complex in the Granada province (southern Spain). Int J Parasitol. 1994; 24(3):405-408. [ Links ]
10. Molina R, Aransay A, Nieto J, Cañavate C, Chicharro C, Sans A, et al. The phlebotomine sand flies of Ibiza and Formentera islands (Spain). Fifth International Symposium on Phlebotomine Sandflies (ISOPS 5); Arch. Inst. Pasteur. 2005; 82:12. [ Links ]
11. Morillas MF, Sanchis Marin MC, Martin SJ, Acedo SC. On Phlebotomus perniciosus Newstead, 1911 (Diptera, Phlebotomidae) in the Province of Almeria in southeastern Spain. Parassitologia. 1991; 33 Suppl:437-44.:437-444. [ Links ]
12. Rioux JA, Guilvard E, Gállego J, Moreno G, Pratlong F, Portús M et al. Phlebotomus ariasi Tonnoir, 1921 et Phlebotomus perniciosus Newstead, 1911 vecteurs du complexe Leishmania infantum dans un même foyer: Infestations par deux zymodèmes syntopiques. A propôs d´une enquête en Catalogne (Espagne). P439-444. Montpellier, France: IMEEE (Ed.) Leishmania. Taxonomie et Phylogenèse. Applications Éco-Épidemiologiques. 1986. [ Links ]
13. Martin-Sanchez J, Morales-Yuste M, cedo-Sanchez C, Baron S, Diaz V, Morillas-Marquez F. Canine leishmaniasis in southeastern Spain. Emerg Infect Dis. 2009; 15(5):795-798. [ Links ]
14. Ashford RW, Bettini S. Ecology and epidemiology: Old World. En: The leishmaniasis in biology and medicine. Londres: Academic Press; 1987. [ Links ]
15. Molina R, Amela C, Nieto J, San-Andres M, Gonzalez F, Castillo JA, et al. Infectivity of dogs naturally infected with Leishmania infantum to colonized Phlebotomus perniciosus. Trans R Soc Trop Med Hyg. 1994; 88(4):491-493. [ Links ]
16. Acedo Sanchez C, Martin Sanchez J, Velez Bernal I, Sanchis Marin MC, Louassini M, Maldonado JA, et al. Leishmaniasis eco-epidemiology in the Alpujarra region (Granada Province, southern Spain). Int J Parasitol. 1996; 26(3):303-310. [ Links ]
17. Amela C, Mendez I, Torcal JM, Medina G, Pachon I, Canavate C, et al. Epidemiology of canine leishmaniasis in the Madrid region, Spain. Eur J Epidemiol. 1995; 11(2):157-161. [ Links ]
18. Galvez R, Miro G, Descalzo MA, Nieto J, Dado D, Martin O, et al. Emerging trends in the seroprevalence of canine leishmaniasis in the Madrid region (central Spain). Vet Parasitol. 2010; 169(3-4):327-334. [ Links ]
19. Reyes Magaña A, Morillas-Márquez F, Valero-López A, González Castro J, Benavides Delgado I, Sanchís Marín MC. Encuesta sobre la leishmaniasis canina en las comarcas naturales de la provincia de Granada (Sur de España). Rev Iber Parasitol. 1988; 48:233-240. [ Links ]
20. Alvar J, Amela C, Molina R. El perro como reservorio de la leishmaniasis. Med Vet. 1995; 12(7-8):431-438. [ Links ]
21. Morse SS. Factors in the emergence of infectious diseases. Emerg Infect Dis. 1995; 1(1):7-15. [ Links ]
22. Chappuis F, Sundar S, Hailu A, Ghalib H, Rijal S, Peeling RW, et al. Visceral leishmaniasis: what are the needs for diagnosis, treatment and control? Nat Rev Microbiol. 2007; 5(11):873-882. [ Links ]
23. Euzeby J. Les parasitoses humaines d'origen animale. Caractères épidemiologiques. Paris: Flamarion Médicine-Sciences;1984. [ Links ]
24. Galvez R, Descalzo MA, Guerrero I, Miro G, Molina R. Mapping the current distribution and predicted spread of the leishmaniosis sand fly vector in the madrid region (Spain) based on environmental variables and expected climate change. Vector Borne Zoonotic Dis. 2011; 11(7):799-806. [ Links ]
25. Ballart C, Alcover MM, Portus M, Gallego M. Is leishmaniasis widespread in Spain? First data on canine leishmaniasis in the province of Lleida, Catalonia, northeast Spain. Trans R Soc Trop Med Hyg. 2012; 106(2):134-136. [ Links ]
26. Franco AO, Davies CR, Mylne A, Dedet JP, Gallego M, Ballart C, et al. Predicting the distribution of canine leishmaniasis in western Europe based on environmental variables. Parasitology. 2011; 14:1-14. [ Links ]
27. Wilcox B, Colwell R. Emerging and reemerging Infectious Dieases: Biocomplexity as an Interdisciplinary Paradigm. EcoHealth. 2005; 2:244-257. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Carmen Amela Heras
Centro de Coordinación de Alertas y Emergencias Sanitarias
Ministerio de Sanidad, Servicios Sociales e Igualdad
Paseo del Prado, 18-20
28071 Madrid
camela@msssi.es