Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.87 no.4 Madrid jul./ago. 2013
https://dx.doi.org/10.4321/S1135-57272013000400005
Evaluación económica de la monoterapia con tocilizumab frente a adalimumab en artritis reumatoide
Economic Evaluation of Rheumathoid Arthritis Monotherapy with Tocilizumab and Adalimumab
Federico Navarro Sarabia (1), Francisco J. Blanco (2), José Ma Álvaro Gracia (3), Juan A. García Meijide (4), José Luis Poveda (5), Darío Rubio-Rodríguez (6) y Carlos Rubio-Terrés (6)
(1) Hospital Virgen Macarena. Sevilla.
(2) Complejo Hospitalario Universitario A Coruña. A Coruña.
(3) Hospital Universitario La Princesa. Madrid.
(4) Hospital Ntra. Sra de la Esperanza. Santiago de Compostela.
(5) Hospital Universitario La Fe. Valencia.
(6) Health Value. Madrid.
Dirección para correspondencia
RESUMEN
Fundamento: Tocilizumab (TCZ) fue superior a adalimumab (ADA) en monoterapia en la reducción de los signos y síntomas de la artritis reumatoide del adulto (AR) en pacientes intolerantes o con respuesta inadecuada a metotrexato (MTX). El objetivo del estudio fue analizar el coste-efectividad de TCZ vs ADA en estos pacientes.
Métodos: Evaluación económica del coste por respuesta o remisión con TCZ vs ADA a partir del estudio ADACTA (horizonte temporal: 24 semanas). Criterios de respuesta clínica ACR o de remisión de la enfermedad, índice DAS28. Ámbito: Sistema Nacional de Salud. Los costes incluidos (adquisición, administración y monitorización de los medicamentos en € de 2012) se obtuvieron de fuentes españolas. Se efectuaron análisis de sensibilidad simples univariantes.
Resultados: Las tasas de respuesta ACR20, ACR50 y ACR70 con TCZ y ADA se obtuvieron en el 65% y 49,4% (p <0,01); 47,2% y 27,8% (p <0,01); y en el 32,5% y 17,9% (p <0,01) de los pacientes, respectivamente. La remisión DAS28 se produjo en el 39,9% y 10,5%, respectivamente (p <0,0001). El coste por respuesta fue menor con TCZ que con ADA (ACR20: 8.105 y 11.553 €; ACR50: 11.162 y 20.529 €; ACR70: 16.211 y 31.882 €) respectivamente. El coste de la remisión DAS28 fue de 13.204 € y 54.352 € respectivamente. En todos los escenarios el tratamiento con TCZ tuvo mayor eficacia y menores costes que con ADA.
Conclusiones: Según este análisis, en España la monoterapia con TCZ es una estrategia eficiente frente a ADA para el tratamiento de los pacientes con AR intolerantes o con respuesta inadecuada a MTX.
Palabras clave: Artritis reumatoide. Coste-efectividad. Adalimumab. Tocilizumab.
ABSTRACT
Background: Tocilizumab (TCZ) was superior to adalimumab (ADA), as monotherapy, in reducing signs and symptoms of adult rheumatoid arthritis (RA) when methotrexate (MTX) treatment is poorly tolerated or inappropriate. The aim of the study was to analyze the cost-effectiveness of TCZ vs ADA in these patients.
Methods: Economic evaluation of the cost per response or remission of TCZ vs ADA from ADACTA (time horizon: 24 weeks). Clinical response criteria ACR or disease remission criteria, DAS28. Perspective: National Health System. The costs included (acquisition, administration and monitoring of medicines; € 2012) were obtained from Spanish sources. Simple univariate sensitivity analyzes were performed.
Results: ACR20, ACR50 and ACR70 response rates with TCZ and ADA were obtained in 65% and 49.4% (p <0.01), 47.2% and 27.8% (p <0.01); and 32.5% and 17.9% (p <0.01) of patients, respectively. DAS28 remission occurred in 39.9% and 10.5%, respectively (p <0.0001). The cost per response was lower with TCZ than with ADA (ACR20: € 8,105 and € 11,553; ACR50: € 11,162 and € 20,529; ACR70: € 16,211 and € 31,882) respectively. The cost of DAS28 remission was € 13,204 and € 54,352, respectively. Treatment with TCZ was dominant (more effective, with lower costs vs ADA) in all scenarios analyzed.
Conclusions: According to this analysis, in Spain TCZ monotherapy is an efficient strategy vs ADA for treating RA patients intolerant to MTX or in which there is inappropriate response.
Key words: Rheumatoid arthritis. Cost-effectiveness. Adalimumab. Tocilizumab.
Introducción
La artritis reumatoide (AR) es una enfermedad caracterizada por la inflamación crónica de las articulaciones1 que en España afecta al 0,5% de la población adulta2. En la mayoría de los casos, el curso es progresivo y conduce al daño articular irreversible, lo que tiene como consecuencia el deterioro funcional, la disminución de la calidad de vida y la mortalidad prematura de los pacientes1.
El coste anual de la AR en España se ha estimado que está entre 590-1.262 millones de euros3. Un estudio realizado por la Sociedad Española de Reumatología estimó que el 56% de los costes totales corresponden a los tratamientos farmacológicos4.
El tratamiento de la AR debe dirigirse a controlar la actividad inflamatoria, evitar la progresión de la lesión estructural articular y prevenir la invalidez de los pacientes1. En los últimos años, la utilización precoz de los agentes biológicos ha permitido establecer objetivos terapéuticos concretos, como alcanzar la remisión o bien grados bajos de actividad1. El 36,9% de los pacientes españoles con AR recibe algún agente biológico a lo largo de la enfermedad, siendo adalimumab (ADA) [un inhibidor del factor de la necrosis tumoral (TNF)] el más prescrito (27,3%)5. El 19,6% de los agentes biológicos se administra como monoterapia5.
Tolicizumab (TCZ) es el primer anticuerpo monoclonal inhibidor del receptor de la interleucina 6 (IL-6). En combinación con metotrexato (MTX) o en monoterapia en caso de intolerancia a MTX o cuando el tratamiento continuado con él es inadecuado, está indicado en el tratamiento de la AR activa de moderada a grave, en pacientes adultos con respuesta inadecuada o intolerancia a un tratamiento previo con uno o más fármacos antirreumáticos modificadores de la enfermedad (FAME) o con antagonistas del TNF6.
Recientemente se han publicado los resultados del ensayo clínico ADACTA7 que ha comparado la eficacia de TCZ y ADA, ambos en monoterapia, en pacientes con AR con un valor de actividad según el índice DAS28 mayor de 5,1 (el índice DAS28 es una escala de actividad de la enfermedad que utiliza el recuento de 28 articulaciones) y con intolerancia o respuesta inadecuada a MTX. De acuerdo con este estudio, TCZ fue más eficaz que ADA en la reducción de los signos y síntomas de la AR7.
El análisis del coste-efectividad de los nuevos medicamentos, en comparación con los ya disponibles, es un instrumento de especial relevancia para la toma de decisiones del Sistema Nacional de Salud (SNS)8.
Dada la mayor eficacia observada de TCZ frente a ADA7 el objetivo del presente estudio fue analizar el coste-efectividad de la monoterapia de la AR con TCZ y ADA en caso de intolerancia a MTX o cuando el tratamiento continuado con MTX es inadecuado.
Material y métodos
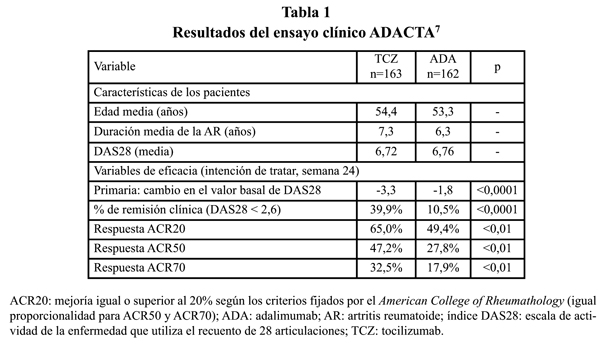
Se realizó una evaluación económica desde la perspectiva del Sistema Nacional de Salud, por lo que solo se incluyeron los costes directos sanitarios derivados del manejo de la enfermedad, para calcular el ratio coste-efectividad incremental y el coste incremental por respuesta o remisión de TCZ frente a ADA a partir de los resultados de eficacia del ensayo clínico ADACTA7, los cuales se resumen en la tabla 1. La efectividad de TCZ fue superior a la de ADA en las respuestas ACR20, ACR50 y ACR70 (mejoría igual o superior al 20%, 50% y 70% respectivamente, según los criterios fijados por el American College of Rheumathology)9. TZC también fue superior a ADA en la tasa de remisión clínica, según el índice DAS28 de actividad de la enfermedad (DAS28<2,6)10.
El ratio coste-efectividad incremental se calculó mediante la fórmula siguiente:

El análisis se hizo para un horizonte temporal de 24 semanas (la duración del estudio ADACTA).
Se analizaron los costes de adquisición de los fármacos (caso base) y los correspondientes a la administración y monitorización de los medicamentos en el análisis de sensibilidad. Todos los costes se obtuvieron de fuentes españolas habitualmente utilizadas en las evaluaciones económicas realizadas en nuestro país y se presentan en euros (€) de 2012 (tabla 2). No se analizaron los costes por reacciones adversas debido a que en el estudio ADACTA no se observaron diferencias estadísticamente significativas o clínicamente relevantes a ese respecto7.
El coste de adquisición de los tratamientos se calculó para las pautas posológicas utilizadas en el estudio ADACTA (TCZ: 8 mg/kg IV cada 4 semanas; ADA:40 mg SC cada 2 semanas, ambos en monoterapia)7,11 y considerando, por tanto, que en el período de 24 semanas se administrarían 6 dosis de TCZ y 12 dosis de ADA. La dosis de TCZ (544,0 mg por paciente) se calculó para un peso corporal medio de 68 kg, según el estudio PRAXIS12. El coste por mg de TCZ (1,61 €) se estimó para las dosis de 80 mg y 200 mg de TCZ, por lo que el coste por dosis fue de 878,09 € (tabla 2). Para calcular el coste de adquisición de los medicamentos se aplicó el PVL con la reducción del 7,5% establecida en el Real Decreto-Ley 8/201013. Se efectuaron dos tipos de análisis respecto al coste de adquisición de los fármacos: para el coste por mg (caso base) y para el coste por viales completos, considerando el coste de las cantidades de fármaco desechadas (análisis de sensibilidad).
De acuerdo con el estudio PRAXIS12, el coste de la administración de ADA se calculó asumiendo que el 15,6% de las inyecciones SC las realiza una enfermera de atención primaria, para lo que dedican 4,32 minutos por inyección. En cuanto al coste de la administración de TCZ se asumió que se administra mediante perfusión IV durante 1 hora en el hospital de día12 de acuerdo con su ficha técnica6. El coste de su administración durante 1 hora en el hospital de día se estimó a partir del uso de recursos de la administración de infliximab obtenido en el estudio PRAXIS12 y considerando que: (i) El coste semestral de la administración de infliximab es de 735,93 € (actualizado a 2012); (ii) Que su frecuencia de administración es cada 7,61 semanas; (iii) Que en un semestre el número de administraciones sería de 3,42 (26 semanas/7,61 semanas); (iv) Que, en consecuencia, el coste de una administración de infliximab ascendería a 215,40 € (735,43 €/3,42 administraciones); (v) Según la ficha técnica de infliximab, éste debe ser administrado por vía intravenosa durante un período de 2 horas y los pacientes se mantendrán en observación durante al menos 1-2 horas después, debido a las reacciones agudas relacionadas con la perfusión. Por tanto, cada vial consume 3,82 horas en su reconstitución, administración y vigilancia [(6,36+120,82+101,78 minutos)/60 minutos por hora); y consiguientemente (vi) el coste de 1 hora de perfusión intravenosa se calculó en 56,45 € (215,40 €/3,82 horas; la diferencia de 7 céntimos (54,45-54,38) se debe a la contabilización de todos los decimales de los valores]12 (tabla 2).
Respecto al coste de la monitorización o seguimiento de los tratamientos con TCZ y ADA, se consideró que sería similar con ambos fármacos. El coste de las consultas y de las pruebas se obtuvo del estudio PRAXIS12 (301,71 €) (tabla 2).
Con objeto de comprobar la solidez del cálculo, se realizaron análisis de sensibilidad simples univariantes en aquellos parámetros que presentaron un mayor grado de incertidumbre: (i) el coste de TCZ ajustado por el número de viales (no por mg); (ii) incluyendo el coste de la administración de ambos fármacos; (iii) incluyendo el coste de la monitorización de ambos fármacos; (iv) incluyendo los costes de administración y monitorización; (v) considerando los pesos corporales de 67,0 y 69,1 kg, correspondientes al IC95% del peso medio obtenido en el estudio PRAXIS12.
Los resultados del análisis económico son aplicables a los pacientes que tengan características similares a los incluidos en el estudio ADACTA (tabla 1).
Resultados
El coste por paciente tratado con TCZ y ADA ascendería a 5.269 € y 5.707 € respectivamente, obteniéndose un ahorro con TCZ de 438 €.
En la tabla 3 se muestra que el coste por respuesta es menor con TCZ que con ADA (ACR20: 8.105 € y 11.553 €; ACR50: 11.162 € y 20.529 €; ACR70: 16.211€ y 31.882 €) respectivamente, por lo que el coste de obtener una respuesta con TCZ frente a ADA se reduciría en 3.448 €, 9.367 € y 15.671 €, respectivamente.
El coste de cada remisión clínica (DAS28 < 2,6) fue de 13.204 € y 54.352 € con TCZ y ADA respectivamente, por lo que se produciría un ahorro por remisión de 41.148 € con TCZ (figura 1).
En el caso base del análisis, con un horizonte temporal de 24 semanas, el tratamiento con TCZ fue dominante (más eficaz y con menores costes que con ADA) tanto en respuesta ACR como en remisión de la enfermedad. En la tabla 4 se resumen los resultados obtenidos en el análisis coste-efectividad para la remisión (coste por remisión adicional obtenida con TCZ), confirmándose en todos los análisis de sensibilidad la dominancia de TCZ observada en el caso base.
Discusión
Según el presente análisis, en España la monoterapia con TCZ es una estrategia eficiente frente a ADA para el tratamiento de los pacientes con AR que no toleran el MTX o en los que la respuesta a este fármaco es inadecuada.
El presente estudio no está exento de algunas limitaciones. En primer lugar, debe tenerse en cuenta que el coste de una hora de perfusión intravenosa de TCZ en el hospital de día es un factor que puede determinar el resultado del estudio. Ese coste se ha calculado a partir de la duración de la reconstitución, administración y vigilancia de la perfusión intravenosa de infliximab obtenida en un estudio español12 en el que se revisaron las historias clínicas de 396 pacientes con AR tratados con infliximab. Otra limitación del estudio es su breve horizonte temporal (24 semanas), acorde con la duración del ensayo clínico ADACTA en el que se basa14. Por último, debe tenerse en cuenta que los resultados de este análisis económico son válidos para pacientes con las características de los participantes en el estudio ADACTA, ensayo clínico en el que participaron centros y pacientes españoles.
Entre las fortalezas del estudio debe mencionarse que todos los costes se obtuvieron a partir de fuentes y estudios españoles11,12 y que la totalidad de los análisis de sensibilidad realizados confirmaron la estabilidad del caso base.
No se ha identificado ningún otro análisis económico previamente publicado que analice el coste-efectividad de TCZ y ADA en monoterapia basádose en el estudio ADACTA7. Según un metaanálisis publicado por Liu et al.15, el coste por respuesta adicional ACR50 sería mayor con TCZ (31.363 $) que con ADA (27.853 $). Otro tanto ocurriría en ACR70 (48.320 $ y 47.533 $ respectivamente). Sin embargo, este estudio no incluyó el ensayo clínico ADACTA (por no estar disponible en el momento de su realización) que es el primero que ha comparado directamente la eficacia de TCZ y ADA en la AR. Por el contrario, el estudio de Liu et al15 realizó comparaciones indirectas utilizando únicamente un ensayo clínico de TCZ controlado con placebo16. A este respecto, debe considerarse que las comparaciones de eficacia (y las consiguientes evaluaciones económicas) tienen mayor validez cuando proceden de ensayos clínicos de comparaciones directas17.
De acuerdo con el presente estudio, puede concluirse que en pacientes con artritis reumatoide activa de moderada a grave, con respuesta inadecuada o intolerancia a metotrexato, el tratamiento en monoterapia con tocilizumab ha demosrado ser una estrategia eficaz y rentable desde la perspectiva del Sistema Nacional de Salud en España frente al tratamiento con adalimumab.
Bibliografía
1. Tornero J, Sanmartín R, Rodríguez V, Martín E, Marenco JL, González I, et al. Actualización del Documento de Consenso de la Sociedad Española de Reumatología sobre el uso de terapias biológicas en la artritis reumatoide. Reumatol Clin. 2010; 6: 23-36. [ Links ]
2. Carmona L, Ballina J, Gabriel R, Laffon A. The burden of musculoskeletal diseases in the general population of Spain: results from a national survey. Ann Rheum Dis. 2001; 60: 1040-5. [ Links ]
3. Lajas C, Abásolo L, Bellajdel B, Hernández-García C, Carmona L, Vargas E, et al. Costs and predictors of costs in rheumatoid arthritis: a prevalence-based study. Arthritis Rheum. 2003; 49: 64-70. [ Links ]
4. Ruiz-Montesinos MD, Hernández-cruz B, Ariza-Ariza R, Carmona L, Ballina J, Navarro-Sarabia F, en representación del Grupo de Estudio de Costes, Calidad de vida en Artritis Reumatoide de la Sociedad Española de Reumatología. Utilización de recursos en una cohorte de pacientes con artritis reumatoide atendidos en área especializada de reumatología en España. Reumatol Clin. 2005; 1: 193-9. [ Links ]
5. Sociedad Española de Reumatología. Proyecto EMAR II: Variabilidad en el manejo de la artritis reumatoide y las espondiloartritis en España. Disponible en: http://www.google.com/url?sa=t&rct=j&q=emar%20ii&source=web & cd=1&cad=rja&ved=0CCEQFjAA&url=http%3A%2F%2Fwww.ser.es%2FArchivos DESCARGABLES%2FProyectos%2FEmar%2FEMAR_Informe.pdf&ei=9a9ZUJPDO8KGhQeK84DACQ&usg=AFQjCNEC5jisJdNGDzg8hY-jadpUyfdLOg (consulta: 19 de septiembre de 2012). [ Links ]
6. European Medicines Agency. RoActemra. Tocilizumab. Resumen de las características del producto. RoActemra 20 mg/ml concentrado para solución para perfusión Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000955/ human_med_001042.jsp&mid=WC0b01ac058001d124 (consulta: 19 de septiembre de 2012). [ Links ]
7. Gabay C, Emery P, van Vollenhoven R, Dikranian A, Alten R, Pavelka K, Klearman M, Musselman D, Agarwal S, Green J, Kavanaugh A. ADACTA Study Investigators. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, double-blind, controlled phase 4 trial. Lancet. 2013; 381: 1541-50. [ Links ]
8. Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones. BOE num 98 de 24/04/2012. [ Links ]
9. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum. 1988; 31: 315-24. [ Links ]
10. Balsa A, Carmona L, Gonzalez-Alvaro I, Belmonte MA, Tena X, Sanmarti R. Value of Disease Activity Score 28 (DAS28) and DAS28-3 compared to American College of Rheumatology-defined remission in rheumatoid arthritis. J Rheumatol. 2004; 31: 40-6. [ Links ]
11. Base de datos de medicamentos. Consejo General de Colegios Oficiales de Farmacéuticos. (citado el 21/09/2012). Disponible en: http://www.portalfarma.com/home.nsf [ Links ]
12. Rubio-Terrés C, Ordovás Baines JP, Pla Poblador R, Martínez Nieto C, Sánchez Garre MJ, Rosado Souvirón MA, por el Grupo de Investigadores del Estudio PRAXIS. Utilización y coste de los modificadores biológicos de la artritis reumatoide en España (Estudio PRAXIS). Farm Hosp. 2007; 31: 78-92. [ Links ]
13. Real Decreto-Ley 8/2010 por el que se adoptan medidas extraordinarias para la reducción del déficit público. BOE núm 126 del 24/05/2010. [ Links ]
14. Gabriel S, Drummond M, Maetzel A, et al. OMERACT 6 Economics Working Group Report: A proposal for a refence case for economic evaluation in rheumatoid arthritis. J Rheumatol. 2003; 30: 886-90. [ Links ]
15. Liu Y, Wu EQ, Bensimon AG, Fan CP, Bao Y, Ganguli A, Yang M, Cifaldi M, Mulani P. Cost per responder associated with biologic therapies for Crohn's disease, psoriasis, and rheumatoid arthritis. Adv Ther. 2012; 29: 620-34. [ Links ]
16. Smolen JS, Beaulieu A, Rubbert-Roth A, et al; OPTION Investigators. Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double-blind, placebo-controlled, randomised trial. Lancet. 2008; 371: 987-97. [ Links ]
17. Wells GA, Sultan SA, Chen L, Khan M, Coyle D. Indirect Evidence: Indirect Treatment Comparisons in Meta-Analysis. Ottawa: Canadian Agency for Drugs and Technologies in Health; 2009. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Carlos Rubio Terrés
HEALTH VALUE.
C/ Virgen de Aránzazu, 21. 5.o B.
28034-Madrid.
Correo electrónico: crubioterres@healthvalue.org