Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.27 no.1 Pamplona ene./abr. 2004
REVISIONES
Inmunoterapia activa en el tratamiento de neoplasias hematológicas
Active immunotherapy in the treatment of haematological neoplasias
S. Inogés, M. Rodríguez Calvillo, A. López Díaz de Cerio, N. Zabalegui, I. Melero,
A. Sánchez Ibarrola, E. Rocha, M. Bendandi
| RESUMEN La continua búsqueda de abordajes terapéuticos que mejoren los tratamientos convencionales de las enfermedades neoplásicas junto con el mejor conocimiento del sistema inmunitario ha llevado en los últimos años al desarrollo de la inmunoterapia. Palabras clave. Vacuna idiotípica. Células dendríticas. Inmunoterapia. Linfoma folicular. | ABSTRACT The continuous search for therapeutic approaches that improve the conventional treatments of neoplasms, together with an improved understanding of the immune system, has led in recent years to the development of Immunotherapy. Key words. Idiotypic vaccine. Dendritic cells. Immunotherapy. Follicular lymphoma. |
| Área de Terapia Celular. Clínica Universitaria de Navarra. Aceptado para su publicación el 23 de enero de 2004. | Correspondencia: |
INMUNOTERAPIA ACTIVA EN EL TRATAMIENTO DE NEOPLASIAS HEMATOLÓGICAS
La limitada eficacia de muchas estrategias convencionales (cirugía, quimioterapia, radioterapia) en el tratamiento de la mayoría de tumores sólidos y en ciertas hemopatías malignas justifica la búsqueda de nuevas estrategias para intentar mejorar los resultados de los protocolos terapéuticos aplicados hasta la fecha. La propiedad del sistema inmunitario para reconocer y en muchos casos destruir células tumorales ha hecho que se considere a la inmunoterapia como una modalidad terapéutica complementaria a los tratamientos habituales.
El objetivo de la inmunoterapia es establecer, reparar o aumentar la respuesta inmune frente a una enfermedad, en este caso las enfermedades oncológicas. De esta forma, se pretende conseguir una destrucción selectiva de las células tumorales, eliminando así los efectos que sobre células normales tienen la radioterapia y la quimioterapia. Aunque este objetivo se ha buscado desde principios del siglo XX, realmente todavía son pocas las indicaciones en las que la inmunoterapia ha demostrado ser realmente útil.
Desde el desarrollo de los primeros tratamientos contra el cáncer, los tumores hematológicos han sido los primeros en los que se han investigado tratamientos innovadores que vayan mejorando los convencionales. De hecho, la combinación de fármacos y el concepto de intensificación de dosis inicialmente aplicado con éxito en tumores hematológicos, se ha utilizado posteriormente en el tratamiento de otros tumores1. De la misma forma, el papel crítico del sistema inmunitario en el tratamiento de tumores hematológicos ha permitido plantearse la posibilidad de usar la inmunoterapia para mejorar el tratamiento convencional de estas otras neoplasias1.
FORMAS DE INMUNOTERAPIA
Podemos distinguir básicamente dos tipos de inmunoterapia (Tabla 1), la inmunoterapia pasiva que consiste en la transferencia a portadores de tumores de células o anticuerpos previamente generados in vitro y dirigidos contra el tumor, y la inmunoterapia activa, en la que nos vamos a centrar en esta revisión, que lo que pretende es inducir in vivo una respuesta inmune.
Tanto la inmunoterapia pasiva como la activa pueden dirigirse directamente contra antígenos tumorales (inmunoterapia específica) o puede pretender una activación global del sistema inmune (inmunoterapia inespecífica).
Inmunoterapia pasiva
Inmunoterapia celular adoptiva
En oncología, la inmunoterapia celular adoptiva se define como la transferencia a portadores de tumores de células inmunológicamente reactivas que pueden mediar directa o indirectamente una actividad antitumoral. El objetivo consiste en identificar células capaces de reconocer y eliminar las células tumorales para poder generarlas y expandirlas in vitro a gran escala hasta obtener el número suficiente para conseguir el efecto deseado (Fig. 1).
En la década de los 80 la atención se centró en las células LAK (Lymphokine-Activated Killer), generadas por incubación de linfocitos no purificados, de una muestra obtenida de sangre periférica, bazo o conducto torácico con IL-2 recombinante (rIL-2) durante 3 ó 4 días. En estos cultivos la IL-2 es capaz de inducir proliferación en células previamente activadas por antígenos. Las células así generadas son células no T, no B y no NK que son capaces de lisar in vitro una gran variedad de células tumorales tanto autólogas como alogénicas, sin lisar células normales2. La mayoría de estas células LAK se originan a partir de células NK y, por tanto, carecen de receptores de células T, por lo que la lisis de células tumorales es sin restricción MHC (Complejo Mayor de Histocompatibilidad). En los primeros ensayos en modelos murinos se comprobó que, cuando estas células se administran junto con rIL-2 sistémica, son capaces de mediar regresión de metástasis pulmonares y hepáticas3,4. Posteriormente, en ensayos clínicos en humanos, se observó también que estas células son capaces de reducir el tamaño del tumor en cánceres metastásicos5,6. En este caso el éxito depende de la carga tumoral, siendo mayor en pacientes con poca enfermedad y en aquellos en los que el tumor primario ha sido erradicado. El inconveniente de este tipo de tratamiento es la severa toxicidad que pueda derivarse tras la administración de rIL-2 sistémica; por tanto, aunque estas células median efectos antitumorales tanto in vitro como in vivo, debe sistematizarse de forma rigurosa la utilización de esta modalidad terapéutica.
La observación de la presencia de infiltrados inflamatorios en algunos tumores sólidos7,8 puede atribuirse a una respuesta inmunológica del huésped frente al tumor y por tanto ser indicativo de una reacción específica9. De hecho se ha comprobado que tumores en los que aparece este infiltrado inflamatorio tienen mejor pronóstico que aquellos que no lo tienen. En vista de estos hechos se plantearon la recuperación, aislamiento, caracterización y expansión in vitro de estas células para ser utilizadas en inmunoterapias adoptivas en determinados tumores sólidos. Aunque se han descrito algunas células NK o células con marcadores de células NK (CD56, CD57) e incluso, dependiendo de la histología del tumor, macrófagos y células B, las células TIL (Tumor Infiltrating Lymphocytes) son generalmente linfocitos T CD3+ (tanto CD4+ como CD8+) con actividad citotóxica específica, restringida por MHC y dirigida contra células de los tumores de los que se derivan y no contra otro tipo de tumores.
Aunque el inicio fue lento por la dificultad que presentaba el aislamiento y la siguiente expansión de este tipo de células, posteriormente se diseñaron protocolos de generación de TIL que permitieron obtener el número de células necesario (1010-1011 células) para conseguir una respuesta inmunológica adecuada. Las células TIL han demostrado tener una eficacia 50-100 veces superior a las células LAK y, a diferencia de éstas, no se precisa la administración de altas dosis de rIL-2 sistémica para conseguir el efecto terapéutico, si bien la administración de bajas o moderadas dosis de rIL-2 aumenta considerablemente su potencia. Por tanto su mayor efectividad, especificidad y menor dependencia de rIL-2, con menos efectos secundarios, hace que la inmunoterapia con células TIL sea una modalidad idónea en determinados tumores sólidos (Tabla 2).
Aunque la mayoría de los estudios se han centrado en pacientes con melanoma10-15, con aproximadamente 30% de respuestas, también se han obtenido buenos resultados en pacientes con cáncer de ovario16, carcinoma renal17,18 y carcinoma de pulmón19. El único inconveniente de este tipo de tratamiento es que resulta laborioso, técnicamente complejo y además se necesitan aproximadamente 8 semanas para conseguir el número de células necesario con eficacia terapéutica.
La mayoría de los ensayos clínicos de inmunidad celular adoptiva se han llevado a cabo en tumores sólidos no hematológicos, aunque la capacidad de inducir remisiones en pacientes con trastornos linfoproliferativos sólo con infusiones de linfocitos de donante ha permitido plantearse la posibilidad de usar este tipo de inmunoterapia para mejorar el tratamiento convencional de tumores hematológicos1. En este campo se centran también los estudios de June y col quienes están llevando a cabo un ensayo para valorar el efecto de la infusión de células T activadas in vitro con CD3/CD28 en pacientes con linfoma no Hodgkin después de quimioterapia a altas dosis y trasplante de células CD34+20. Aunque todavía es pronto para resultados definitivos, parece que la inmunoterapia celular adoptiva puede ser útil como tratamiento complementario en neoplasias hematológicas.
Anticuerpos monoclonales
El primer paso ha sido el uso de anticuerpos monoclonales desnudos en el tratamiento de leucemias y linfomas. Hace aproximadamente 10 años se usó por primera vez un anticuerpo monoclonal anti-CD20 en el tratamiento de linfomas de células B de bajo grado. Después de que la FDA (Food and Drug Administration) aprobara el uso clínico de este tipo de anticuerpos, se desarrolló un ensayo clínico fase II21 en el que 166 pacientes con linfomas de bajo grado en recaída se trataron con 4 dosis semanales de Rituximab (anti CD20: 375 mg/m2). Se obtuvo un 48% de respuestas con un 6% de remisiones completas y con una media de tiempo hasta la progresión de 12 meses. En los pacientes que inicialmente respondieron y luego progresaron, un 40% respondió a un segundo tratamiento con rituximab registrándose una media de tiempo hasta la progresión de 17 meses. También Coiffier y col22 han publicado los resultados de su estudio en el que se incluyeron 54 pacientes con linfoma difuso de células grandes: 31 % de los pacientes alcanzaron una respuesta clínica e incluso un 14% respuesta completa. El tiempo medio hasta la progresión en los pacientes que respondieron fue de 246 días. Este tratamiento se está ensayando también en otras patologías como la macroglobulinemia de Waldenström, leucemia linfática crónica y linfoma linfocítico, aunque no hay todavía resultados definitivos23-29.
En este momento el objetivo es buscar nuevas dianas, por ejemplo CD22, CD52 y CD4030 contra las que se puede dirigir la respuesta, así como explorar nuevas estrategias que conduzcan a una mayor eficacia que las que existen actualmente, por ejemplo usar anticuerpos radiomarcados (los más utilizado son 131I o 90Y) o conjugados con fármacos o toxinas naturales. También se está explorando un nuevo método que trata de aprovechar tanto el brazo celular como el brazo humoral del sistema inmunitario mediante el desarrollo de anticuerpos biespecíficos que reconocen por una parte a la célula tumoral y por otra a la célula efectora citotóxica, lo que origina que esta última se dirija más específicamente contra el tumor. Hasta el momento, la mayoría de los anticuerpos biespecíficos involucran al CD19 (o CD20) y al CD3. En estudios in vitro y en modelos animales31-34 se ha demostrado la eficacia del uso de anticuerpos biespecíficos CD3XCD19, pero en humanos todavía no existen resultados clínicos claros. Hasta el momento se han tratado 3 pacientes con linfoma no Hodgkin y 1 paciente con leucemia linfática crónica. Los anticuerpos han sido bien tolerados y no se han producido efectos secundarios35, pero tampoco se ha observado ningún efecto inmunológico, tal vez por la imposibilidad de obtener la cantidad de anticuerpo necesaria mediante las técnicas convencionales de hibridomas.
Inmunoterapia activa
Inmunoterapia activa inespecífica
Una de las formas más antiguas y eficaces de inmunoterapia activa inespecífica ha sido la utilización del BCG (bacilo de Calmette-Guerin), que produce una estimulación inespecífica del sistema retículo endotelial. Sin embargo su uso quedó restringido al tratamiento del carcinoma superficial de vejiga.
Otra forma de este tipo de inmunoterapia activa inespecífica es el uso de citoquinas que, aunque son proteínas producidas normalmente por nuestro organismo, actualmente también se pueden producir in vitro por tecnología recombinante. El uso de citoquinas se considera estándar en algunas situaciones, por ejemplo el interferón-a es eficaz en leucemia mieloide crónica, tricoleucemia, linfomas de bajo grado, mieloma, melanomas, tumores carcinoides e hipernefroma, mientras la interleukina-2 es eficaz en algunos tumores sólidos como el hipernefroma.
Inmunoterapia activa específica
La inmunoterapia activa específica ofrece un gran número de alternativas, desde las primeras vacunas hasta las de segunda generación en las que actualmente se ponen muchas esperanzas (Fig. 2).
El concepto de vacunas en enfermedades neoplásicas (hematológicas o no hematológicas) es claramente diferente al concepto de vacunas en enfermedades infecciosas. Mientras en estas enfermedades la vacuna se dirige contra un antígeno bien conocido, muy inmunogénico y con un fin claramente preventivo, en el caso de los tumores el antígeno no siempre es conocido, es débilmente inmunogénico y la primera intención es terapéutica, aunque también se pretende evitar recurrencias en tumores con alta posibilidad de recaídas después de obtener respuestas completas con otros tratamientos.
Además, en la preparación de vacunas contra el cáncer, el hecho de disponer o no de material tumoral condicionará el tipo de vacuna que se puede producir. A su vez, si se dispone de material tumoral, las vacunas a desarrollar serán diferentes si se conocen los antígenos contra los que hay que dirigir la respuesta (por ejemplo vacunas idiotípicas) o si estos antígenos no se conocen (en este caso se pueden usar vacunas de células enteras). En ambos casos el problema que habitualmente se plantea es que los antígenos tumorales son poco inmunogénicos, generalmente porque el sistema inmunitario se ha hecho tolerante; por eso un paso básico en el desarrollo de prácticamente todas las vacunas es aumentar la inmunogenicidad del antígeno contra el que se dirige la respuesta o de la célula tumoral entera, por ejemplo, mediante trasfección del gen de GM-CSF (Granulocyte Monocyte Colony-Stimulatory Factor) en la célula tumoral o de moléculas coestimuladoras que favorezcan la presentación antigénica.
Vacunas de células enteras
Las vacunas de células completas pueden ser especialmente útiles cuando no se conocen los antígenos contra los que debe ir dirigida la respuesta. Para este tipo de vacunas pueden usarse células tumorales obtenidas del paciente, cultivadas y dañadas de forma irreversible (irradiadas o lisadas), para evitar su propagación cuando se reinfundan al paciente. En cambio, si no se dispone de tumor autólogo se pueden utilizar vacunas derivadas de cultivo de células multivalentes que se producen tras el procesado de varias líneas de células tumorales cultivadas in vitro, siendo por tanto vacunas de células no procedentes del paciente. Con la mezcla de varias cepas se intenta que alguno de los antígenos incluidos en la mezcla sea expresado por las células tumorales del paciente. La ventaja de estas vacunas es que no son necesarios la obtención y el cultivo de células tumorales del propio paciente. Sin embargo, su desventaja es que son vacunas poco eficaces, probablemente porque gran parte de la respuesta inmune se organice contra antígenos irrelevantes, es decir no presentes en el tumor del paciente. Por otra parte, la ventaja de las vacunas de células tumorales autólogas es que la mayor parte de los antígenos presentados, al provenir del propio paciente, son relevantes; sin embargo estas células no siempre son capaces de inducir una respuesta inmune. Por eso las técnicas de ADN recombinante pueden emplearse para alterar vacunas de células autólogas, con la finalidad de potenciar su inmunogenicidad. Por ejemplo se puede inducir en las células tumorales la producción de inmunomoduladores como IL-2, GM-CSF u otras citoquinas. Entonces, la combinación de antígenos tumorales específicos presentados como células vivas dañadas irreversiblemente con niveles localmente elevados de inmunomoduladores, puede potenciar notablemente la respuesta inmune de las células inmunocompetentes que infiltran la zona de administración de la vacuna. La desventaja principal de este tipo de vacunas es la dificultad de obtener un número suficiente de células malignas, que sólo suele ser posible alcanzar cuando el tumor está muy extendido. Además el procesamiento del tumor resulta muy laborioso y costoso, mientras la presencia de antígenos propios que no se expresan sólo en las células tumorales puede dar lugar a procesos autoinmunes. El objetivo con este tipo de vacunas es aumentar la eficacia disminuyendo los posibles efectos secundarios.
Hasta el momento, la mayor parte de los ensayos clínicos con este tipo de vacunas celulares se ha llevado a cabo en tumores no hematológicos, pero también se han obtenido importantes resultados en un modelo murino de linfoma, donde se ha conseguido erradicar tumores establecidos36 utilizando una vacuna de células tumorales irradiadas y trasfectadas con el gen de GM-CSF. Para hacer esta estrategia más fácil, otros grupos utilizan una línea celular (K562) que produce GM-CSF para administrarla conjuntamente con la célula tumoral autóloga irradiada. El uso de esta línea evitaría tener que trasfectar las células de cada paciente37. Este tipo de vacunas se está ya estudiando en pacientes con mieloma múltiple y leucemia mieloide aguda38.
Vacunas proteicas
Los avances en la identificación de los antígenos expresados en las células tumorales han hecho posible el desarrollo de otras vacunas dirigidas específicamente contra estos antígenos tumorales. En este sentido es importante distinguir entre antígenos asociados a tumores (AATs), que se localizan en células tumorales y también en algunas células normales y antígenos específicos de tumor (AETs), que son específicos de células tumorales. Estos AETs son obviamente la diana de elección para las estrategias de inmunoterapia diseñadas para destruir las células tumorales sin dañar células normales.
Actualmente podemos decir que la Ig sintetizada y expresada en células B tumorales es el único AET que se conoce completamente. Por tanto los síndromes linfoproliferativos B representan el tumor ideal para el desarrollo de vacunas proteicas. La Ig contiene el idiotipo (Id), es decir el conjunto de determinantes antigénicos denominados idiotopos localizados en las regiones variables de las cadenas pesada y ligera. Por tanto, se comporta como un anticuerpo monoclonal que, debido a su naturaleza autóloga, ha fallado en la estimulación del sistema inmunitario del paciente para activarlo contra el clon tumoral que lo produce. Mediante vacunas que incluyan en su formulación dicho Id, denominadas vacunas idiotípicas, se puede inducir una respuesta inmune frente a esta región que destruya las células B tumorales que llevan la Ig que lo contiene quedando intactas las células B normales.
Los dos principales pasos en la estrategia que conduce a la producción de vacunas idiotípicas son en primer lugar obtener el AET, es decir el Id y después transformarlo en un inmunógeno suficientemente potente para ser usado con intención terapéutica.
Los primeros esfuerzos para explotar en una situación preclínica el Id tumor-específico como antígeno diana fueron llevados a cabo en 1972 en el mieloma múltiple39 y en 1974 para linfomas40. La facilidad y posibilidad de producción de la vacuna parece depender del tipo de tumor de células B del que se trate. Hasta el momento, el linfoma folicular parece ser la diana principal de este tipo de tratamiento. A diferencia del mieloma múltiple, donde la obtención del Id es fácil puesto que el antígeno tumoral circula en el torrente sanguíneo41-46, en los linfomas el proceso es complicado, ya que la Ig que contiene el Id no es secretada por las células tumorales y por tanto tiene que ser aislada directamente desde el tejido tumoral que constituye su limitada y única fuente original. Sin embargo, en el mieloma múltiple el estudio de esta aproximación terapéutica se complica puesto que los pacientes frecuentemente presentan una situación clínica grave que hace necesaria la aplicación de tratamientos convencionales, mientras que la buena situación clínica que típicamente caracteriza a los pacientes con linfoma folicular hace de esta enfermedad el terreno más fácil para el desarrollo clínico de vacunas idiotípicas47,48. Además, comparado con las leucemias linfoide crónica o linfoblástica aguda de células B, que generalmente presentan clones o subclones carentes de positividad para Ig en el inmunofenotipo, casi todos los linfomas foliculares presentan el antígeno específico de tumor en la superficie de sus células49. También es importante destacar que el linfoma folicular, aunque es sustancialmente incurable, se caracteriza por su larga supervivencia media independientemente del tratamiento elegido50. Este hecho puede ser considerado como un arma de doble filo: por una parte nos permite tener mucho tiempo para la larga y costosa labor de producir una vacuna específica de tumor y de paciente, pero por otra parte se necesita un largo período de seguimiento para que se puedan obtener desde un punto de vista clínico conclusiones definitivas sobre su eficacia51.
La producción de la proteína soluble para la vacuna idiotípica se ha basado durante mucho tiempo en una técnica de hibridoma (Fig. 3) que permite la generación in vitro exactamente del mismo Id tumor específico que contiene la Ig que se expone en el clon de células tumorales52.
La suspensión de células individuales que se obtiene de una muestra de ganglio linfático que, por definición, contiene una población residual de linfocitos B normales que contamina la pureza del clon de células tumorales, se fusiona con una línea celular procedente de un heterohibridoma murino/humano (la célula K6H6/B5) de forma que el hibridoma resultante es capaz de secretar al medio la inmunoglobulina que expresa en su membrana. De todos los hibridomas obtenidos, se selecciona el que produce la misma inmunoglobulina del clon tumoral mediante secuenciación y alineación perfecta de una huella molecular única para cada Ig, la Complementarity-Determining Region 3 (CDR3) de su cadena pesada53. Una vez seleccionado, el hibridoma se cultiva a gran escala hasta obtener el sobrenadante del cultivo necesario para purificar la cantidad deseada del Id tumoral. Después este Id necesita ser transformado en un inmunógeno más potente de lo que típicamente está en su forma natural. Con este objetivo en mente, puede ser conjugado con Keyhole Limpet Hemocyanin54 (KLH), que es un transportador altamente inmunogénico, o utilizado para pulsar células dendríticas autólogas55, dando lugar a distintas formulaciones de vacunas que actualmente se están probando en distintos ensayos.
El primer informe sobre un ensayo clínico fase I con vacunas idiotípicas en linfoma folicular humano fue publicado hace más de 10 años. En 1992 Kwak y col utilizaron una vacuna en la que el Id se conjugó con KLH como transportador inmunológico para el Id y se administró con Syntex adjuvant formulation-1 (SAF-1 ) como adyuvante inmunológico56. Demostraron que en siete de nueve pacientes con linfoma folicular en situación de respuesta completa o con evidencia de enfermedad persistente después de la quimioterapia la vacuna idiotípica fue capaz de inducir una respuesta inmune específica en términos de respuesta humoral frente al mismo Id57. Este trabajo proporcionó la primera prueba formal de que los humanos pueden ser inmunizados contra un antígeno derivado de su propio tumor y de sus exitosos resultados, se han derivado una serie notable de ensayos clínicos fase II. En primer lugar, el número de pacientes incluidos en el mismo estudio se amplió y posteriormente, en 1997, Hsu y col informaron el seguimiento a largo plazo de 41 pacientes tratados con la misma formulación de vacuna idiotípica50. Como se esperaba, en todos los 41 pacientes vacunados se indujo una respuesta inmune específica frente a KLH. Mucho más destacable, 20 de ellos también mostraron una respuesta inmune humoral o en términos de proliferación celular específica frente al Id. Desde un punto de vista clínico, en la mayoría de los pacientes que habían sido inmunizados en situación de respuesta completa y que desarrollaron una respuesta inmune específica del tumor se obtuvieron largas supervivencias libres de enfermedad, mientras que en la mayoría de los que fallaron en el desarrollo de una respuesta específica contra el Id, aunque también hubieran sido vacunados en respuesta completa, no. Además, los pocos casos de regresiones tumorales registradas en pacientes que tenían evidencia de enfermedad en el momento de la inmunización parecen depender de la inducción por la vacuna de una respuesta inmune específica frente al Id. La comparación de los resultados de los pacientes que responden inmunológicamente con los que no responden, demuestra diferencias estadísticamente significativas en términos de supervivencia global y tiempo libre de progresión en los pacientes vacunados en primera respuesta completa. Lo mismo podría ser mostrado, aunque de forma menos llamativa, en cuanto al tiempo libre de progresión entre pacientes vacunados sin evidencia de enfermedad y aquellos que habían sido inmunizados con enfermedad evidente. Globalmente estos resultados sugieren que las estrategias de inmunoterapia basadas en la vacunación idiotípica para el linfoma folicular humano puede resultar beneficioso para los pacientes que la reciben en respuesta completa.
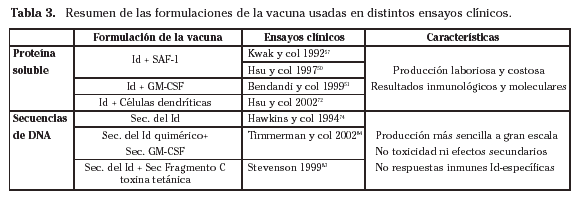
En un continuo intento para mejorar las vacunas existentes, se ha probado la asociación de otros adyuvantes inmunológicos a la formulación de la vacuna (Tabla 3).
Entre el panel de citoquinas probados en modelos murinos para potenciar el efecto del Id-KLH, el GM-CSF ha demostrado ser el más eficaz58,59. El GM-CSF tiene un papel importante en la respuesta inmune, puesto que es mediador en el crecimiento, maduración, migración y presentación de antígenos por células dendríticas. En particular, se ha terminado recientemente un ensayo clínico fase II basado en los resultados de 39 pacientes incluidos51,60. Estos pacientes recibieron una quimioterapia estándar seguida, 6 meses después de lograr una respuesta completa continuada, de la vacuna idiotípica conjugada con KLH más GM-CSF. Entre los 25 pacientes que finalmente alcanzaron respuesta completa, 1 recayó dentro de los 6 meses y por lo tanto antes de administrarle la vacuna, mientras que 2 no fueron inmunizados por problemas técnicos en la producción de la vacuna. Los datos clínicos son todavía preliminares, pero ya es notable que, con un seguimiento de aproximadamente 3-6 años, 19 de 22 pacientes inmunizados mantenían su primera respuesta completa. La respuesta inmune celular y humoral inducida por la vacuna ha sido documentada in vitro en 19/22 y en 16/22 pacientes, respectivamente. Además, todas estas respuestas fueron específicas frente al tumor y al Id. El hallazgo más notable de este estudio es la demostración formal en 9 de 12 pacientes evaluables de remisiones moleculares mantenidas inducidas por la vacuna, determinadas por la monitorización de t14,18 y reordenamiento bcl-2 mediante PCR. Como consecuencia de estos resultados, se comenzó en el NCI un ensayo clínico fase III aleatorizado en pacientes con linfoma folicular a los que se vacuna con Id-KLH + GM-CSF o con KLH + GM-CSF, así como otro ensayo fase II en pacientes con linfoma del manto que reciben Id-KLH + GM-CSF después de quimioterapia + rituximab61.
Además de resultados en el tratamiento de linfoma folicular también se han publicado los obtenidos en otras neoplasias hematológicas como el mieloma múltiple usando formulaciones similares. En concreto, investigadores de la Universidad de Duke y del National Cancer Institute (NCI) han descrito las implicaciones biológicas de la vacuna idiotípica en pacientes con mieloma múltiple62: en este caso, se transfirieron al paciente células T efectoras obtenidas tras la vacunación del donante con el Id tumoral del paciente. Hay otros trabajos publicados que también avalan la utilidad de las vacunas idiotípicas en el tratamiento del mieloma múltiple. Entre ellos destacan Kwak y col63 que inmunizaron al donante con la Ig de los pacientes afectos de mieloma múltiple conjugada con KLH y posteriormente extrajeron las células para el transplante alogénico de progenitores hematopoyéticos y Cabrera y col64, que emplearon con éxito una metodología similar en el contexto de la infusión de linfocitos del donante.
En todos los ensayos mencionados sobre el Id de linfoma, el antígeno tumoral necesario para la vacuna (bien administrado como proteína soluble o bien utilizado para pulsar células dendríticas) se prepara mediante la técnica de los hibridomas. Sin embargo, esta técnica es muy laboriosa y costosa y requiere unos 6 meses para completar el procedimiento. Además la producción de la vacuna falla en el 15-20% de los casos. Actualmente se ha presentado un método alternativo para producir el mismo Id posiblemente a mayor escala. Este método se basa en técnicas de biología molecular y en particular, en un proceso que consiste en tres pasos fundamentales: amplificación mediante PCR de la secuencia del Id; clonaje de dicha secuencia en vectores y finalmente trasfección del vector que contiene la secuencia del Id en células de mamíferos. Estas células de mamíferos podrían representar una fuente adecuada y estable de la Ig que contiene el Id tumor y paciente-específico. El Id así producido puede utilizarse para preparar vacunas proteicas o para pulsar células dendríticas, tal como el producido por hibridomas.
En un reciente estudio fase I/II se ha mostrado la seguridad del uso de una vacuna de Id recombinarte conjugado a KLH + GM-CSF (GTOP 99); además su inmunogenicidad fue similar a la producida por el Id obtenido por la técnica de los hibridomas65. Es importante señalar que los anticuerpos y las células T que reaccionan con el Id recombinante también son capaces de reaccionar con el Id obtenido por la técnica de los hibridomas. Actualmente esta vacuna está siendo evaluada en un estudio aleatorizado fase III en pacientes con linfoma folicular y en uno fase II en linfomas agresivos66.
La proteína idiotípica recombinante también puede ser producida en células de insecto sf19 usando como vector un baculovirus. En un reciente ensayo, el uso de rId obtenido de sf19 conjugado con KLH y administrado con GM-CSF ha demostrado ser seguro e inmunogénico67. Esta vacuna se usó en pacientes con linfoma folicular en recaída y se alcanzaron respuestas parciales o menores en 5 de 7 pacientes. Actualmente se están probando otros sistemas para la obtención del Id recombinante68,69 y pronto se conocerán los resultados de estos ensayos.
Vacunas de células dendríticas
Otra posibilidad para intentar mejorar la eficacia de las vacunas idiotípicas es el uso de células dendríticas. El papel crítico de estas células en el inicio de la respuesta inmune las hace muy atractivas para su uso en estrategias terapéuticas contra el cáncer. Las células dendríticas son células centinelas en la periferia del sistema inmunitario que facilitan la llegada de los antígenos a los órganos linfoides secundarios. El transporte de los antígenos por células dendríticas es clave en el inicio de la respuesta inmune y además un pequeño número de células dendríticas es suficiente para inducir una potente respuesta inmune in vivo. Estas células especializadas en la presentación de antígenos, pueden inducir la generación y la proliferación de Cytotoxic T lymphocytes (CTL) y de células T helper presentando el antígeno por la vía MHC-I o MHC-II respectivamente, así como modular el crecimiento y diferenciación de células B y, por tanto estar implicadas en la respuesta humoral.
Por ello, se produjo un gran avance en el campo de la inmunoterapia activa al descubrir la posibilidad de cultivar grandes cantidades de células dendríticas a partir de precursores monocitarios en presencia de GM-CSF e IL-455,70. El primer ensayo publicado sobre el uso de estas células empleó células dendríticas autólogas pulsadas con el Id en cuatro pacientes con linfoma folicular y demostró tanto la inducción de linfocitos T reactivos frente al tumor como la eficacia clínica del procedimiento, aunque no se acompañaba de una activación simultánea del brazo humoral de la respuesta inmune71. Estos resultados preliminares se actualizaron en 2002, incluyendo un total de 35 pacientes: la respuesta inmune celular se documentó en 8/10 pacientes (80%) tratados después de recaídas y en 8/16 pacientes (50%) inmunizados en la primera respuesta completa72. En 2 de estos últimos 8 pacientes (25%) también se logró una remisión molecular inducida por la vacuna. Estos resultados parecen proporcionar confirmación indirecta de que las células dendríticas autólogas pulsadas con el Id son capaces de presentar determinantes antigénicos del Id asociados con moléculas HLA de su superficie para inducir una respuesta inmune tumor-específica mediada por células T. Al mismo tiempo los datos presentados contemplan la posibilidad de que la vacuna idiotípica induzca un efecto sinérgico mediante la administración secuencial de células dendríticas pulsadas con el Id e Id en forma de proteína soluble para intentar estimular ambos brazos de la respuesta inmune. En 3 de los 5 pacientes que han sido tratados así se ha descrito el desarrollo de respuesta inmune humoral y celular Id-específica. Más recientemente, se han informado un pequeño número de regresiones macroscópicas en algunos pacientes con linfoma folicular en progresión que han sido inmunizados con el Id en forma de proteína soluble conjugado con KLH + SAF-1 en individuos que previamente habían recaído (o nunca habían respondido) a células dendríticas pulsadas con el Id conjugado con KLH73.
Vacunas de ADN
Una alternativa a las vacunas ya mencionadas es el uso de las llamadas vacunas de ADN desnudo74,75. El primer paso para llegar a este tipo de vacunas fue el descubrimiento de que plásmidos de ADN que contenían el gen que codificaba la b-galactosidasa, cuando se inyectan de forma intramuscular, generan la producción del enzima. Posteriormente Ulmer y col encontraron que el ADN que codifica una nucleoproteína de un influenza virus induce una respuesta humoral y celular que protege de la infección por el virus76. Las vacunas de ADN desnudo son uno de los tipos más recientes de vacunas, que consisten en un ADN bacteriano circular en el que se insertan determinados genes que codifican la proteína tumoral. EL ADN bacteriano contiene secuencias inmunoestimuladoras que no están presentes en células de mamíferos y que son capaces de activar el sistema inmune innato por liberación de IFN-g, IFN-a, IL-12 e IL-18; además dirigen la respuesta inmune hacia un patrón Th177,78. El ADN plasmídico tiene pues dos componentes: una unidad transcripcional dirigida por un potente promotor y capaz de inducir la síntesis del antígeno tumoral y una secuencia inmunoestimuladora que estimula la respuesta inmune. Cuando este tipo de vacunas es inyectado de forma intramuscular o subcutánea, se trasfectan las células del huésped (generalmente células musculares, queratinocitos o fibroblastos), creando una zona de expresión ectópica de la proteína. La proteína liberada por la célula diana es captada por las células presentadoras locales (que en ocasiones pueden trasfectarse) y después de ser adecuadamente procesada se presenta al sistema inmune en los órganos linfoides secundarios79. Sin embargo, las vacunas así producidas tienen un bajo potencial inmunogénico y por eso se está considerando la posibilidad de introducir en el plásmido información genética que codifique para inmunomoduladores o citoquinas que aumenten la inmunidad natural frente al tumor al ser liberadas continuamente por las células trasfectadas.
Aunque las secuencias de ADN indudablemente ofrecen ventajas potenciales, particularmente porque la producción de vacunas es más fácil, éste es el tipo de vacuna en el que se tiene menos experiencia. Aunque los estudios en animales han demostrado que las vacunas de ADN pueden inducir una respuesta humoral efectiva frente a antígenos víricos, bacterianos y tumorales80,81 se cree que una de las principales dificultades puede ser la de mantener la expresión tisular de la proteína codificada por el plásmido a lo largo del tiempo. En particular, el problema puede no ser importante para la producción de antígenos tumorales, pero sí lo es para la producción continuada de citoquinas e inmunomoduladores.
En el caso de los tumores de células B, como ya hemos dicho el Id de la Ig es claramente un antígeno específico de tumor. Los genes que codifican la Ig derivan de la recombinación de los segmentos génicos V, D, J. En el clon tumoral se conserva la región V (variable) y por lo tanto el Id es una diana ideal para la inmunoterapia.
Con el avance de las técnicas de biología molecular, actualmente resulta fácil obtener los genes VH y VL que codifican para el Id a partir de células de biopsias tumorales tras reacciones de PCR, clonaje y secuenciación. Estos genes pueden ensamblarse con un péptido de unión de 15 aminoácidos para constituir la molécula final denominada scFv que, tras insertarse en un plásmido con un adecuado promotor constituyen la vacuna. Desgraciadamente las vacunas así producidas sólo son capaces de inducir niveles muy bajos de anticuerpos anti-Id que no son suficientes para proteger del tumor. Se han obtenido resultados similares cuando se usan los genes que codifican la Ig completa en vez del scFv (single chain fragment variable). Por ello, se hace necesaria la búsqueda de estrategias que aumenten la eficacia de este tipo de vacunas. En este sentido, los modelos preclínicos están demostrando que la potencia de la vacuna puede aumentar por medio de la adición al vector de otra secuencia de ADN que codifica para adyuvantes inmunológicos como GM-CSF o para potentes inmunógenos como el fragmento C de la toxina tetánica82.
A pesar de todas las dificultades, en los últimos años se ha acumulado una considerable cantidad de datos preclínicos sobre vacunas idiotípicas de ADN que proporcionan un sólido impulso hacia su aplicación clínica. Hasta el momento hay dos ensayos con este tipo de vacunas: uno en fase I y otro en fase I/II diseñados para probar seguridad y viabilidad. En el primero, 7 pacientes con linfoma no Hodgkin en situación terminal fueron vacunados con scFv-FrC (scFv fusionado con el fragmento C de la toxina tetánica), pero en ninguno se consiguió una respuesta inmune específica frente al Id83. En el segundo ensayo 12 pacientes fueron vacunados con un plásmido que codificaba para una Ig quimérica cuyas regiones variables eran específicas de la Ig tumoral. En ninguno de los pacientes se observaron efectos secundarios ni toxicidad, pero tampoco se observó respuesta humoral o celular frente al Id84. Podrían llegar resultados más interesantes de un ensayo clínico comenzado recientemente que ha sido diseñado para incluir a 30 pacientes con linfoma. Estos pacientes reciben tras la primera respuesta completa la vacuna con dosis crecientes de 0,5 a 2,4 mg ADN que codifica para el scFv de cada paciente, fusionado con una secuencia de cDNA (DNA complementario al RNA mensajero) de un fragmento de la toxina tetánica dentro del mismo vector83. El principal objetivo de este estudio es la detección de una respuesta inmune humoral y celular contra el fragmento C y contra la proteína idiotípica específica del tumor de cada paciente, junto con la confirmación de la ausencia real de toxicidad ya observada en el ensayo previo.
De todo esto se puede concluir que las vacunas de ADN son una alternativa prometedora en un futuro más o menos cercano, pero todavía queda por determinar cuál es el vector más adecuado, cuál es la dosis que hay que utilizar, cuál es la mejor forma de potenciar la vacuna y cuál es la mejor vía de administración.
CONCLUSIONES
En la actualidad, las vacunas contra el cáncer se conciben como una herramienta terapéutica, en contraste con las vacunas profilácticas que previenen de algunas enfermedades infecciosas. Además, las vacunas idiotípicas han empezado a tener resultados clínicos tangibles. Sólo hace diez años ni siquiera se sabía si los pacientes podían ser inmunizados contra sus propios antígenos tumorales y ahora ya se están realizando de manera independiente varios ensayos clínicos basados en este hallazgo. La rapidez de este desarrollo fomenta la esperanza de que la inmunoterapia activa pueda llegar a ser decisiva en oncología. Hasta el momento, ya se han logrado importantes resultados: la evidencia de respuestas humorales y celulares tumor-específicas inducidas por las vacunas y las primeras remisiones moleculares documentadas tras la vacunación. Sin embargo quedan preguntas cruciales por responder: ¿curan hoy las vacunas?, ¿cuál es la formulación más eficaz de la vacuna?, ¿hace falta administrar dosis de recuerdo de la vacuna a lo largo del tiempo?, ¿es posible disminuir la carga de trabajo que implica la producción de una vacuna eficaz?, ¿es posible predecir qué candidatos desarrollarán con mayor probabilidad una respuesta inmune específica frente al antígeno tumoral? Todas estas cuestiones nos proporcionan una inagotable fuente de investigación para los próximos años.
Actualmente, en el campo de la inmunoterapia en cáncer, en la Clínica Universitaria de Navarra se está llevando a cabo un protocolo de vacunación con el Id conjugado con KLH más GM-CSF tras quimioterapia estándar en pacientes con linfoma folicular en primera recaída. Además se está a punto de comenzar un ensayo clínico en pacientes con mieloma que consistirá en vacunación idiotípica (Id-KLH+GM-CSF) de donante y posteriormente, tras transplante alogénico de progenitores hematopoyéticos con acondicionamiento no mieloablativo, vacunación idiotípica del paciente con la misma formulación de la vacuna. Simultáneamente, se está llevando a cabo una investigación pre-clínica en modelos murinos para determinar cuál de las estrategias de vacunas diseñadas es la más eficaz en la generación de una respuesta inmunológica eficaz dirigida contra los antígenos tumorales. De esta investigación se pretende sacar conclusiones que nos permitan mejorar las estrategias actualmente disponibles para el tratamiento de enfermedades neoplásicas.
AGRADECIMIENTOS
Las investigaciones que actualmente se llevan a cabo en el Área de terapia Celular sobre inmunoterapia activa en neoplasias hematológicas, están financiadas por el Departamento de Educación y Cultura y el Departamento de Salud del Gobierno de Navarra, por el Instituto de Salud Carlos III (RTIC cáncer C03/10), por el Ministerio de Ciencia y Tecnología (SAF 2002) y por la Leukemia and Lymphoma Society (Maurizio Bendandi es un Scholar in Clinical Research).
BIBLIOGRAFÍA
1. Sotomayor EM. Immunotherapy of hematologic malignancies: the road to the future. Cancer control 2002; 9:97-98. [ Links ]
2. Rayner AA, Grimm EA, Lotze MT, Chu EW, Rosenberg SA. Lymphokine-activated killer (LAK) cells. Analysis of factors relevant to the immunotherapy of human cancer. Cancer 1985; 55: 1327-1333. [ Links ]
3. Mule JJ, Shu S, Schwarz SL, Rosenberg SA. Adoptive immunotherapy of established pulmonary metastases with LAK cells and recombinant interleukin-2. Science 1984; 225: 1487-1489. [ Links ]
4. Lafreniere R, Rosenberg SA. Adoptive immunotherapy of murine hepatic metastases with lymphokine activated killer (LAK) cells and recombinant interleukin 2 (RIL 2) can mediate the regression of bothi immunogenic and nonimmunogenic sarcomas and an adenocarcinoma. J Immunol 1985 ; 135: 4273-4280. [ Links ]
5. Rosenberg SA, Lotze MT, Muul LM, Leitman S, Chang AE, Ettinghausen SE et al. Observations on the systemic administration of autologous lymphokine-activated killer cells and recombinant interleukin-2 to patients with metastatic cancer. N Engl J Med 1985; 313: 1485-1492. [ Links ]
6. Rosenberg SA. Adoptive immunotherapy of cancer using lymphokine activated killer cells and recombinant interleukin-2. Important Adv Oncol 1986; 1: 55-91. [ Links ]
7. Rosenberg SA, Spiess P, Lafreniere R. A new approach to the adoptive immunotherapy of cancer with tumor-infiltrating lymphocytes. Science 1986; 233: 1318-1321. [ Links ]
8. Fisher B, Packard BS, Read EJ, Carrasquillo JA, Carter CS, Topalian SL et al.Tumor localization of adoptively transferred indium-111 labeled tumor infiltrating lymphocytes patients with metastatic melanoma. J Clin Oncol 1989; 7: 250-261. [ Links ]
9. Gold JE, Osband ME, Krane RJ. Adoptive cellular therapy of urological neoplastic disease. Cancer Treat Rev 1994; 20: 173-190. [ Links ]
10. Kawakami Y, Rosenberg SA, Lotze MT. Interleukin 4 promotes the growth of tumor-infiltrating lymphocytes cytotoxic for human autologous melanoma. J Exp Med 1988; 168: 2183-2191. [ Links ]
11. Rosenberg SA, Yannelli JR, Yang JC, Topalian SL, Schwartzentruber DJ, Weber JS et al. Treatment of patients with metastatic melanoma with autologous tumor-infiltrating lymphocytes and interleukin 2. J Natl Cancer Inst 1994; 86: 1159-1166. [ Links ]
12. Topalian SL, Solomon D, Avis FP, Chang AE, Freerksen DL, Linehan WM et al. Immunotherapy of patients with advanced cancer using tumor-infiltrating lymphocytes and recombinant interleukin-2: a pilot study. J Clin Oncol 1988; 6: 839-853. [ Links ]
13. Dillman RO, Oldham RK, Barth NM, Cohen RJ, Minor DR, Birch R et al. Continuous interleukin-2 and tumor-infiltrating lymphocytes as treatment of advanced melanoma. A national biotherapy study group trial. Cancer 1991; 68: 1-8. [ Links ]
14. Arienti F, Belli F, Rivoltini L, Gambacorti-Passerini C, Furlan L, Mascheroni L et al. Adoptive immunotherapy of advanced melanoma patients with interleukin-2 (IL-2) and tumor-infiltrating lymphocytes selected in vitro with low doses of IL-2. Cancer Immunol Immunother 1993; 36: 315-322. [ Links ]
15. Schwartzentruber DJ, Hom SS, Dadmarz R, White DE, Yannelli JR, Steinberg SM et al. In vitro predictors of therapeutic response in melanoma patients receiving tumor-infiltrating lymphocytes and interleukin-2. J Clin Oncol 1994; 12: 1475-1483. [ Links ]
16. Aoki Y, Takakuwa K, Kodama S, Tanaka K, Takahashi M, Tokunaga A et al. Use of adoptive transfer of tumor-infiltrating lymphocytes alone or in combination with cisplatin-containing chemotherapy in patients with epithelial ovarian cancer. Cancer Res 1991; 51: 1934-1939. [ Links ]
17. Belldegrun A, Pierce W, Kaboo R, Tso CL, Shau H, Turcillo P et al. Interferon-alpha primed tumor-infiltrating lymphocytes combined with interleukin-2 and interferon-alpha as therapy for metastatic renal cell carcinoma. J Urol 1993; 150: 1384-1390. [ Links ]
18. Bukowski RM, Sharfman W, Murthy S, Rayman P, Tubbs R, Alexander J et al. Clinical results and characterization of tumor-infiltrating lymphocytes with or without recombinant interleukin 2 in human metastatic renal cell carcinoma. Cancer Res 1991; 51: 4199-4205. [ Links ]
19. Kradin RL, Kurnick JT, Lazarus DS, Preffer FI, Dubinett SM, Pinto CE et al. Tumour-infiltrating lymphocytes and interleukin-2 in treatment of advanced cancer. Lancet 1989; 1: 577-580. [ Links ]
20. Laport GG, Levina BL, Stadrmauer EA, Schuster SJ, Luger SM, Grupp S et al. Adoptive transfer of costimulated T cells induces lymphocytosis in patients with relapsed/refractory non-Hodgkin lymphoma following CD34+-selected hematopoietic cell transplantation. Blood 2003; 102: 2004-2013. [ Links ]
21. McLaughlin P, Grillo-López AJ, Link BK, Levy R, Czuczman MS, Williams ME et al. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four-dose treatment program. J Clin Oncol 1998; 16: 2825-2833. [ Links ]
22. Coiffier B, Haioun C, Ketterer N, Engert A, Tilly H, Ma D et al. Rituximab (anti-CD20 monoclonal antibody) for the treatment of patients with relapsing or refractory aggressive lymphoma: a multicenter phase II study. Blood 1998; 92: 1927-1932. [ Links ]
23. Milpied N, Vasseur B, Parquet N, Garnier JL, Antoine C, Quartier P et al. Humanized anti-CD20 monoclonal antibody (Rituximab) in post transplant B-lymphoproliferative disorder: a retrospective analysis on 32 patients. Ann Oncol 2000; 11 (Suppl 1): 113-116. [ Links ]
24. Treon SP, Kelliher A, Keele B, Frankel S, Emmanouilies C, Kimby E et al. Expression of serotherapy target antigens in Waldenstrom`s macroglobulinemia: Therapeutic applications and considerations. Semin Oncol 2003; 30: 248-252. [ Links ]
25. Horwitz SM, Tsai D, Twist C. Rituximab is effective therapy for post-transplant lymphoproliferative disorder not responding to reduction in immunosuppression: a prospective trial in adult and children. Proc Am Soc Clin Oncol 2001; 20: 284a. [ Links ]
26. Byrd JC, Murphy T, Howard RS, Lucas MS, Goodrich A, Park K et al. Rituximab using a thrice weekly dosing schedule in B-cell chronic leukemia and small lymphocytic lymphoma demonstrated clinical activity and acceptable toxicity. J Clin Oncol 2001; 19: 2153-2164. [ Links ]
27. O`Brien SM, Kantarjian H, Thomas DA, Giles FJ, Freireich EJ, Cortes J et al. Rituximab dose-escalation trial in chronic lymphocytic leukemia. J Clin Oncol 2001; 19: 2165-2170. [ Links ]
28. Buckstein R, Imrie K, Spaner D, Mangel J, Tompkins K, Crump M et al. Autologous stem cell transplants combined with rituximab for relapsed follicular lymphoma achieve rolonged clinical and molecular remissions. Blood 2001; 98: 680a. [ Links ]
29. Flinn IW, Jones RJ, Goodrich A, Carter-Brookins DC, Moss TJ. Rituximab during autologous stem cell transplantation for lymphoma produces lymphoma free grafts in most patients by PCR and clonogenics assays. Blood 2001; 98: 676a. [ Links ]
30. Timmerman JM. Immunotherapy for lymphomas. Int J Hematol 2003; 77: 444-455. [ Links ]
31. Loffler A, Kufer P, Lutterbuse R, Zettl F, Daniel PT, Schwenkenbecher JM et al. A recombinant bispecific single-chain antibody, CD19 x CD3, induces rapid and high lymphoma-directed cytoxicity by unestimulated T lymphocytes. Blood 2000; 9: 2098-2103. [ Links ]
32. Bohlen H, Manzke O, Patel B, Moldenhauer G, Dorken B, Von Fliedner et al. Cytolisis of leukemic B-cells by T-cells activated via two bispecific antibodies. Cancer Res 1993; 53: 4310-4314. [ Links ]
33. Haagen IA, de Lau WB, Basts BJ, Geerars AJ, Clark MR, de Gast BC. Unprimed CD4+ and CD8+ T cells can be rapidly activated by CD3 x CD19 bispecific antibody to proliferate and become cytotoxic. Cancer Immunol Immunother 1994; 39: 391-396. [ Links ]
34. Bohlen H, Hopff T, Manzke O, Engert A, Kube D, Wickramanayade PD et al. Lysis of malignant B cells from patients with B-chronic lymphocytic leukemia by autologous T cells activated with CD3 x CD19 bispecific antibodies in combination with bivalent CD28 antibodies. Blood 1993; 82: 1803-1812. [ Links ]
35. De Gast GC, Van Houten AA, Haagen IA, Klein S, De Weger RA, Van Dijk A et al. Clinical experience with CD3 x CD19 bispecific antibodies in patients with B cell malignancies. J Hematother 1995; 4: 433-437. [ Links ]
36. Levitsky HI, Montgomery J, Ahmadzadeh M, Staveley-OCaroll K, Guarnieri F, Longo DL et al. Immunization with granulocyte-macrophage colony-stimulating factor-transduced, but not B7-1 transduced, lymphoma cells primes idiotype-specific T cells and generates potent systemic antitumor immunity. J Immunol 1996; 156: 3858-3865. [ Links ]
37. Borello I, Sotomayor EM, Cooke SK, Gu L, Levitsky HI. A universal granulocyte-macrophage colony-stimulating factor-producing bystander cell line for use in the formulation of autologous tumor cell-based vaccines. Hum Gene Ther 1999; 10: 1983-1991. [ Links ]
38. Borello IM, Sotomayor EM. Cancer vaccines for hematologic malignancies. Cancer control 2002; 100: 269-280. [ Links ]
39. Abbas AK, Lichtman AH, Pober JS. Cellular and Molecular Immunology (3rd Edition). Saunders, Philadelphia, USA, (1997). [ Links ]
40. Paul WE. Fundamental Immunology (4th Edition). Lippincott, Williams and Wilkins. Philadelphia, USA, (1999). [ Links ]
41. Lynch RG, Graff RJ, Sirisinha S, Simms ES, Eisen HN. Myeloma proteins as tumor-specific transplantation antigens. Proc Natl Acad Sci USA 1972; 69: 1540-1544. [ Links ]
42. Stevenson GT, Stevenson FK. Antibody to a molecularly-defined antigen confined to a tumor cell surface. Nature 1974; 254 : 714-716. [ Links ]
43. Boon T, Cerottini JC, Van den Eynde B, Van der Bruggen P, Van Pel A. Tumor antigens recognized by T lymphocytes. Ann Rev Immunol 1994; 12: 337-365. [ Links ]
44. Cheever MA, Disis ML, Bernhard H, Gralow JR, Hand SL, Huseby ES et al. Immunity to oncogenic proteins. Immunol Rev 1995; 145: 33-59. [ Links ]
45. Henderson RA, Finn OJ. Human tumor antigens are ready to fly. Adv Immunol 1996; 62: 217-256. [ Links ]
46. Syrengelas AD, Levy R. DNA vaccination against the idiotype of a murine B cell lymphoma: mechanism of tumor protection. J Immunol 1999; 162: 4790-4795. [ Links ]
47. Schultze JL, Nadler LM. T cell mediated immunotherapy for B cell lymphoma. J Mol Med 1999; 77: 322-331. [ Links ]
48. Raffeld M, Neckers L, Longo DL, Cossman J. Spontaneous alteration of idiotype in a monoclonal B-cell lymphoma. Escape from detection by anti-idiotype. N Engl J Med 1985; 312: 1653-1658. [ Links ]
49. Meeker T, Lowder J, Cleary ML. Emergence of idiotype variants during treatment of B-cell lymphoma with anti-idiotype antibodies. N Engl J Med 1985; 312: 1658-1665. [ Links ]
50. Hsu FJ, Caspar CB, Czerwinski D. Tumor –specific idiotype vaccines in the treatment of patients with B-cell lymphoma – long-term results of a clinical trial. Blood 1997: 89; 3129-3135. [ Links ]
51. Bendandi M, Gocke CD, Kobrin CB. Complete molecular remissions induced by patient-specific vaccination plus granulocyte-monocyte colony-stimulating factor against lymphoma. Nature Med 1999; 5: 1171-1177. [ Links ]
52. Carroll WL, Thielemans K, Dilley J, Levy R. Mouse x human heterohybridomas as fusion partners with human B cell tumors. J Immunol Methods 1986; 89: 61-72. [ Links ]
53. Kobrin CB, Kwak LW. Development of vaccine strategies for the treatment of B-cell malignancies. Cancer Invest 1997; 15: 577-587. [ Links ]
54. Kaminski MS, Kitamura K, Maloney DG, Levy R. Idiotype vaccination against murine B cell lymphoma. Inhibition of tumor immunity by free idiotype protein. J Immunol 1987; 138: 1289-1296. [ Links ]
55. Sallusto F, Lanzavecchia A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med 1994; 179: 1109-1118. [ Links ]
56. Allison AC, Byars NE. An adjuvant formulation that selectively elicits the formation of antibodies of protective isotypes and of cell-mediated immunity. J Immunol Meth 1986; 95: 157-68. [ Links ]
57. Kwak LW, Campbell MJ, Czerwinski DK, Hart S, Miller RA, Levy R. Induction of immune responses in patients with B-cell lymphoma against the surface-immunoglobulin idiotype expressed by their tumors. N Engl J Med 1992; 327: 1209-1215. [ Links ]
58. Kwak LW, Young Ha, Pennington RW, Weeks SD. Vaccination with syngenic lymphoma-derived immunoglobulin idiotype combined with granulocyte/macrophage colony-stimulating factor primes mice for a protective T-cell response. Proc Natl Acad Sci 1996; 93: 10972-10997. [ Links ]
59. Disis ML, Bernhard H, Shiota FM, Hand SL, Gralow JR, Huseby ES et al. Granulocyte-macrophage colony-stimulating factor: an effective adjuvant for protein and peptide-based vaccines. Blood 1996; 88: 202-210. [ Links ]
60. Bendandi M, Kwak LW. Translational development of patient-specific vaccination for follicular lymphoma. Haematologica 1999; 84: S70-72. [ Links ]
61. Wilson WH, Neelapu S, White T. Idiotype vaccine following EPOCH-Rituximab treatment in untreated mantle cell lymphoma. Blood 2000; 100: 162a. [ Links ]
62. Li Y, Bendandi M, Deng Y, Dunbar C, Munshi N, Jagannath S et al. Tumor-specific recognition of human myeloma cells by idiotype-induced CD8(+) T cells. Blood 2000; 96: 2828-2833. [ Links ]
63. Kwak LW, Taub DD, Duffey PL, Bensinger WI, Bryant EM, Reynolds CW et al. Transfer of myeloma idiotype-specific immunity from an actively immunised marrow donor. Lancet 1995; 345:1016-1020. [ Links ]
64. Cabrera R, Diaz-Espada F, Barrios Y, Briz M, Fores R, Barbolla L, Sanjuan I et al. Infusion of lymphocytes obtained from a donor immunised with the paraprotein idiotype as a treatment in a relapsed myeloma. Bone Marrow Transplant 2000; 25:1105-1108. [ Links ]
65. Timmerman JM, Czerwinski D, Van Beckhoven A, Vose J, Ingolia D, Kunkel L et al. A phase I/II trial to evaluate the immunogenicity of recombinant idiotype protein vaccine for the treatment of non-Hodgkins lymphoma (NHL). Blood 2000; 96: 578a. [ Links ]
66. Timmerman JM, Vose J, Kunkel L, Bierman P, Czerwinski D, Hohenstein H et al. A phase 2 study demonstrating recombinant idiotype vaccine elicits specific anti-idiotype immune responses in aggressive non-Hodgkins lymphoma. Blood 2001; 98: 341a. abstract 1440. [ Links ]
67. Redfern C, Guthrie TH, Smith MR, Adler M, Holman P, Leonard JP et al. A phase I trial of FavId (Id-KLH) for relapsed indolent non-Hodgkins lymphoma. Blood 2002; 100: 357a. Abstract 1383. [ Links ]
68. McCormick AA, Kumagai MH, Hanley K, Turpen TH, Hakim I, Grill LK et al. Rapid production of specific vaccines for lymphoma by expression of the tumor-derived single-chain Fv epitopes in tobacco plants. Proc Natl Acad Sci USA 1999; 96: 703-708. [ Links ]
69. Reddy SA, Czerwinski D, Rajapaksa R, Reinl S, Garger SJ, Cameron T et al. Plant derived single-chain Fv idiotype vaccines are safe and immunogenic in patients with follicular lymphoma: results of a phase I study. Blood 2002; 100: 163a. Abstract 609. [ Links ]
70. Timmerman JM, Czerwinski DK, Van Beckhoven A, Vose J, Ingolia D, Kunkel L et al. A Phase I/II trial to evaluate the immunogenicity of recombinant idiotype protein vaccines for the treatment of non-Hodgkins lymphoma (NHL). Proceedings of the 42 nd Annual Meeting of the American Society of Hematology. San Francisco, USA, Abstract 2481 (2000). [ Links ]
71. De Gruijl TD, Curiel DT. Cancer vaccine strategies get bigger and better. Nature Med 1999; 5: 1124-1125. [ Links ]
72. Timmerman JM, Czerwinski DK, Davis TA, Hsu FJ, Benike C, Hao ZM et al. Idiotype-pulsed dentritic cell vaccination for B-cell lymphoma: clinical and immune responses in 35 patients. Blood 2002; 99: 1517-1526. [ Links ]
73. Timmerman JM, Hsu FJ, Davis TA, Liles MM, Czerwinski DK, Taidi B et al. Regressions of follicular lymphoma following vaccination with idiotype protein coupled to keyhole limpet hemocyanin (Id-KLH) and idiotype-pulsed dentitic cells. Blood 2000; 96 (Suppl 1), Abstract 2185. [ Links ]
74. Hawkins RE, Zhu D, Ovecka M, Winter G, Hamblin TJ, Long A et al. Idiotypic vaccination against human B-cell lymphoma. Rescue of variable region gene sequences from biopsy material for assembly as single-cahin Fv personal vaccines. Blood 1994; 83: 3279-3288. [ Links ]
75. Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A et al. Direct gene transfer into mouse muscle in vivo. Science 1990; 247: 1465-1468. [ Links ]
76. Ulmer JB, Donnelly JJ, Parker SE, Rhodes GH, Felgner PL, Dwarki VJ et al. Heterologous protection against influenza by injection of DNA encoding a viral protein. Science 1993; 259: 1745-1749. [ Links ]
77. Klinman DM, Yi AK, Beaucage SL, Conover J, Krieg AM. CpG motifs present in bacteria DNA rapidly induce lymphocytes to secrete interleukin 6, interleukin 12, and interferon gamma. Proc Natl Acad Sci U S A 1996; 93: 2879-2883. [ Links ]
78. Sato Y, Roman M, Tighe H, Lee D, Corr M, Nguyen MD et al. Immunostimulatory DNA sequences necessary for effective intradermal gene immunization. Science 1996; 273: 352-354. [ Links ]
79. Davis HL, Millan CL, Watkins SC. Immune-mediated destruction of transfected muscle fibers after direct gene transfer with antigen-expressing plasmid DNA. Gene Ther 1997; 4: 181-188. [ Links ]
80. McCluskie MJ, Brazolot Millan CL, Gramzinski RA, Robinson HL, Santoro JC et al. Route and methood of delivery of DNA vaccine influence immne responses in mice and non-human primates. Mol Med 1999; 5: 287-300. [ Links ]
81. Boyle CM, Robinson HL. Basic mechanism of DNA-raised anibody responses to intramuscular and gene gun immunizations. DNA Cell Biol 200; 19: 157-165. [ Links ]
82. King CA, Spellerberg MB, Zhu D, Rice J, Sahota SS, Thompsett AR et al. DNA vaccines with single-chain Fv fused to fragment C of tetanus toxin induce protective immunity against lymphoma and myeloma. Nature Med 1998; 4: 1281-1286. [ Links ]
83. Stevenson FK. Vaccine strategies in indolent lymphoma. En: Education Program Book. ASH, Washington, USA, 1999. [ Links ]
84. Timmerman JM, Singh G, Hermanson G, Hobart P, Czerwinski DK, Taidi B et al. Immunogenicity of a plasmid DNA vaccine encoding chimeric idiotype in patients with B-cell lymphoma. Cancer Res 2002; 62: 5845-58. [ Links ]