Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Enfermería Global
versión On-line ISSN 1695-6141
Enferm. glob. vol.15 no.41 Murcia ene. 2016
REVISIONES
Brote de Leishmaniasis en la Comunidad Autónoma de Madrid. Importancia de las medidas de prevención
Leishmaniasis's outbreak in the autonomous community of Madrid. Importance of the measures of prevention
Pérez Roldan, Francisca; Montilla Pérez, Manuel y Muñoz Lomas, Fernando
Enfermeros. Hospital de Fuenlabrada, Madrid. España. E-mail: paquiperez7@gmail.com
RESUMEN
Objetivo: Conocer el origen del brote de Leishmaniasis producido en 2009-2014 en la Comunidad Autónoma de Madrid (C.A.M.) y dar a conocer las pautas de prevención.
Metodología: Se realizó una revisión bibliográfica a través de varias bases de datos utilizando diferentes descriptores relacionados con el brote de Leishmaniasis en la C.A.M. acontecido entre 2009-2014.
Resultados: Se obtuvieron un total de 177 estudios sobre Leishmaniasis, de los cuales 29 estudios analizan aspectos relevantes sobre la Leishmaniasis. Los estudios afirman que la modificación por el ser humano de los grandes paisajes verdes y el avance en la construcción de nuevas autovías y redes de cercanías junto con las condiciones climáticas podrían haber sido relevantes para explicar el comportamiento espacial del brote, contribuyendo a la creación de un ecosistema favorable para la proliferación y estabilización de un nuevo ciclo urbano de Leishmaniasis. La única medida de prevención eficaz es actuar de forma adecuada para evitar la picadura del mosquito.
Conclusiones: Cabe destacar que para la creación de un nuevo ciclo urbano de Leishmaniasis podrían haber contribuido factores relevantes como el crecimiento poblacional, la presencia de grandes espacios verdes de reciente construcción periurbana y la construcción de extensas infraestructuras de ferrocarril y carreteras. Aunque se ha trabajado de forma activa y conjunta desde las Autoridades Sanitarias y han disminuido el número de casos, el problema no se ha erradicado, por tanto juega un papel muy importante la difusión y aplicación de las medidas preventivas, siendo esencial que la población conozca cómo debe actuar.
Palabras clave: Leishmaniasis, Brote Leishmaniasis Madrid, Flebótomos, Lagomorfos, Niños.
ABSTRACT
Aim: knowing the origin of the outbreak of Leishmaniasis occurred in 2009-2014 in the Autonomous Community of Madrid (CAM) and publicizes the patterns of disease prevention.
Methods: A literature review was performed using several databases using different descriptors related to the outbreak of Leishmaniasis in the CAM happened between 2009-2014.
Results: A total of 177 studies on Leishmaniasis, of which 29 studies analyze relevant aspects of Leishmaniasis were obtained. Studies claim that the modification by humans of the great green landscapes and progress in the construction of new highways and commuter networks along with weather conditions might have been relevant in explaining the spatial behavior of the outbreak, contributing to the creation of a favorable ecosystem for the growth and stabilization of a new urban cycle Leishmaniasis. The only effective preventive measure is to act adequately to prevent mosquito bites.
Conclusions: It is noteworthy that for the creation of a new urban cycle Leishmaniasis may have contributed relevant factors such as population growth, the presence of large green spaces peri recent construction and building extensive rail and road infrastructure . Although it has worked actively and jointly from the Health Authorities and have decreased the number of cases, the problem has not been eradicated, therefore it plays an important role the dissemination and implementation of preventive measures is essential that people know how to act.
Key words: Leishmaniasis, Leishmaniasis outbreak in Madrid, Diagnosi, Sandflies, Lagomorphs, Children.
Introducción
Las Leishmaniasis son un grupo de enfermedades causadas por parásitos del género Leishmania, que se transmiten al ser humano por la picadura de distintas especies de insectos flebótomos (mosquito hembra), actuando como vector de la enfermedad y cuyo periodo de actividad está comprendido entre los meses de mayo a octubre (1). La enfermedad, cuyo periodo de incubación es variable de semanas a meses, se caracteriza clínicamente por un síndrome febril acompañado de astenia, hepatoesplenomegalia y alteraciones analíticas como anemia (2,3).
El diagnóstico de la Leishmaniasis puede realizarse mediante métodos serológicos que son sencillos, no invasivos y útiles para el diagnóstico en pacientes con un cuadro clínico compatible, aunque tienen ciertas limitaciones. El diagnóstico definitivo se realiza mediante la visualización de amastigotes en el aspirado de medula ósea (AMO) o por la observación de los promastigotes procedentes del cultivo, siendo técnicas más sensibles (4).
La larga duración de los tratamientos con antimoniales, su toxicidad, largas estancias de ingreso hospitalario y una mayor incidencia de fracasos terapéuticos han motivado a la utilización de nuevos fármacos, siendo la Anfotericina B Liposómica (ABL) como primera línea de elección, demostrándose eficaz y segura, incluso en pautas cortas de tratamiento en adultos y en niños (5).
Según la OMS, la Leishmaniasis es una enfermedad endémica en 98 países, estimándose una incidencia mundial anual de 2 millones de casos (0,5 millones de Leishmaniasis Visceral (LV) y 1,5 millones de Leishmaniasis Cutánea (LC) (6). En España, la Leishmaniasis es considerada una zoonosis endémica presente en la mayor parte del territorio peninsular sobre todo en la zona de la cuenca mediterránea y en las Islas Baleares. El parásito que se detecta con mayor frecuencia en España, tanto en las formas viscerales como cutáneas, es la Leishmania Infantum (LI) y el principal reservorio encontrado hasta el momento era el perro (7).
La transmisión del parásito al ser humano se realiza mediante vectores y en España hay dos especies de flebótomos que han demostrado ser competentes: Phlebotomus perniciosus y Phlebotomus ariasi. Estos se encuentran distribuidos por todo el territorio peninsular, por lo que el riesgo de transmisión de L. Infantum puede presentarse en cualquier área geográfica en la que se den las condiciones apropiadas para que circule el parásito (7).
Recientemente, desde julio de 2009, se viene detectando un Brote Comunitario de Leishmaniasis en la Comunidad Autónoma de Madrid (C.A.M.) debido al incremento de casos notificados en la zona suroeste de la Comunidad de Madrid. Se trata del mayor brote conocido en la cuenca mediterránea en el que, además, se ha producido un cambio en el patrón epidemiológico habitual, desde una enfermedad de ámbito rural, ligada al perro y con un número pequeño de casos humanos muy focalizada en puntos concretos, a una enfermedad urbana, con nuevos reservorios y un incremento del número de casos y de la superficie afectada (8). Aunque los perros son el principal reservorio, los lagomorfos (liebres y conejos) se sospecha como culpable potencial para el sorprendente aumento de los casos en el brote ocurrido (9).
Ante el aumento de ingresos por Leishmaniasis en nuestro Hospital a partir de 2009 y ante esta serie de cambios en la cadena epidemiológica y el brote de Leishmaniasis detectado en Fuenlabrada, nos planteamos realizar un estudio con el objetivo de conocer el Brote de Leishmaniasis en el área metropolitana de la C.A.M. y dar a conocer las pautas de prevención de la enfermedad llevadas a cabo y recomendadas a la población.
Metodología
Es una revisión narrativa de la literatura que pretende analizar las publicaciones científicas sobre el Brote de Leishmaniasis en la Comunidad de Madrid y sus medidas preventivas.
La búsqueda bibliográfica se realizó en la Biblioteca Virtual de la Comunidad de Madrid, teniendo en cuenta las bases de datos de Literatura Latinoamericana y del Caribe en Ciencias de la Salud (LILACS), Medical Literature Analysis and Retrieval System Online (MEDLINE), CUIDEN, SCIELO, ELSEVIER y Cochrane Library. Además se tuvieron en cuenta los últimos informes realizados por el Ministerio de Sanidad de España y los publicados por la Comunidad de Madrid.
Se definieron como criterios de inclusión: publicaciones nacionales e internacionales relacionadas con el tema del estudio, publicadas en el período comprendido entre Enero de 2007 y Agosto de 2014 y puestas a disposición en línea en forma de informe, guía, protocolo y artículo completo o sólo en forma de resúmenes. Y como criterios de exclusión las publicaciones en las que no estaban contemplando el tema en cuestión. Optamos por este período de referencia, para poder obtener los datos existentes unos años antes del brote en la C.A.M. y justo los años posteriores al brote, en los cuales se producen el mayor número de publicaciones nacionales e internacionales. Se han tenido en cuenta las referencias bibliográficas secundarias y los artículos recomendados de los artículos encontrados.
Después de recoger los datos se realizó la lectura íntegra de cada estudio, orientado a minimizar los sesgos de selección y con el fin de extraer datos clave referentes a los elementos explícitos e implícitos acerca de la Leishmaniasis.
Se utilizaron descriptores como "Leishmaniasis outbreak and Madrid "[Mesh] AND "Children", "Leishmaniasis AND zoonotic diseases AND sandflies AND lagomorphs" , "Leishmaniasis Infantum y Madrid", "Leishmaniasis AND Madrid AND Preventive Measures". Para seleccionar la evidencia se tuvo en cuenta el año de publicación teniendo que ser menor de 8 años, los resúmenes y los artículos relacionados con los artículos que se encontraron.
Resultados
Se obtuvo un total de 177 artículos indexados en las bases de datos descritas anteriormente. De estos sólo 40 se ajustaron a los criterios de inclusión, de los que 29 producciones se adaptaron al objetivo del presente estudio. En ellos se describen las características, vigilancia, situación epidemiológica y análisis espacial de Brotes de Leishmaniasis, así como las medidas de prevención y control de la enfermedad.
Cabe destacar que de los 29 artículos seleccionados el 34% son publicaciones nacionales y el 66% son internacionales.
Después de analizar el material bibliográfico encontrado, se pudieron crear unas categorías temáticas, y de acuerdo a ellas se han encontrado los siguientes resultados:
• Notificación de los casos de Leishmaniasis en España
La Leishmaniasis es endémica en 98 países y hay más de 350 millones de personas en riesgo. Las cifras publicadas indican una incidencia estimada de 2 millones de casos nuevos al año (0,5 millones de LV y 1,5 millones de LC) (1,6,8,10,12). En el mundo hay aproximadamente 500.000 casos nuevos por año de Leishmaniasis y más de 50.000 muertes por año por esta enfermedad1.
A nivel mundial esta enfermedad está muy difundida, pero se ha calculado que más del 90% de la carga de Leishmaniasis se concentra en Bangladesh, Brasil, Etiopía, India, Nepal y Sudán (8,9).
En la bibliografía revisada se muestra unanimidad al afirmar que en España la Leishmaniasis es una zoonosis endémica presente en toda la cuenca mediterránea (la mayor parte del territorio peninsular e Islas Baleares). El parásito que se detecta, tanto en las formas viscerales como cutáneas, es L. Infantum y el principal reservorio hasta el momento ha sido el perro (11,12,13,14).
Dos publicaciones realizadas en 2012 (11,13), una realizada en la Revista Española de Salud Pública (11) y la otra un informe público del Ministerio de Sanidad (13) muestran evidencia sobre la evolución de la situación epidemiológica de la Leismaniasis en España durante las últimas décadas.
La vigilancia epidemiológica de la Leishmaniasis comienza en 1982, una vez que la enfermedad es incluida en la lista de EDO (13). Posteriormente el RD 2210/1995, por el que se crea la RENAVE, clasifica a la Leishmaniasis como enfermedad endémica de ámbito regional y deja de ser de notificación obligatoria en aquellas CCAA en donde la enfermedad no se considera endémica. En la última década las CCAA que han notificado casos son: Andalucía, Aragón, Baleares, Cantabria, Castilla-León, Cataluña, Comunidad Valenciana, Extremadura, Madrid, Murcia, Navarra y La Rioja. Registrando desde el año 1996 hasta el 2011, en España la Incidencia Media Anual (IMA) era de 0,45 casos/100.000 hab (11,13).
Los datos disponibles por el CMBD correspondientes al periodo entre 2000-2010 recogieron 2.739 casos. Esto se traduce con una Tasa Media Anual (TMA) nacional de 2,8/100.000 hab. Al comparar los casos notificados a la RENAVE (1.201), y los registrados para el mismo período por el CMBD (2.739) (Fig. 1), se pone de manifiesto la existencia de una importante subnotificación de casos al Sistema Nacional de Vigilancia, estimable en aproximadamente el 50%. Es posible que esta diferencia en parte sea debida a que no es una enfermedad de declaración obligatoria en todas las CCAA, únicamente en aquellas que consideran que la enfermedad es endémica. En este sentido es importante destacar que el CMBD registra casos hospitalizados en todas las CCAA, por lo que el carácter de enfermedad endémica debería ser revisado (o el ámbito de la endemia) (11,13).
Según aporta el propio informe del Ministerio de Sanidad (12), la gran subnotificación de casos a la RENAVE, es preocupante, ya que este sistema debería ser más oportuno, aportando datos con el fin de tomar medidas de prevención y control.
• Población más susceptible ante un Brote de Leishmaniasis.
En los países mediterráneos la Leishmaniasis Infantum es una enfermedad endémica que afecta principalmente a niños menores de 10 años, con especial incidencia en menores de 4 años (2,5,7,8,11).
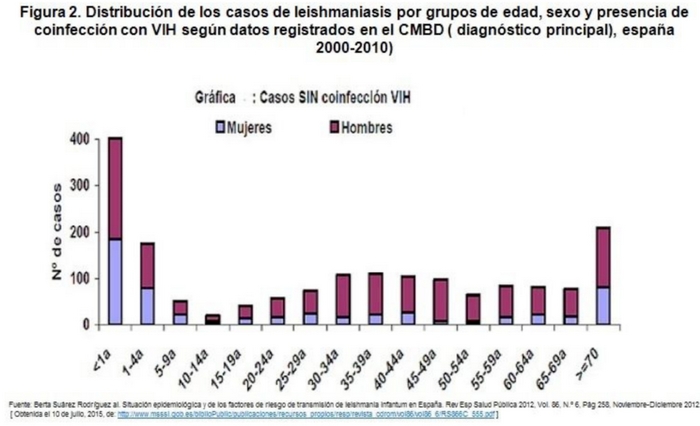
Como se puede ver en la figura 2, la enfermedad presenta dos máximos patrones endémicos: uno en menores de 4-5 años y el otro en mayores de 65-70 años. También se puede observar cómo la razón hombre/mujer en menores de 10 años es de 1,2/1, mientras que entre los 30 y los 49 años, en los casos que presentan coinfección con VIH es de 7/1. Concluyendo que cuando se trata de población pediátrica o mayor de 65 no hay diferencias significativas en el sexo, los datos cambian si hablamos de población de mediana edad con coinfección de VIH, siendo mayor la incidencia en hombre.
Este predominio de mayor incidencia en las edades extremas (<5 años y >65 años) de presentación de la enfermedad está relacionado con varios factores de riesgo innatos a la edad como una respuesta inmadura inmune innata, falta de exposición previa e inmunidad adquirida y mayores tasas de desnutrición (1,8,11).
• Datos Epidemiológicos del Brote de Leishmaniasis en la C.A.M.
Según el Documento Técnico de Salud Pública de la C.A.M. (8) entre 2001 y 2014 se han notificado 966 casos de Leishmaniasis en la C.A.M.. El número de casos anuales notificados se muestra estable, con mínimas variaciones, a partir de 2010 se produce un incremento notable, alcanzando su máximo en 2011 y volviendo a disminuir desde entonces.
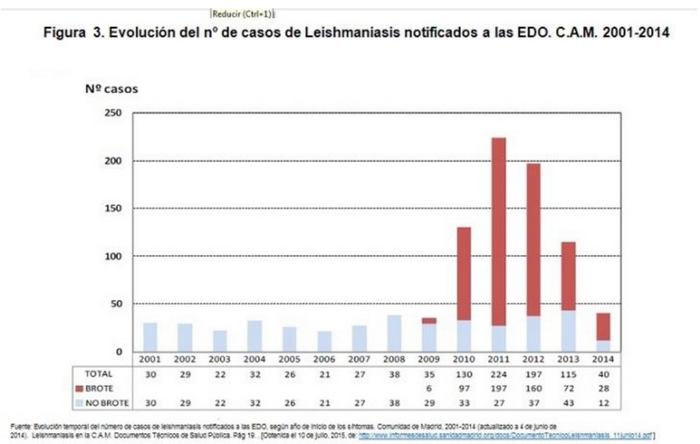
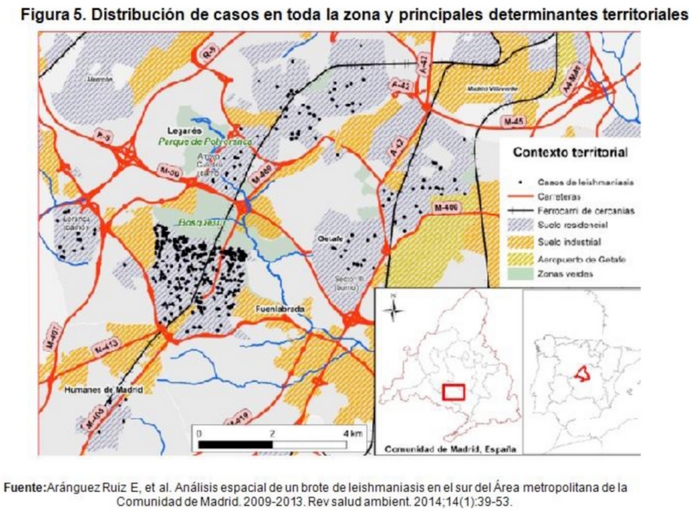
Toda la bibliografía revisada (7,8,11,12) coincide en que la investigación del incremento de casos demostró que desde julio de 2009 hasta 2014 se estaba produciendo un brote de Leishmaniasis en la zona suroeste de la CM, afectando fundamentalmente a 4 municipios de la C.A.M.; Principalmente a Fuenlabrada, y en menor magnitud a residentes de Leganés, Humanes de Madrid y Getafe (Fig.3).
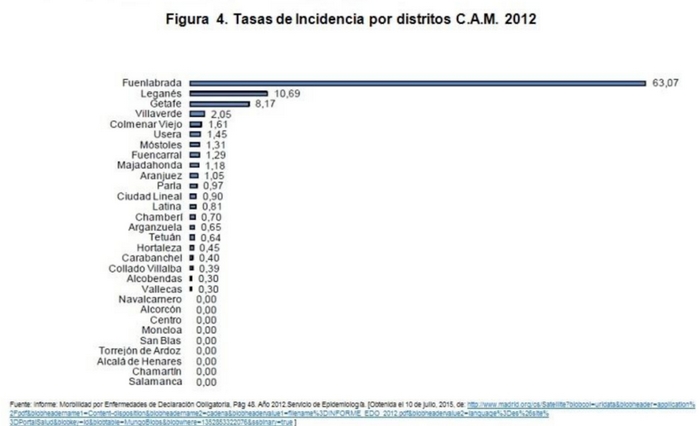
Desde julio de 2009 hasta el 4 de junio de 2014 se han notificado 560 casos de Leishmaniasis a la RENAVE que cumplen los criterios para ser incluidos en el brote comunitario, con una TI de 19,64 casos por 100.000 hab. Se han identificado 6 casos en 2009, 97 casos en 2010, 197 casos en 2011, 160 casos en 2012, 72 casos en 2013 y 28 casos en 2014. (Fig.4)
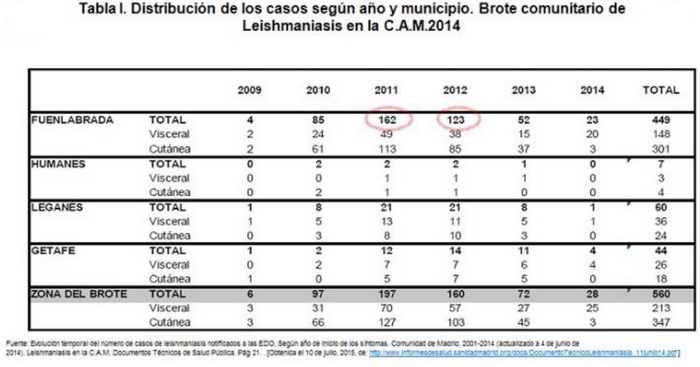
Las notificaciones son de casos ubicados en Fuenlabrada (449 casos; TI: 45,98), Leganés (60 casos; TI: 6,52), Getafe (44 casos; TI: 5,25) y Humanes de Madrid (7 casos; TI: 6,01)7,8,12. (Tabla I).
• ¿Por qué la C.A.M. y en especial Fuenlabrada?
Los resultados de los estudios encontrados (15,16) muestran que la zona con mayor concentración de casos coincide espacialmente con zonas residenciales cercanas a espacios verdes, con alta densidad de flebotomos y prevalencia relativamente elevada de Leishmaniasis en liebres y con ausencia de barreras territoriales. Esto se produce en el norte del suelo edificado del casco urbano de Fuenlabrada. La identificación de áreas periféricas como las zonas con mayor incidencia de Leishmaniasis, sobre todo en los primeros estadios de un brote ha sido definida en los dos estudios mencionados.
La presencia de grandes espacios verdes de reciente construcción por el ser humano, una amplia red de comunicaciones, la incursión de las explotaciones agrícolas y los asentamientos en las grandes zonas verdes junto con las condiciones climáticas, temperatura, humedad, y los cambios en las precipitaciones son factores que podrían haber sido relevantes para explicar el comportamiento espacial del presente brote, contribuyendo a la creación de un ecosistema favorable para la proliferación de flebotomos y lagomorfos, lo que ha llevado a la aparición y estabilización de un nuevo ciclo urbano para la proliferación de Leishmania.
Estos cuatro municipios de la C.A.M. superan el medio millón de habitantes. El crecimiento de estas poblaciones se ha visto en los últimos 50 años multiplicado por 19, con un máximo en Fuenlabrada donde se ha multiplicado por 70 (16). El clima de la zona es de tipo mediterráneo continentalizado con grandes amplitudes térmicas anuales, temperaturas suaves en primavera y otoño, y escasas precipitaciones (17).
Algunos estudios (12,18) vinculan la extensión del brote de Leishmaniasis con grandes obras de infraestructuras y el consiguiente movimiento de tierras que pudiera extender los nichos del hábitat natural del flebotomo. Los resultados de este análisis espacial (12) indican la posible relación entre la creación de amplios parques periurbanos: Parque de Polvoranca, de unas 150 hectáreas (que se comenzó a construir en 1986) y Parque de Bosque Sur, con una superficie de más de 500 hectáreas construido entre 2005 y 2011, como condiciones favorables para el vector. Por otro lado, la reciente creación de una extensa red de carreteras (cercanías y autovía M50) en el sector de Bosque Sur, con los terraplenes y desniveles generados en su trazado, puede haber contribuido a generar las condiciones ideales para el desarrollo de hábitats idóneos tanto para el vector como para los reservorios.
La bibliografía parece indicar que las infraestructuras viarias (red de autovías y cercanías) podrían haber tenido un papel decisivo en la distribución espacial del brote ocurrido en la C.A.M. comportándose de 2 maneras: en primer lugar como barreras territoriales que aíslan y delimitan en cierta medida a varios núcleos urbanos de la exposición al patógeno y en segundo lugar, el trazado del ferrocarril pudiera actuar como elemento de apoyo a la penetración del vector vías generadoras de un entorno de hábitats idóneos para reservorios y vectores (12). Parece que la incidencia de la enfermedad decrece al aumentar la distancia desde el eje del ferrocarril hasta un determinado umbral (300 m). Hay que considerar que algunos estudios (12) señalan los 300 metros como distancia máxima de vuelo autónomo del vector por lo que los resultados son congruentes y permiten plantear la hipótesis de que el trazado de la línea férrea pudiera tener influencia en la difusión espacial del brote. Los puntos sospechosos de haber sido lugares de contacto entre la población y los vectores se sitúan en las proximidades de las viviendas de los casos, sugiriendo que se está ante una exposición domiciliaria o peridomiciliaria. (Fig. 5).
El uso tradicional de estos terrenos ha sido el cultivo de cereal de secano, siendo este el motivo por el cual han abundado clásicamente los lagomorfos (liebres y conejos)(12).
Varios estudios internacionales y nacionales (8,12,19,20,21) coinciden al afirmar que aunque los perros son el principal reservorio de la Leishmaniasis, las liebres podrían ser culpable potencial para el sorprendente aumento de los casos en este brote. Una vez conocidos los datos de aparición de Leishmaniasis en seres humanos, se inició un estudio para conocer la prevalencia de esta enfermedad en el perro, hasta ahora, reservorio principal de la enfermedad, encontrándose prevalencias menores tanto en perros de compañía, como en los perros considerados de riesgo que la media del resto de la CM. Estos datos hicieron cuestionar que el perro estuviera actuando como reservorio principal de la enfermedad, por lo que paralelamente se iniciaron investigaciones en otros posibles reservorios, liebres y conejos, fundamentalmente, y los datos obtenidos dan indicios de que los lagomorfos pueden estar actuando como reservorio de la enfermedad en este brote. Respecto a la prevalencia en lagomorfos, se han evaluado mediante PCR anidada, encontrándose porcentajes de infección muy superior al de la media. En liebre, la prevalencia de Leishmania es alta en Bosque Sur y en el Parque de Polvoranca y áreas limítrofes. En conejos, la prevalencia es más alta en las capturas realizadas en el entorno de la M50.
• Sintomatología y Tratamiento de la Leishmaniasis.
Es una enfermedad que afecta de forma sistémica y suelen iniciarse los síntomas de 2 a 8 meses después de que la persona es picada por el flebótomo. La mayoría de las personas no recuerdan haber tenido una picadura y/o llaga en la piel. El desarrollo de la enfermedad se produce cuando no existe eliminación espontánea del parásito y se produce un daño y una depresión del sistema inmunológico. La sintomatología clínica que han presentado los casos de este brote es la característica del cuadro, compatible con la descrita en otros estudios (3,4,8,22) fiebre en el 80,4% de los casos, esplenomegalia en el 73,0%, anemia en el 72,5% y leucopenia en el 71,6%.El 94,1% son casos confirmados por laboratorio y el 5,9% restante son casos probables.
Entre los casos en los que se ha realizado aislamiento del parásito se ha identificado L. infantum (22).
El tratamiento clásico de la Leishmaniasis ha estado constituido por los antimoniales (24), debido a fracaso terapéutico, larguísima duración de su tratamiento (28 días) y la toxicidad cardiaca tardía por acumulación del fármaco. Todo esto ha condicionado la aparición de nuevas terapias como primera de elección: anfotericina b liposómica (abl), en pautas cortas en adultos y en niños a una dosis máxima de 4mg/kg/día los días 1 a 5 y 10 (2,5).
En el estudio de L.M. Prieto Tato et.al.(3) realizado en Servicios de Pediatría concluye que con "Una dosis total de 24 mg/kg administrada en 6 dosis a lo largo de 10 días es eficaz y segura en el tratamiento de la Leishmaniasis visceral y permite reducir la estancia hospitalaria".
Según el estudio de M.C. Figueras Nadal et.al.(5) de 32 niños inmucompetentes (7 meses-7 años). El 100% tuvo una respuesta rápida respuesta clínica y en 21 días los 24 pacientes a los que se les realizó el Aspirado de Médula Ósea (AMO) fue normal. Se definió curación como ausencia de amastigotes en AMO o promastigotes en cultivo de Médula Ósea (MO) realizado el día 21 de tratamiento, más clínica favorable y ausencia de recidivas en los 6 meses de seguimiento. EFICAZ 90% casos, como la ausencia de amastigotes de Leishmaniasis en el aspirado de MO o proamstigotes Leishmaniasis en el cultivo de MO realizado a los 21 días de tratamiento + ausencia de recaída en los siguientes 6 meses de seguimiento.
• Plan Integral sobre Medidas de Prevención
Este brote de Leishmaniasis, tanto desde el punto de vista epidemiológico como ambiental, es de gran complejidad y ha requerido del trabajo y la dedicación de muchos profesionales de diferentes organismos e instituciones, viéndose reflejado en un Plan de Acción Múltiple compuesto por vigilancia epidemiológica y entomológica, vigilancia de reservorios y protección de la población, haciendo especial énfasis en conseguir una máxima difusión de la información sobre medidas preventivas dirigida a la población de riesgo y a la población general (13).
En primer lugar se realizó vigilancia y control del reservorio: animales de compañía y fauna silvestre, posteriormente la vigilancia y control del vector, Flebotomo. Para luchar contra este vector, se hizo de forma coordinada con los municipios y con la Dirección General de Medio Ambiente, se puso en marcha un plan de lucha antivectorial que lo han llevado a cabo empresas especializadas, incluyendo desinsectación en zonas de riesgo y zonas limítrofes, escombreras, vertederos, alcantarillado, parques aguas pluviales y el uso de insecticidas.
Paralelamente se llevaron a cabo medidas de control medioambiental, este plan recayó fundamentalmente sobre los ayuntamientos, incluyendo la identificación de zonas de riesgo, limpieza de restos vegetales, parcelas y parques, desbrozamiento de los márgenes de las carreteras, eliminación de madrigueras de roedores, limpieza de alcantarillado, eliminación de lodos, recogida de animales abandonados.
En materia de comunicación tanto la Consejería de Sanidad como los Ayuntamientos han realizado una importante campaña de información y educación sanitaria dirigida a los ciudadanos y a los profesionales de la zona difundiendo el protocolo de vigilancia y manejo de la enfermedad en las áreas para garantizar que los médicos de atención primaria y especializada consideren el diagnóstico diferencial de Leishmaniasis (13).
Haciendo un especial énfasis en conseguir una máxima difusión de la información sobre medidas preventivas (25,26,27,28,29) se repartieron folletos explicando cómo evitar la picadura del mosquito: manteniéndose alejado de las áreas que pudieran estar infestadas como Parque Polvoranca y Bosque Sur, no permanecer al aire libre entre el oscurecer y el alba en estos lugares, vestir ropas gruesas y holgadas, utilizar pantalones largos y camisas de manga larga, las ropas pueden tratarse con repelentes, siempre que sean aptos para la edad pediátrica y se realice un uso correcto en su aplicación, alojarse en edificios protegidos con telas metálicas en puertas y ventana. Educar en un uso adecuado de repelentes en la edad pediátrica.
Discusión
El creciente número de publicaciones sobre el brote de Leishmaniasis en la C.A.M. en los últimos seis años, refleja la creciente preocupación surgida en los expertos en esta materia. De hecho la OMS, en un informe de 2010 de la reunión del Comité de Expertos sobre el Control de las Leishmaniasis (8), destaca que la educación sanitaria sigue siendo un elemento primordial para el control de las enfermedades epidemiológicas. Define como clave del éxito lograr un compromiso político con las actividades de control y desarrolla los principales objetivos basados en el reflejo de un modelo de atención inspirado en el empowerment donde se busca hacer posible que la población tenga una información clara y correcta y potencie su capacidad propia de tomar decisiones y conseguir cambios en los comportamientos que conduzcan a asumir una posición activa y participen en las campañas de prevención y control.
El hecho de que la mayor parte de los estudios se hayan centrado en la C.A.M. se justifica por ser en esta región donde se concentran más casos de Leishmaniasis de toda España y en un periodo de tiempo muy corto (7,8,11,12). Además la población más susceptible de padecer la enfermedad son menores de 4-5 años y mayores de 65-70 años, motivo que justifica también el interés en realizar un seguimiento epidemiológico de la enfermedad debido a la vulnerabilidad que presenta esta población diana(2,5,7,8,11).
Cabe destacar que para la creación de un nuevo ciclo urbano de Leishmaniasis podrían haber contribuido factores relevantes como el crecimiento poblacional, la presencia de grandes espacios verdes de reciente construcción periurbana y la construcción de extensas infraestructuras de ferrocarril y carreteras, todos coincidentes en la zona sur de Madrid (12,16,17).
Toda la información publicada del brote de Leishmaniasis en la C.A.M. presenta concordancia con la bibliografía publicada sobre el tema en los años anteriores(15,18).
Conclusión
El minucioso análisis epidemiológico realizado sobre el brote de la C.A.M. ha permitido orientar de manera específica las medidas de prevención y control de la Leishmaniasis. Aunque se ha trabajado de forma activa y conjunta desde las Autoridades Sanitarias y han disminuido el número de casos, el problema no se ha erradicado, por tanto juega un papel muy importante la difusión y aplicación de las medidas preventivas, siendo esencial que la población conozca cómo debe actuar, en especial cómo deben proteger a la población pediátrica.
Futuras líneas de investigación deberían ir encaminadas a educar a la población en un uso adecuado de los repelentes pediátricos y al estudio de repelentes apropiados a la población pediátrica que es la más vulnerable, pues precisamente esta población es la que más restricciones tienen para un uso seguro de repelentes, puesto que en menores de 6 meses no se puede aplicar el producto y de 6 meses a 2 años solo se puede realizar una aplicación de repelente con DEET (N,N-dietil-m-toluamida ) o Propidina/Picaridina (KBR3023) al 10% o concentraciones inferiores al día. En el mercado tan solo hay una marca de repelente con concentraciones inferiores de DEET o Propidina al 10%, por tanto la única medida de prevención eficaz es evitar la picadura del mosquito.
Bibliografía
1. Dr. Horacio Echenique. Director. Enfermedades infecciosas: Leishmaniasis Visceral. Diagnóstico de leishmaniasis visceral. Guía para el equipo de Salud. (monografía en Internet).Ministerio de Salud: Presidencia de la Nación. República Argentina (acceso 10 de Junio de 2015). Disponible en: http://www.higiene.edu.uy/materiales/Galeria/terminada/guia.pdf. [ Links ]
2. Olbrich P., Hurtado Mingo A., Baltasar Navas C., Anchóriz Esposito M., Neth O. Manejo diagnóstico y terapéutico de un niño afecto de una Leishmaniasis visceral refractaria al tratamiento con Anfotericina B Liposomal. Sociedad de Pediatría de Andalucía Occidental y Extremadura. Vox Paediatrica 2010; 17(2):63-66. [ Links ]
3. L.M. Prieto Tato, E. La Orden Izquierdo, S. Guillén Martín, E. Salcedo Lobato, C. García Esteban, I. García-Bermejo, J.T. Ramos Amador. Diagnóstico y tratamiento de la leishmaniasis visceral infantil. An Pediatr (Barc). 2010;72(5):347-351. [ Links ]
4. Caryn Bern, MD, MPH Clinical manifestations and diagnosis of visceral leishmaniasis (Internet). (citado 21 de junio de 2015). Disponible en: http://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-visceral-leishmaniasis. [ Links ]
5. Baeza, I. Ausín Aoiz. Tratamiento de corta duración de la leishmaniasis visceral con anfotericina B liposómica en pacientes inmunocompetentes. An Pediatr. 2003;59:535-40 - Vol. 59 Núm.6. [ Links ]
6. World Health Organization. (2010). Control of the leishmaniases: report of a meeting of the WHO Expert Commitee on the Control of Leishmaniases, Geneva, 22-26 March 2010. [ Links ]
7. Arce, A., Estirado, A., Ordobas, M., Sevilla, S., García, N., Moratilla, L., Vilas, F. (2013). Re-emergence of leishmaniasis in Spain: community outbreak in Madrid, Spain, 2009 to 2012. Euro Surveill, 18(30), 20546. [ Links ]
8. Subdirección de Promoción de la Salud y Prevención. Dirección General de Atención Primaria. Comunidad Autónoma de Madrid. Leishmaniasis en la Comunidad de Madrid. Documento Técnico de Salud. Madrid, Junio de 2014; 1994. Serie de Informes de Salud. [ Links ]
9. Almeida AS, Andrade Medronho R, Werneck GL. Identification of Risk Areas for Visceral Leishmaniasis in Teresina, Piaui State, Brazil. Am. J. Trop. Med. Hyg. 84(5), 2011, pp. 681-7. [ Links ]
10. Carrillo E, Moreno J, Cruz I. What is responsible for a large and unusual outbreak of leishmaniasis in Madrid. Trends Parasitol. 2013 Dec; 29(12):579-80. [ Links ]
11. Berta Suárez Rodríguez, Beatriz Isidoro Fernández, Sara Santos Sanz, María José Sierra Moros, Ricardo Molina Moreno, Jenaro Astray Mochales, Carmen Amela Heras. Colaboración Especial. Situación Epidemiológica y de los factores de riesgo de transmisión de la Leishmaniasis Infantum en España. Rev Esp Salud Pública 2012; 86: 555-564. [ Links ]
12. Aránguez Ruiz E, Arce Arnáez A, Moratilla Monzo L, Estirado Gómez A, Iriso Calle A, De la Fuente Ureña S, Soto Zabalgogeazcoa MJ, Fuster Lorán F, Ordobás Gavín M, Martínez Serrano AM, Vilas Herranz F. Análisis espacial de un brote de leishmaniasis en el sur del Área metropolitana de la Comunidad de Madrid. 2009-2013. Rev salud ambient. 2014;14(1):39-53. [ Links ]
13. Carmen Amela, Berta Suarez, Beatriz Isidoro, Ma José Sierra, Sara Santos y Fernando Simón. Evaluación del riesgo de transmisión de Leishmania Infantum en España. Centro Coordinación de Alertas y Emergencias Sanitarias. Ministerio de Sanidad, Servicios Sociales e Igualdad. 23 de Octubre de 2012. Informe de situación. [ Links ]
14. Dirección General de Atención Primaria. Morbilidad por Enfermedades de Declaración Obligatoria, comunidad de Madrid, año 2012. Boletin Epidemiológco de un grupo del Servicio de Epidemiología. [ Links ]
15. Rodríguez EM, Díaz F, Pérez MV. Spatio-temporal clustering of American Cutaneous Leishmaniasis in a rural municipality of Venezuela. Epidemics. 2013;5(1):11-9. [ Links ]
16. Instituto Nacional de Estadística. Padrón continuo. INEbase. (Consultado en junio 2014) Disponible en http://www.ine.es/inebmenu/mnu_padron.htm. [ Links ]
17. Agencia Estatal de Meteorología. Valores climatológicos normales. Getafe. Serie 1971-2000. (Consultado junio de 2014). Disponible en: http://www.aemet.es/es/serviciosclimaticos/datosclimatologicos/valoresclimatologicos?l=3200&k=mad. [ Links ]
18. Correa Antonialli SA, Torres TG, Paranhos Filho AC, Tolezano JE. Spatial analysis of American Visceral Leishmaniasis in Mato Grosso do Sul State, Central Brazil. J Infect. 2007;54(5):509-14. Epub 2006 Sep 15. [ Links ]
19. Jiménez M, González E, Iriso A, Marco E, Alegret A, Fúster F, Molina R. Parasitol Res. Detection of Leishmania infantum and identification of blood meals in Phlebotomus perniciosus from a focus of human leishmaniasis in Madrid, Spain. Parasitol Res. 2013 Jul;112(7):2453-9. [ Links ]
20. Jiménez M, González E, Martín-Martín I, Hernández S, Molina R. Could wild rabbits (Oryctolagus cuniculus) be reservoirs for Leishmania infantum in the focus of Madrid, Spain. Vet Parasitol. 2014 May 28;202(3-4):296-300. [ Links ]
21. Martín-Martín I, Molina R, Rohoušová I, Drahota J, Volf P, Jiménez M. High levels of anti-Phlebotomus perniciosus saliva antibodies in different vertebrate hosts from the re-emerging leishmaniosis focus in Madrid, Spain. Vet Parasitol. 2014 May 28;202(3-4):207-16. [ Links ]
22. Gradoni L. Epidemiological surveillance of leishmaniasis in the European Union: operational and research challenges. Euro Surveill. 2013;18(30):pii=20539. (Acceso 11 de Junio de 2015). Disponible en http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20539. [ Links ]
23. Ruiz-Fons F, Ferroglio E, Gortázar C. Leishmania infantum in free-ranging hares, Spain, 2004-2010. Euro Surveill. 2013;18(30):pii=20541. Available online: http://www.eurosurveillance.org/images/dynamic/EE/V18N30/art20541.pdf. [ Links ]
24. Caryn Bern, MD, MPH. Treatment of visceral leishmaniasis (Internet). (acceso 21 de junio de 2015). Disponible en: http://www.uptodate.com/contents/treatment-of-visceral-leishmaniasis. [ Links ]
25. Dr. Rogelio López-Vélez, Esteban Martín Echevarría. Viajar sano (Sede Web). (Acceso 11 de Junio de 2015). Disponible en: http://www.viajarsano.com/home.html. [ Links ]
26. UK Health Protection Agency. National Travel Health Network and Centre (Sede Web). (Acceso 11 de Junio de 2015). Disponible en: http://www.nathnac.org/. [ Links ]
27. U.S. Centers for Disease Prevention and Control (Sede Web). Creada en 2013. (Acceso 11 de Junio de 2015). Disponible en: http://wwwn.cdc.gov/travel/contentInsectProtection.aspx. [ Links ]
28. Grupo de Cooperación Internacional de la Asociación Española de Pediatría de Atención Primaria (AEPap). Consejos Sanitarios para viajeros en países en desarrollo. Revista electrónica de información para padres de la Asociación Española de Pediatría de Atención Primaria (AEPap) (revista en Internet) Junio, 2013. (Acceso 11 de Junio de 2015). 6(2). Disponible en: http://www.famiped.es/volumen-6-no2-junio-2013. [ Links ]
29. WORLD Health Organization. Leishmaniasis, surveillance and control. (Acceso 11 de Junio de 2015). Disponible en: http://www.who.int/leishmaniasis/surveillance/en/. [ Links ]
Recibido: 14 septiembre 2015
Aceptado: 24 de noviembre 2015