Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.59 no.10 dic. 2006
CÁNCER DE PRÓSTATA: NUEVAS TÉCNICAS DIAGNÓSTICAS
Metodología diagnóstica ante la recidiva bioquímica después de la radioterapia.
Diagnostic methodology for the biochemical recurrence of prostate cancer after radiotherapy
Javier Maldonado Pijoan.
Oncológica Radioterápica. Hospital Vall d'Hebron. Universidad Autónoma de Barcelona. Barcelona. España.
Dirección para correspondencia
RESUMEN
Debido a que la glándula prostática permanece in situ tras la radioterapia radical, el antígeno prostático específico (PSA) no cae a niveles indetectables tal como ocurre tras la prostatectomía radical. El PSA como parámetro de respuesta a la radioterapia o bien como caracterización de recidiva bioquímica es muy sensible pero poco especifico. El valor predictivo positivo para recidiva clínica local o sistémica es bajo, por lo que el uso de solo el valor del PSA para indicar tratamientos de rescate esta abierto al debate. Existen diferentes definiciones de recidiva bioquímica tras la radioterapia. Hasta la fecha, la definición mas estandarizada era la de la Conferencia de Consenso de la American Society for Therapeutic Radiology and Oncology (ASTRO) del 1996, pero era exclusivamente para pacientes tratados con radioterapia externa como monoterapia. Esta era muy sensible a la duración del seguimiento, se basaba en fechas retrospectivas y la correlación con la progresión clínica era subóptima. Con la finalidad de mejorar la definición de fallo bioquímico vigente hasta entonces, la ASTRO de nuevo reunió a una comisión de expertos en el 2005 creando una nueva definición de fallo bioquímico mas especifica para eventos clínicos y valida en el contexto de una deprivación androgénica a corto plazo o bien de un tratamiento con braquiterapia. Las recomendaciones finales fueron considerar un incremento de 2 ng/ml o mas sobre el nadir de PSA o bien pacientes en los que se han aplicado tratamientos de rescate. La biopsia prostática post radioterapia se emplea a pacientes con la sospecha de recidiva exclusivamente local para dirigirlos a tratamientos de rescate. Los criterios para el diagnostico de carcinoma post-tratamiento se deben homogeneizar antes de establecer esta prueba de forma rutinaria en la evaluación de respuesta al tratamiento. Las técnicas de imagen estándar para la localización de la recidiva clínica (gammagrafía ósea con tecnecio-99, TC y RM) son poco sensibles por lo que es de prever que otras técnicas diagnosticas de carácter metabólico (como el PET con diferentes trazadores, espectroscopia por RM) se puedan incorporar en futuro próximo al estudio de la recidiva bioquímica tras la radioterapia.
Palabras clave: Recidiva bioquímica. Radioterapia radical. Definiciones.
SUMMARY
Objectives: Due to the permanence of the prostate, PSA does not descend to undetectable levels after radical radiotherapy the way it happens after radical prostatectomy. PSA as response parameter after radiotherapy or for the characterization of biochemical recurrence is very sensitive but not much specific. The positive predictive value for local or systemic clinical recurrence is low, so that the use of PSA alone for the indication of rescue therapies is open to debate. There are different definitions of biochemical recurrence after radiotherapy. To date, the most standardized definition was that of the American Society for Therapeutic Radiology and Oncology (ASTRO) in 1996, but it was exclusive for patients treated with external beam radiotherapy as monotherapy. It was very sensitive to the follow-up time, but it was based on retrospective data, and its correlation with clinical progression was suboptimal. With the aim of improving the definition of biochemical failure ASTRO reunited a new expert commission in 2005 that gave a new definition of biochemical failure more specific for clinical events and valid in the context of short-term androgen deprivation or brachytherapy. The final recommendations were to consider biochemical recurrence a PSA increase of 2 ng/ml or greater over the nadir, or patients that have received rescue therapies. Prostate biopsy after radiotherapy is employed in patients with suspicion of exclusively local recurrence to direct them to rescue therapies. The criteria for the diagnosis of post-therapy carcinoma must be homogenized before establishing this test as a routine in the evaluation of treatment response. Standard imaging techniques for the localization of clinical recurrences (99-technetium bone scan, CT scan and MRI) are not much sensitive and it is predictable that other diagnostic tests which have a metabolic character (such as PET with various tracers, MR spectroscopy) will be used for the study of biochemical recurrence after radiotherapy in the near future.
Key words: Biochemical recurrence. Radical radiotherapy. Definitions.
Introducción
Debido a que la glándula prostática permanece in situ tras la radioterapia radical, el antígeno prostático especifico (PSA) no cae a niveles indetectables tal como ocurre tras la prostatectomía radical. La medición de los niveles de PSA tras la radioterapia es el método mas ampliamente empleado para evaluar el resultado de este tratamiento, pero la sensibilidad y especificidad del método para predecir un evento clínico son imperfectas y abiertas al debate (1,2).
El ascenso del PSA es el signo mas común de recurrencia tras la radioterapia, pero puede indicar un fallo local, regional, a distancia o bien una combinación de ambos. El tacto rectal combinado con el PSA se emplea en el seguimiento post radioterapia, aunque el rendimiento del mismo apenas alcanza el 30% (3) relacionándose en el 75% de estos casos mas con hallazgos de perdidas sanguíneas rectales que con recidivas tumorales.
El nivel de PSA en suero se correlaciona con el tumor residual, por lo que este parámetro se emplea como "end point" en la respuesta al tratamiento en cáncer de próstata. El valor de la respuesta del PSA se ha documentado en diferentes estudios (4-8). El uso de hormonoterapia adyuvante hace que la interpretación del valor del PSA sea poco fiable ya que depende de la producción hormonal mas que de la presencia o ausencia de tumor. El descenso del PSA tras la radioterapia es lento, aproximadamente requiere entre 6 a 24 meses o mas para alcanzar el nadir.
Tras el tratamiento con radioterapia, el PSA se emplea para determinar la eficacia del mismo. Los trabajos publicados en la primera era del PSA (inicios de los 90) tendieron a enfatizar la necesidad de valores normales (<4.0 ng/ml) o bien otros valores umbral (tales como 2 ng/ml o 1 ng/ml) (9). Esta falta de estandarización hizo imposible comparar resultados entre instituciones.
Nadir del PSA post radioterapia y recidiva bioquímica
El nadir del PSA es el nivel mas bajo del PSA tras la radioterapia. Un nadir predice una futura recidiva bioquímica y local (6), pero el nivel del nadir por si mismo no es un indicador de remisión de la enfermedad o recidiva. Intervalos prolongados desde el tratamiento hasta el nadir de PSA se correlacionan de forma positiva con el intervalo libre de metástasis (5,6), mientras que la progresión del PSA inmediatamente tras la radioterapia es un indicador de la presencia de metástasis sistémicas.
Tres aumentos consecutivos de PSA es una definición razonable de fallo bioquímico, con la fecha del fallo referenciada como el punto medio del nadir del PSA y el primero de los tres aumentos consecutivos. El motivo de requerir tres aumentos consecutivos es para filtrar a los pacientes con PSA oscilante que no están realmente en fallo bioquímico.
Estos criterios por lo general se correlacionan bien con el resultado clínico (7,10), pero tienen ciertas limitaciones. La especificidad y sensibilidad del PSA ascendente para predecir un fallo clínico como una recaída local, un fallo a distancia o un inicio de un tratamiento hormonal, se relacionan con la magnitud del incremento de PSA sobre el nadir y la pendiente de la curva de dicho aumento (concepto de tiempo de doblaje del PSA) (11). Por ejemplo, pequeños aumentos proporcionales, consecutivos, en un intervalo corto de tiempo pueden obedecer a causas benignas y ser erróneamente clasificados como progresión bioquímica. Otro escenario confuso seria el de las recidivas locales en que se traducen por pequeños aumentos del PSA, lentos, con ocasionales disminuciones de los niveles del PSA, demorando estas el reconocimiento del fallo del tratamiento.
Definiciones de recidiva bioquímica
La respuesta bioquímica, es decir la respuesta del PSA tras el tratamiento se puede definir como "nadir del PSA" o "fallo del PSA".
En 1994, una comisión de la American Society for Therapeutic Radiology and Oncology (ASTRO) fue instituida para desarrollar una definición estandarizada para el fallo de PSA tras la radioterapia externa. En 1996, ASTRO esponsorizó una conferencia de consenso con el mismo fin. Un panel de expertos que incluía radioterapeutas, urólogos, estadísticos y oncólogos médicos crearon una definición consensuada y estandarizada que permitió comparar resultados de diferentes series e instituciones. (12).
De forma simple, el consenso de la ASTRO definió el fallo de PSA tras tres aumentos consecutivos del PSA tras un nadir con la fecha del fallo establecida como el punto medio entre la fecha del nadir y el primer aumento del PSA o bien cualquier incremento suficientemente importante para motivar un tratamiento de rescate. El panel de expertos fue mas allá diciendo: "se recomienda que las series que han de ser sometidas a publicación tengan un periodo mínimo de observación de 24 meses" y que "...las determinaciones de PSA deben ser obtenidas cada tres o cuatro meses durante los primeros dos anos tras completar la radioterapia y después cada 6 meses". Por desgracia, en ocasiones estos puntos no han sido seguidos por diferentes investigadores comprometiendo la estimación real de los resultados a largo plazo y la consistencia de la definición.
En la primera conferencia de consenso se alcanzaron tres conclusiones adicionales:
1. "El fallo bioquímico, por si, no es una justificación para iniciar un tratamiento adicional";
2. "Es, sin embargo, un objetivo de estudio precoz para estudios clínicos";
3. "Ninguna definición de fallo de PSA, hasta la fecha, es válida como predictiva para progresión clínica o supervivencia".
Estas conclusiones reflejan la necesidad y deseo de tener recomendaciones para intervenciones terapéuticas basadas en la evidencia. Incluso dejan la puerta abierta para que, en ocasiones, el fallo de PSA sea un objetivo clínico irrelevante.
Los problemas mas importantes de esta definición eran que los datos retrospectivos sesgaban de forma importante la estimación por Kaplan y Meyer de la supervivencia libre de eventos y que esta dependía del tiempo de seguimiento, por lo que series con diferente tiempo de seguimiento no podían ser comparadas (13, 14). Segundo, quedo claro desde el comienzo que esta definición no podía ser vinculada a progresión clínica, supervivencia o intervenciones terapéuticas. Además, a pesar del hecho que esta definición se genero con pacientes que no habían sido sometidos a braquiterapia u hormonoterapia, se empleo en estos escenarios (15-17).
Con la finalidad de mejorar la definición de fallo bioquímico vigente hasta entonces, la ASTRO de nuevo reunió a una comisión de expertos en el 2005 en Phoenix, Arizona. Se establecieron unas premisas básicas: la definición creada no debía ser de carácter individual sino colectivo y que debía ser útil en pacientes que habían recibido una deprivación androgénica con un esquema de corta duración. Esta definición no aplica a pacientes con seguimiento tras prostatectomía, radioterapia de rescate o crioterapia.
Revisando las áreas en que la definición de la ASTRO de recidiva bioquímica del ano 1996 eran problemáticas, podemos destacar:
1. Es muy sensible a la duración del seguimiento.
2. Se creo para valorar la radioterapia externa como monoterapia.
3. Hay un efecto censor por las fechas retrospectivas.
4. Hay un potencial para falsos positivos secundarios a los rebotes benignos del PSA asociados a hormonoterapia, braquiterapia e irradiación externa.
5. Hay una falta de correlación con la progresión clínica.
Especificidad y sensibilidad
Dentro del nuevo consenso se planteo la necesidad de clarificar el "end-point" de la definición. Si este se basa en conocer si el paciente esta curado o no, el problema serian los falsos positivos en fallos, y que se requerirían unos tiempos de seguimiento excesivamente largos para poder analizar la mayoría de series. El panel de expertos opto por priorizar una definición basada en un resultado clínico por la facilidad de interpretación, eliminando las posibilidades de catalogar a un paciente en fallo clínico cuando la recidiva es clínicamente insignificante. Es decir se priorizaba la especificidad. Desafortunamente, una definición que enfatiza la especificidad para un evento clínico magnifica la frecuencia de curación. Un ejemplo podría ser considerar un nivel de PSA de 20 ng/ml como recidiva. De esta manera, la posibilidad de encontrar metástasis óseas en la gammagrafía es muy superior a si empleamos el valor de 1 ng/ml. Así si la prioridad es identificar curaciones, la sensibilidad es la prioridad, mientras que si lo que prima es identificar recidivas locales, regionales o a distancia, o riesgo de muerte, lo prioritario es la especificidad.
La predicción de la progresión de la enfermedad basada en la cinética del PSA, en combinación con otros factores clínicos como el PSA pre tratamiento, la T del estadiaje o la dosis de radioterapia podría ser empleada para monitorizar la progresión de la enfermedad. Esta estrategia se pensó en principio para ser empleada en pacientes tratados con radioterapia exclusiva y no en pacientes sometidos adicionalmente a hormonoterapia o braquiterapia. Un inconveniente es que esta estrategia no ha sido muy testada de forma prospectiva y que es complicada de efectuar. (18)
Recidiva bioquímica y radioterapia externa exclusiva
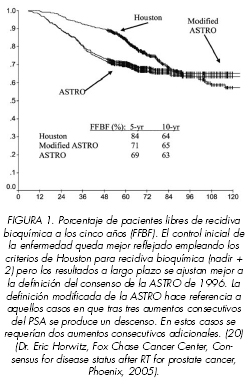
Para pacientes con enfermedad localizada tratados con radioterapia exclusiva D.Kuban (14) recopilo los datos de nueve instituciones incluyendo 4839 pacientes afectos de carcinoma de prostata T1-2. Con una mediana de 6.3 anos de seguimiento, aproximadamente un tercio de los pacientes obtuvo un nadir de <0.5 ng/ml, un tercio entre 0.5 y 1.0 ng/ml y el resto de nadir fue > 1.0 ng/ml. Existen diferencias en el riesgo de recidiva en función si se adopta la definición con valores de PSA retrospectivos o bien si se adopta la fecha de la recidiva de forma prospectiva. También evidencio en esta serie que el valor de los aumentos del PSA transitorios se producían en un 26% de los pacientes en los primeros 5 anos con un valor medio de 0.7 ng/ml. La definición con medición retrospectiva de los valores del PSA es sensible al tiempo de seguimiento. Esta sensibilidad puede desaparecer si se adoptan definiciones con valores prospectivos. Existen diferentes modelos de definición mas sensibles y específicos, pero un buen modelo podría ser considerar el nadir + 2 ng/ml. Este valor es mas sensible, especifico, robusto y generalizable para pacientes con riesgo bajo, intermedio y alto. Por el contrario, la definición ASTRO empeora de forma progresiva con el aumento de los grupos de riesgo de los pacientes. Es de destacar que con un tiempo de seguimiento corto , los resultados usando nadir +2 se ajustan mas a eventos clínicos que con la definición ASTRO del 1996, pero con un seguimiento largo, esta ultima definición de recidiva bioquímica, tiende a ser mejor. (19) (Figura 1).
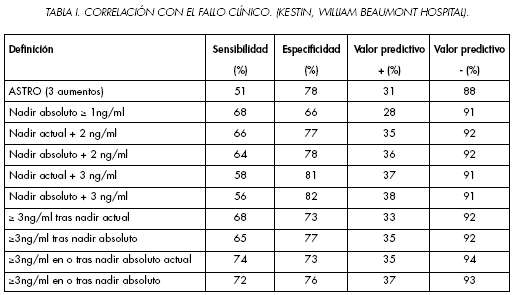
En la serie del William Beaumont Hospital se analizaron 1457 pacientes afectos de un carcinoma de próstata T1-3 con una dosis media de 66 Gy. La media del nadir del PSA fue de 0,7 ng/ml y a los 10 anos el 13% tenían una recidiva locoregional y el 14% metástasis. En este estudio el empleo de hormonoterapia de rescate no se contemplo como fallo bioquímico en el análisis. (20). Empleando el fallo clínico como "end point", comparo la sensibilidad, especificidad y valor predictivo positivo en 10 escenarios diferentes (Tabla I). En la Tabla II se puede ver que los pacientes en que el PSA iguala o excede 3,0 ng/ml tras el nadir, tenían la asociación mayor para presentar un fallo local a los 10 anos. No obstante un 13% de los pacientes con fallo clínico permanecían bioquímicamente controlados.
Recidiva bioquímica y tratamientos combinados con hormonoterapia
Cuando se ha empleado la hormonoterapia de forma adyuvante, el escenario cambia por completo. En la conferencia de consenso se presentaron los datos de la British Columbia Cancer Agency de Vancouver. De 1885 pacientes tratados con irradiación externa, el 46% habían sido tratados con hormonoterapia y de 483 tratados con implante permanente prostático, el 70% habían sido tratados con hormonoterapia con un seguimiento mínimo de tres anos. Es de destacar que el 95% de los hombres recuperaban los niveles de testosterona como antes de la castración con una mediana de 10 meses (21). Este centro reporto la idoneidad de la definición de nadir + 2 ng/ml para detectar recidivas en pacientes tanto tratados con hormonoterapia como sin ella. La definición ASTRO se asocia a un numero importante de falsos positivos para recidiva bioquímica debido al rebote del PSA al parar el bloqueo hormonal en comparación con el nadir +2 o 3 (28% vs. < 5% para los dos últimos). A los pacientes tratados con deprivación androgénica se debería sustraer del seguimiento el tiempo en que los niveles de testosterona son de castración, por termino medio 10 meses. (21).
Otra experiencia pivotal en este contexto es la del Fox Chase Cancer Center de Philadelphia (22). Analizó 688 pacientes afectos de carcinoma de próstata con estadios T1c-T3 Nx-N0 M0 que habían recibido radioterapia exclusiva o bien radioterapia combinada con hormonoterapia con un seguimiento mínimo de cuatro anos para los pacientes que no habían recibido hormonoterapia y de cinco para los que si. Se compararon las definiciones del consenso de la ASTRO del 1996, la del consenso de la ASTRO modificado (requiere dos incrementos consecutivos del PSA si tras el tercer aumento consecutivo de PSA hay una disminución del mismo) y la definición de Houston (nadir + 2 ng/ml). Las tasas de no correspondencia con la definición para recidiva bioquímica empleando la definición del nadir + 2 fueron del 2% para radioterapia sola y 0% para radioterapia asociada a hormonoterapia en comparación con 0% y 0% para la definición modificada de la ASTRO y 5% y 23% para la definición de la ASTRO respectivamente. La definición del nadir + 2 no parecía ser influenciada por el periodo de seguimiento, era mas especifica que la del consenso de la ASTRO (80% si RT exclusiva, 75% si RT con hormonoterapia), tenia un valor predictivo positivo mayor sin o con empleo de hormonoterapia (36% vs 25%) y una precisión superior (RT, 81% vs RT con hormonoterapia, 77%). Es de destacar que una gran proporción de recidivas bioquímicas fueron diagnosticadas en los primeros dos anos de seguimiento con la definición del nadir + 2 ng/ml en comparación con la de la ASTRO (13% vs 5%, p=0.0138) (Figura 2).
En el contexto de la combinación de irradiación externa y bloqueo hormonal se ha comunicado recientemente los datos del ensayo de la RTOG 9202 en que los pacientes con cáncer de próstata de riesgo intermedio y alto son sometidos a hormonoterapia neoadyuvante seguida o no de bloqueo androgénico 24 meses tras la radioterapia. Se ha valorado el tiempo de doblaje del PSA (PSADT) como predictor de muerte ya que la definición ASTRO no cumplía los criterios de Prentice. Basados en este análisis, el PSADT < 12 meses cumplía los criterios de Prentice debiendo ser considerado como "end point" en futuros ensayos. (17).
Nivel del nadir de PSA y técnicas de tratamiento
Los niveles del nadir de PSA dependen de la técnica de radiaciones empleadas. Por ejemplo, los niveles de nadir oscilan entre 0,6 ng/ml para pacientes tratados con 70 Gy de irradiación externa a 0,3 ng/ml para pacientes tratados con 79 Gy a 0,1 ng/ml o menos para los que fueron tratados con irradiación externa e implante permanente de próstata. El grado de ablación prostática es diferente si se emplea la irradiación externa o la combinación de esta con la braquiterapia tal como se evidencian en los estudios de resonancia magnética endorrectal espectroscopica. (23). Estos hechos implican que una sola definición de fallo puede no ser valida para todas las modalidades terapéuticas. El empleo de la definición como fallo bioquímico el nadir +2 o +3 podría mantener la tasa de falsos positivos entre el 3% y el 5%. (20).
Rebote del PSA post radioterapia o "bounce"
El ascenso inicial del PSA superior a 0,4 ng/ml tras el tratamiento, o el ascenso mayor o igual al 15% del valor previo separado 6 meses en los primeros 60 meses de seguimiento se conoce como rebote del PSA o "bounce" si posteriormente desciende al nivel de valores previos al ascenso o inferiores. (24,25,26). Un rebote de los valores del PSA se identifica entre el 12% al 33% de los pacientes sometidos a irradiación externa, con un tiempo medio de 9 meses (26). El rebote del PSA no es predictor de fallo bioquímico y no debe emplearse como un indicador único de recidiva, aunque si es conocido que los pacientes que desarrollan múltiples oscilaciones del PSA tienen un mayor índice de recidivas. (25).
Biopsia post tratamiento con radioterapia
Hay autores, como Crook et al (27) que defienden que la biopsia prostática trans-rectal guiada por ecografía, realizada de forma sistemática y rutinaria, podría ser un buen método para evaluar el control tumoral tras la radioterapia. Observaron que las biopsias secuenciales positivas, con el tiempo, frecuentemente se negativizaban, recomendando el tiempo optimo de biopsia tras la radioterapia entre 24 a 30 meses. (28). El problema fundamental esta en la interpretación de la biopsia post tratamiento ya que es muy complejo. Incluso en centros con patólogos muy especializados en patología prostática, entre un 3% y un 40% quedan como indeterminadas. Además hay una variabilidad significativa inter observador y poco consenso entre patólogos. Las tinciones inmunohistoquímicas para PSA, queratinas de alto peso molecular y el antígeno de proliferación nuclear, han aumentado la sensibilidad y especificidad de las biopsias dadas como positivas y la correlación del estatus de la biopsia con el nadir de PSA post radioterapia (29).
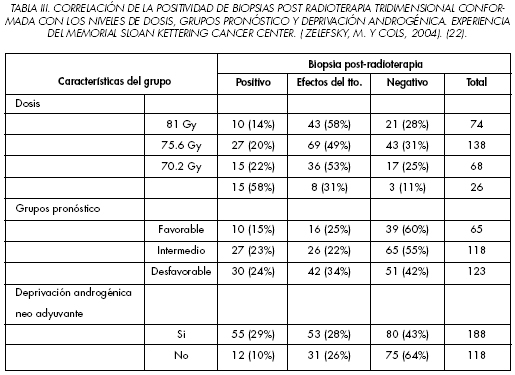
Es de destacar la experiencia de Zelefsky y cols. (32) en que comunican los resultados a largo plazo de control bioquímico en una serie de pacientes sometidos a radioterapia tridimensional conformada. Efectuaron trescientas biopsias a los tres anos de finalizar la radioterapia. Estas se caracterizaron como positivas (adenocarcinoma de próstata sin cambios debidos al tratamiento), negativas (sin tumor) o con severos cambios inducidos por el tratamiento (células tumorales residuales con cambios por radioterapia). Analizaron los diferentes niveles de dosis empleados y efectuaron una estratificación en función de los diferentes grupos de riesgo. (Tabla III). La tasa de supervivencia libre de progresión bioquímica a los cinco anos para los pacientes con biopsia negativa, con biopsia positiva con cambios por el tratamiento y biopsia positiva fueron del 58%, 47% y 11% respectivamente (p<0.001). Estas resultados se mantenían para todos los grupos pronostico. Las conclusiones fueron que las biopsias negativas tras el tratamiento de radioterapia tridimensional se correlacionaban con resultados duraderos de control bioquímico. Los pacientes con biopsias positivas con cambios extensos post tratamiento, experimentaban unos valores de supervivencia libre de recidiva bioquímica similar a los pacientes con biopsias negativas.
Actualmente la biopsia post tratamiento se emplea a pacientes con la sospecha de recidiva exclusivamente local para dirigirlos a tratamientos locales de rescate. Los criterios para el diagnostico de carcinoma post-tratamiento se deben homogeneizar antes de establecer esta prueba de forma rutinaria en la evaluación de respuesta al tratamiento. (30,31).
Técnicas de imagen
Las mediciones seriadas del PSA pueden orientar a un fallo del tratamiento de una forma precoz, pero no del sitio de la recidiva. Hay autores que aconsejan técnicas de imagen en el contexto de una recidiva bioquímica solo si el grado de Gleason inicial es mayor de 7 o el PSA superior a 50 ng/ml. (33).
La imágenes generadas con tecnecio-99 unido a difosfonato es la técnica mas empleada para la detección de metástasis óseas. (34) Debido a que el ascenso del PSA se anticipa a la potencial detección de metástasis en pacientes con cáncer de próstata, esta prueba no se aconseja de forma rutinaria a los pacientes en seguimiento. (35,36). La gamma grafía ósea se debiera emplear para diferenciar la recidiva local de la sistémica en pacientes con PSA ascendente, aunque se ha demostrado que en pacientes con PSA < 20 ng/ml y Gleason mayor de 7, o para valores de PSA inferiores a 50 ng/ml y Gleason inferior a 8, la posibilidad de una gamma grafía ósea de salir positiva es inferior al 10% (33). Esta prueba no debiera utilizarse en pacientes con valores muy bajos de PSA.
El capromab pentedetide (ProstaScint) es una forma conjugada del anticuerpo monoclonal de la inmunoglobulina murina G1contra el antígeno prostático especifico de membrana (PSAMA). El capromab pentedetide con Indio-111 es capaz de discernir tejido tumoral en partes blandas así como hueso, teniendo la autorización para la detección de metástasis de partes blandas. Una comparación reciente entre capromab pentedetide, TC y resonancia de cara a la detección de tejido tumoral en 51 pacientes intervenidos de cáncer de próstata, demostró que el capromab pentedetide tiene una sensibilidad del 75% para la detección de la afectación ganglionar, en comparación con el 20% de la detección de TC o RM. La sensibilidad y el valor predictivo positivo para la imagen de capromab pentedetide es del 86% y 79% respectivamente en comparación con una sensibilidad y valor predictivo positivo del 68% y 31% para el TC o RM respectivamente. (37). La interpretación de las imágenes generadas con capromab pentedetide es difícil y requiere un aprendizaje especifico por lo que esta prueba no se contempla como rutinaria en el seguimiento de los pacientes.
La tomografía con emisión de positrones (PET), en especial con 18-fluorodesoxiglucosa (FDG) es una prueba rutinaria para la detección de metástasis en varios tumores. El bajo consumo celular de FDG por las células tumorales prostáticas ha limitado su uso tanto en la estadificación como en el seguimiento de los pacientes con adenocarcinoma de próstata. (38,39).
Otros trazadores en fase de investigación clínica como la C11 Colina, acetato y fluorocolina parecen ser mas específicos para la filiación de una recidiva bioquímica que la FDG, pero la disponibilidad esta por el momento limitada a centros investigadores (40).
Recomendaciones finales del Consenso de la ASTRO del 2006
Las recomendaciones finales (20) fueron considerar un incremento de 2 ng/ml o mas sobre el nadir de PSA (definido como el mas bajo conseguido) como el estándar actual para definir un fallo bioquímico en pacientes tratados con radioterapia con o sin un curso corto de hormonoterapia. La fecha de fallo debe ser comunicada de forma prospectiva, no retrospectiva. Si embargo se deben descartar errores de laboratorio o episodios de prostatitis en que el PSA desciende tras el uso de antibióticos. Los pacientes que no cumplen estos criterios de fallo bioquímico pero en los que se emplean tratamientos de rescate como la deprivación androgénica, la prostatectomía radical o la crioterapia, deben ser considerados como fallo del tratamiento en el momento que se obtiene una biopsia positiva o bien se administra la terapia de rescate. Para los pacientes que han recibido hormonoterapia, la definición del Consenso de la ASTRO de 1996 es inapropiada. Esta definición puede seguir empleándose en los pacientes sometidos a irradiación externa o braquiterapia como monoterapias, siempre y cuando el seguimiento sea apropiado. Para ello se deben citar los datos del seguimiento medio y de dos anos antes. Por ejemplo, si la mediana de seguimiento es de solo 5 años, los datos del control a los tres anos deben ser citados. De este modo, para comunicar los datos de control bioquímico a los 5 anos se requiere un seguimiento mínimo de 7 años.
Bibliografía y lecturas recomendadas (*lectura de interes y ** lectura fundamental)
1. HODGSON, D.; CATION, C.; WARDE, P. y cols.: "The impact of irregularly rising prostate specific antigen and "impending failure" on the apparent outcome of localized prostate cancer following radiotherapy". Int. J. Radiat Oncol. Biol. Phys., 49: 957, 2001. [ Links ]
2. PICKLES, T.; DUNCAN, G.; KIM SING, C. y cols.: "PSA relapse definitions the Vancouver rules show superior predictive power". Int. J. Radiat. Oncol. Biol. Phys., 43: 699, 1999. [ Links ]
3. JOHNSTONE, P.; McFARIAND, J.; RIFFENBURGH, R. y cols.: "Efficacy of digital rectal examination after radiotherapy for prostate cancer". J. Urol., 166: 1684, 2001. [ Links ]
4. CRITZ, F.; WILLIAMS, W.; HOLLADAY, C. y cols.: "Post treatment PSA < or + 0.2 ngImI defines disease freedom after radiotherapy for prostate cancer using modern techniques". Urology, 54: 968, 1999. [ Links ]
5. CROOK, J.; CHOAN, E.; PERRY, G. y cols.: "Serum prostate specific antigen profile following radiotherapy for prostate cancer: implications for patterns of failure and definition of cure". Urology, 51: 566, 1998. [ Links ]
6. HANLON, A.; DIRATZOUIAN, H.; HANKS, G.: "Posttreatment prostate specific antigen nadir highly predictive of distant failure and death from prostate cancer". Int. J. Radiat. Oncol. Biol. Phys., 53: 297, 2002. [ Links ]
7. HANLON, A.; HANKS, G.: "Scrutiny of the ASTRO consensus definition of biochemical failure in irradiated prostate cancer patients demonstrates its usefulness and robustness. American Society for Therapeutic Radiology and Oncology". Int. J. Radiat. Oncol. Biol. Phys., 46: 559, 2000. [ Links ]
*8. POLLACK, A.; ZAGARS, G.; ANTOLAK, J. y cols.: "Prostate biopsy status and PSA nadir level as early surrogates for treatment failure: analysis of a prostate cancer randomized radiation dose escalation trial". Int. J. Radiat. Oncol. Biol. Phys., 54: 677, 2002. [ Links ]
9. ROACH, M.: "The role of PSA in the radiotherapy of prostate cancer". Oncology, 10: 1143, 1996. [ Links ]
*10. HORWITZ, E.; VICINI, F.; ZIAJA, E. y cols.:"The correlation between the ASTRO consensus panel definition of biochemical failure and clinical outcome for patients with prostate cancer treated with external beam irradiation". American Society of Therapeutic Radiology and Oncology. Int. J. Radiat. Oncol. Biol. Phys., 41: 267, 1998. [ Links ]
11. TAYLOR, J.; GRIFFITH, K.; SANDLER, H.: "Definitions of biochemical failure in prostate cancer following radiation therapy". Int. J. Radiat. Oncol. Biol. Phys., 50: 1212, 2001. [ Links ]
**12. ASTRO consensus statement: Guidelines for PSA following Radiation Therapy. Int. J. Radiat. Oncol. Biol. Phys., 37: 1035, 1997. [ Links ]
13. VICINI, F.A.; KESTIN, L.L.; MARTINEZ, A.A.: "The importance of adequate follow-up in defining treatment success after external beam irradiation for prostate cancer". Int. J. Radiat. Oncol. Biol. Phys., 45: 553, 1999. [ Links ]
*14. THAMES, H.; KUBAN, D.; LEVY, L. y cols.: "Comparison of alternative biochemical failure definitions based on clinical outcomes in 4389 prostate cancer patients treated by external beam radiotherapy between 1986-1995". Int. J. Radiat. Oncol. Biol. Phys., 57: 929, 2003. [ Links ]
15. MERRICK, G.S.; BUTTLER, W.M.; GALBREATH, R.W. y cols.: "Five-year biochemical outcome following permanent interstitial brachytherapy for clinical T1-T3 prostate cancer". Int. J. Radiat. Oncol. Biol. Phys., 51: 41, 2001. [ Links ]
16. SYLVESTER, J.E.; BLASKO, J.C.; GRIMM, P.D. y cols.: "Ten-year bio-chemical relapse-free survival after external beam radiation and brachytherapy for localized prostate cancer: The Seattle experience". Int. J. Radiat. Oncol. Biol. Phys., 57: 944, 2003. [ Links ]
17. HANKS, G.E.; PAJAK, T.F.; PORTER, A. y cols.: "Phase III trial of long-term adjuvant androgen deprivation after neoadjuvant hormonal cytoreduction and radiotherapy in locally advanced carcinoma of the prostate: The Radiation Therapy Oncology Group Protocol 92-02". J. Clin. Oncol., 21: 3972, 2003. [ Links ]
18. TAYLOR, J.M.; YTT, M.; SANDLER, H.M.: "Individualized predictions of disease progression following radiation therapy for prostate cancer". J. Clin. Oncol., 23: 816, 2005. [ Links ]
19. SUBAN, D.A.; THAMES, H.D.; LEVY, L.B. y cols.: "Long-term multiinstitutional analysis of stage TI-T2 prostate cancer treated with radiotherapy in the PSA era". Int. J. Radial. Oncol. Biol. Phys., 57: 915, 2003. [ Links ]
**20. ROACH, M.; HANKS, G.; THAMES, H. y cols.: "Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: Recommendations of the RTOG-ASTRO Phoenix Consensus Conference". Int. J. Radial. Oncol. Biol. Phys., 65: 965, 2006. [ Links ]
21. PICKLES, T.; AGRANOVICH, A.; BERTHELET, E. y cols.: "Testosterone recovery following prolonged adjuvant androgen ablation for prostate carcinoma". Cancer, 94: 362, 2002. [ Links ]
*22. BUYYOUNOSKI, M.; HANLON, A.; EISENBERG, D. y cols.: "Defining Biochemical failure after radiotherapy with and without androgen deprivation for prostate cancer". Int. J. Radial. Oncol. Biol. Phys., 63: 1455, 2005. [ Links ]
23. PICKETT, B.; TEN HAKEN, R.K.; KURHANEWIEZ, J. y cols.: "Time to metabolic atrophy after permanent prostate seed implantation based on magnetic resonance spectroscopic imaging". Int. J. Radiat. Oncol. Biol. Phys., 59: 665, 2004. [ Links ]
24. DAS, P.; CHEN, M.; VALENTINE, K. y cols.: "Using the magnitude of PSA bounce after MRI-guided prostate brachytherapy to distinguish recurrence, benign precipitating factors, and idiopathic bounce". Int. J. Radiat. Oncol. Biol. Phys., 54: 698, 2002. [ Links ]
*25. HANLON, A.; PINOVER, W.; HORWITZ, E. y cols.: "Patterns and fate of PSA bouncing following 3DCRT". Int. J. Radiat. Oncol. Biol. Phys., 55: 845, 2001. [ Links ]
26. ROSSER, C.; KUBAN, D.; LEVY, L. y cols.: "Prostate specific antigen bounce phenomenon after external beam radiation for clinically localized prostate cancer". J. Urol., 168: 2001, 2002. [ Links ]
27. CROOK, J.; ROBERTSON, S.; COLLIN, G. y cols.: "Clinical relevance of trans-rectal ultrasound, biopsy, and serum prostate-specific antigen following external beam radiotherapy for carcinoma of the prostate". Int. J. Radiat. Oncol. Biol. Phys., 27: 31, 1993. [ Links ]
28. CROOK, J.; PERRY, G.; ROBERTSON, S. y cols.: "Routine prostate biopsies following radiotherapy for prostate cancer: results for 226 patients". Urology, 45: 624, 1995. [ Links ]
*29. CROOK, J.; BAHADUR, Y.; BOCICK, R. y cols.: "Radiotherapy for localized prostate carcinoma. The correlation of pretreatment prostate specific antigen and nadir prostate specific antigen with outcome as assessed by systematic biopsy and serum prostate specific antigen". Cancer, 79: 328, 1997. [ Links ]
30. LUKKA, H.; HAYTER, C.; JONES, E. y cols.: "Assessment of post-radiation prostatic needle biopsies for residual adenocarcinoma: a study of interobserver agreement (abstract)". Radiother Oncol. 65: 13, 2002. [ Links ]
**31. COX, J.; GALLAGHER, M.; HAMMOND, E. y cols.: "Consensus statements on radiation therapy of prostate cancer: guidelines for prostate re-biopsy after radiation and for radiation therapy with rising prostate-specific antigen levels after radical prostatectomy". American Society for Therapeutic Radiology and Oncology consensus panel. J. Clin. Ocol., 17: 1155, 1999. [ Links ]
32. ZELEFSKY, M.J.; CHAN, H.M.; FUKS, Z. y cols.: "Correlation of long term bioquemical outcome with post treatment biopsy results for patients treated with 3-D dimensional conformal radiotherapy for prostate cancer". Int. J. Radiat. Oncol. Biol. Phys, 60: 170, 2004. [ Links ]
33. ALBERTSEN, P.; HANLEY, J.; HARLAN, L. y cols.: "The positive yield of imaging studies in the evaluation of men with newly diagnosed prostate cancer: a population based analysis". J. Urol., 163: 1138, 2000. [ Links ]
34. O'SULLIVAN, J.; COOK, G.: "A review of the efficacy of bone scanning in prostate and breast cancer". Q. J. Nucl. Med., 46: 152, 2002. [ Links ]
35. MILLER, P.; EARDLEY, L.; KIRBY, R.: "Prostate specific antigen and bone scan correlation in the staging and monitoring of patients with prostatic cancer". Br. J. Urol., 70: 295, 1992. [ Links ]
36. TERRIS, M.; KLONECKE, A.; McDOUGALL, L. y cols.: "Utilization of bone scans in conjunction with prostate-specific antigen levels in the surveillance for recurrence of adenocarcinoma after radical prostatectomy". J. Nucl. Med., 32: 1713, 1991. [ Links ]
37. HINKLE, G.; BURGERS, J.; NEAL, C. y cols.: "Multicenter radioimmunoscintigraphic evaluation of patients with prostate carcinoma using Indium-111 capromab pendetide". Cancer, 83: 739, 1998. [ Links ]
38. PRICE, D.T.; COLEMAN, R.E.; LIAO, R.P. y cols.: "Comparison of (18 F) fluorocholina and (18F) fluorodesoxyglucose for positron emission tomography of androgen dependent and androgen independent prostate cancer". J. Urol., 168: 273, 2002. [ Links ]
39. SALMINEN, E.; HOGG, E.; BINNS, D. y cols.: "Investigations with FDG-PET scanning in prostate cancer show limited value for clinical practice". Acta oncol., 41: 425, 2002. [ Links ]
40. TOMBAL, B.: "Alternatives to imaging". Prostate Cancer Symposium, San Francisco. p-85, ASCO 2006. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier Maldonado Pijoan
Oncología Radioterápica
Hospital Universitari Vall d'Hebron
Passeig Vall d'Hebron Barcelona. (España)
xmaldona@vhebron.net