Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.61 no.4 may. 2008
Fibrohistiocitoma maligno "inflamatorio" de cordón espermático con infiltración sobre un leiomioma inguinal. Presentación de 1 caso con revisión conceptual y de la literatura
Inflammatory malignant fibrous histiocytoma of the spermatic cord infiltrating an inguinal leiomyoma. Case report with conceptual and bibliogrphic reviews
Juan Manuel Ruiz Liso, Juan Ruiz García1, María Luisa Pardo López, Agustín Vaillo Vinagre, Antonia Gutiérrez Martín, María Cruz Marrón Martínez y María Ascensión García Pérez.
Servicio de Patología y Servicio de Urología. Complejo Hospitalario de Soria Hospital Virgen del Mirón. Soria. Hospital Gregorio Marañón1. Madrid. España.
Dirección para correspondencia
RESUMEN
Objetivo: Estudiar los fibrohistiocitomas malignos (FHM) paratesticulares desde el punto de vista clínico-histológico, inmunohistoquímico y su histogénesis.
Métodos: A través de Medline y búsqueda no indexada de la literatura científica internacional hemos encontrado un total de 77 casos de FHM paratesticulares que globalmente plantean problemas diagnósticos, terminológicos y terapeúticos.
Resultado: Incluímos el caso número 78 de FHM de cordón espermático que presenta unas especiales características (no descritas hasta la fecha) de fistulización cutánea e infiltración de un leiomioma inguinal, con confirmación histológica e inmunohistoquímica. Realizamos una revisión conceptual de este tipo de neoplasias incluyendo la valoración de las contradicciones y reclasificaciones que ha sufrido desde su primera descripción, lo que hace que sean subestimados y su prevalencia real en las series internacionales sea muy variable: del 7 al 37% de los sarcomas paratesticulares. También, el hecho de su baja incidencia ha condicionado una carencia de protocolos de diagnóstico y tratamiento.
Conclusiones: Los tumores paratesticulares, aunque infrecuentes, tienen una alta tasa de malignidad. El concepto de FHM ha variado a lo largo de los últimos 15 años. Hoy, este término, es sinónimo de sarcoma pleomórfico indiferenciado y ha llegado a ser un diagnóstico de exclusión (Vimentina + / CD 68 + -ocasionalmente- sin diferencias ultraestructurales), reservándose el subtipo inflamatorio para aquellos que tienen un componente inflamatorio e histiocítico. Es imprescindible en esta localización la realización de una biopsia intraoperatoria, ya que incluso es difícil precisar preoperatoriamente, si una lesión es benigna o maligna. El diagnóstico diferencial tan solo se resuelve tras el estudio microscópico e inmunohistoquímico. Un leiomioma próximo a esta localización (inguinal) podría diagnosticarse y confundirse con un nódulo del FHM principal. Su inmunofenotipo nos permitió diagnosticarlo no solo como leiomioma (marcadores de actinas y desmina positivos), sino también observar la infiltración por el FHM.
Palabras clave: Fibrohistiocitoma maligno. Cordón espermático. Leiomioma.
SUMMARY
Objectives: To study paratesticular malignant fibrous histiocytomas (FHM) from the clinical, histological, immunohistochemical and histogenetic, point of view.
Methods: Through Medline and not index-linked search of international scientific literature we have found a total of 77 cases of paratesticular FHM that globally create diagnostic, terminological and therapeutic problems.
Results: We include the case number 78 of FHM of spermatic cord, that presents a few special characteristics (not described before) of cutaneous fistula and infiltration of an inguinal leiomyoma, with histological and immunohistochemical confirmation. We performed a conceptual review of this type of tumours, including the evaluation of contradictions and reclassifications that has undergone from its first description, which causes that they are underestimated and their real prevalence in international series is very variable: from 7 to 37 % of paratesticular sarcomas. Also, the fact of their low incidence has determined the lack of protocols for diagnosis and treatment.
Conclusions: Paratesticular tumours, although infrequent, have a high rate of malignancy. The FHM concept has varied throughout the last 15 years. Today, this term is synonymous of pleomorphic undifferentiated sarcoma and has been an exclusion diagnosis (Vimentin [+] / CD 68 [+] - occasionally - without ultrastructural differences), reserving the inflammatory subtype for which they have an inflammatory and histiocytic component. The accomplishment of an intraoperatory biopsy is essential in this location, since it is even difficult to know preoperatively, if a lesion is benign or malignant. The differential diagnosis is only solved after microscopic and inmunohistochemical study. Leiomyoma next to this location (inguinal) could be diagnosed and confused with a nodule of the main FHM. Their immunophenotype allowed us to diag-nose it not only as leiomyoma (myogenic markers were positive -non skeletal muscle-), but also to observe the infiltration by the FHM.
Key words: Malignant fibrous histiocytoma. Spermatic cord. Leiomyoma.
Introducción
La región paratesticular es un área anatómica compleja que contiene el conducto deferente, las túnicas vaginales testiculares, epidídimo y restos vestigiales así como los testículos. Histogenéticamente, este área está compuesta de varias estructuras tisulares: epiteliales, mesoteliales y mesodérmicas. Por este motivo, los patrones tumorales que surgen en esta región son heterogéneos y con diferente biología. Clínicamente los tumores paratesticulares son indistinguibles de los tumores testiculares, lo que provoca que inicialmente se presten a un diagnóstico erróneo. La mayoría se presentan como una masa escrotal o bien como una tumefacción que puede o no ser dolorosa y ocasionalmente acompañarse de un hidrocele. No suele distinguirse preoperatoriamente entre lesiones benignas y malignas paratesticulares, lo que incide en un problema sobreañadido (1,2).
Aunque infrecuentes, tienen una elevada tasa de malignidad y se estima que el 30% de los tumores paratesticulares son malignos y el 70% benignos, con dificultad para determinar con exactitud la localización exacta de estos y su origen, siendo el cordón espermático el más frecuente (90%) (1,2). Aproximadamente el 50% de estos tumores recurren a nivel locoregional y las metástasis a veces aparecen incluso 15 años después de la extirpación de la lesión primaria (3,43). Señalar también que la incidencia de las lesiones paratesticulares de partes blandas es difícil de estimar, especialmente en el caso de los tumores benignos, que generalmente no suelen ser publicados (4).
Los tumores del cordón espermático y del tejido paratesticular son raros y su verdadera incidencia no se ha establecido nunca. Lo que es evidente es que la mayoría de los tumores malignos paratesticulares son sarcomas. Significar, también, que la presencia de hidrocele en asociación con un tumor paratesticular es generalmente un signo de malignidad (2, 43, 44).
Señalar que, los leiomiomas son los tumores mesodérmicos benignos más frecuentes en los tejidos de partes blandas, aunque se cuestiona su existencia en las zonas profundas, postulándose su malignidad en dichas localizaciones así como su origen vascular (5 - 7).
De la prevalencia e incidencia de sarcomas, que anualmente se diagnostican, puede servir de referencia los 9420 casos nuevos registrados en el año 2005 y los 8300 en el 2001, en los EE. UU. de Norteamérica y que representan menos del 1% de los tumores malignos que se diagnostican en ese país (14). Los sarcomas son tumores infrecuentes, representando los del tracto genitourinario menos del 5% del total y del 2% de todos los tumores urológicos. En concreto, en el Memorial Sloan-Kettering Cancer Center de Nueva York, sobre un total de más de 5.000 sarcomas tratados, los localizados en el cordón espermático no llegaban al 1% (9). El cordón espermático es la afectación urológica más frecuente, y le corresponden el 30% aproximadamente de todos los sarcomas genitourinarios. (8 - 11, 14, 38, 53).
La investigación, en los sarcomas del cordón espermático, ha sido difícil debido a su rareza. La literatura registró solo 212 casos de 1845 a 1978. Además, ha habido falta de consenso en la estrategia quirúrgica y terapéutica. Con excepción del rabdomiosarcoma embrionario, no hay en la actualidad diferencias significativas en el pronóstico de los diferentes subtipos sarcomatosos, independientemente del grado tumoral, invasión y del tamaño tumoral (8, 9,14).
La última clasificación de la OMS de los tumores mesenquimales del escroto, cordón espermático y anejos testiculares realizada en 2004 (12) incluye:
- Lipoma
- Linfangioma
- Hemangioma
- Leiomioma
- Neurofibroma
- Schwannoma
- Tumor de células granulares
- Angiofibroma celular: tumor tipo angiomiofibroblastoma del varón
- Pseudotumor fibroso calcificante
- Hamartoma fibroso de la infancia
- Liposarcoma
- Leiomiosarcoma
- Fibrohistiocitoma maligno
- Fibrosarcoma
- Rabdomiosarcoma
A ellos deberíamos añadir el Tumor desmoplásico de células redondas (1).
Los tumores paratesticulares, generalmente, son de origen mesotelial o bien, la mayoría, surgen en partes blandas. Los tumores intraescrotales, no testiculares, derivan del epidídimo, del cordón espermático, de la túnica vaginal, y de los tejidos o partes blandas del escroto: adiposo, fibroconectivo, muscular, linfático y nervioso, sin olvidar los tumores metastásicos. La prevalencia de malignidad apenas alcanza el 3% (10, 20). La existencia de masas fibromatosas de las túnicas testiculares se conoce desde que Sir Astley Cooper las publicara en 1830 y Goodwin las describiera en 1946 (19 - 21).
La edad de aparición de los FHM y liposarcomas es también muy semejante, incidiendo en varones de edad avanzada y el 75% se diagnostican entre 50 y 85 años, con una edad -media- en torno a los 60 años. Por debajo de 30 años es muy raro encontrar un tumor de estas características en el escroto (9, 12, 14).
Generalmente se presentan como masas firmes, duras, palpables en el canal inguinal o/y en el escroto, que antes de cualquier intervención quirúrgica deberían ser evaluadas por ecografía escrotal. Si la biopsia intraoperatoria confirma el origen sarcomatoso o maligno de la lesión procede realizar una orquiectomía radical con ligadura alta del cordón espermático y escisión de todos los tejidos blandos periféricos. Los riesgos de recurrencia local son elevados (50-60%), tras la aparente "escisión completa" y con mayor potencial de agresividad que en la lesión primitiva (1,9,14,29,30,53,83).
Al contrario que en otras localizaciones como retroperitoneo y extremidades, en que los FHM son frecuentes, sin embargo, en la zona genitourinaria son muy raros (83).
Las series más grandes de sarcomas del área paratesticular, muestran una incidencia desigual, según las diferentes publicaciones, siendo los de mayor frecuencia los liposarcomas (20-51%) seguidos de los leiomiosarcomas (19-32%) y rabdomiosarcomas (13-45%) con todos sus subtipos (Tabla I).
Los FHM paratesticulares, varían, según la revisión de las series de bibliografía internacional entre el 7 y el 37 % (1, 8, 9, 12, 13, 18, 19, 35, 42 ). No obstante, hay algunos autores (1) que consideran esta incidencia subestimada, al considerar que muchos sarcomas diagnosticados en algunas series como "sarcomas sin especificar" y sarcomas pleomórficos deberían ser reclasificados como FHM. En una serie en que se realizó esta reclasificación sobre un panel de 36 sarcomas paratesticulares, cambió el tipo de diagnóstico en el 35% de los casos y el número de FHM aumentó de 1 a 6 (8). No obstante, dado que la terapia de todo el grupo de estos sarcomas es semejante, y a pesar de la utilización de nuevos marcadores inmunohistoquímicos, el estudio reclasificatorio no ha sido una prioridad por no serlo para los oncólogos.
El primer FHM del cordón espermático, fue descrito en 1972 por Cole y Straus, publicándose tan sólo 25 casos en el periodo 1972-1996 en la bibliografía internacional. (39,45). El Instituto de Patología de las Fuerzas Armadas de los EE.UU. tan sólo recogía tres casos de FHM hasta 1999 (19).
La patogénesis de los FHM es desconocida. Las células neoplásicas tienen características que sugieren un origen fibroblástico, miofibroblástico y/o histiocítico (29,66). Uno de los casos de FHM recogidos en la bibliografía, presenta antecedentes de haber recibido una sustancia desconocida en un campo de concentración nazi en el año 1943 -cuarenta años antes (56)-.
El diagnóstico diferencial de los FHM con otros sarcomas paratesticulares es, a veces, muy difícil, por confluir estirpes celulares muy semejantes y muchos de ellos con células gigantes multinucleadas que también presentan positividad para marcadores histiocitarios, con células dismórficas y pleomórficas que los hacen prácticamente indistinguibles, a pesar de que su inmunofenotipo precisa una amplia batería de negatividades para un diagnóstico de exclusión (14, 47, 51).
Material y método
Revisión Conceptual de los FHM:
El concepto de FHM fue introducido en 1964 por O´Brien y Scout, basado en la morfología y los cultivos celulares (45). Durante muchos años este tumor se ha valorado como el sarcoma más frecuente en adultos y representan del 31,5 -sobre más de 8.200 sarcomas- al 45% de todos los tumores malignos de partes blandas, según las series (39, 46, 83). También hay amplia variación en su localización: 30,7 a 70% surgen en extremidades y de un 11,7 a 16% en retroperitoneo, siendo -como hemos visto- infrecuentes en la región inguinal (1, 9, 13, 14,18, 35, 38, 39, 41, 42, 49). La introducción de técnicas auxiliares que fracasaron, para demostrar alguna evidencia de una diferenciación histiocítica, y el hecho de que neoplasias poco diferenciadas pudieran mostrar áreas indistinguibles de un FHM, llevaron a algunos patólogos a cuestionarlos como una entidad independiente (3).
Fletcher en su conocido trabajo sobre este tipo de neoplasias, pudo identificar un subtipo de sarcoma en el 63% de 159 casos diagnosticados de FHM. En la misma serie demostró que 20 casos no eran neoplasias sarcomatosas. Hoy, se cuestiona por muchos investigadores si realmente el FHM ¿existe? (4). Recientemente estudios de hibridación genómica comparada demostraron que los subtipos de FHM, compartían anormalidades genómicas del leiomiosarcoma o del liposarcoma desdiferenciado, lo que les lleva a pensar en la hipótesis de que el FHM sea un patrón morfológico mas que una verdadera entidad (3). A pesar del descenso de credibilidad de la existencia como tal del FHM, el concepto se ha mantenido por el hecho de que el tipo histológico no tiene trascendencia en la terapia ni en el pronóstico. Recientemente, algunas series han mostrado diferencias significativas en tasa de metástasis y supervivencia entre los sarcomas pleomórficos, justificando una subclasificación. N. de Saint Aubain, también incluye una clasificación en subtipos, con una serie de consideraciones dependiendo de la localización y estirpe. Revisiones críticas de los subtipos, inflamatorio y de células gigantes han demostrado que son patrones inespecíficos más que verdaderos sarcomas (3).
1). Estoriforme-Pleomórfico: patrón inespecífico
2). Mixoide: entidad verdadera
3). De células gigantes: patrón inespecífico
4). Inflamatorio: patrón inespecífico
5). Angiomatoide: entidad verdadera
Sin embargo, el tipo angiomatoide ha sido reclasificado dentro de los tumores fibrohistiocíticos de bajo potencial maligno (52). El fenotipo de los FHM no tiene una especificidad en relación con su línea fibrohistiocítica dentro de los sarcomas. La evidencia de que los FHM son un segundo componente de otros sarcomas, representando una modulación de la progresión tumoral es cada día más evidente para Lagace y Aurias (52). Existen investigaciones genético-moleculares que son compatibles con la hipótesis de que un análisis comparativo entre el desequilibrio genómico más frecuente observado en las series de FHM y de leiomiosarcomas, demuestra que ambos tumores tienen recurrencias semejantes en sus desequilibrios genéticos. Al mismo tiempo, estudios de biología molecular han mostrado dianas semejantes de delecciones en sus cromosomas en ambos sarcomas. A pesar de esto, consideran los autores, que una nueva reclasificación de los sarcomas de partes blandas basado en parámetros moleculares es, en principio, prematura (52).
Destacar por último la significación pronóstica que parece tener la expresión positiva de "ezrin" en algunos casos de FHM y en concreto en los de tipo pleomórfico, como predictor de invasión metastásica en estos tumores (84).
Histopatología
De acuerdo con los criterios de Kempson y cols. (22) que son quienes más ampliamente definen sus caracteres morfo e histopatológicos, los FHM son tumores firmes, lobulados y amarillentos o levemente blanquecinos, siendo inusuales las zonas de hemorragia y necrosis. Microscópicamente se observa, sobre un mar de células inflamatorias, otras células de hábito histiocitario y/o xantomatoso, aunque la necrosis en la mayoría de los casos está ausente. Las células de hábito histiocitario muestran algunos núcleos vesiculares y otros dismórficos atípicos así como presencia de células gigantes bizarras. El componente inflamatorio está compuesto por linfocitos, plasmáticas y eosinófilos. Todo ello acompañado de un componente fibroso o miofibroblástico fusocelular. En algunas células, el hábito es el de un FHM pleomórfico. El componente puede ser marcadamente inflamatorio a expensas de sábanas de polimorfonucleares neutrófilos que pueden envolver y obscurecer las células malignas provocando un retraso en su diagnóstico (30,48).
La necrosis es frecuente en otros subtipos de FHM de alto grado de malignidad, pero no en los de tipo inflamatorio.
Diagnóstico Diferencial (22):
- Procesos Inflamatorios
- Linfomas no Hodgkin
- Linfomas Hodgkin
- Metástasis de Carcinomas
- Metástasis de Melanomas
- Otros Sarcomas –liposarcoma fundamentalmente-
- Otros subtipos de FHM
- Pseudotumor Inflamatorio
Localización
Prácticamente los FHM los encontramos en todas las áreas anatómicas del cuerpo humano, incluyendo no sólo partes blandas, sino también estructuras viscerales y endocrinas: aparato digestivo, mama, corazón, pulmón, hueso, aparato urinario (2, 7, 10, 12-15,22, 23,27, 28, 31,32,48, 83, 84).
Revisión de la Literatura
Revisada la literatura científica a través de MEDLINE y búsqueda no indexada, hemos encontrado hasta el mes de Julio de 2007 un total -tan solo- de 77 casos publicados (completadas a través de otros sistemas de búsqueda), de FHM del cordón espermático y áreas paratesticulares. Nuestro caso es, pues, el número 78 de las series (1, 4, 18, 29, 35-42, 50, 53-65). En la revisión que hizo Miyagi y cols., eran únicamente 20, el número de FHM registrados hasta 1985 (34); Glazier y cols., en su revisión, encuentra un total 25 casos y el suyo 26, hasta 1996 (39). Son los autores japoneses quienes prácticamente han publicado el 40% de los FHM del cordón espermático en la literatura científica (50).
Son tumores que se presentan en la edad adulta y en personas mayores, preferentemente con una edad media de presentación -en el momento diagnóstico- en la sexta y séptima década de la vida, encontrando numerosos casos en mayores de 80 años, como el que presentamos nosotros (1,4,18,29,35-42, 50, 53-65), alcanzando incluso los 90 años (62). El intervalo etario es muy amplio: 32-91 años, aunque sólo encontremos un caso descrito por debajo de los 40 años (29).
El tamaño tumoral es muy variable, encontrando casos aislados menores de 1 cm., y un mayor número de casos entre 5 y 20 cm., en aquellos en que se pudo resecar todo el tumor (29). La mayoría se presentan como masas solitarias aunque en ocasiones existen nódulos satélites tumorales, e invasión de la de la piel escrotal (1,4,18,29,35-42, 50, 53-65). No hemos hallado descrito ninguno que invadiera o metastatizara en tumores subcutáneos de la región inguino-escrotal.
Los datos histopatológicos son escasos en una gran parte de las publicaciones y ausentes en muchas de las series revisadas (29, 30, 34, 36, 41, 42, 53, 55). Además, el contraste diagnóstico ha sido realizado por algunos autores con resultados muy pobres. Así en una revisión de 130 sarcomas de partes blandas, en el caso de los FHM consideran debe realizarse una reevaluación de los criterios histológicos, ya que la validez del diagnóstico del tipo histológico entre 4 patólogos, de reconocido prestigio, tuvo una sensibilidad del 73-75% y una especificidad del 93-95% (54). Sin embargo, hay también quien a través de una punción aspiración con aguja fina, es capaz de diagnosticar un FHM del cordón espermático (55).
El único autor que realiza una amplia revisión de los subtipos histológicos de los FHM del cordón espermático, incluye unos valores porcentuales del 83% para los pleomórficos/storiformes, 9% para los de células gigantes (11% -en otra serie limitada-), 6% los inflamatorios, y un 3% los mixoides (29, 37).
Inmunofenotipo
Además de utilizar aquellos marcadores que nos pueden descartar linfomas, carcinomas y melanomas, hay algunos linfomas anaplásicos que son semejantes a los FHM inflamatorios aunque generalmente no expresan el CD-45 (antígeno común linfocitario). No obstante, es muy raro que los linfomas se manifiesten con el componente inflamatorio de este tipo de FHM (4, 22).
Coindre J.M. (5) en el estudio inmunohistoquímico (IHQ) para el diagnóstico de los tumores de partes blandas que realizó en el año 2003, pone de manifiesto de una forma taxativa que los FHM no tienen marcadores específicos, pero que la inmunohistoquímica debe ser usada como norma para su diagnóstico diferencial con otros tumores sean tumores malignos mesenquimales o no, con una línea específica diferenciadora. Para él, la IHQ es decisiva en los sarcomas paratesticulares en casos de rabdomiosarcomas y tumores vasculares. En los casos de leiomiosarcomas y liposarcomas son inconstantes e inespecíficos y deben ser valorados con precaución. Ya Miettinem en 1990, había enfatizado esta misma opinión (72).
En general en los FHM, hay positividad para vimentina y lisozima en las células mesodérmicas neoformadas, así como también para CD68 a nivel de los histiocitos acompañantes no atípicos (no tumorales). Los marcadores para músculo liso y otras estirpes mesenquimales suelen ser negativos, al igual que para epitelio, mesotelio y melanocitos (29). Los FHM son negativos para citoqueratinas, presentando -en general- expresión positiva para vimentina y alfa-1-antiquimotripsina, y focalmente reactiva para CD 68. Algunos tumores han mostrado también positividad para enolasa neuro-específica y proteína S-100 (84). Son también invariablemente negativos para marcadores hematolinfoides, hecho este a significar, dado que el dismorfismo de las células -semejando células de Reed Sternberg- y el componente inflamatorio pueden sugerir un proceso linfoproliferativo hodgkiniano -tipo celularidad mixta- o bien uno no hodgkiniano (29,67,83).
En la revisión bibliográfica también hemos encontrado tumores escrotales de patrón histológico inusual -fibrohistiocitoma atípico- tanto por su localización como por su inmunofenotipo, con expresión positiva para músculo liso y c-kit (CD117) (33).
Hay investigadores que han reclasificado los sarcomas de partes blandas de sus registros, ya que la inmunohistoquímica ha permitido conocer sus fenotipos, observando a nivel de la región paratesticular el hecho de que el 35% de los mismos estaban mal diagnosticados (periodo 1958-1967) (8).
En cuanto a la evolución y la significación de los marcadores inmunohistoquímicos, ha habido muchos patrones diagnósticos -a lo largo del "tiempo bibliográfico"-, que han sido descartados, después, como no valorables, de igual forma que surgían otros más específicos. Algunos autores establecieron una relación entre la inmunoreactividad positiva para p-53 con un peor pronóstico, independientemente del grado tumoral, mostrando un espectro semejante al de los carcinomas (70). Otros, no justifican esta relación (71) considerando más acertado la sobre expresión de Ki-67 ligada a otros factores pronósticos y siendo -para ellos- el tamaño tumoral y el grado histológico los principales factores pronósticos. Ahlen y cols. en el año 2003, descartan a su vez la implicación pronóstica de p-53, Ki-67 y p27, postulando sin embargo, una relación entre una alta expresión de Bcl-2 y el riesgo de desarrollar metástasis y/o recurrencias (74).
La positividad del factor XIIIa como marcador de los FHM (73) no es signo de especificidad para estos tumores, ni siquiera para los más fibrohistiocíticos de las series.
Por otro lado, es importante significar el trabajo de Potti en 2004, en el que observa en un estudio de 273 sarcomas de partes blandas que la sobre-expresión del marcador c-kit (CD 117) y del factor de crecimiento (VEGF) en FHM incrementa su supervivencia (75).
No obstante, la nosología y la entidad FHM sigue siendo ambigua desde el punto de vista de su inmunofenotipo, incluso en la última clasificación de tumores de la OMS (2, 76). Al menos para su diagnóstico- que será por exclusión- requerirá un panel de actinas, desmina, vimentina, S-100, CD34, CD68, citoqueratinas, CD45, CD3, EMA, BerEp4, CEA, CK 20 y Factor VIII, sin excluir los citados anteriormente (29,67,77,78-80,84). Tampoco podremos olvidar estas técnicas en aquellas tumoraciones infrecuentes por su localización y que en muchos casos corresponden a metástasis de FHM, tan atípicos en su evolución y progresión como puede ser la pared gástrica con 10 casos publicados en la actualidad (79).
La investigación con nuevos marcadores se orienta en la actualidad en la evaluación de mecanismos autocrinos/paracrinos de control de proliferación en estos tumores (81). La angiogénesis de los FHM muestra -junto con los liposarcomas- una mayor densidad de neovasos por unidad de área, que el resto de los sarcomas de partes blandas lo que podría postular una terapia angiogénica complementaria a los métodos tradicionales (82).
El FHM así como el fibrosarcoma son diagnosticados, por exclusión, en base a su morfología e inmunohistoquímica con marcadores sin expresión, en relación al resto de sarcomas (83).
Presentación del caso
Paciente varón de 88 años, invidente -amaurosis- con cuadro depresivo, residente en un establecimiento sociosanitario de ancianos, con tumoración inguino-escrotal izquierda de 4 semanas de evolución, en tratamiento con Cefuroxima desde hace 24 horas. No fiebre ni síndrome miccional.
Presenta externamente una tumoración mal delimitada, fibrosa, fluctuando el apex, sugestiva de absceso de cordón espermático.
La ecografía escrotal muestra junto a un hidrocele bilateral con testes normales una masa de ecoestructura heterogénea con áreas anecoicas, sugestivas de un absceso escrotal.
El TAC abdomino-pélvico presenta una masa escrotal izquierda de naturaleza a determinar con dos nódulos uno de 3,5 cm. hiperdenso y otro en cara posterior de (+/-) 8 cm. de diámetro mayor, que capta contraste, especialmente en la periferia y con abundante gas en su zona central, rodeadas ambas por abundante hidrocele.
El paciente precisa durante su ingreso drenaje de su absceso escrotal y colocación de sonda vesical.
En la exploración quirúrgica se encuentra una tumoración de cordón espermático izquierda y otra a nivel muscular inguinal izquierda, realizando una resección ampliada de ambas tumoraciones.
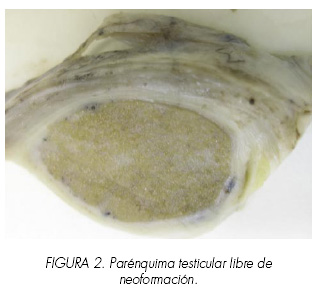
En el servicio de Patología de nuestro Complejo Hospitalario recibimos varias piezas, con especificación, las mayores, de origen escrotal y la menor, de origen muscular inguinal. Las escrotales medían en conjunto 20x8x7cm. y presentaban zonas densas irregulares blanquecinas, nodulares y dismórficas junto a áreas pardas con zonas de hemorragia no estructurada, así como estructuras cutáneas con pérdida tisular de tipo necrótico (Figura 1); contienen también un hidrocele y un testículo -3,7 cm de diámetro- cuyo parénquima está integro, sin signos de infiltración (Figura 2). La lesión remitida como inguinal, de 7x4x5 cm presentaba una neoformación en su interior, bien delimitada, no en capsulada de consistencia firme elástica y blanquecina (Figura 3).
Microscópicamente nos encontramos con dos tumoraciones mesodérmicas de diferente estructura biológica, la primera maligna y la segunda benigna pero con infiltración focal por la primera.
Observamos a nivel escrotal una neoformación mesodérmica atípica con amplias zonas de edema y necrosis tumoral, a expensas de células fusiformes junto a otras epitelioides y mixoides, muchas de ellas bi y trinucleadas, con vesiculación nuclear - de tipo sternbengoide-, marcada anisocitosis y anisocariosis y nucleolos prominentes. El grado de actividad mitótica llega a ser de 5 mitosis atípicas (x cga). Hay zonas de hialinización del estroma con presencia de áreas multifocales con células gigantes multinucleadas, otras estrelladas de aspecto mixoide y un patrón vascular muy prominente con fibrosis hialina en algunas de las paredes vasculares. Áreas pleomórficas con estroma colágeno entremezclado. Citofagocitosis. Es llamativo que toda la neoformación tiene a manera de cubierta un denso proceso inflamatorio agudo y crónico inespecífico con presencia de microabscesos en las zonas más periféricas (Figuras 4 y 5).
Por otro lado, la tumoración de la región inguinal se corresponde también con una proliferación mesodérmica benigna de músculo liso, con micro calcificaciones residuales y marcada hialinización, que muestra focalmente infiltración por la neoplasia mesodérmica descrita a nivel escrotal (Figura 6). Ver inmunofenotipo y panel inmunohistoquímico de ambas tumoraciones (Tabla II).
El diagnóstico se corresponde con un fibrohistiocitoma maligno (FHM) de cordón espermático izquierdo, con inmunofenotipo inespecífico (Tabla II) [Vimentina (+) (Figura 7)/ CD68 (+) para células histiocitarias, y (-) para las células más pleomórficas (Figura 8)], de patrón inflamatorio, grado 3 de la clasificación de French, con hidrocele y leiomioma inguinal subcutáneo e invasión focal por dicho FHM.
Discusión
Presentamos un caso singular de FHM por varios motivos. En primer lugar por su fistulización a superficie cutánea, provocando un primer diagnóstico clínico de absceso paratesticular. Al mismo tiempo nos encontramos a nivel inguinal con un segundo tumor mesodérmico -en este caso benigno y de estirpe muscular lisa- infiltrado su estroma por el primero, según pudimos demostrar inmunohistoquímicamente. Revisada la literatura internacional, no hemos encontrado una evolución neoplásica paratesticular con este comportamiento invasivo. No hemos hallado ningún FHM que infiltre otro tumor mesodérmico de biología diferente, como en nuestro caso y que se pone de manifiesto por el heterogéneo inmunofenotipo de ambas neoplasias.
El número de FHM paratesticulares diagnosticados en nuestro país es también muy bajo y aun así es importante tenerlos presentes tanto desde el punto de vista clínico como anatomopatológico.
También en nuestro caso hemos podido evidenciar macro y microscópicamente su origen en la pared del cordón espermático.
En cuanto al perfil inmunohistoquímico, es evidente -y así lo hemos testado- que su expresión está basada más en la negatividad de sus marcadores que en su positividad.
Sin embargo, la presencia, en el caso que presentamos, de un leiomioma infiltrado por las células neoplásicas del FHM, podría conducir a un diagnóstico erróneo de leiomiosarcoma desde el punto de vista histopatológico, aunque clínica y evolutivamente todos los sarcomas de esta localización tengan un mismo tratamiento oncológico.
Su etiopatogenia es desconocida, aunque exista un caso puntualmente relacionado con las "prácticas médicas hitlerianas" alejadas de la ética más simple.
La edad de presentación de este tipo de tumores es también significativa ya que la mayoría de ellos están por encima de la sexta década de la vida.
Estudios prospectivos randomizados son muy difíciles de hacer, debido a la rareza de los casos en esta localización.
Los tumores paratesticulares, se presentan como masas escrotales o inguino escrotales (como en nuestro caso) que pueden ser dolorosas, más aún si están abscesificadas o fistulizadas y en muchos casos acompañadas de hidrocele.
Es la ecografía el método de diagnóstico más utilizado en la evaluación diagnóstica inicial de las masas escrotales, presentando dificultades en la mayoría de los casos y obligando en la casi totalidad de los casos a una biopsia intraoperatoria, pues incluso es muy difícil precisar preoperatoriamente, si se trata de un tumor benigno o maligno. Ya hemos indicado el diagnóstico diferencial tan amplio que pueden presentar estas neoplasias antes de ser resecadas, y que sólo se resuelve tras el estudio microscópico. Ante una sospecha diagnóstica, la cirugía debe ser radical.
Desde el punto de vista anatomopatológico, es significativo el hecho de que existan muy pocos casos con contraste histológico en los 77 casos hallados en la bibliografía internacional, lo que se presta a muchos interrogantes.
Los estudios de extensión incluyen radiografía simple de tórax, ecografía abdominopélvica, tomografía axial computerizada abdominal y pélvica y una resonancia magnética de la región inguino-escrotal.
El AJCC -American Joint Committee on Cancer- diseñó un protocolo de estadiaje para los sarcomas de esta localización, en el que se valora el tipo histológico, el grado tumoral (G1,G2), el tamaño (>/< 5 cm.), la profundidad (superficial o profunda) y la presencia de metástasis ganglionares o a distancia. Sin embargo, los estudios más amplios y contrastados realizados con este tipo de tumores en los últimos años, consideran el subtipo histológico, la localización de la lesión y el estadío como factores pronósticos independientes, observando mayores supervivencias -con significación estadística- entre los liposarcomas y fibrosarcomas comparados con los FHM y leiomiosarcomas (p<0,001).
Análisis multivariantes mostraron también que la edad avanzada, el sexo varón, las razas no caucásicas, el estadío avanzado y la localización retroperitoneal eran factores independientemente asociados con menor supervivencia, sin que el subtipo histológico fuera un factor individual pronóstico. La resección quirúrgica y la radioterapia fueron las únicas variables terapeúticas que mejoraron la supervivencia (14). La expresión positiva –independiente- del marcador "ezrin" recientemente descrito, creemos que precisa de un número mayor de estudios para su valoración como factor pronóstico positivo en estas neoplasias y para la utilización de nuevas dianas terapeúticas (84).
La baja incidencia de este tipo de neoplasias hace que los tratamientos no estén sistematizados y se realicen terapias individualizadas, lo que condiciona dificultad en el estudio de los resultados, generando debates y controversias. Para la mayoría de los autores es la orquiectomía radical el tratamiento de elección y único, aunque debido a las recidivas y recurrencias que un número importante presentan, también indican un tratamiento adyuvante. A veces es también muy difícil resecar la totalidad del tumor, como en nuestro caso.
La diseminación de los sarcomas paratesticulares generalmente es a través del cordón umbilical hacia el canal inguinal y de este a la cavidad abdominal, no encontrando casos contrastados de diseminación vascular.
Conclusiones
Los FHM paratesticulares, y en concreto, los de cordón espermático, son sarcomas muy raros y de baja incidencia, tal y como hemos podido comprobar en este estudio, que precisan de una mayor convergencia y consenso entre urólogos, radiólogos, oncólogos y patólogos.
Ese hecho, marcado en todas las series, y que conduce a tratar con el mismo tipo de terapia a todos los sarcomas en esta localización (cirugía radical y radioterapia en los casos procedentes) no justifica la inexistencia de protocolos específicos para cada uno de los principales tumores mesodérmicos malignos paratesticulares (leiomiosarcomas, liposarcomas, rabdomiosarcomas y FHM). Quizás la reclasificación y el cambio diagnóstico -en la revisión de algunas series- realizado en los últimos años, haya servido para justificar este tipo de actitudes terapeúticas en el pasado. No obstante, consideramos que los nuevos marcadores en inmunohistoquímica y la citogenética permitirán acceder a dianas terapeúticas específicas para estos sarcomas paratesticulares.
Desde estas páginas abogamos por una conferencia o reunión específica de las Sociedades Científicas, en las especialidades implicadas, que permitan una terapeútica individualizada.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
1. KHOUBEHI, B.; MISHRA, V.; ALI, M. y cols.: "Adult paratesticular tumours". BJU Internacional., 90: 707, 2002. [ Links ]
**2. FLETCHER, C.D.M.; UNNI, K.; MERTENS, F.: " WHO-OMS Classification of tumours. Tumours of soft tissue and bone". Eds. IARC Press, Lyon (France), 2002. [ Links ]
*3. DE SAINT AUBAIN, N.: "Pleomorphic cell tumors of soft tissue. Differential diagnosis". Forum of Pathology. Forpath Slide Seminar. January 2004. [ Links ]
*4. FLETCHER, C.D.M.: "Pleomorphic Malignant fibrous histiocytoma: Fact or Fiction?". Am. J. Surg. Pathol., 16: 213, 1992. [ Links ]
*5. COINDRE, J.M.: "Immunohistochemistry in the diagnosis of soft tissue tumours". Histopathology, 43: 1, 2003. [ Links ]
6. BILLINGS, S.D.; FOLPE, A.L.; WEISS, S.W.: "Do leiomyomas of deep soft tissue exist?". Am. J. Surg. Pathol., 25: 1134, 2001. [ Links ]
7. FARSHID, G.; PRADHAN, M.; GOLDBLUM, J. y cols.: "Leiomyosarcoma of somatic soft tissues". Am. J. Surg. Pathol., 26: 14, 2002. [ Links ]
8. SOOSAY, G.N.; PARKINSON, M.C.; PARADINAS, J. y cols.: "Paratesticular sarcomas: A review of cases in the British Testicular Tumour Panel and Registry". BJU International, 77 :143, 1996. [ Links ]
9. COLEMAN, J.; BRENNAN, M.F.; ALEKTIAR, K.y cols.: "Adult spermatic cord sarcomas: Management and results". Ann. Surg. Oncol., 10: 669, 2003. [ Links ]
*10. WOODWARD, P.J.; SCHWAB, C.M.; SESTERHENN, I.A.: "Extratesticular scrotal masses: Radiologic-pathologic correlation. From the archives of the AFIP". Radiographics, 23: 215, 2003. [ Links ]
*11. FRANK, I.; TAKAHASHI, S.; TSUKAMOTO, T. y cols.: "Genitourinary sarcomas and carcinosarcomas in adults". Vogelzang N.J., Shipley W.U., Scardino P.T., Coffey D.S., Eds. Comprehensive Textbook of Genitourinary Oncology. 2nd Ed. Philadelphia: Lippincott Williams & Wilkins, 1110–1113, 2000. [ Links ]
**12. WHO-OMS: "Classification of tumours. Tumours of the urinary system and male genital organs". Eble J.N., Sauter G., Epstein J.I., Sesterhenn I.A., Eds. IARC Press, Lyon (France), 2004. [ Links ]
13. RUSSO, P.; BRADY, M.S.; CONLON, K. y cols.: "Adult urological sarcoma". J. Urol., 147: 1032, 1992. [ Links ]
14. GUTIERREZ, J.C.; PEREZ, E.A.; FRANCESCHI, D. y cols.: "Outcomes for soft-tissue sarcoma in 8249 cases from a large state cancer registry". J. Surg. Res., 141: 105, 2007. [ Links ]
15. LEWIS, J.J.; LEUNG, D.; WOODRUFF, J. y cols.: "Retroperitoneal soft-tissue sarcoma: Analysis of 500 patients treated and followed at a single institution". Ann. Surg., 228: 355, 1998. [ Links ]
16. LEWIS, J.J.; LEUNG, D.; ESPAT, J. y cols.: "Effect of reresection in extremity soft tissue sarcoma". Ann. Surg., 231: 655, 2000. [ Links ]
17. BLITZER, P.H.; DOSORETZ, D.E.; PROPPE, K.H. y cols.: "Treatment of malignant tumors of the spermatic cord: A study of 10 cases and a review of the literature". J. Urol., 126: 611, 1981. [ Links ]
18. BALLO, M.T.; ZAGARS, G.K.; PISTERS, P.W.T. y cols.: "Spermatic cord sarcoma: Outcome, patterns of failure and management". J. Urol., 166: 1306, 2001. [ Links ]
**19. ULBRIGHT, T.H.M.; AMIN, M.B.; YOUNG, R.H.: "Tumors of the testis, adnexa, spermatic cord and scrotum. Atlas of tumor pathology". Fascicle 25, 3th series. Washington, D.C., 1999. [ Links ]
20. RUIZ LISO, J.M.; RUIZ GARCÍA, J.; DEL AGUA ARIAS, C. y cols.: "Proliferación nodular y difusa fibrosa de la túnica vaginal del testículo". Rev. Esp. Patología, 37: 91, 2004. [ Links ]
*21. GOODWIN, W.E.: "Multiple, bening fibrous tumors of tunica vaginalis testis". J. Urol., 56: 438, 1946. [ Links ]
22. KEMPSON, R.L.; FLETCHER, C.D.M.; EVANS, H. y cols.: "Tumors of the soft tissues Atlas of tumor pathology". Fascicle 30, 3th series. Washington, D.C., 2001. [ Links ]
23. STERNBERG, S.S.; ANTONIOLI, D.A.; CARTER, D.: "Diagnostic Surgical Pathology". Vol 2, 3th Ed., Lippincott Williams & Wilkins. Philadelphia, 1999. [ Links ]
24. SEGURA SÁNCHEZ, J.; PAREJA MEGÍA, M.J.; GARCÍA ESCUDERO, A. y cols.: "Liposarcomas. Aspectos clínico-patológicos y moleculares". Rev. Esp. Patología, 39: 135, 2006. [ Links ]
25. JONES, M.A.; YOUNG, R.H.; SCULLY, R.E.: "Benign fibromatous tumors of the testis and paratesticular region: A report of 9 cases with a proposed classification of fibromatous tumors and tumor-like lesions". Am. J. Surg. Pathol., 21: 296, 1997. [ Links ]
26. JAYARAM, N.; RAMAPRASAD, A.V.; CHETHAN, M. y cols.: "Tumours and tumour-like conditions of the paratesticular region. A study of morphological features". Indian. J. Pathol. Microbiol., 41: 287, 1998. [ Links ]
**27. WEISS, S.W.; GOLDBLUM, J.R.: "Soft Tissues Tumors". Enzinger F.M., Weiss S.W., Eds. 4th edition. Mosby, 2001. [ Links ]
28. WEISS, S.W.; ENZINGER, F.M.: "Malignant fibrous histiocytoma: An analysis of 200 cases". Cancer, 41: 2250, 1978. [ Links ]
29. TZY-YOUNG LIN, B.; HARVEY, D.A.; MEDEIROS, L.J.: "Malignant fibrous histiocytoma of the spermatic cord: Report of two cases and review of the literature". Mod. Pathol., 15: 59, 2002. [ Links ]
30. ABDELAZIZ, B.; ALAA, K.; AYMAN, A. y cols.: "Malignant fibrous histiocytoma . A retrospective study of 109 cases". Am. J. Clin. Oncol., 25: 16, 2002. [ Links ]
*31. FLETCHER, C.D.; GUSTAFSON, P.; RYDHOLM, A.: "Clinicopathologic reevaluation of 100 malignant fibrous histiocytomas: Prognostic relevance of subclassification". J. Clin. Oncol., 19: 3045, 2001. [ Links ]
*32. LETCHER, C.D.: "Pleomorphic malignant fibrous histiocytoma: Fact or fiction? A critical reappraisal based on 159 tumors diagnosed as pleomorphic sarcoma". Am. J. Surg. Pathol., 16: 216, 1992. [ Links ]
33. HUAN, Y.; VAPNEK, J.; UNGER, P.D.: "Atypical fibrous histiocytoma of the scrotum". Ann. Diagn. Pathol., 7: 370, 2003. [ Links ]
34. MIYAGI, T.; OHTAKI, M.; RIN, S. y cols.: "Intrascrotal malignant fibrous histiocytoma: A case report and review of the literature". Hinyokika Kiyo, 31: 527, 1985. [ Links ]
*35. BERKMEN, F.; CELEBIOGLU, A.S.: "Adult genitourinary sarcomas: A report of seventeen cases and review of the literature". J. Exp. Clin. Cancer Res., 16: 45, 1997. [ Links ]
36. SHOJA, M.M.; TUBBS, R.S.; ASVADI, I. y cols.: "Malignant fibrous histiocytoma of the spermatic cord: A case report and review of the literature". Folia. Morphol. (Warsz), 65: 390, 2006. [ Links ]
37. HYOUCHI, N.;YAMADA, T.; TAKEUCHI, S. y cols.: "Malignant fibrous histiocytoma of spermatic cord: A case report". Hynyokika Kiyo, 42: 469, 1996. [ Links ]
38. FAGUNDES, M.A.; ZIETMAN, A.L.; ALTHAUSEN, A.F. y cols.: "The management of spermatic cord sarcoma". Cancer, 77: 1873, 1996. [ Links ]
39. GLAZIER, D.B.; VATES, T.S.; CUMMMINGS, K.B. y cols.: "Malignant fibrous histiocytoma of the spermatic cord". J. Urol., 155: 955, 1996. [ Links ]
40. BEDROSSIAN, C.W.M.; KRADIN, R.L.; MARK, E.J. y cols.: "Malignant mesothelioma and its mimics: Pathological spectrum and molecular histogenesis". Seminars in Diagnostic Pathology, Santa Cruz D.J. Ed. Vol 23, 1: 1, 2005. [ Links ]
41. MERIMSKY, O.; TERRIER, P.; BONVALOT, S. y cols.: "Spermatic cord sarcoma in adults". Acta Oncol., 38: 635, 1999. [ Links ]
42. CATTON, C.N.; CUMMMINGS, B.J.; FORNASIER, V. y cols.: "Adult paratesticular sarcomas: A review of 21 cases". J. Urol., 146: 342,1991. [ Links ]
43. ENOCH, S.; WHARTON, S.M.; MURRAY, D.S.: "Management of leiomyosarcomas of the spermatic cord: The role of reconstructive surgery". World J. Surg. Oncol., 28: 23, 2005. [ Links ]
44. SANE, S.Y.; NIMBKAR, S.A.; BAPAT, R.D.: "Leiomyosarcoma of hydrocele sac: A case report". J. Postgrad. Med., 26: 145, 1980. [ Links ]
45. O´BRIEN, J.E.; STOUT, A.P.: "Malignant fibrous xanthomas". Cancer, 17: 1445, 1964. [ Links ]
46. COLE, A.T.; STRAUS, F.H.; GILL, W.B.: "Malignant fibrous histiocytoma: An unusual inguinal tumor". J. Urol., 107: 1005, 1972. [ Links ]
47. GIMENEZ, A.; SOLA, J.; SERVER, G.: "Giant cell leiomyiosarcoma of the spermatic cord: A case report". Actas Urol. Esp., 19: 476, 1995. [ Links ]
48. SINGH, S.K.; MANDAL, A.K.; AGARWAL, M.M. y cols.: "Primary renal inflammatory malignant fibrous histiocytoma: A diagnostic challenge". Int. J. Urol., 13: 1000, 2006. [ Links ]
49. JO, E.J.; KANG, S.J.; HAN, C.S. y cols.: "A case of leiomyosarcoma of the spermatic cord". Korean J. Urol., 30: 274, 1989. [ Links ]
50. INAGAKI, T.; EBISUNO, S.; NAGAREDA, T.: "Malignant mesenchymoma of the spermatic cord with a brief review of the literature". Int. J. Urol., 4: 225, 1997. [ Links ]
51. KATO, K.; KOJIMA, T.; SHIMIZU, T. y cols.: "Inflammatory malignant fibrous histiocytoma of the gallbladder: Report of a case". Surg. Today, 32: 81, 2002. [ Links ]
52. LAGACE, R.; AURIAS, A.: "Does malignant fibrous histiocytoma exist?". Ann. Pathol., 22: 29, 2002. [ Links ]
53. SCHMITZ, M.: "Adult paratesticular malignant fibrous histiocytoma treated with surgery, systemic chem postoperative adjuvant radiotherapy". J. Can. Res. Ther., 2: 201, 2006. [ Links ]
54. HASEGAWA, T.; YAMAMOTO, S.; NOJIMA, T. y cols.: "Validity and reproducibility of histologic diagnosis and grading for adult soft-tissue sarcoma". Hum. Pathol., 33: 111, 2002. [ Links ]
55. BOSCH, R.; MARTINEZ, S.; ALVARO, T. y cols.: "Fine needle aspiration and touch imprint cytology of a malignant fibrous histiocytoma of the spermatic cord. Case report". Acta Cytol., 44: 423, 2000. [ Links ]
56. STAIMAN, V.R.; O´TOOLE, K.M.; RUBIN, M.A. y cols.: "Giant malignant fibrous histiocytoma of the testis/spermatic cord: Psychologic and possible etiologic complications of unethical Nazi medical experimentation". Urology, 48: 939, 1996. [ Links ]
57. URDIALES, M.; FERNÁNDEZ, A.; MARTOS, S. y cols.: "Fibrohistiocitoma maligno del cordon espermático". Actas Urol. Esp., 26: 581, 2002. [ Links ]
58. ORIO, P.F.; DAHIYA, R.; HERMAN, T. y cols.: "Malignant fibrous histiocytoma of the spermatic cord: A case report". Am. J. Clin. Oncol., 25: 227, 2002. [ Links ]
59. LIN, B.T.; HARVEY, D.A.; MEDEIROS, L.J.: "Malignant fibrous histiocytoma of the spermatic cord: Report of two cases and review of the literature". Mod. Pathol., 15: 59, 2002. [ Links ]
60. SEKINE, Y.; OHKI, K.; OKAMOTO, K. y cols.: "Malignant fibrous histiocytoma of the spermatic cord: A case report". Int. J. Urol., 8: 581, 2001. [ Links ]
61. UCHIDA, K.; ODA, T.; ADACHI, H.: "Malignant fibrous histiocytoma of the spermatic cord: A case report". Int. J. Urol., 6: 630, 1999. [ Links ]
62. MEDINA, M.; VALERO, J.; VALPUESTA, I. y cols.: "Fibrohistiocitoma maligno intraescrotal". Arch. Esp. Urol., 52: 393, 1999. [ Links ]
63. MAY, M.; MARUSCH, F.; HELKE, C. y cols.: "Locally recurrent malignant fibrous histiocytoma of the kidney and spermatic cord". Urologe A., 43: 976, 2004. [ Links ]
64. SETHI, S.; ASHOK, S.: "Malignant fibrous histiocytoma of the spermatic cord". J. Indian. Med. Assoc., 101: 599, 2003. [ Links ]
65. ANDREU, A.; SCHIEFENBUSCH, E.; BROTONS, J.L. y cols.: "Fibrohistiocitoma maligno de cordón espermático. Presentación de un caso". Arch. Esp. Urol., 47: 525, 1994. [ Links ]
66. ESCALONA ZAPATA, J.; DIEZ NAU, M.D.: "Estudio del fibrohistiocitoma maligno por medio del cultivo, con especial énfasis en las formas monofásicas". Rev. Esp. Patología, 1: 1, 1990. [ Links ]
67. SABATER, V.; MUÑOZ, C.; TAMARIT, L.V.: "Histiocitoma fibroso maligno. Un estudio histopatológico e inmunohistoquímico de 29 casos". Rev. Esp. Patología, 3: 186, 1988. [ Links ]
68. MENTZEL, T.H.; CALONJE, E.; WADDEN, C. y cols.: "Myxofibrosarcoma. Clinicopathologic analisis of 75 cases with emphasis on the low grade variant". Am. J. Surg. Pathol., 20: 391, 1996. [ Links ]
69. TSUNODA, R.: "Immunohistochemical study on the histogenesis of malignant fibrous histiocytoma". Nippon Ika Daigaku Zasshi, 63: 365, 1996. [ Links ]
*70. TAUBERT, H.; WURL, P.; MEYE, A. y cols.: "Molecular and immunohistochemical p-53 status in liposarcoma and malignant fibrous histiocytoma: Identification of seven new mutations for soft tissues sarcomas". Cancer, 76: 1187, 1995. [ Links ]
*71. YANG, P.; HIROSE, T.; HASEGAWA, T. y cols.: "Prognostic implication of the p-53 protein and Ki-67 antigen immunohistochemistry in malignant fibrous histiocytoma". Cancer, 76: 618, 1995. [ Links ]
*72. MIETTINEM, M.: "Immunohistochemistry of solid tumors. Brief review of selected problems". APMIS, 98: 191, 1990. [ Links ]
73. NEMES, Z.; THOMAZY, V.: "Factor XIIIa and the classic histiocytic markers in malignant fibrous histiocytoma: A comparative immunohistochemical study". Hum. Pathol., 19: 822, 1988. [ Links ]
*74. AHLEN, J.; WENG, W.W.; BROSJO, O. y cols.: "Evaluation of immunohistochemical parameters as prognostic markers in malignant fibrous histiocytoma". Oncol. Rep., 10: 1641, 2003. [ Links ]
75. POTTI, A.; GANTI, A.K.; FOSTER, H. y cols.: "Immunohistochemical detection of Her-2/neu, c-kit (CD 117) and vascular endothelial growth factor (VEGF) overexpression in soft tissue sarcomas". Anticancer Res., 24: 333, 2004. [ Links ]
76. MEISTER, P.: "Malignant fibrous histiocytoma: Pleomorfic sarcoma NOS or pleomorfic fibrosarcoma". Pathologe, 26: 127, 2005. [ Links ]
77. SHAH, H.; PERVEZ, S.: "Immunophenotypic characterization of high grade pleomorphic sarcomas: A demographic and immunohistochemical study in a major referral center of Pakistan". J. Pak. Med. Assoc., 55: 101, 2005. [ Links ]
*78. MORRIS, J.S.; MC INNES, E.F.; BOSTOCK, D.E. y cols.: "Immunohistochemical and histopathologic features of malignant fibrous histiocytomas from Flat-Coated Retrievers". Vet. Pathol., 39: 473, 2002. [ Links ]
79. AKATSU, Y.; SAIKAWA, Y.; KUBOTA, T. y cols.: "Metastatic gastric cancer from malignant fibrous histiocytoma: Report of a case". Surg. Today, 36: 385, 2006. [ Links ]
80. WINSTANLEY, A.M.; LANDON, G.; BERNEY, D. y cols.: "The immunohistochemical profile of malignant mesotheliomas of the tunica vaginalis. A study of 20 cases". Am. J. Surg. Pathol., 30: 1, 2006. [ Links ]
81. YAMAMOTO, T.; AKISUE, T.; MARUI, T. y cols.: "Immunohistochemical analysis of platelet-derived growth factor and its receptors in soft tissue malignant fibrous histiocytoma". Anticancer Res., 23: 4325, 2003. [ Links ]
82. BANETH, V.; RAICA, M.; CIMPEAN, A.M.: "Assessment of angiogenesis in soft-tissue tumors". Rom. J. Morphol. Embryol., 46: 323, 2005. [ Links ]
83. LOTT, S.; LOPEZ BELTRÁN, A.; MONTIRONI, R. y cols.: "Soft tissue of the urinary bladder. Part II: Malignant neoplasms". Hum. Pathol., 38: 963, 2007. [ Links ]
*84. KIM, M.S.; CHO, W.H.; SONG, W.S. y cols.: "Prognostic significance of ezrin expression in pleomorphic malignant fibrous histiocytoma". Anticancer Res., 27: 1171, 2007. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Juan Manuel Ruiz Liso
Linajes, 4 - 2ºA
42003 Soria. (España).
jruiz@hsor.sacyl.es
Trabajo recibido: 10 de agosto 2007