Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.31 no.7 jul./ago. 2007
Influencia del retraso en el procesamiento preanalítico de la orina en la determinación del NMP22
Influence of the delay in urinary NMP22 preanalytical processing
Fatela-Cantillo D.1, Fernández-Suárez A.2, Menéndez-López V.3, Carro Rubias C.4, Galán J.A.5, García Serrado D.4
1Área de Biotecnología. Centro Hospitalario de Alta Resolución Sierra del Segura, EPHAG. La Puerta de Segura-Puente de Génave. Jaén.
2Área de Biotecnología. Hospital Alto Guadalquivir, EPHAG. Andújar, Jaén.
3Servicio de Urología. Hospital del Mar. IMAS. Barcelona.
4Servicio de Urología. Hospital General Universitario de Elche, Elche. Alicante.
5Servicio de Urología. Hospital General Universitario de Alicante. Alicante.
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar la influencia del retraso en el procesamiento preanalítico de orinas en las que se realiza la determinación del marcador tumoral NMP22.
Material y métodos: Se recogieron 28 muestras de orina: tumores vesicales (14), infecciones urinarias (4), litiasis (4), voluntarios sanos (1), y otras patologías vesicales benignas (5). De cada muestra, mantenida a temperatura ambiente, se fueron estabilizando alícuotas con el conservante suministrado por el fabricante a los 0, 30, 90 y 150 minutos, guardándose a 4ºC hasta su procesamiento. El análisis del NMP22 se realizó en autoanalizador IMMULITE One.
Resultados: No se apreciaron diferencias significativas en los niveles del NMP22 entre los diferentes puntos de demora estudiados.
Conclusiones: La demora de hasta dos horas y media en la adición de la solución conservante a la orina para determinación de NMP22 no afecta significativamente a los resultados obtenidos. Este hecho permite una mayor confianza y flexibilidad en los inmunoensayos cuantitativos que requieren estabilización de la muestra.
Palabras clave: Cáncer vesical. Orina. Marcador tumoral. NMP22. Fase preanalítica.
ABSTRACT
Objectives: To evaluate the influence of the delay in urinary NMP22 preanalytical processing.
Material and methods: Twenty-eight voided urine samples were taken: bladder cancer (14), urine tract infections (4), lithiasis (4), healthy volunteers (1), and with other no malignant bladder diseases (5). All samples, were maintained at environment temperature, and were processed according to the stabilization of parts of urine collected at 0, 30, 90 and 150 minutes. Samples were stored at 4 ºC until its determination. NMP22 was determined with the IMMULITE One analyzer.
Results: There were no significant differences for NMP22 levels between each different point of time studied.
Conclusions: Delay up to 2 hours and a half when we add stabilization solution to urine samples no affects NMP22 results. Thatthing, might provide more confidence and flexibility on quantitative immunoassays that required urine stabilization.
Key words: Bladder cancer. Urine. Tumour marker. NMP22. Preanalytical phase.
La incidencia de cáncer de vejiga en España puede ser considerada alta si se compara con el resto de países desarrollados1. Del total de muertes por cáncer en el año 2004 en nuestro país, el 6,1% correspondió a muertes por cáncer de vejiga en hombres (3.710 casos) y el 2,1% a mujeres (783 casos). Según datos del estudio EUROCARE-3 el porcentaje de supervivencia a 5 años para hombres es del 75,4% y para mujeres del 70,4%, cifras que son superiores a la del resto de países europeos incluidos en el estudio2.
Estas cifras y la elevada tasa de recidiva del carcinoma vesical ponen de manifiesto los importantes costes asociados desde el momento del diagnóstico hasta el éxitus3. Estos pacientes se controlan regularmente mediante cistoscopias, citologías urinarias y procedimientos radiológicos del tracto urinario superior en seguimientos que se prolongan en el tiempo, en muchos casos, durante años. La cistoscopia, patrón de oro para la detección de nuevos tumores, persistencia o recurrencia de la enfermedad, es un procedimiento invasivo y costoso. Por otra parte, la citología urinaria, herramienta ampliamente utilizada tanto con fines diagnósticos como de seguimiento, presenta una baja sensibilidad para tumores bien y moderadamente diferenciados que oscila del 35% al 49%, según diversos estudios4-6. Es por tanto necesario encontrar nuevos marcadores tumorales, no invasivos, que ayuden a los métodos diagnósticos tradicionales a mejorar la detección del cáncer de vejiga pues, a día de hoy, hasta el 10% de todos los tumores se pierden en este proceso7,8.
En los últimos años, se han comparando diversos métodos diagnósticos, siendo el análisis del NMP22 en orina, correspondiente a la proteína de la matriz nuclear que se encuentra en las células epiteliales del tracto urinario, uno de los marcadores propuestos para mejorar en el diagnóstico de cáncer de vejiga9-11. Actualmente, se dispone de inmunoensayos cuantitativos y sistemas de análisis semicuantitativos rápidos como el BladderChek® para la determinación del NMP2212-14. Los tests cuantitativos precisan de una solución estabilizante que se añade a la orina para inhibir agentes proteolíticos y microorganismos. Una vez estabilizada la orina se mantiene estable 24 horas a temperatura ambiente y a 2-8ºC durante una semana. En la práctica clínica diaria, esto obliga al paciente a recoger la muestra de orina en el mismo laboratorio, o a proporcionar a los pacientes viales con la solución estabilizadora. Este hecho ha motivado que el sistema BladderChek®, operador independiente y de fácil uso en la consulta de urología gane posiciones con respecto a los primeros inmunoensayos15.
El objetivo del presente trabajo consiste en evaluar la influencia del retraso en el procesamiento preanalítico de las orinas en las que se realizará la determinación del marcador tumoral NMP22 mediante un inmunoensayo cuantitativo, que precisa de una solución conservante que estabiliza la orina.
Material y métodos
Pacientes: Se consideraron 28 sujetos a estudio con una edad media de 65,3 años (rango desde 40 a 85 años). La distribución por sexos fue de 23 hombres y 5 mujeres. A cada uno de ellos, se le recogió una muestra de orina recién emitida por micción espontánea. De cada muestra, mantenida a temperatura ambiente, se fueron estabilizando alícuotas con conservante a los 0, 30, 90 y 150 minutos, almacenándose a 4ºC hasta su procesamiento. Las orinas incluidas en el estudio se agruparon en función de las diversas patologías o situaciones de cada individuo: tumores vesicales (14), infecciones urinarias (4), litiasis (4), voluntarios sanos (1) y otras patologías vesicales benignas (5 casos: 3 hiperplasias benignas de próstata; 1 síndrome irritativo miccional; 1 caso con antecedentes de tumor vesical pero sin evidencia de enfermedad en el momento actual). Los datos histopatológicos de los tumores se establecieron de acuerdo a los criterios de la Asociación Internacional Contra el Cáncer16.
Procedimientos: Para realizar la determinación de NMP22 se siguen las instrucciones del fabricante que comercializa dicho test, que mide proteínas de la matriz nuclear involucradas en la replicación de DNA y en la síntesis de RNA durante la mitosis17. Para ello, se recogieron las muestras de orina en recipientes sin vidrio, de las que se dispensó un 1mL de cada una a los viales con solución estabilizante para cada uno de los tiempos. La solución estabilizante se compone de un tampón salino con proteínas bovinas, agentes antimicrobianos y verde de bromocresol como colorante, y también es suministrada por el fabricante del ensayo. La determinación del NMP22 en la orina se realizó en un autoanalizador IMMULITE One, utilizando un kit comercial (Diagnostic Products Co, Los Angeles, CA, USA), que emplea anticuerpos que reconocen un dominio del aparato nuclear mitótico (NuMA). El NuMA se encuentra en concentraciones muy elevadas en las células uroteliales cancerosas, llegando a estar 25 veces más alta que en células uroteliales normales. El procedimiento está basado en un ensayo inmunométrico quimioluminiscente en fase sólida. Los resultados obtenidos fueron expresados en U/mL. Se consideran positivos para el NMP22 valores mayores de 10 U/mL.
Análisis estadístico: No fue posible asumir una distribución normal de los datos, por lo que los cálculos de inferencia estadística fueron realizados mediante tests no paramétricos. Se utilizó el test de Kruskal-Wallis para comparar los niveles medios del marcador entre los distintos grupos del estudio. Se empleó el test de Friedman para conocer si existen diferencias en los niveles de NMP22 antes y después del procesamiento preanalítico en cada uno de los tiempos.
Resultados
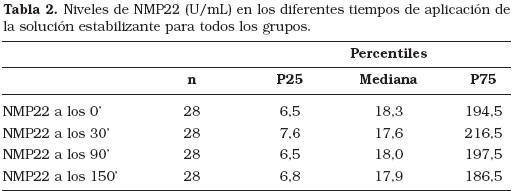
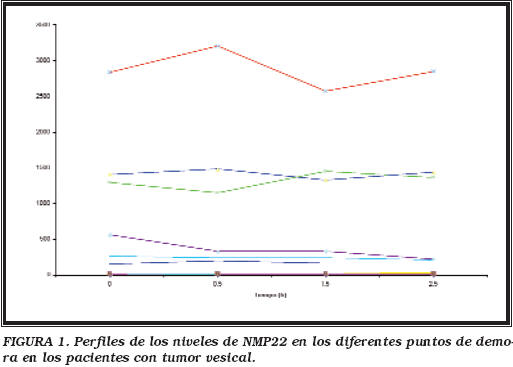
La Tabla 1 resume los niveles de NMP22 encontrados en todos los grupos para el momento basal y tras 150 minutos de retraso en la adición del conservante. Los pacientes con tumores vesicales presentaron niveles de NMP22 significativamente más altos (p<0,05), con respecto a los otros grupos considerados. Por otra parte, no se apreciaron diferencias significativas (test de Friedman, p=0,250) en los niveles de NMP22 entre los diferentes puntos de demora estudiados (Tabla 2). Así, al representar la concentración del NMP22 frente a los diferentes tiempo de demora, tanto para el grupo de los tumores vesicales como para el resto de grupos (Figuras 1 y 2), se observa que la mayor parte de los perfiles de cada una de las orinas estudiadas presentan una forma de curva plana.
De los 28 sujetos considerados en el estudio, 14 correspondían a tumores vesicales confirmados mediante el estudio histológico realizado tras cistoscopias diagnósticas. Las características de cada uno de estos casos se muestran en la Tabla 3. Como se puede apreciar, las concentraciones más elevadas de NMP22 coinciden con grados de diferenciación elevados y estadios mayores. No obstante, no se asociaron significativamente con el grado de diferenciación o el estadio del tumor (p=0.052).
Discusión
Los antígenos tumorales presentes en la orina presentan la ventaja de ser muy accesibles para analizar, aunque pueden ser altamente inestables y susceptibles de ser degradados rápidamente. El NMP22 es uno de los marcadores urinarios aprobado por la Food and Drug Administration (FDA) para la detección del cáncer de vejiga18,19. En los últimos años ha sido intensamente evaluado, aunque su uso no se ha extendido en la práctica clínica diaria debido a la disparidad de resultados obtenidos20.
Algunos de los factores limitantes que han favorecido este hecho se ponen de manifiesto cuando se estudian pacientes con otras patologías vesicales benignas y/o hematuria donde se han encontrado niveles más elevados del marcador, aumentando la probabilidad de recoger falsos positivos21,22. En este estudio dicha situación se hace patente, al encontrar en los grupos de individuos sin tumor 8 casos (57,1%) con valores por encima del punto de corte propuesto (10 U/mL). Sin embargo, no se debe ocultar el elevado poder predictivo negativo del NMP22 y su más que aceptable sensibilidad en la detección de tumores vesicales descrita en la literatura23. No obstante, la aplicación de este test no se puede generalizar a toda la población, debiendo restringir su uso en cohortes específicas de pacientes24.
Otro factor limitante de los inmunoensayos cuantitativos referido por diversos autores es el procesamiento preanalítico de la muestra de orina9,20,25, al señalar que el uso de este test no es ventajoso para el diagnóstico al tratarse de un procedimiento largo que requiere cierta infraestructura hospitalaria. Los resultados encontrados en el presente estudio están en contra de este inconveniente, al demostrar que el retraso de hasta dos horas y media en la adición de la solución conservante a la orina para la determinación del NMP22 no afecta a los resultados de dicho marcador. Si bien es cierto, como se ha mostrado, que existe un ligero descenso en la concentración del NMP22 con el paso del tiempo, la relevancia de dicho decremento es despreciable. Además, este fenómeno se repite tanto a altas como a bajas concentraciones y en presencia de patologías de muy diversa entidad. Este hecho permite una mayor confianza y flexibilidad en el test cuantitativo, puesto que la llegada de las muestras de orina a los laboratorios, ya sean procedentes de las unidades de hospitalización, consultas externas o transportadas por los propios pacientes, pueden sufrir algunos retrasos. No obstante, y debido al escaso número de pacientes analizados, estos resultados deberían ser confirmados en estudios posteriores con series más amplias.
A día de hoy, el sistema BladderChek® parece más atractivo que los tradicionales inmunoensayos, debido principalmente a su fácil manejo sin necesidad de personal experto12. Sin embargo, en contra de este novedoso sistema a la cabecera del paciente, se revela su mayor coste económico, muy superior al de los inmunoensayos cuantitativos, como el ensayado en este estudio. En resumen, la exactitud y fiabilidad tanto de éste test cualitativo como el de sus homólogos cuantitativos, debería ser evaluada extensamente en los nuevos escenarios de combinación de distintos test que hoy se proponen26,27, para mejorar el diagnóstico del cáncer de vejiga y sus frecuentes recurrencias.
Conclusión
La demora de hasta dos horas y media en la adición de la solución conservante a la orina con objeto de realizar la determinación del NMP22 no afecta de forma significativa a los resultados de dicho marcador. Este hecho permite una mayor confianza y flexibilidad en los inmunoensayos cuantitativos que requieren estabilización de la muestra. No obstante, serían necesarios posteriores estudios con series más amplias que corroboren los resultados obtenidos en cada una de las patologías consideradas.
Referencias
1. Parkin DM, Whelan SL, Ferlay J, WHO: Cancer incidence in five continents. Vol III IARC, Scientific publications nº 155 (2002). Consultado 20/02/07. Disponible en http://www.iarc.com.fr/ci5v8.htm. [ Links ]
2. Estudio EUROCARE-3. Supervivencia en cáncer en Europa (2003). Consultado 20/02/07. Disponible en http://www.eurocare.it/. [ Links ]
3. Svatek RS, Sagalowsky AI, Lotan Y. Economic impact of screening for bladder cancer using bladder tumor markers: A decision analysis. Urol Oncol. 2006 Jul-Aug;24(4):338-343. [ Links ]
4. Lokeshwar VB, Soloway MS. Current bladder tumor tests: does their projected utility fulfill clinical necessity?. J Urol 2001;165:1067-1077. [ Links ]
5. Lotan Y, Roehrborn CG. Cost-effectiveness of a modified care protocol substituting bladder tumor markers for cystoscopy for the followup of patients with transitional cell carcinoma of the bladder: a decision analytical approach. J Urol. 2002 Jan;167(1):75-79. [ Links ]
6. Konety BR, Getzenberg RH. Urine based markers of urological malignancy. J Urol. 2001 Feb;165(2):600-611. [ Links ]
7. Pfister C, Chautard D, Devonec M, Perrin P, Chopin D, Rischmann P, et al. Immunocyt test improves the diagnostic accuracy of urinary cytology: Results of a French multicenter study. J Urol 2003;169:921-924. [ Links ]
8. Lorenzo-Gómez MF. El papel de los marcadores tumorales en la consulta de urología para el screening, diagnóstico y seguimiento del cáncer de vejiga. Actas Urol Esp. 2003 Feb;27(2):110-116. [ Links ]
9. Gutiérrez Baños JL, Rebollo Rodrigo MH, Antolín Juárez F, Martín García B, Hernández Rodríguez R, Portillo Martín JA, et al. El NMP-22 en el diagnóstico del cáncer vesical. Actas Urol Esp. 2000 Oct;24(9):715-720. [ Links ]
10. Pérez García FJ, Escaf Barmadah S, Fernández Gómez JM, Rodríguez Martínez JJ, Martín Benito JL. Determination of NMP-22 as recurrente marker in bladder cancer. Preliminary study. Arch Esp Urol. 2000 May;53(4):305-312. [ Links ]
11. Sánchez-Carbayo M, Herrero E, Megías J, Mira A, Soria F. Evaluation of nuclear matrix protein 22 as a tumour marker in the detection of transitional cell carcinoma of the bladder. BJU Int. 1999 Oct;84(6):706-713. [ Links ]
12. Grossman HB, Messing E, Soloway M, Tomera K, Katz G, Berger Y, et al. Detection of bladder cancer using a point-of-care proteomic assay. JAMA. 2005 Feb 16;293(7):810-816. [ Links ]
13. Feil G, Stenzl A. Pruebas de marcadores tumorales en el cáncer de vejiga. Actas Urol Esp. 2006 Jan;30(1):38-45. [ Links ]
14. Grossman HB, Soloway M, Messing E, Katz G, Stein B, Kassabian V, et al. Surveillance for Recurrent Bladder Cancer Using a Point-of-Care Proteomic Assay. JAMA. 2006 Jan 18;295(3):299-305. [ Links ]
15. Black PC, Brown GA, Dinney CP. Molecular Markers of Urothelial Cancer and Their Use in the Monitoring of Superficial Urothelial Cancer. J Clin Oncol. 2006 Dec 10;24(35):5528-5535. [ Links ]
16. Sobin Lh, Wittekind C. UICC TNM. Classification of Malignant Tumours, 5th ed. New York, Wiley Liss, 1997, pp187–190. [ Links ]
17. Wiener HG, Mian C, Haitel A, Pycha A, Schatzl G, Marberger M. Can urine bound diagnostic tests replace cystoscopy in the management of bladder cancer? J Urol. 1998 Jun;159(6):1876-1880. [ Links ]
18. Keesee SK, Briggman JV, Thill G, Wu YJ. Utilization of nuclear matrix proteins for cancer diagnosis. Crit Rev Eukaryot Gene Expr. 1996;6(2-3):189-214. [ Links ]
19. Soloway MS, Briggman V, Carpinito GA, Chodak GW, Church PA, Lamm DL, et al. Use of a new tumor marker, urinary NMP22, in the detection of occult or rapidly recurring transitional cell carcinoma of the urinary tract following surgical treatment. J Urol. 1996 Aug;156(2 Pt 1):363-367. [ Links ]
20. Shariat SF, Marberger MJ, Lotan Y, Sanchez-Carbayo M, Zippe C, Lüdecke G, et al. Variability in the Performance of Nuclear Matrix Protein 22 for the Detection of Bladder Cancer. J Urol. 2006 Sep;176(3):919-26; discussion 926. [ Links ]
21. Atsü N, Ekici S, Oge O O, Ergen A, Hasçelik G, Ozen H. False-positive results of the NMP22 test due to hematuria. J Urol. 2002 Feb;167(2 Pt 1):555-558. [ Links ]
22. Menéndez V, Filella X, Alcover JA, Molina R, Mallafre JM, Ballesta AM et al. Usefulness of urinary nuclear matrix protein 22 (NMP22) as a marker for transitional cell carcinoma of the bladder. Anticancer Res 2000;20:1169-1172. [ Links ]
23. Glas AS, Roos D, Deutekom M et al. Tumor markers in the diagnosis of primary bladder cancer. A systematic review vol. J Urol. 2003 Jun;169(6):1975-1982. [ Links ]
24. Van Rhijn BW, van der Poel HG, van der Kwast TH. Urine Markers for Bladder Cancer Surveillance: A Systematic Review. Eur Urol 2005;47:736–748. [ Links ]
25. Giannopoulos A, Manousakas T, Mitropoulos D, Botsoli-Stergiou E, Constantinides C, Giannopoulou M, et al. Comparative evaluation of the btastat test, nmp22, and voided urine cytology in the detection of primary and recurrent bladder tumors. Urology. 2000 Jun;55(6):871-875. [ Links ]
26. Parekattil SJ, Fisher HA, Kogan BA. Neural network using combined urine nuclear matrix protein-22, monocyte chemoattractant protein-1 and urinary intercellular adhesion molecule-1 to detect bladder cancer. J Urol. 2003 Mar;169(3):917-920. [ Links ]
27. Fatela-Cantillo D, Fernández-Suárez A, Menéndez V, Galán JA, Filella X. Low utility of Cyfra 21-1 serum levels for diagnosis and follow up in bladder cancer patients. J Clin Lab Anal. 2005;19(4):167-171. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Daniel Fatela Cantillo.
Área de Biotecnología. Centro Hospitalario Alta Resolución Sierra del Segura.
EPHAG. La Puerta de Segura-Puente de Génave
23360 Jaén.
E-mail autor: danielfatela@yahoo.es
Trabajo recibido: abril 2007
Trabajo aceptado: mayo 2007