Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.34 no.9 oct. 2010
Angiomiolipoma retroperitoneal: revisión de la literatura y reporte de un nuevo caso
Retroperitoneal angiomyolipoma: review of the literature and report of a new case
Dirección para correspondencia
Sr. Director:
Los angiomiolipomas (AML) son tumores mesenquimales benignos, compuestos por tejido adiposo maduro, músculo liso y vasos sanguíneos de pared engrosada, irregular y carente de fibras elásticas. Usualmente se originan en riñón, y muy raras veces en órganos extrarenales como hígado, regiones ginecológicas, bazo, hueso, mediastino, pene, colon, corazón, pulmón, parótidas, piel, cordón espermático, ganglios linfáticos y retroperitoneo1-3. Sus características histológicas fueron inicialmente descritas por Fischer en 1911, asociado a esclerosis tuberosa o enfermedad de Bourneville donde suele ser bilateral, múltiple y de pequeño tamaño4,5. La localización retroperitoneal es extremadamente rara, con solo 18 casos descritos hasta la actualidad en la literatura mundial (Cocharane Library, Ovid databases, Pubmed 1966-2009)1-3,6-19.
Nuestro objetivo es revisar la literatura de esta patología, recopilando los casos descritos hasta la fecha, y presentar un nuevo caso de angiomiolipoma de origen retroperitoneal (AMLR) asociado al embarazo y puerperio.
Paciente puérpera de 34 años, sin antecedentes de interés, que después de 10 días del parto persistía el aumento del perímetro abdominal, asociado a dolor abdominal. Al examen físico se palpaba una masa firme y dolorosa a la presión, que ocupaba parte del abdomen. Sin estigmas de facomatosis. Las analíticas de sangre y de orina estaban en rangos normales. La Rx simple de tórax no evidenciaba infiltrados ni condensaciones. Por ecografía se observó un enorme tumor retroperitoneal, que la TC describió como una gran masa de 30×15cm, sólida, encapsulada, de densidad grasa, tabicada en su interior, con vasos de gran tamaño y zonas de sangrado, que parecía introducirse en el seno renal izquierdo, extendiéndose desde la bifurcación de los vasos iliacos hasta el diafragma. El diagnóstico radiológico fue de angiomiolipoma vs liposarcoma retroperitoneal (figura 1). El tratamiento consistió en la extirpación completa de la tumoración a través de una laparotomía media, incluyendo el riñón izquierdo, cuyo pedículo y seno estaban englobados por el tumor (figura 2A). El estudio histopatológico de la pieza, describía una tumoración de 28×26×10cm, revestida por una superficie lisa, de 3.321gr, en contigüidad con el seno renal sin invadirlo (figura 2A). Al corte mostraba un tejido heterogéneo de coloración amarillenta, constituida por acúmulos de histiocitos, tejido adiposo maduro, vasos de gran tamaño y células epiteliales de aspecto fusiforme que se teñían positivo al HMB45, y negativo para vimentina y queratina (figura 2B). El diagnóstico anatomopatológico fue de un angiomiolipoma retroperitoneal.
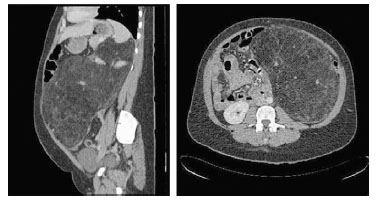
Figura 1. TC abdominal que muestra una gran tumoración retroperitoneal
de densidad grasa, que se extiende desde la bifurcación de los vasos iliacos
hasta el diafragma izquierdo, ocupando casi todo el abdomen.

Figura 2. A) Pieza quirúrgica que incluye al riñón izquierdo.
El tumor estaba en contigüidad con el pedículo y el seno renal,
pero sin invadirlo. B) Microscópicamente estaba constituido
por tejido adiposo maduro, vasos de gran tamaño, acúmulos
de histiocitos y células epitelioides de aspecto fusiforme.
HMB45 (+), actina (-) y desmina (-).
La paciente presentó un postoperatorio sin incidencias, con evolución satisfactoria. A los 6 meses de seguimiento se encuentra asintomática, con TC abdominal normal.
El AML representa el 3% de los tumores sólidos renales, con una incidencia en la población general entre el 0,07-0,3%. Más frecuentes entre la 5.a y 6.a década de la vida, con mayor incidencia en la mujer que en el hombre (3-4/1)5, asociándose entre 30-40% a facomatosis como esclerosis tuberosa, neurofibromatosis o enfermedad de Von Recklinghausen, o a la enfermedad de Von Hippel-Lyndau, y hasta en un 50% a la linfangioleiomiomatosis pulmonar20. De tal forma que entre 40-80% de los pacientes con AML múltiples y bilaterales suelen presentar esclerosis tuberosa. Y a la inversa, el 80% de los pacientes con esclerosis tuberosa tienen AML5. Asociaciones que no han sido observadas para los casos de AMLR. Su localización extrarrenal es extremadamente rara, siendo más frecuente en el hígado, seguido del útero y la cavidad oral2,6,10.
Presentamos el caso número 19 de AMLR publicado en la literatura mundial, revisando su etiopatogénia, clínica, diagnóstico, manejo y tratamiento.
El AMLR, como en este caso, tiene mayor predominancia por el sexo femenino que el de origen renal, con una relación 5,6/1, y una media de presentación de 46,6 años (28-73 años). Las manifestaciones clínicas suelen ser muy inespecíficas, no diferenciándose de los AML renales, los síntomas más frecuentes son la sensación de masa y el dolor abdominal inespecífico. Suelen alcanzar un considerable tamaño, y presentar hematuria, vómitos, fiebre, hipertensión arterial, sangrado intratumoral, hemorragia retroperitoneal o shock hemorrágico (menos frecuente en el AML de origen renal)11,13,21. La hemorragia probablemente esté relacionada con la gran cantidad de vasos y sus características, que se adaptan mal al crecimiento tumoral y a los microtraumas de la respiración6.
Observamos que la cuarta parte de los AMLR se manifestaron durante al embarazo o el puerperio inmediato, hecho que reafirmaría su dependencia hormonal, y que durante el embarazo experimentan un gran desarrollo11. Apoyan esta teoría su predominio en mujeres en edad fértil, su rareza antes de la pubertad, mayor índice de crecimiento en mujeres que en varones y la presencia de receptores de estrógenos y progesterona en las células musculares lisas11,22. La exploración física inicial suele ser normal en la mayoría de los pacientes, siendo el hallazgo más común la masa abdominal palpable y los signos iniciales de sangrado. Llama la atención que ningún caso de AMLR estuviera relacionado con alguna facomatosis, contrario a los de origen renal, no habiendo razones claras para ello.
La biopsia percutánea con estudio inmunohistoquímico ayudaría a determinar la naturaleza prequirúrgica del tumor, y solo debe considerarse cuando exista una masa con componente graso, músculo liso y vasos sanguíneos, ya que el riesgo de sangrado es alto9,19. Para Fegan et al3 solamente se debería realizar en pacientes asintomáticos y de bajo riesgo.
El diagnóstico definitivo del AMLR es siempre histopatológico, complementado con técnicas inmunohistoquímicas (Ac monoclonales), donde coexpresan marcadores melanocíticos positivos (HMB45, HMB50, C63), con marcadores epiteliales siempre negativos, que los diferencia del liposarcoma, histiocitoma fibroso maligno, leiomiosarcoma o el carcinoma sarcomatoide1,5.
Ecográficamente el AMLR se ve como un tumor de hiperecogenicidad intensa, radicando su principal utilidad en el control periódico de estos pacientes cada 6-12 meses. En cambio, la TC es el estudio de elección ante la sospecha de un AMLR, mostrándo un tumor de 20-100 unidades Hounsfield, con zonas de baja atenuación, y mínimo aumento de densidad tras el contraste. Sin embargo, ambas pruebas se hacen insuficientes a fin de aclarar la naturaleza prequirúrgica de la masa21. El diagnóstico diferencial es muy difícil, y por regla general se debe hacer con los tumores de la grasa retroperitoneal: lipoma, leiomioma con cambios grasos y el liposarcoma, al que no se debe descartar hasta no demostrar lo contrario12. El crecimiento irregular por fuera de la fascia de Gerota, las calcificaciones intratumorales y el crecimiento mayor de 0,5cm/año debe hacernos dudar del diagnóstico de benignidad10,11,20.
Actualmente el valor de la arteriografía diagnóstica ha disminuido, y solo se recomienda para definir la vascularización y extensión del tumor6,10,23. Para otros, ante aneurismas extrarrenales pequeños, con ramificación arterial renal normal, deberíamos plantearnos la posibilidad de un AML extrarrenal. Algunos autores refieren, que aneurismas mayores a 5mm proporcionarían un valor pronóstico superior al tamaño tumoral a fin de predecir el sangrado retroperitoneal6,20.
Moorhead et al en 1977 describió el primer caso de embolización arterial selectiva (EAS) en el tratamiento de los AML, admitiéndose actualmente como alternativa a la cirugía renal conservadora (nefrectomía parcial o tumorectomía) en los tumores bilaterales sintomáticos, tumores pequeños y múltiples, o con sangrado activo, y en aquellos pacientes con elevado riesgo quirúrgico20. Para otros solamente estaría justificada en los casos quirúrgicamente inabordables8. En cambio en los AMLR, la EAS es inadecuada como tratamiento único (solo en un caso la EAS fue suficiente), dando mejor resultado como terapia neoadyuvante a la cirugía.
Se considera como éxito a la EAS que logra reducir más del 30% del tamaño tumoral original, dentro del primer año. Asimismo, las recurrencias, incremento de 2cm de diámetro luego de la EAS, suelen manifestarse en más del 30% de los casos. Además, cerca del 10% de las EAS presentarán complicaciones como: sepsis, absceso, migración del material de embolización, resangrado, licuefacción estéril, derrame pleural y el síndrome postembolización (dolor lumbar, fiebre y reacción leucocitaria)20.
La afectación de los nódulos linfáticos y del bazo por un AML renal, representa un desorden benigno más que una propagación maligna2,3. Aunque, se ha descrito que estos pueden presentar extensión local y recurrir sino se extirpan completamente. Comunicándose como criterios de malignidad la transformación sarcomatosa y las metástasis pulmonares (diseminación a distancia)3,9.
El manejo quirúrgico del AMLR es controvertido. Las publicaciones de Oesterling et al y Steiner et al son las más aprobadas, aceptándose la cirugía en tumores mayores a 4cm, con clínica de sangrado activo o de compresión tumoral, en casos de incertidumbre diagnóstica de la masa, alta sospecha de malignidad o que no respondan a la EAS. Para otros autores la cirugía es el único método seguro y eficaz como el tratamiento definitivo de esta enfermedad, y así evitar las recidivas tumorales. Describiéndose en el 2004 el abordaje laparoscópico en el tratamiento de esta patología20.
En los AMLR se requirió cirugía exploratoria en casi todos los casos (excepto en uno), a fin de controlar el sangrado o de disipar la incertidumbre diagnóstica del tumor, acompañándose de nefrectomía en más del 60% de los casos.
A pesar de los adelantos en los exámenes auxiliares, y de la mayor experiencia en el reconocimiento en las pruebas de imagen de las características de este tumor, creemos que la cirugía es el procedimiento más adecuado para el manejo del AMLR.
L. Ramírez Daniel, L. García Sabela, R. Rey Jorge y O. Calvo Antonio
Servicio de Urología del Complejo Hospitalario Universitario de Vigo (CHUVI), Vigo, Galicia, España
Bibliografía
1. Tseng C.-A., Pan Y.-S., Su Y.-C., Wu D.-C., Jan C.-M., Wang W.-M. Extrarenal retroperitoneal angiomyolipoma: case report and review of the literature. Abdom Imaging. 2004:721-3. [ Links ]
2. Angulo J.C., López J.I., Carnicero J.A., Flores N. Extrarrenal retroperitoneal angiomyolipoma. Urol Int. 1994:58-60. [ Links ]
3. Fegan J.E., Shah H.R., Mukunyadzy P., Schutz M.J. Extrarenal retroperitoneal angiomyolipoma. South Med J. 1997:59-62. [ Links ]
4. Fischer W. Die Nierentumoren bei der Tuberosen Hirnsklerose. Beitr Pathol Anat. 1911; 235-82. [ Links ]
5. Gimeno V., Bosquet M., Bonillo M.A. Cirugía conservadora del angiomiolipoma renal bilateral durante el embarazo. Actas Urol Esp. 2006:633-7. [ Links ]
6. Ditonno P., Smith R.B., Koyle M.A., Hannah J., Belldegrun A. Extrarenal angiomyolipomas of the perinephric space. J Urol. 1992:447-50. [ Links ]
7. Law S.Y., Fok M., Shek W.H., Ma L.T., Wong J. Retroperitoneal extrarenal angiomyolipoma. Aust N Z J Surg. 1994:449-51. [ Links ]
8. Murphy D.P., Glazier D.B., Chennen E.S., Principato R., Diamond S.M. Extrarenal retroperitoneal angiomyolipoma: nonoperative management. J Urol. 2000:234-5. [ Links ]
9. Wadih G.E., Raab S.S., Silverman J.F. Fine needle aspiration cytology of renal and retroperitoneal angiomyolipoma. Report of two cases with cytologic findings and clinicopathologic pitfalls in diagnosis. Acta Cytol. 1995:945-50. [ Links ]
10. Gómez García I., Sanz Mayayo E., Allona Almagro A., Ruiz Rubio J.L., García - Cosio Piqueras M., Rodríguez Patrón R., et al. Angiomiolipoma pararrenal "Revisión de la bibliografía y presentación de un nuevo caso" Arch Esp Urol. 2004:434-7. [ Links ]
11. Molina M., Ruipérez J.., Ortega N., Parrilla P. Retroperitoneal angiomyolipoma and pregnancy. Med Clin (Barc). 2001; 117:199. [ Links ]
12. Mogi Yoshihiro, Takimoto Rishu, Kura Tshiro, Tamakawa Mitsuharu, Sakamaki Sumio, Niitsu Yoshiro. Retroperitoneal extrarenal angiomyolipoma with early gastric carcinoma. Journal of Gastroenterology. 1998:86-90. [ Links ]
13. Wang L.J., Lim K.E., Wong Y.C., Chen C.J. Giant retroperitoneal angiomyolipoma mimicking liposarcoma. Br J Urol. 1997:1001-2. [ Links ]
14. Lee Y.-C., Huang S.-P., Liu C.-C., Wu W.-J., Chou Y.-H., Huang C.-H. Giant Extrarenal retroperitoneal Angiomyolipoma: A case report and literature review. Kaohsiung J Med Sci. 2003:579-82. [ Links ]
15. Mansi M.K., Al-Khudair W.K., Al-Bqami N.M., Wenckepach G.S. Extrarenal retroperitoneal angiomyolipoma. Saudi Med J. 2002:1124-6. [ Links ]
16. Ganzera S., Nguyen H.N., Wiemann H., Schneider J., Jakubowski H.D. Retroperitoneal giant angiomyolipoma diagnosed post-partum with lymph node involvement. Dtsch Med Wochenschr. 2002:1463-6. [ Links ]
17. Cavazza A., Giunta A., Pedrazzoli C., Putrino I., Serra L., De Marco L., et al. Extrarenal retroperitoneal angiomyolipoma: description of a case and review of the literature. Pathologica. 2001:44-9. [ Links ]
18. Hruban R.H., Bhagavan B.S., Epstein J.I. Massive retroperitoneal angiomiolipoma. Alesion that may be confused with well-differentiated liposarcoma. American Journal of Clinical Pathology. 1989:805-8. [ Links ]
19. Piccinini E.E., Rosati G., Ugolini G., Marroccu S., Salfi N.C., Pasquinelli G., et al. Giant retroperitoneal angiomyolipoma. A case report. Hepatogastroenterology. 1999:182-4. [ Links ]
20. Bestard Vallejo J.E., Trilla Herrera E., Celma Domenech A., Pérez Lafuente M., de Torres Ramírez I., Morote Robles J. Angiomiolipomas renales: presentación, tratamiento y resultado de 20 casos. Actas Urol Esp. 2008:307-15. [ Links ]
21. Pascual Samaniego M., Calleja Escudero J., De Castro Olmedo C., Cortiñas González J.R., Martín Blanco S., Fernández Del Busto E. Angiomiolipoma renal intrasinusal. Diagnóstico diferencial con el aneurisma de arteria renal. Actas Urol Esp. 2002:515-8. [ Links ]
22. Raft J., Lalot J.M., Meistelman C., Longrois D. Influence of pregnancy on renal angiomyolipoma. Gynecol Obstet Fertil. 2005:898-906. [ Links ]
23. Fariña L.A., Villavicencio H., Algaba F., Palou J., Caparros J., Solé Balcells F.J. Angiomiolipoma renal: dificultades diagnósticas e indicaciones quirúrgicas en 20 pacientes operados. Actas Urol Esp. 1994:639-45. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
danielleonramirez@hotmail.com
(L. Ramírez Daniel).














