Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.32 no.6 Cantabria 2012
https://dx.doi.org/10.3265/Nefrologia.pre2012.Jul.11539
Desarrollo de un programa de trasplante renal con órganos procedentes de donación tras asistolia controlada, tipo III de Maastricht
Development of a program for kidney transplants using organs donated from donors awaiting cardiac arrest (type III Maastricht)
José Portolés-Pérez1, Juan J. Rubio-Muñoz2, Omar Lafuente-Covarrubias1, Beatriz Sánchez-Sobrino1, Joaquín Carballido-Rodríguez3, Gabriel Rodríguez-Reina3, Diego Rengifo-Abadd3, Amparo Medina-Carrizo1, Carmen Sanz-Moreno1, José Fernández-Fernández1 y REDInRen ISCIII (red06/0016)
1Servicio de Nefrología. Hospital Universitario Puerta de Hierro. Madrid
2Unidad de Cuidados Intensivos. Hospital Universitario Puerta de Hierro. Madrid
3Servicio de Urología. Hospital Universitario Puerta de Hierro. Madrid
Dirección para correspondencia
RESUMEN
Introducción: La disponibilidad de donantes es el factor limitante para el trasplante renal. El donante en asistolia (DAS) no controlado proporciona hasta un tercio de los órganos. El DAS controlado tras limitación de técnicas de soporte vital (LTSV) o tipo III de Maastricht constituye una alternativa aún por desarrollar de forma sistemática.
Tipo de estudio: Descriptivo, serie de 10 casos realizados entre enero y abril 2012.
Métodos: A lo largo de 6 meses se diseña el protocolo de extracción y manejo del trasplante e inmunosupresión entre los equipos implicados. Se evalúan los pacientes de acuerdo con los criterios consensuados por un equipo distinto al responsable de coordinación de trasplante. Se establece un tiempo máximo 120 min desde LTSV hasta fallecimiento y de 60 min de isquemia caliente. Se utilizan dos tipos de perfusión de injerto, uno in situ por abordaje directo en lecho quirúrgico y otro con canalización vascular antemortem. La pauta de inmunosupresión incluye inducción con timoglobulina, esteroides y micofenolato e introducción de tacrolimus al séptimo día. Se muestran datos como mediana y (rango).
Resultados: Se incluyen los 10 primeros casos de trasplante renal con órganos procedentes de 5 DAS tipo III de Maastricht: 4 varones, edad media 57 años (45-66), con LTSV por encefalopatía anóxica (2), intoxicación (1), accidente cerebrovascular agudo (2) e insuficiencia respiratoria terminal (1). Los tiempos registrados fueron: isquemia caliente efectiva de 20 min (8-23) e isquemia fría de 7,5 horas (4-14,1). Los receptores tenían 58 años (32-71), con distintas etiologías (2 glomerulonefritis, 1 poliquistosis, 2 nefropatía tubulointersticial, 4 vasculares y 1 no filiada), llevaban en hemodiálisis 31,7 meses (11-84) y para 2 de ellos era su segundo trasplante. Ninguno era hiperinmunizado. Seis pacientes precisaron alguna sesión de diálisis y cuatro presentaron necrosis tubular aguda prolongada, durante un ingreso de 24,5 días (8-44 d). La creatinina (Cr) al mes del trasplante fue de 2,1 mg/dl (0,7-3,2) y la Cr nadir fue de 1,2 mg/dl (0,7-3,2 mg/dl). Un paciente no mejoró su Cr por debajo de 3,2 mg/dl aunque la biopsia no mostró toxicidad ni rechazo, y su pareja de trasplante alcanzó una Cr de 1,4 mg/dl. En toda la serie se constataron complicaciones quirúrgicas similares a las de nuestra serie histórica de donantes convencionales.
Conclusiones: Con las limitaciones de un estudio preliminar, el uso de este tipo de injertos presenta una evolución favorable a corto plazo. La utilización de este tipo de donante puede ayudar a reducir el tiempo de espera para un trasplante.
Palabras clave: Donante en asistolia, Donante tipo III Maastricht, Donante criterios expandidos.
ABSTRACT
Introduction: The availability of organ donors is a limiting factor for kidney transplants. Donations from non-heart-beating donors (NHBD) can provide as many as one-third of all organs. Controlled patients awaiting cardiac arrest following limitation of life support techniques, or type III Maastricht donors, constitute an alternative that still has yet to be systematically developed.
Study type: Descriptive series of 10 cases occurring between January and April 2012.
Method: Over a period of 6 months, we designed a protocol for extracting and managing kidney transplants and providing immunosuppression therapy. Patients are evaluated in accordance with the criteria agreed by a different team responsible for transplant coordination. We established a maximum duration of time between limitation of life-sustaining therapy and death of 120 minutes and 60 minutes warm ischaemia. Two types of graft perfusion were used, one in situ through direct application to the surgical area, and another using ante mortem vascular canalisation. Immunosuppression therapy included induction with thymoglobulin, steroids, and mycophenolate, with introduction of tacrolimus on the seventh day. Data are expressed as median and (range).
Results: We included the first 10 cases of kidney transplants with organs from 5 NHBD (type III Maastricht): 4 males, mean age of 57 years (45-66 years), with limitation of life-sustaining therapy due to anoxic encephalopathy (2), intoxication (1), acute stroke (2) and terminal respiratory failure (1). The following mean time intervals were recorded: effective warm ischaemia: 20 minutes (8-23 minutes) and cold ischaemia: 7.5 hours (4-14.1 hours). Recipients had a mean age of 58 years (32-71 years), with various aetiologies (2 cases of glomerulonephritis, 1 polycystic kidney disease, 2 tubulo-interstitial nephropathy, 4 vascular, and 1 unknown), with a mean 31.7 months on haemodialysis (11-84 months); the kidney was a second transplant in two cases. No patients were hyper-immunised. Six patients required a dialysis session at some point, and four had prolonged acute tubular necrosis, over a mean hospitalisation period of 24.5 days (8-44 days). Mean creatinine (Cr) one month after transplantation was 2.1mg/dl (0.7-3.2mg/dl), and mean nadir creatinine was 1.2mg/dl (0.7-3.2mg/dl). One patient did not improve upon Cr values <3.2mg/dl, despite the absence of evidence of toxicity or rejection in a renal biopsy, and the transplant pair reached a Cr of 1.4mg/dl. Throughout the series, similar surgical complications were recorded to those observed in conventional donor situations.
Conclusions: Despite the limitations of this preliminary study, the use of this type of transplant produces favourable short-term evolution. Expanded use of this type of donor could reduce the waiting-list time for a kidney transplant.
Key words: Non Heart-beating donor, Maastricht type III donor, Expanded criteria donor.
Introducción
El número de donantes en muerte encefálica (DME) se va reduciendo en los últimos años y se ha producido un cambio progresivo en sus características. El perfil de DME más frecuente hoy en día es el de un varón mayor de 65 años que fallece por problemas cerebrovasculares1. Los equipos de coordinación han mejorado la tasa de donación efectiva hasta el 63 % de los pacientes en muerte encefálica, pero, a pesar de ello, se mantiene la desproporción entre órganos disponibles y pacientes en lista de espera.
La estrategia para aumentar la accesibilidad al trasplante incluye tres ejes: potenciar el trasplante de vivo en sus distintas modalidades, considerar el donante con criterios expandidos y desarrollar programas con donante en asistolia. En alguna comunidad de nuestro país, el donante en asistolia representa ya el 37 % de todos los donantes y proviene casi en exclusiva del donante en asistolia no controlada (tipos I y II de Maastricht)2. Este grupo incluye el donante que no se recupera tras parada cardiorrespiratoria dentro o fuera del ámbito hospitalario. Sin embrago, en otros países es más común el donante controlado, que procede de una parada tras limitación de las técnicas de soporte vital (LTSV) en el medio hospitalario (tipo III de Maastricht)3. Este modelo de donante en asistolia es respetuoso con los deseos de la familia, está aprobado desde el punto de vista ético y ha sido reconocido en un reciente consenso de expertos publicado por la Organización Nacional de Trasplantes (ONT)4,5. La experiencia con este tipo de trasplante es reciente y escasa en nuestro país, y se limita a dos casos publicados en 20116,7.
Presentamos nuestra experiencia con la puesta en marcha de un programa específicamente orientado a este tipo de donantes, que recoge el seguimiento a corto plazo de los 10 primeros trasplantes realizados en 4 meses.
Pacientes y protocolo
Se trata de un estudio descriptivo de serie de casos que incluye todas la extracciones de donante en asistolia controlada realizadas entre enero y abril de 2012. Durante el último trimestre de 2011 se elaboró un protocolo de donación tras la muerte cardíaca controlada al mismo tiempo que se priorizó y reestructuró el proceso de trasplante renal, para reducir el tiempo de isquemia fría. Participaron en todo este proceso los Servicios de Coordinación de Trasplantes, Nefrología, Urología, Inmunología y Anestesia. El protocolo de donación en asistolia controlada se presentó a todos los Servicios implicados en el trasplante renal y a la Comisión de Trasplantes, y recibió el visto bueno del Comité de Ética Asistencial del Centro, de la Oficina Regional de Coordinación de Trasplantes y de la ONT. La priorización del proceso completo de donación y trasplante renal fue respaldada por la Gerencia y la Dirección del Hospital, y presentada en una sesión general hospitalaria.
Los pacientes con lesiones neurológicas irreversibles, enfermedades neuromusculares terminales, lesiones espinales altas y enfermedades respiratorias igualmente terminales son candidatos a este programa de donación tras LTSV. Una vez que el equipo médico de la Unidad de Cuidados Intensivos (UCI) tomaba la decisión de LTSV de acuerdo al protocolo establecido en el Servicio, lo comunicaba a la familia. Tan solo después de que esta aceptase la limitación, el equipo de Coordinación de Trasplantes planteaba la posibilidad de una donación. De esta forma, se separaba el proceso de LTSV del de donación, evitando cualquier conflicto ético o de intereses.
Se consideraron como criterios de inclusión del donante renal los acordados por la British Trasplantation Society: edad < 65 años, función renal normal o creatinina (Cr) < 2 mg/dl si se conocía función renal normal previa al evento. En los casos dudosos se exigía biopsia renal8. Utilizamos el score de la Universidad de Wisconsin para estimar el tiempo esperable desde la LTSV hasta el fallecimiento9. Tras la asistolia se certificaba la muerte del paciente una vez transcurridos 5 minutos de observación. Si la asistolia no se producía en 120 min desde la LTSV, la donación era suspendida y se continuaba con los cuidados del paciente hasta su fallecimiento.
Se consideraron dos protocolos para la extracción de los órganos. El primero consistía en la laparotomía rápida con canulación directa de la aorta, perfusión in situ de solución de preservación combinada con enfriamiento local y extracción de los órganos. El segundo requería la canulación antemortem de los vasos femorales con catéteres de doble balón y triple luz (AJ6536 de Porgès S.A., Le Plessis-Robinson, Francia) que quedan con los balones deshinchados hasta el fallecimiento del paciente. Una vez trascurridos 5 minutos, se utilizan para la perfusión de líquido frío de preservación (Celsior®), logrando reducir al mínimo el tiempo de isquemia caliente (TIC). Se establece que el TIC no debe superar los 60 minutos para considerar los riñones válidos. El TIC se cuantificó desde la aparición de hipoperfusión funcional (presión arterial media (PAM) < 60 mmHg) hasta el comienzo de la perfusión fría con líquido de preservación9. Hemos diseñado un consentimiento informado específico para el receptor que detalla las características de este tipo de donante, datos de utilización, riesgos y resultados publicados por otros equipos.
El protocolo de inmunosupresión elegido tiene en cuenta el alto riesgo de función retrasada del injerto propio del donante en asistolia. Por ello se contempla una fase de inducción con esteroides y timoglobulina (1 mg/kg/día x 7 días); añadimos micofenolato mofetilo (1-2 g/día) desde el día 1 y comenzamos con tacrolimus (0,1 mg/kg/día) el séptimo día. En aquellos casos en que se produzca una mejoría significativa de la función renal, se permite adelantar la conversión de timoglobulina a tacrolimus. Se añade profilaxis de infección por citomegalovirus según las guías clínicas10.
Presentamos los datos de evolución de 10 pacientes que reciben un riñón procedente de 5 donantes en asistolia (DAS), con un seguimiento clínico analítico de entre 6 y 24 semanas. Por ser un grupo reducido de pacientes, donde los valores numéricos no siguen una distribución normal, se muestran los datos como mediana y rango. No se realizan test estadísticos.
Resultados
Incluimos los datos de los 5 primeros donantes en asistolia (4 hombres, 1 mujer) recogidos entre enero y abril de 2012. La mediana de edad fue de 57 años (rango 45-66). Las causas de LTSV fueron: tres encefalopatías graves (dos tras parada cardiorrespiratoria por infarto de miocardio y una por intoxicación con metanol), una hemorragia cerebral masiva y una fibrosis pulmonar terminal. Las características fundamentales del donante y el proceso de extracción se recogen en la tabla 1. En los dos primeros casos se realizó la extracción ultrarrápida con perfusión en lecho quirúrgico, y en los otros tres casos, con canulación antemortem y perfusión fría tras confirmar fallecimiento. Todos los órganos se consideraron viables tras inspección y valoración clínica, pero en el caso 3 se realizó una biopsia debido a la edad límite del donante y se consideró viable tras confirmar el patólogo un solo glomérulo esclerosado de los 35 valorables.
Tabla 1. Características básicas de los donantes 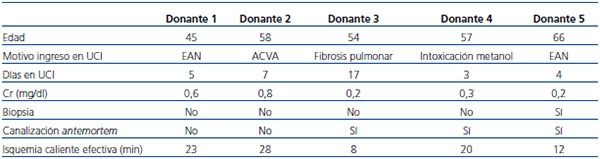
ACVA: accidente cerebrovascular-hemorragia masiva; Cr: creatinina; EAN: encefalopatía
anóxica tras parada cardiorrespiratoria por infarto de miocardio; UCI: Unidad de Cuidados intensivos.
Isquemia caliente efectiva desde PAM < 60 mmHg hasta perfusión.
Las características básicas de los pacientes trasplantados se recogen en la tabla 2. La mediana de edad era de 58 años (rango 32-71 años), con una permanencia media en diálisis de 31,7 meses (rango 11-84 meses). Para dos de ellos era su segundo trasplante y ninguno estaba hiperinmunizado. La medida de compatibilidad HLA fue de 1,2 sobre 6, el tiempo de isquemia caliente efectiva fue de 20 min (rango 8-23 min) y el de isquemia fría de 7,5 horas (rango 4-14,1 h). Seis pacientes precisaron alguna diálisis o ultrafiltración y 4 pacientes presentaron necrosis tubular aguda (NTA) prolongada, con función retrasada del injerto. La duración del ingreso fue de 24,5 días (rango 8-44 d). La Cr al mes del trasplante fue de 2,1 mg/dl (rango 0,7-3,2 mg/dl) y la mediana de Cr nadir fue de 1,2 mg/dl (rango 0,7-3,3 mg/dl).
Tabla 2. Características de los pacientes trasplantados y de su evolución clínico-analítica 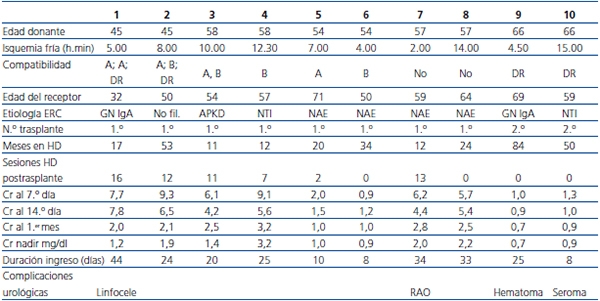
APKD: poliquistosis renal; Cr: creatinina; ERC: enfermedad renal crónica;
GN: glomerulonefritis; HD: hemodiálisis;
NAE: nefroangioesclerosis; NTI: nefropatía intersticial; RAO: retención aguda de orina.
El paciente que no consiguió mejorar su Cr por debajo de 3,2 mg/dl fue biopsiado, sin que se encontrasen signos de rechazo agudo, tan solo datos de esclerosis glomerular sin hialinosis ni otros datos de afectación vascular. No había datos de toxicidad aguda ni crónica por inhibidores de calcineurina, y las técnicas para poliomavirus fueron negativas. El otro riñón del mismo donante alcanzó una Cr nadir de 1,4 mg/dl. En toda la serie se constataron complicaciones quirúrgicas similares a las de nuestra serie histórica de donantes convencionales.
Discusión
Hemos presentado los primeros resultados de la puesta en marcha de nuestro programa de donación en asistolia tras LTSV. En un período de seguimiento corto, los pacientes alcanzan una mediana de Cr de 1,2 mg/dl y solo un paciente parece mantenerse en cifras elevadas pese a ser el de seguimiento más largo. Los resultados son, globalmente considerados, similares a los de otras series internacionales11 mucho más amplias y lo bastante prometedores como para continuar con el programa.
Las experiencias comunicadas en otros centros del país tienen una aproximación menos sistemática y no parecen encaminadas a constituir una actividad programada en sí misma, sino un aprovechamiento de casos esporádicos. Nosotros planteamos que este tipo de donante merece un enfoque específico y un diseño de plan de acción propio, puesto que pueden llegar a constituir una parte importante de la actividad de un servicio. De hecho, nuestra estimación inicial nos hacía esperar 3-4 donantes al año, pero hemos encontrado una incidencia mayor de pacientes susceptibles de LTSV, una excelente aceptación familiar y un aprovechamiento óptimo de los órganos. Esta baja tasa de negativas coincide con la obtenida tradicionalmente para el donante en asistolia no controlado. Los datos previos del informe de la oficina regional de trasplante de Madrid recogen para 2011 una tasa de negativas del 22 % para DME y de solo el 8 % para DAS12.
La escasa utilización de este tipo de donantes en España se debe a la disponibilidad de suficientes donantes convencionales y a una cierta reticencia ante este modelo, que fue expresada en un documento de la ONT en 1996. Ambas condiciones han cambiado, facilitando la puesta en marcha de esta nueva etapa. El documento recientemente elaborado por la ONT está en la línea de los consensos previos de otros países y tiene un gran valor para aquellos que decidan emprender este tipo de programas de donante en asistolia controlada5.
Los órganos procedentes de donantes tipo III de Maastricht permiten realizar el 50 % de los trasplantes renales en países de nuestro entorno, como Bélgica, Reino Unido u Holanda3. Según datos de la United Network for Organ Sharing (UNOS) entre 2000 y 2005, se registró un aumento del 22 % para los trasplantes renales procedentes de DME y de un 361 % de los procedentes de donante en asistolia2.
El desarrollo de los programas de donantes en asistolia no controlados desde hace más de 15 años nos ha permitido aplicar su experiencia al modelo propuesto13. Los donantes en asistolia no controlados parten de una peor situación para el órgano, ya que se desconocen las condiciones exactas y el tiempo trascurrido en parada cardiorrespiratoria sin soporte vital avanzado. Por ello, hasta un 35 % de los órganos se desechan para su implantación y las tasas de NTA prolongada son elevadas, aumentando el tiempo necesario para alcanzar la Cr nadir. Pese a todo ello, el funcionamiento a medio plazo de estos riñones ha demostrado ser superponible al de los donantes en muerte encefálica13.
En el caso del donante en asistolia controlada, nos enfrentamos en un escenario de información y manejo muy distinto que podría justificar una mejor evolución. En nuestra serie se han utilizado todos los riñones extraídos; la evolución de función renal ha sido mas lenta que en los DME de nuestro histórico, pero ha permitido alcanzar una Cr nadir razonable, que puede continuar mejorando en los pacientes de seguimiento más breve. Otro valor añadido de la puesta en marcha de este programa es que ha contribuido a reorientar el proceso asistencial del trasplante en el hospital, reduciendo los tiempos de isquemia fría a la mitad del histórico en trasplante de órgano procedente de DME.
En su conjunto, los donantes de nuestra serie son algo más jóvenes, con una estancia reducida en UCI y con menos comorbilidad aguda que los donantes habituales en muerte encefálica. No hemos considerado necesaria la realización de la biopsia sistemática del órgano extraído, y hemos preferido utilizar criterios clínicos más restrictivos y de evaluación macroscópica del órgano.
Algunos autores consideran que la donación tras LTSV compite y se anticipa a la situación de muerte encefálica, reduciendo así la disponibilidad de otros órganos que serían viables en un donante convencional1. Sin embargo, el perfil de paciente resulta distinto en ambos casos, y por ello es preciso un cuidadoso diagnóstico clínico en las UCI. Además, es importante deslindar la toma de decisión de LTSV, práctica clínica habitual en UCI, del hecho de la donación. En nuestra corta experiencia, la tasa de donantes convencionales del hospital se ha mantenido y, por todo lo anteriormente dicho, consideramos que los trasplantes realizados no se habrían llevado a cabo de no haberse puesto en marcha este modelo.
La utilización del donante tipo III tiene mucha menor complejidad organizativa que la de los tipos I y II, y puede implementarse en muchos centros con pocos recursos añadidos. Solo es preciso un trabajo de protocolización y orientación del modelo asistencial hospitalario hacia el trasplante. De hecho, el consenso canadiense recomienda que aquellos centros que deseen comenzar a trabajar con el donante en asistolia lo hagan con el donante controlado4.
Obviamente, se trata de un análisis preliminar a corto plazo y esa es su mayor limitación. Sin embargo, es en la fase inicial de implantación de un programa donde se encuentran los mayores problemas organizativos, de igual manera que es en el primer ingreso donde se concentran los problemas para el paciente, como son las complicaciones quirúrgicas y la función retrasada del injerto. Otros grupos han señalado que los riñones procedentes estos donantes tienen una mayor tendencia a presentar rechazo agudo, aunque la supervivencia del paciente y del injerto a medio plazo no es distinta de la que se registra en trasplante con injerto procedente de donante en muerte encefálica12. La pauta de inmunosupresión utilizada pretende evitar el daño tubular añadido en las primeras fases, pero también ser suficientemente eficaz como para proteger del rechazo. En nuestro corto seguimiento no hemos detectado ningún episodio de rechazo agudo. El seguimiento a largo plazo debe realizarse comparando los resultados de los distintos tipos de donantes. Por ello, proponemos que los registros autonómicos de enfermos renales contemplen una variable específica que clasifique los pacientes por el tipo de donante para poder reunir la experiencia de varios grupos.
Consideramos que los pacientes deben recibir información específica sobre el tipo de órgano que van a recibir, especialmente si es un riñón de donante de criterio expandido o de asistolia. En estos casos se debe informar sobre los riesgos específicos para evaluarlos frente al riesgo de continuar en diálisis esperando un donante convencional. Por eso hemos redactado un modelo específico para el trasplante de órgano procedente de donante en asistolia controlado. En nuestra serie solo hubo un paciente que rechazó el trasplante al ser informado de estos aspectos.
Podemos concluir que la implementación de un programa de trasplante renal de donante en asistolia tipo III de Maastricht es una alternativa adecuada para aumentar el número de trasplantes renales, disminuyendo la lista de espera de los receptores. Si bien se trata de una serie pequeña de trasplantes, nos permite mirar al futuro considerándolos como una alternativa válida y adecuada para superar la progresiva disminución de los DME.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Domínguez-Gil B, Haase-Kromwijk B, Van Leiden H, Neuberger J, Coene L, Morel P, et al. Current situation of donation alter circulatory death in european countries. Transpl Int 2011;24(7):676-86. [ Links ]
2. Kootstra G, Daemen JH, Oomen AP. Categories of non-heart-beatingdonors. Transplant Proc 1995;27(5):2893-4. [ Links ]
3. Ledicnh H, Bonvoisin C, Weekers L, de Roover A, Honoré P, Squifflet JP, et al. Results of kidney transplantation from donors after cardiac death. Transplant Proc 2010;42:2407-14. [ Links ]
4. Shemie SD, Baker AJ, Knoll G, Wall W, Rocker G. Donation after cardiocirculatory death in Canada. CMAJ 2006;175(8):S1-S24. [ Links ]
5. Documento de consenso de la ONT sobre donación en asistolia. Available at: http://www.ont.es/infesp/DocumentosDeConsenso/DONACIÓN EN ASISTOLIA EN ESPAÑA. SITUACIÓN ACTUAL Y RECOMENDACIONES.pdf. (Accessed: May 10,2012). [ Links ]
6. Corral E, Maynar J, Saralegui I, Manzano A. Donantes a corazón parado tipo III de Maastricht: una opción real. Med Intensiva 2011;35:59-60. [ Links ]
7. Sanchez-Izquierdo A, Cisneros A, García-Guijarro R, Montejo JC, Baldrés A. Donantes tipo III de Maastricht (cartas al director). Med Intensiva 2011;35:524-5. [ Links ]
8. Shemie SD, Doig C, Dickens B, Byrne P, Wheelock B, Rocker G, et al. Severe brain injury to neurological determination of death: Canadian forum recommendations. CMAJ 2006;174(6):S1-12. [ Links ]
9. DeVita MA, Mori-Brooks M, Zawistowski C, Rudich S, Daly B, Chaitin E. Donors alter cardiac death: validation of identification criteria (DVIC) study for predictors of rapid death. Am J Transplant 2008;8:432-44. [ Links ]
10. Amenabar J, Arriceta G, Beneyto I, Bernis C, Calvo N, Crespo JF, et al. Estrategias de prevención y tratamiento de la enfermedad por citomegalovirus en pacientes con trasplante renal. Nefrologia Sup Ext 2012;3(1):21-7. [ Links ]
11. Pieter ER, Snoeijs M, van Heurn LW. DCD kidney transplantation: results and measures to improve outcome. Curr Opin Organ Transplant 2010;15:177-82. [ Links ]
12. ONT. Memoria de actividades 2010. Revista española de trasplantes 2011;2:1-31. [ Links ]
13. Sánchez-Fructuoso A, Giorgi M, Barrientos A. Kidney transplantation from non-heartbeating donors: a Spanish view. Transplantation Reviews 2007;21:249-54. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Portolés-Pérez
Servicio de Nefrología
Hospital Universitario Puerta de Hierro
Manuel de Falla, 1, 28222, Madrid
josem.portolés@salud.madrid.org
Enviado a Revisar: 1 Jun. 2012
Aceptado el: 9 Jul. 2012














