Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.32 no.6 Cantabria 2012
https://dx.doi.org/10.3265/Nefrologia.pre2012.Jul.11465
Efecto de la modalidad de diálisis y otros factores de prescripción sobre las pérdidas proteicas peritoneales en diálisis peritoneal
Effect of dialysis modality and other prescription factors on peritoneal protein excretion in peritoneal dialysis
Ana Rodríguez-Carmona1, Miguel Pérez-Fontán1, Sonia Pértega-Díaz2, Beatriz López-Calviño2, Andrés López-Muñiz1 y Teresa García-Falcón1
1Servicio de Nefrología. Complejo Hospitalario Universitario A Coruña
2Servicio de Epidemiología. Complejo Hospitalario Universitario A Coruña
Dirección para correspondencia
RESUMEN
Antecedentes: Existe información insuficiente sobre los factores que influyen en las pérdidas proteicas peritoneales (PPP) durante el tratamiento con diálisis peritoneal (DP). En particular, se desconoce el efecto que la modalidad de DP y otras condiciones de prescripción pueden tener sobre esta variable.
Método: Siguiendo un diseño prospectivo y observacional, analizamos el efecto de las condiciones de prescripción de DP sobre las PPP en 24 horas (variable principal) en una cohorte de pacientes incidentes en DP. La estrategia de análisis incluyó análisis estadístico mediante modelos mixtos multinivel y estimaciones estandarizadas del transporte proteico peritoneal durante pruebas de equilibrio peritoneal seriadas, con el fin de ajustar para desigualdades en las características de las poblaciones manejadas con diferentes pautas de prescripción.
Resultados: Estudiamos 284 pacientes, 197 en DP continua ambulatoria (DPCA) y 87 en DP automática (DPA) al inicio de seguimiento. Ambos grupos mostraron diferencias significativas en sus características clínicas y de función peritoneal. Las estimaciones seriadas de las PP de 24 horas mostraron valores marginalmente más altos en DPCA, permaneciendo esencialmente estables durante el seguimiento. El análisis multivariante identificó a la DPCA (B = 888,5 mg, intervalo de confianza 95%: 327,5/1448,6), el volumen total de dializado infundido (B = 275,9 mg/l, 153,9/397,9) y la ultrafiltración diaria (B = 0,41 mg/ml, 0,02/0,80) como predictores independientes de las PPP de 24 horas. El modelo también mostró tendencia a disminución en las PPP con el tiempo en DP.
Conclusiones: Las características individuales de transporte peritoneal de proteínas son el principal determinante de las PPP en 24 horas. La pauta de cambios largos (DPCA) asocia mayores PPP que la de cambios cortos (DPA), aunque esta diferencia se compensa en la práctica por la correlación positiva entre PPP y volumen infundido. Ultrafiltración y tiempo en diálisis son predictores secundarios de PPP en 24 horas.
Palabras clave: DPCA, Diálisis peritoneal automática, Proteína, Prueba de equilibrio peritoneal, Prescripción.
ABSTRACT
Background: There is a deficit of information regarding the factors that influence peritoneal protein excretion (PPE) during PD therapy. In particular, the effects of the modality of PD and other conditions of the dialysis prescription remain unclear.
Method: This prospective, observational study analysed the effects of prescription characteristics on 24-hour PPE (study variable) in a cohort of patients starting PD. Our statistical analysis included a multi-level mixed model and standardised estimations of peritoneal protein transport during serial four-hour peritoneal equilibrium tests in order to control for disparities in the characteristics of patients managed on different regimens.
Results: We evaluated 284 patients, 197 on CAPD and 87 on automated PD (APD), at the start of PD treatment. The two groups differed in terms of clinical characteristics and peritoneal function. Univariate, serial estimates of 24-hour PPE were marginally higher in CAPD patients, and remained essentially stable over time in both groups. Multivariate analyses identified CAPD (B=888.5mg, 95% CI: 327.5/1448.6), total dialysate volume infused per day (B=275.9mg/Ll; 153.9/397.9) and ultrafiltration (B=0.41mg/mL; 0.02/0.80) as independent predictors of 24-hour PPE. The model also revealed a minor trend for a lower 24-hour PPE as time on PD increases.
Conclusions: The individual characteristics of peritoneal protein transport are the major determinants of 24-hour PPE. The use of CAPD as the dialysis modality is associated with higher PPE rates than the APD technique, although this difference is counterbalanced by a direct correlation between PPE and the volume of dialysate infused per day. Ultrafiltration and time on dialysis also act as minor independent predictors of PPE during PD therapy.
Key words: CAPD, Automated PD, Protein, Peritoneal equilibration test, Prescription.
Introducción
Las pérdidas proteicas peritoneales (PPP) son una consecuencia indeseada de la diálisis peritoneal (DP), ya que contribuyen en grado variable a la malnutrición1 y otras complicaciones de esta técnica2-4. Existe escasa información sobre los factores que modifican la magnitud de las PPP en la práctica clínica, aparte de la esperada correlación con las características generales de transporte peritoneal5-8. No está claro el efecto de las condiciones de prescripción ni, en particular, cómo influye la modalidad de DP sobre esta variable. Intentos previos destinados a aclarar estas cuestiones se han visto limitados por los notables desequilibrios en las características de las poblaciones comparadas. Es de destacar que el tipo de transporte peritoneal determina la prescripción, incluyendo la selección de DP crónica ambulatoria (DPCA) o DP automática (DPA). Las técnicas de análisis estratificado y multivariante ayudan a ajustar estos desequilibrios, pero el uso del transporte peritoneal de creatinina para este propósito es inadecuado, ya que esta variable es un predictor impreciso del transporte peritoneal de proteínas9,10.
Presentamos los resultados de un estudio observacional sobre una cohorte amplia de pacientes incidentes en DP, con el objetivo principal de establecer la influencia de las características de prescripción (incluyendo la modalidad de DP) sobre las PPP de 24 horas, aprovechando la disponibilidad de estimaciones estandarizadas del transporte peritoneal de proteínas durante pruebas de equilibrio peritoneal (PEP) seriadas.
Población y método
Diseño general
Estudio prospectivo y observacional sobre una cohorte de pacientes incidentes en DP en nuestro centro entre enero de 2000 y junio de 2010. Los criterios de inclusión fueron seguimiento mínimo de dos meses sin peritonitis y disponibilidad de estimaciones iniciales de PPP en 24 horas y durante PEP basal. La variable principal de estudio fue la magnitud de las PPP en efluente de 24 horas. La principal variable de ajuste fue la estimación del transporte peritoneal de proteínas durante una PEP estándar, con glucosa al 2,27 %. También utilizamos las principales variables demográficas, clínicas y de laboratorio para obtener estimaciones ajustadas.
En nuestro centro se utilizaron soluciones de DP tradicionales hasta mayo de 2008. A partir de esa fecha, todos los pacientes fueron tratados con soluciones bajas en productos de degradación de la glucosa.
El protocolo de estudio satisfizo los criterios éticos requeridos para estudios observacionales en nuestro centro, y se ajustó a la declaración de Helsinki.
Métodos de laboratorio y cálculos secundarios
Los niveles sanguíneos de hemoglobina, glucosa, urea, creatinina, albúmina y colesterol se estimaron con un autoanalizador estándar. Los niveles de glucosa y creatinina en dializado y de urea y creatinina en orina se midieron con procedimientos adaptados del mismo autoanalizador. La proteína C reactiva (PCR) plasmática se estimó con una prueba inmunoturbidimétrica (Roche Diag., Mannheim, RFA). Utilizamos una prueba colorimétrica modificada (rojo pirogalol) para medir las proteínas totales en orina y efluente peritoneal. En un estudio previo10 hemos mostrado que esta técnica es adecuada, y no se ve modificada por el almacenamiento de muestras ni por concentraciones altas de glucosa en dializado.
Las PEP siguieron procedimientos generales universalmente aceptados. El filtrado glomerular se estimó como la media de los aclaramientos de 24 horas de urea y creatinina. Los valores medios de ultrafiltración (UF) diaria y tensión arterial se recogieron de los gráficos diarios rellenados por los propios pacientes.
Estrategia de análisis
Comparamos el curso temporal de las PPP de 24 horas en pacientes tratados con DPCA y DPA hasta el final del segundo año de seguimiento, utilizando estrategias de intención de tratar y tratamiento final. Los resultados con ambas estrategias fueron similares, siendo los resultados por tratamiento final los que se exponen. También monitorizamos longitudinalmente diferentes variables demográficas, clínicas, de función peritoneal, adecuación y prescripción, buscando correlaciones univariantes con las PPP de 24 horas. Sin embargo, nuestro objetivo principal fue analizar cómo influyen las condiciones de prescripción sobre la variable principal, teniendo en cuenta posibles variaciones temporales en las tasas de PPP y los cambios introducidos a la prescripción de DP (incluyendo la propia modalidad) durante el seguimiento.
Análisis estadístico
Las variables numéricas se presentan como media ± desviación típica o valores medianos con amplitud, según proceda. Las comparaciones univariantes se realizaron mediante la prueba de la t de Student, ANOVA y pruebas de Mann-Whitney y Wilcoxon (variables numéricas) y distribución χ2 (variables categóricas). Calculamos las correlaciones entre variables numéricas mediante la prueba de Spearman. Utilizamos un modelo general lineal de medidas repetidas para analizar las tendencias univariantes a lo largo del tiempo, tanto para PPP en 24 horas como durante PEP seriadas.
El análisis multivariante se realizó mediante modelos lineales mixtos multinivel, con selección de variables hacia delante por pasos. El efecto paciente se ajustó como efecto aleatorio, mientras que las covariables analizadas se ajustaron como efectos fijos. Las estimaciones seriadas de PPP durante las PEP, que representan las características individuales de transporte peritoneal de proteínas a lo largo del tiempo, se incluyeron sistemáticamente en los modelos testados. También analizamos los efectos potenciales de eventos cardiovasculares (solo los que demandaron hospitalización) y peritonitis durante el seguimiento, así como los del tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA)-antagonistas de los receptores de angiotensina (ARA), sobre el curso temporal de las PPP. Las asociaciones entre las variables estudiadas y las PPP fueron estimadas mediante coeficientes beta (intervalos de confianza [IC] 95 %) en los capítulos de efectos fijos de los modelos. También analizamos términos de interacción. Por último, utilizamos los Criterios de Información Akaike (CIA) y Bayesianos (CIB) para comparar los modelos de máxima verosimilitud.
Utilizamos los programas SPSS v.18.0 y Stata v.11 para el procesamiento estadístico.
Resultados
De 313 pacientes evaluados, 284 cumplieron los criterios de inclusión. La tabla 1 muestra las características generales de la población del estudio al inicio de DP. Quince pacientes (5,3 %) sufrieron al menos un evento cardiovascular durante los primeros 6 meses, 24 (8,5 %) entre 6 y 12 meses, y 49 (17,3 %) durante el segundo año de seguimiento. Las incidencias acumuladas correspondientes de peritonitis fueron de 59 (20,8 %), 45 (15,8 %) y 26 episodios (9,2 %), respectivamente. La tabla 2 muestra los parámetros de prescripción y adecuación durante el seguimiento. Solo dos pacientes tenían día seco al inicio de DP, y cuatro más en diferentes fases del seguimiento. La mayor parte de las diferencias observadas eran esperables pero, de manera destacada, las PPP durante PEP seriadas fueron consistentemente mayores en pacientes en DPCA, mientras que el transporte de pequeños solutos (D/P de creatinina a las 4 horas D/Pcrea) mostró tendencia a valores más altos en los pacientes tratados con DPA, aunque la diferencia solo fue significativa en estimaciones basales (tabla 2).
Tabla 1. Características generales de los grupos de estudio al inicio de diálisis peritoneal 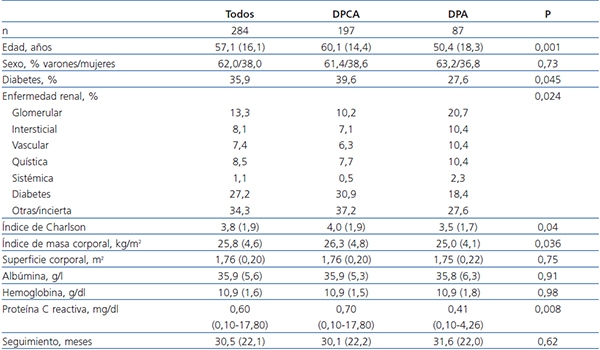
Las cifras indican medias (DT), excepto proteína C reactiva (mediana con amplitud).
Los valores de p comparan DPCA y DPA.
DPA: diálisis peritoneal automática; DPCA: diálisis peritoneal continua ambulatoria.
Tabla 2. Variables de adecuación y prescripción 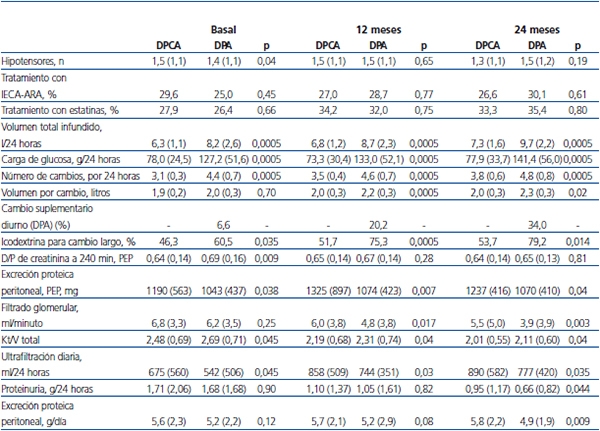
Las cifras expresan medias con desviación típica (DT) oporcentaje de casos.
IECA-ARA: inhibidores de la enzima de conversión de angiotensina-antagonistas
del receptor de angiotensina; PEP: pruebas de equilibrio peritoneal.
Los valores de p indican comparaciones entre diálisis peritoneal continua ambulatoria (DPCA)
y diálisis peritoneal automática (DPA) en cada punto temporal.
Los cambios de modalidad de DP fueron relativamente frecuentes, e implicaron paso de DPCA a DPA en 43 casos, frente a solo 4 cambios de DPA a DPCA. La tabla 3 muestra las principales correlaciones univariantes entre PPP de 24 horas por un lado y variables de adecuación y prescripción por otro. La variable principal del estudio mostró también correlación univariante significativa con el índice de comorbilidad de Charlson (r = 0,16, p = 0,006) y la PCR (r = 0,15, p = 0,014) basales. Tanto los análisis univariantes por intención de tratar como por tratamiento (tabla 2, figura 1) mostraron tendencias a valores más altos de PPP de 24 horas en los pacientes en DPCA durante el seguimiento, aunque la diferencia solo alcanzó significación estadística a los 24 meses. Por otra parte, los análisis univariantes de medidas repetidas no mostraron cambios significativos a lo largo del tiempo para las PPP durante PEP o en 24 horas, ni en el grupo total ni según modalidad de DP o desarrollo de peritonitis durante el primer año.
Tabla 3. Correlaciones univariantes de adecuación y prescripción con prueba de equilibrio peritoneal de 24 horas 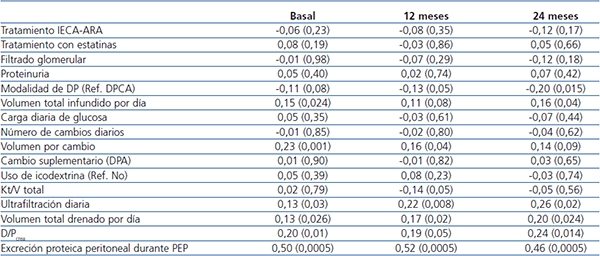
La cifras expresan valores del coeficiente de Spearman (entre paréntesis, valor de p).
D/Pcrea: cociente D/P de creatinina a 240 min; DP: diálisis peritoneal;
DPA: diálisis peritoneal automática; DPCA: diálisis peritoneal continua ambulatoria;
IECA-ARA: inhibidores de la enzima de conversión de angiotensina-antagonistas del receptor de angiotensina;
PEP: prueba de equilibrio
peritoneal.
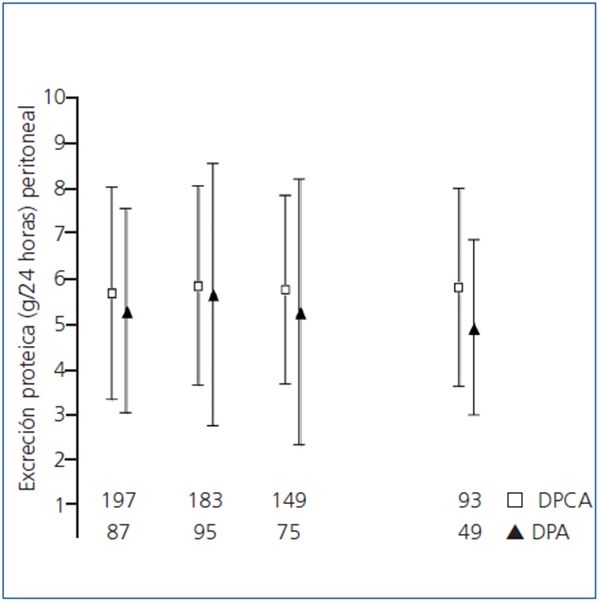
Figura 1. Pérdidas proteicas peritoneales en 24 horas en pacientes tratados con
diálisis peritoneal continua ambulatoria y diálisis peritoneal
automática durante el seguimiento (según tratamiento)
p = 0,009 entre DPCA y DPA a los 24 meses;
todas las demás diferencias inter o intragrupos, no signifcativas.
DPA: diálisis peritoneal automática; DPCA: diálisis peritoneal continua ambulatoria.
El análisis de modelos mixtos multinivel (tabla 4) identificó la DPCA (vs. DPA), el volumen total de dializado infundido en 24 horas y la UF diaria como predictores independientes de las PPP de 24 horas, después de ajustar para el transporte peritoneal de proteínas estandarizado (PEP). El volumen total drenado se comportó en los modelos como surrogado del infundido y la UF (B = 297,9, IC 95 % 203,6/292,3, p < 0,0005). Todas las variables incluidas en el modelo final mostraron impacto significativo en los CIA y CIB, con excepción de la UF diaria, sugiriendo que esta variable tiene una influencia práctica escasa en las PPP de 24 horas. No detectamos términos de interacción significativos entre las variables del modelo final, excepto por una interacción menor entre PPP durante PEP y volumen total infundido (B = -0,18, IC 95 % -0,6/-0,01, p = 0,039), que ignoramos para mayor claridad en la exposición. Ninguna otra variable clínica, de adecuación o de prescripción (tabla 3) mostró asociación independiente con las PPP de 24 horas. En particular, ni los eventos cardiovasculares (B = -149,9, IC 95 % -969,5/669,7, p = 0,72), ni las peritonitis (B = 389,0, IC 95 % -117,6/895,7, p = 0,13) ni el tratamiento con IECA-ARA (B = -17,6, IC 95 % -443,2/407,9, p = 0,94) mostraron correlación dependiente del tiempo con las PPP de 24 horas.
Tabla 4. Predictores de pérdidas proteicas peritoneales de 24 horas. Modelo mixto multinivel. Mejor modelo 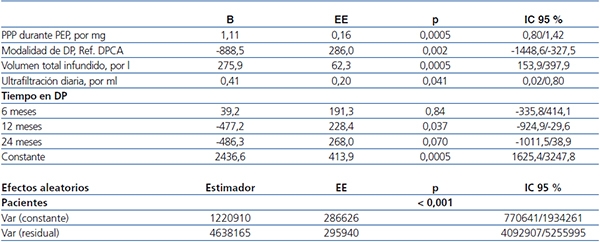
Criterio de información Akaike (CIA) 14556,7; criterio de información Bayesiano 14603,5.
B:
coeficiente de regresión; DP: diálisis peritoneal; DPCA: diálisis peritoneal continua ambulatoria;
EE: error estándar; IC: intervalo de confianza; PEP: prueba de equilibrio peritoneal;
PPP: pérdidas proteicas peritoneales.
El análisis multivariante mostró tendencias a una disminución de las PPP durante el seguimiento, aunque el efecto solo alcanzaba significación estadística a los 12 meses (tabla 4). Realizamos un análisis estratificado para descartar la posibilidad de que este efecto fuera consecuencia de una salida más precoz de DP de los pacientes con mayores tasas de PPP de 24 horas. El análisis mostró tendencias marginales y no significativas a tasas aumentadas de salida tardía de DP (24 meses) en pacientes tanto en primer como en cuarto cuartil de PPP durante PEP.
Discusión
Las PPP se relacionan con las características generales de transporte peritoneal de cada individuo. Sin embargo, la utilización de estimadores del transporte de solutos pequeños como marcador del de proteínas es poco fiable, ya que, aunque la correlación entre PPP y D/Pcrea es estadísticamente significativa, dista de ser inequívoca9,10. Esta limitación resulta lógica, dada la existencia de vías diferenciadas de transporte peritoneal de proteínas y solutos pequeños11. Si se pretende una evaluación ajustada del efecto de otros factores sobre las PPP de 24 horas, hace falta un marcador más específico de las características de transporte peritoneal de proteínas. En estudios previos hemos mostrado que una estimación estandarizada del transporte de proteínas durante una PEP es útil para este objetivo10,12.
Varios estudios han explorado los principales marcadores demográficos y clínicos del transporte peritoneal de proteínas en pacientes en DP. Edad avanzada, diabetes, comorbilidad cardiovascular, sobrepeso, función renal residual, proteinuria y PCR plasmática son algunos de los más citados8-14. Una valoración conjunta sugiere que las PPP se asocian con enfermedad cardiovascular, apoyando la hipótesis de que son un marcador de trastorno de poros peritoneales grandes e, indirectamente, de disfunción endotelial15,16. De hecho, algunos estudios han mostrado asociación entre PPP al inicio de DP y mortalidad en DP9,12. En nuestro estudio, observamos asociación univariante entre las PPP, por un lado, y el índice de comorbilidad de Charlson o la PCR plasmática por otro, aunque la correlación no se mantenía tras ajustar para la variable transporte peritoneal de proteínas durante PEP.
Muy pocos estudios han analizado la influencia de las condiciones de prescripción de DP sobre las PPP de 24 horas. Kathuria et al.5 compararon las PPP en pacientes tratados con DPCA y DP intermitente nocturna (DPIN), sin observar diferencias consistentes, incluso tras estratificar para transporte peritoneal de pequeños solutos (D/Pcrea). Por el contrario, Heaf et al.15 observaron valores más bajos de PPP durante DPIN que en pautas de DPA con día húmedo. En un estudio más pequeño, Westra et al.17 observaron niveles relativamente elevados de PPP en nueve pacientes tratados con DPA. Tanto un aumento en el número de ciclos como una mayor duración de las permanencias parecían asociar mayores PPP17. Sin embargo, el diseño de este estudio, incluyendo la falta de un grupo control en DPCA, no permitía conclusiones claras.
En nuestro estudio, los pacientes en DPCA presentaban diferentes características de transporte peritoneal de proteínas (estimadas durante PEP seriadas) que los pacientes en DPA (tabla 2). Esta diferencia en sí misma podría explicar por qué el análisis simple de las PPP de 24 horas mostró tendencia a niveles más altos en DPCA que en DPA (tabla 2). Por otra parte, las pruebas univariantes de medidas repetidas detectaron una notable estabilidad tanto de las PPP durante PEP como de 24 horas, lo que está de acuerdo con estudios anteriores8. El análisis de modelos mixtos multinivel (tabla 4) mostró que las condiciones de prescripción de DP también pueden influir en las PPP de 24 horas. Tanto el volumen total de dializado infundido como la UF diaria presentaron correlación directa e independiente con la variable principal. La UF puede ser contemplada como un simple complemento del volumen infundido, mientras que la posibilidad de un efecto específico de esta variable sobre el transporte peritoneal de proteínas es objeto de controversia. Así, algunos estudios recientes han mostrado una correlación directa entre ambas variables8,10, mientras que un estudio previo de Waniewski et al.18 mostró que la UF puede presentar una correlación tanto directa como inversa con las PPP, dependiendo de la categoría de transporte peritoneal, con efectos prácticamente neutros en el conjunto de la población tratada con DP. El impacto escasamente significativo de la UF sobre los CIA y CIB en el análisis multivariante sugiere una escasa relevancia de esta variable, en términos clínicos.
La pauta de DPCA asoció mayores niveles de PPP de 24 horas que la de DPA, tras ajustar para las características de transporte peritoneal de proteínas (PEP) y el volumen total de dializado infundido. El significado de este hallazgo no está totalmente claro, y no se puede descartar que sea producto de un sesgo residual debido a ajuste incompleto para otros factores. La pauta de DPA, basada en cambios más cortos y frecuentes, podría asociar PPP ligera, pero significativamente menores, debido a la acumulación de tiempos de infusión y drenaje. El impacto de este factor no debería ser importante si aceptamos que el transporte peritoneal de proteínas es lineal durante los intercambios, a diferencia del de pequeños solutos19. Es de destacar que otros estudios han sugerido que la excreción peritoneal de proteínas podría ser más rápida en la primera hora de permanencia18, haciéndose lineal con posterioridad. Si esto fuera cierto, incluso cabría esperar PPP mayores en las pautas de cambios cortos de DPA. Sin embargo, este fenómeno es, probablemente, consecuencia tanto del mezclado del volumen residual, rico en proteínas, con el dializado recién infundido, como del fenómeno de arrastre de proteínas del espacio intersticial hacia la cavidad peritoneal durante las fases precoces del intercambio. Cualquiera de estos efectos podría ser relevante tras permanencias largas (tipo DPCA), pero solo durante el primero de una serie de cambios cortos (tipo DPA).
Nuestro estudio presenta algunas limitaciones, que incluyen una asignación no aleatorizada de las pautas de prescripción de DP. Además, parte de los pacientes cambiaron de modalidad durante el seguimiento, sobre todo de DPCA a DPA, y la disfunción de membrana podría ser el trasfondo de algunos de estos cambios. La estrategia multivariante y dependiente de tiempo de análisis estadístico se dirigió a compensar estos sesgos potenciales. Por otra parte, nuestro centro no utiliza rutinariamente la DPIN, lo que no permite extraer conclusiones válidas respecto a esta modalidad de DPA. Finalmente, la mayoría de los pacientes fueron tratados con soluciones de DP clásicas. Un estudio reciente a corto plazo en nuestro centro mostró tasas similares de PPP en pacientes tratados con soluciones clásicas y biocompatibles20. Por otra parte, el estudio tiene fortalezas significativas. Primero, la población estudiada era relativamente amplia, permitiendo conclusiones significativas. La información clínica disponible fue bastante completa, y el diseño permitía comparaciones tanto transversales como longitudinales. Finalmente, la disponibilidad de estimaciones estandarizadas del transporte peritoneal de proteínas en PEP seriadas permitió el uso de esta variable para ajustar la heterogeneidad esperada en las características individuales de transporte peritoneal, particularmente a la hora de comparar a los pacientes en DPCA y DPA.
En resumen, las características individuales del transporte peritoneal de proteínas representan el determinante básico de las PPP de 24 horas en DP, pero las condiciones de prescripción también pueden influir en esta variable. La pauta de DPCA asocia mayores PPP que la de DPA, aunque esta diferencia se ve compensada por la asociación directa entre PPP y volumen total infundido (que suele ser mayor en DPA). La UF diaria y el tiempo en DP se comportan como marcadores independientes secundarios de las PPP en DP.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Pollock CA, Cooper BA, Ibels LS, Kantzow E. Nutritional aspects of peritoneal dialysis. In: Gokal R, Khanna R, Krediet RT, Nolph KD (eds.). Textbook of Peritoneal Dialysis. Dordrecht: Kluwer Assoc.; 2000. p.515-43. [ Links ]
2. Robey C, Shreedhar K, Batuman V. Effects of chronic peritoneal dialysis on thyroid function tests. Am J Kidney Dis 1989;13:99-103. [ Links ]
3. Burkart J. Metabolic consequences of peritoneal dialysis. Semin Dial2004;17:498-504. [ Links ]
4. Liu J, Rosner MH. Lipid abnormalities associated with end stage renal disease. Semin Dial 2006;19:32-40. [ Links ]
5. Kathuria P, Moore HL, Twardowski ZJ, Goel S, Nolph KD. Effect of dialysis modality and membrane transport characteristics on dialysate protein losses of patients on peritoneal dialysis. Perit Dial Int 1997;17:449-54. [ Links ]
6. Cooper S, Iliescu EA, Morton AR. The relationship between dialysate protein loss and membrane transport status in peritoneal dialysis patients. Adv Perit Dial 2001;17:244-7. [ Links ]
7. Smit W, van Dijk P, Langedijk MJ, Schouten N, van den Berg N, Struijk DG, et al. Peritoneal function and assessment of reference values using a 3.86% glucose solution. Perit Dial Int 2003;23:440-9. [ Links ]
8. Clerbaux G, Francart J, Wallemacq P, Robert A, Goffin E. Evaluation of peritoneal transport properties at onset of peritoneal dialysis and longitudinal follow-up. Nephrol Dial Transplant 2006;21:1032-9. [ Links ]
9. Perl J, Huckvale K, Chellar M, John B, Davies SJ. Peritoneal protein clearance and not peritoneal membrane transport status predicts survival in a contemporary cohort of peritoneal dialysis patients. Clin J Am Soc Nephrol 2009;4:1201-6. [ Links ]
10. Gomes AM, Pérez Fontán M, Rodríguez-Carmona A, López Muñiz A, Fernández M, Peteiro J. Peritoneal total protein transport assessed from peritoneal equilibration tests with different dialysate glucose concentrations. Perit Dial Int 2010;30:549-57. [ Links ]
11. Rippe B. A three-pore model of peritoneal transport. Perit Dial Int 1993;13 (suppl. 2):S35-S38. [ Links ]
12. Pérez Fontán M, Rodríguez-Carmona A, Barreda D, López Muñiz A, Blanco Castro N, García Falcón T. Peritoneal protein transport during the baseline peritoneal equilibration test is an accurate predictor of the outcome of peritoneal dialysis patients. Nephron Clin Pract 2010;116:c104-c113. [ Links ]
13. Szeto CC, Chow KM, Lam CW, Cheung R, Kwan BC, Chung KY, et al. Peritoneal albumin excretion is a strong predictor of cardiovascular events in PD patients: a prospective cohort study. Perit Dial Int 2005;25:445-52. [ Links ]
14. Sánchez-Villanueva R, Bajo A, Del Peso G, Fernández-Reyes MJ, González E, Romero S, et al. Higher daily protein clearance when initiating peritoneal dialysis is independently associated with peripheral artery disease (PAD): a possible new marker of systemic endothelial dysfunction? Nephrol Dial Transplant 2009;24:1009-14. [ Links ]
15. Heaf JG, Sarac S, Afzal S. A high peritoneal large pore fluid flux causes hypoalbuminemia and is a risk factor for death in peritoneal dialysis patients. Nephrol Dial Transplant 2005;20:2194-201. [ Links ]
16. Van Biesen W, Van der Tol A, Veys N, Dequidt C, Vijt D, Lameire N, et al. The personal dialysis capacity test is superior to the peritoneal equilibration test to discriminate inflammation as the cause of fast transport status in peritoneal dialysis patients. Clin J Am Soc Nephrol 2006;1:269-74. [ Links ]
17. Westra WM, Kopple JD, Krediet RT, Appell M, Mehrotra R. Dietary protein requirements and dialysate protein losses in chronic peritoneal dialysis patients. Perit Dial Int 2007;27:192-5. [ Links ]
18. Waniewski J, Wang T, Heimburger O, Werynski A, Lindholm B. Discriminative impact of ultrafiltration on peritoneal protein transport. Perit Dial Int 2000;20:39-46. [ Links ]
19. Kagan A, Bar-Khayim Y, Schafer Z, Fainaru M. Kinetics of peritoneal protein loss during CAPD. I Different characteristics for low and high molecular weight proteins. Kidney Int 1990;37:971-9. [ Links ]
20. Rodríguez-Carmona A, Pérez Fontán M, Guitián A, Peteiro J, García Falcón T, López Muñiz A. Effect of low-GDP bicarbonate-lactate-buffered peritoneal dialysis solutions on plasma levels of adipokines and gut appetite-regulatory peptides. A randomized crossover study. Nephrol Dial Transplant 2012;27(1):369-74. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Miguel Pérez-Fontán
Servicio de Nefrología
Complejo Hospitalario Universitario A Coruña
Xubias, 84, 15006
Miguel.Perez.Fontan@sergas.es
Arodtor@sergas.es
Enviado a Revisar: 31 May. 2012
Aceptado el: 11 Jul. 2012














