Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.33 no.3 Cantabria 2013
https://dx.doi.org/10.3265/Nefrologia.pre2013.Feb.11918
Tablas de ratio fósforo/proteína de alimentos para población española. Utilidad en la enfermedad renal crónica
Table showing dietary phosphorus/protein ratio for the Spanish population. Usefulness in chronic kidney disease
Guillermina Barril-Cuadrado, M. Bernardita Puchulu y José A. Sánchez-Tomero
Unidad de Nefrología. Hospital Universitario de la Princesa. Madrid
Dirección para correspondencia
RESUMEN
Antecedentes: Las guías K/DOQI recomiendan el uso del ratio fósforo/proteína de los alimentos para un buen control del fósforo de la dieta. Existe evidencia de tablas con el ratio fósforo/proteína. No existe hasta el momento una tabla de alimentos habituales en la población española con la estimación del ratio.
Objetivos: Estimar el ratio fósforo/proteína de alimentos de uso general en la población española y establecer su utilidad en la selección de alimentos para los pacientes con enfermedad renal crónica.
Método: Las tablas con el ratio fósforo/proteína se han elaborado a partir de dos fuentes de datos de composición de alimentos españolas. Se ha considerado la composición química por cada 100 g de alimento crudo. Las tablas no incluyen el fósforo de los aditivos. No se eliminaron los alimentos con ratio fósforo/proteína elevado para poder establecer una comparación entre los distintos alimentos de cada grupo.
Resultados: Se encuentran comprendidos en las tablas.
Conclusiones: La prescripción dietética de los pacientes con enfermedad renal crónica debería tener en consideración no solo el valor absoluto de fósforo del alimento en cuestión, sino también el ratio fósforo/proteína de cada alimento y el total de la dieta. Cuanto más «natural» sea la dieta, más fácil será que alcance un ratio fósforo/proteína aceptable y mayor probabilidad de ser menor de 16 mg/g, no aumentando la morbimortalidad. Resulta evidente la necesidad de establecer un programa educativo sobre fuentes de fósforo y nutrición en el que la tabla pueda ser una herramienta útil para el equipo multidisciplinar que atiende al enfermo renal.
Palabras clave: Enfermedad renal crónica, Ratio fósforo/proteína, Fósforo dietético.
ABSTRACT
Background: The K/DOQI guidelines recommend the use of phosphorus/protein food ratios for proper control of dietary phosphorus. Evidence exists from tables with phosphorus to protein ratios for common foods. No such table exists for common foods consumed by the Spanish population with ratio estimations.
Objectives: To estimate the phosphorus to protein ratio in foods commonly used by the Spanish population and to establish its usefulness in the selection of foods for patients with chronic kidney disease.
Method: Tables with the phosphorus to protein ratio were prepared from two data sources concerning Spanish food composition. We evaluated chemical composition per 100g of raw food. The tables do not include phosphorus additives. No foods with high ratio of phosphorus to protein were eliminated in order to allow comparisons between different foods from each group.
Results: Shown in the tables.
Conclusions: The dietary prescription for patients with chronic kidney disease should take into consideration not only the absolute phosphorus value of food consumed, but also the phosphorus to protein ratio of each food and the total amount of phosphorus in the diet. The more "natural" a diet is, the more likely that the patient will reach an acceptable phosphorus to protein ratio of less than 16mg/g, which does not increase mortality. There is clearly a need for an educational program on nutrition and phosphorus sources in which food ratio tables could be a useful tool for the multidisciplinary teams caring for renal patients.
Key words: Chronic Kidney Diseases, Dietary phosphorus to protein ratio, Dietary Phosphorus.
Introducción
La hiperfosfatemia en los pacientes con enfermedad renal crónica (ERC) colabora en el desarrollo de alteraciones del metabolismo mineral óseo (MMO), en sentido amplio, constituyendo un factor de riesgo independiente de morbilidad y mortalidad en los pacientes en diálisis1-4.
El deterioro de la función renal provoca la retención de sustancias como el fósforo, que presentan un mecanismo de adaptación a la pérdida funcional de nefronas a través del balance glomérulo-tubular. La retención de fósforo ocurre desde estadios tempranos de la ERC (probablemente en el estadio 1 y en forma definitiva en el estadio 2) apareciendo en forma de hiperfosfaturia y posteriormente hiperfosfatemia en estadios 4-55,6.
La restricción dietética de fósforo debe ser iniciada cuando los niveles séricos de hormona paratiroidea (PTH) comienzan a elevarse (estadio 2) y/o cuando los niveles séricos de fósforo están elevados en cualquier estadio5. Es adecuado el inicio de una dieta con restricción de fósforo en estadios 1-2, porque ya se puede presentar retención del fósforo, aumento del factor de crecimiento de fibroblastos 23 (FGF-23) e hiperfosfaturia6.
En estadios 4-5, los niveles séricos de fósforo pueden ser elevados, por lo que se necesita la restricción del fósforo, si no se hizo previamente, para controlar sus niveles séricos, del FGF-23 y de PTH5. En el estadio 5 en diálisis, el incremento de los niveles séricos de fósforo es uno de los principales problemas para los pacientes. Uno de los pilares del tratamiento será la restricción de los alimentos ricos en fósforo sin comprometer el aporte adecuado de proteínas6.
Las estrategias terapéuticas para lograr el control del fósforo clásicamente incluyen la restricción dietética, la reducción de la absorción intestinal a través del uso de quelantes y la depuración del fósforo con la terapia renal sustitutiva (si se ha iniciado). A pesar de ello, un control adecuado del nivel sérico del fósforo es difícil y puede repercutir en calcificaciones vasculares que son directamente factor de riesgo cardiovascular aumentando la morbimortalidad7.
Entre las causas que favorecen la hiperfosfatemia se incluyen: la dificultad en la reducción de la ingesta de fósforo con una ingesta proteica adecuada, la dificultad de la hemodiálisis (HD) estándar, o en menor medida de la diálisis peritoneal (DP), para depurar adecuadamente la cantidad de fósforo que se absorbe de la dieta y dificultades, por múltiples motivos, en el correcto cumplimiento en la toma de quelantes de fósforo2.
El conocimiento de las fuentes de fósforo (orgánico e inorgánico) es fundamental para el manejo clínico y dietético de los pacientes con ERC7. Es necesario tener en consideración las diferentes fuentes de fósforo, su biodisponibilidad y la importancia de la estimación del ratio fósforo/proteína, que posibilita un adecuado control del fósforo con el aporte recomendado de proteínas.
La estrecha relación entre contenido de fósforo y proteína de los alimentos hace difícil la restricción del fósforo sin una restricción de la ingesta proteica, en especial de origen animal. Es difícil indicar una dieta con menos de 1000 mg/día de fósforo por el elevado aporte proteico recomendado, así como la gran cantidad de fósforo presente en los alimentos procesados8. En el estadio 5 en diálisis, la reducción de la ingesta de fósforo debe acompañar a una adecuada ingesta proteica y a un esquema de diálisis óptimo5.
Considerando esta limitación, el nivel de fósforo de la dieta debe ser el más bajo posible asegurando una ingesta proteica adecuada5.
Las guías K/DOQI recomiendan un aporte de fósforo de la dieta de entre 10 y 12 mg de fósforo por gramo de proteína o bien una cantidad promedio de 12-16 mg fósforo/g de proteína9. Para ello, habrá que seleccionar aquellos alimentos que son fuente de proteínas y con la menor cantidad de fósforo. Una forma de determinar el fósforo de la dieta es utilizar esta cantidad promedio5.
Con frecuencia la ingesta de fósforo de la dieta es subestimada. Las tablas de alimentos no reflejan el fósforo que se encuentra en aditivos. Estas variaciones en el contenido de fósforo pueden hacer difícil para los nutricionistas o el personal sanitario estimar con precisión el contenido de fósforo7. Además, las empresas productoras de alimentos no están obligadas a presentar el contenido de fósforo en las etiquetas alimentarias10.
Como la ingesta proteica es un importante componente del tratamiento de los pacientes con ERC y los alimentos ricos en proteínas son fuentes de fósforo orgánico, una forma más adecuada para la medición del fósforo es el ratio fósforo (mg)/proteína (g) de un alimento dado. Es una forma de aportar la cantidad necesaria de proteínas con el menor contenido de fósforo5,7,11,12.
Las guías K/DOQI recomiendan esta relación por sus ventajas5,7,12:
• Es independiente del tamaño de la porción del alimento.
• Se concentra en el fósforo y en las proteínas, ambos, importantes en el manejo nutricional del paciente en ERC.
• El ratio es elevado para los alimentos que tienen una alta cantidad de fósforo en aditivos, pero con igual cantidad de proteína.
• Permite la ingesta de alimentos con un ratio adecuado que, si solo se considerara el valor absoluto del fósforo, se excluirían de la dieta del enfermo renal crónico.
• Pone atención sobre los alimentos con excesiva cantidad de fósforo y con poca cantidad de proteína.
La desventaja de la relación fósforo/proteína y de la cantidad de fósforo absoluta es que no informa sobre la biodisponibilidad o la absorción intestinal del fósforo en diferentes tipos de alimentos. Sin embargo, es un método útil para el manejo dietético y educativo del paciente con ERC7,12.
Las Guías brasileras recomiendan emplear los alimentos con el menor ratio fósforo/proteína y restringir al máximo los alimentos con fósforo como aditivo (ácido fosfórico, polifosfatos y pirofosfatos)11.
Se ha demostrado un mayor riesgo de muerte en el grupo de pacientes en HD con una relación fósforo/proteína total de la dieta por encima de 16 mg/g13.
Existe evidencia de que la educación alimentaria sobre los aditivos presentes en los alimentos produce una reducción significativa de la fosfatemia en pacientes en HD3. Un programa de educación alimentaria proporcionaría un mejor conocimiento en la selección de los alimentos según el ratio fósforo/proteína logrando un mejor control de las cifras de fósforo y parámetros nutricionales y del MMO en pacientes con ERC14.
Existen antecedentes en la bibliografía de tablas de alimentos con el ratio fósforo/proteína2,5,7,8,12,15-17. Sin embargo, no existe hasta el momento una tabla con el ratio fósforo/proteína de alimentos habituales en la población española.
Objetivos
Estimar el ratio fósforo/proteína de alimentos de uso general en la población española y establecer su utilidad en la selección de alimentos para los pacientes con ERC.
Método
Las tablas con el ratio fósforo/proteína se han elaborado con la información proporcionada por dos fuentes de datos de composición de alimentos:
• La Base de Datos Española de Composición de Alimentos (BEDCA), que forma parte de la Red de Excelencia Europea EuroFir, avalada por el Ministerio de Ciencia e Innovación y del Ministerio de Sanidad y Política Social de España18.
• Las tablas de composición de alimentos de Mataix Verdú, de la Universidad de Granada19.
Se ha considerado la composición química por cada 100 g de alimento crudo. Para facilitar el análisis, se formaron grupos de alimentos. A partir del dato de los miligramos de fósforo y los gramos de proteína de cada alimento, se estimó el ratio. Las tablas no incluyen el fósforo de los aditivos, pues las fuentes primarias de composición de alimentos no han realizado el análisis del fósforo aportado por los aditivos.
No se eliminaron los alimentos con ratio fósforo/proteína elevado, para poder establecer una comparación entre los distintos alimentos de cada grupo.
Además, se ha incluido el contenido de potasio y de sodio de cada alimento, ya que son componentes básicos de la dieta que se deben monitorizar. Las tablas incluyen la composición de alimentos en crudo, por lo que habrá que considerar las técnicas que posteriormente disminuyan el potasio.
Discusión
Un nivel adecuado de fósforo sérico disminuye la morbimortalidad del enfermo renal (riesgo cardiovascular y MMO) precisando una estrategia terapéutica para su control. Múltiples abordajes educativos (planes alimentarios + uso correcto de quelantes, etc.) son básicos, junto con la elección del esquema más adecuado para su depuración, tanto en HD como en DP, así como la elección del quelante del fósforo adecuado para un mejor cumplimiento de la prescripción.
En relación con las fuentes de fósforo de la dieta, hay que considerar que existen dos formas dietéticas del fósforo con diferente implicación en la fosfatemia: el fósforo orgánico y el inorgánico.
El fósforo orgánico se encuentra naturalmente en los alimentos ricos en proteínas tanto de origen animal como vegetal. El fósforo orgánico es hidrolizado en el tracto intestinal y posteriormente se absorbe como fósforo inorgánico8. En general, solo el 30-60 % del fósforo orgánico se absorbe dependiendo de la digestibilidad de los nutrientes, la biodisponibilidad dietética del fósforo, el grado de activación de los receptores de vitamina D a nivel gastrointestinal y la presencia o ausencia de componentes que pueden unirse al fósforo o interferir en su absorción, como por ejemplo el aluminio o el ácido nicotínico7,8,12.
El fósforo proveniente de la proteína animal se encuentra en el compartimento intracelular, siendo fácilmente hidrolizado y absorbido. La fuente principal de fósforo son las carnes, aves, pescados, huevos y lácteos. La digestibilidad del fósforo de los alimentos de origen animal es mayor que la del fósforo de la proteína vegetal7,12.
El fósforo orgánico de origen vegetal abunda naturalmente en semillas, frutos secos y legumbres, a diferencia de las frutas y verduras, que contienen pequeña cantidad del mineral7.
A diferencia del fósforo de la proteína de origen animal, que se encuentra en el compartimento intracelular, el fósforo de la proteína vegetal se almacena como ácido fítico o fitato. El hombre no expresa la enzima fitasa, por lo que la biodisponibilidad del fósforo es relativamente baja, usualmente menos del 50 %7,8,12.
En el individuo sin ERC, si se le administra la misma cantidad de fósforo de alimentos animales y de vegetales, la excreción urinaria de fósforo es mayor en una dieta de origen animal, por lo que, en un paciente con ERC, una elevada cantidad de proteína de origen vegetal no cubrirá el requerimiento proteico pero ayudará a un mejor manejo del fósforo. Sin embargo, hay algunas consideraciones al respecto. En primer lugar, la calidad biológica de la proteína vegetal es menor que la de origen animal, por lo que, en aquellas personas con ingestas proteicas deficientes, esto podría resultar en un inadecuado aporte proteico. Es importante reseñar en segundo lugar que no está aún dilucidado el efecto de los probióticos sobre el fósforo asociado a la enzima fitasa, que podría influir en la absorción del fósforo7.
El fósforo inorgánico es el componente principal de varios aditivos que se utilizan en el procesamiento alimentario20. Son fuentes comunes de fósforo inorgánico las bebidas, comidas congeladas, cereales para el desayuno, quesos procesados y para untar, productos instantáneos, comidas precocinadas, salchichas, galletas, bollería, bebidas a base de cola, etc.3,7,10,11,21.
El fósforo inorgánico no está unido a las proteínas, sino que son sales (polifosfatos, ácido fosfórico) rápidamente disociables, por lo que fácilmente se absorben en el tracto intestinal20. Entre el 90-100 % del fósforo inorgánico se absorbe a nivel intestinal, a diferencia del 40-60 % del fósforo orgánico presente en los alimentos naturalmente4,7,10,12,22.
Los aditivos tienen un mayor efecto en la hiperfosfatemia que una cantidad equivalente de fósforo de origen natural3,23,24.
Sullivan et al. encontraron una diferencia significativa mayor entre el fósforo que se obtiene del análisis químico y el que proveen las tablas de alimentos si se comparaban con los mismos alimentos tratados con aditivos. Los autores concluyeron que las tablas de alimentos no reflejan el contenido real de fósforo de los alimentos, ya que no suman el fósforo de aditivos. Además, la lista de ingredientes en las comidas rápidas con frecuencia no está presente, por lo que es difícil identificar la presencia de fósforo de aditivos. El simple conocimiento de los productos que contienen fósforo no permite estimar con precisión el contenido real del elemento4. De aquí la conveniencia de no utilizar alimentos preparados.
La cantidad de fósforo en los alimentos de origen animal es variable2,7. Además, es necesario resaltar que el fósforo de los alimentos no proteicos varía ampliamente y es por lo general elevado2.
El ratio fósforo/proteína varía ampliamente en las diferentes fuentes proteicas, lo que sugiere que se puede reducir la ingesta de fósforo de la dieta manteniendo un adecuado aporte proteico2.
Los productos lácteos son un desafío para el nutricionista25. En el caso de la leche, prácticamente no hay diferencia en el contenido de fósforo entre la leche entera, semidesnatada y desnatada, presentando un ratio elevado (tabla 1). Sin embargo, se recomienda seleccionar leche semidesnatada, pues presenta el menor ratio fósforo/proteína y menor contenido de potasio en comparación con la leche entera o desnatada, y un aporte adecuado de vitaminas liposolubles. A pesar de que la leche de soja presenta menor ratio fósforo/proteína que la leche de vaca semidesnatada (14,68 vs. 26,56 mg/g), se debe considerar que la leche de soja puede contener aditivos con fósforo25.
Tabla 1. Ratio fósforo/proteína por cada 100 g de alimento crudo de fuentes orgánicas de origen animal 
Fuente: referencias bibliográficas 18 y 19.
Diferentes variedades de quesos contienen una cantidad de fósforo variable, que puede ser de origen orgánico e inorgánico según el método de procesamiento7. El requesón y el queso blanco untable podrían ser de elección, en especial para aquellos pacientes cuyos requerimientos calóricos y proteicos sean elevados (tabla 1).
La clara de huevo, fuente de proteínas de alto valor biológico y con un escore de aminoácidos corregido por digestibilidad proteica (Protein Digestibility Corrected Amino Acid Score, PDCAAS) del 97 %26, tiene el ratio fósforo/proteína ideal (1,42 mg/g de proteína) y sin el aporte de colesterol, por lo que es una fuente saludable de proteínas para el paciente en diálisis. En cambio, la yema de huevo tiene un elevado ratio con elevado aporte de colesterol (tabla 1)7,12,18.
La menor cantidad de fósforo en proporción con una buena cantidad y calidad proteica de la carne vacuna, cerdo y aves (en promedio 9,2 mg/g de proteína) y de la clara de huevo hacen que sean de elección como fuentes proteicas18.
Para el grupo de las carnes, se debe considerar la presencia de carnes precocinadas, curadas o con aditivos. Es decir, se le inyecta a la carne fresca una solución de agua y mezcla de sales de sodio, fósforo, potasio y antioxidantes15. Este tipo de carnes ofrece al consumidor una solución rápida para la planificación diaria de las comidas. Además, los aditivos mantienen la integridad de la carne al someterla a cocción. Las sales de fosfato mejoran el color de la carne, retienen humedad y reducen la rancidez, por lo que la carne con aditivos tiene una vida útil más larga, presentando una apariencia más atractiva para los consumidores. Sin embargo, estas carnes son una fuente importante de fósforo y sodio8. Actualmente no existe una forma práctica de saber qué cantidad de fosfato adicional presentan estas carnes. El etiquetado nutricional no exige la descripción de la inclusión de fósforo y del tipo de sal de fósforo utilizado en el procesado, por lo que esta información es de propiedad de los fabricantes de alimentos27.
En referencia a los pescados, mariscos y crustáceos, el ratio es variable (en un rango de 7,53 a 23 mg/g), por lo que se recomienda seleccionar aquellos con un ratio menor de 16 mg/g. El salmón ha sido siempre considerado como un pescado con un elevado aporte absoluto de fósforo. Sin embargo, presenta un ratio aceptable de 13,58 mg/g, menor que el lenguado o el abadejo (tabla 1)18. Con respecto al pescado congelado, se introduce previamente a la congelación en una solución de polifosfato de sodio para evitar la pérdida de proteínas durante la descongelación, debiendo considerarse la absorción de fósforo posible a través de esta técnica8.
El huevo entero, las legumbres, los cereales para el desayuno, la leche, el queso y el yogur, los frutos secos y los alimentos precocinados presentan un elevado ratio (tabla 1, tabla 2 y tabla 3). Sin embargo, el fósforo de las legumbres y los frutos secos es en forma de ácido fítico, por lo que se asocia a una menor absorción intestinal. No obstante, hay que considerar, además, el elevado aporte de potasio principalmente de las legumbres, frutos secos y de algunos cereales, lo que justifica que en las tablas se considere el potasio18.
Tabla 2. Ratio fósforo/proteína por cada 100 g de alimento crudo de fuentes orgánicas de origen vegetal 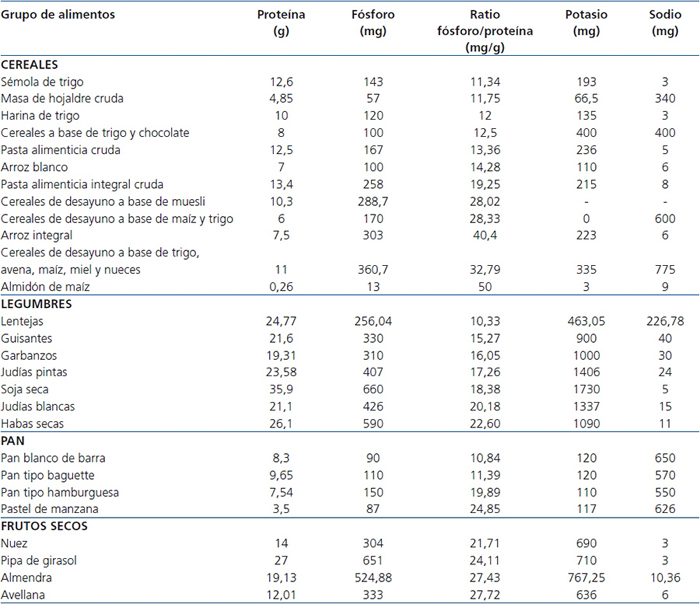
Fuente: referencias bibliográficas 18 y 19.
Tabla 3. Ratio fósforo/proteína por cada 100 g de alimento crudo de fuentes alimenticias con fósforo inorgánico 
Fuente: referencias bibliográficas 18 y 19.
Con respecto al jamón, alimento ampliamente aceptado en la población española, si bien presenta ratios aceptables (entre 3,64 y 12,57 mg/g), es necesario considerar que la tabla no incluye el fósforo de los aditivos alimentarios que presentan los fiambres (denominado «fósforo oculto»), por lo que, si se considerase este aporte, el ratio probablemente sería mayor con una elevada biodisponibilidad18.
Las salsas, bollos y cereales contribuyen al fósforo de la dieta con un mínimo aporte de proteínas de bajo valor biológico (tabla 2 y tabla 3). Dentro del grupo de bollería, el menor ratio se encuentra en las palmeras sin cobertura no industriales y las galletas de tipo María, por lo que podrían recomendarse de forma ocasional en reemplazo del pan.
El chocolate es otra fuente importante con una cantidad promedio de fósforo de 230 mg/100 g de alimento (tabla 3)18.
Con relación a las bebidas a base de cola, además de su elevado aporte de fósforo inorgánico, se debe considerar que se les puede adicionar sales de fosfato para mejorar el sabor8.
La baja biodisponibilidad de fósforo de las proteínas vegetales es una ventaja en el momento de diseñar una dieta con bajo aporte de fósforo8. En un plato con 50 g de arroz blanco y 50 g de lentejas hay aproximadamente 16 g de proteína y 180 mg de fósforo. Sin embargo un 30 % del fósforo se absorbería (54 mg). En cambio, la misma cantidad de proteínas en la carne proporciona mayor cantidad de fósforo. Por ejemplo, 100 g de lenguado aportan 16 g de proteínas y 260 mg de fósforo o 16 g de proteína de la pechuga de pollo aportan aproximadamente 140 mg de fósforo. Es por ello por lo que se recomienda una dieta de composición mixta en la que se absorbe un 60 % de fósforo.
Una dieta donde predominen las comidas rápidas y las carnes procesadas como fuentes proteicas determinará un mayor aporte y absorción de fósforo que una dieta de similar contenido de fósforo de origen «natural», con predominio de alimentos frescos y no procesados8.
El agregado del contenido de fósforo en el etiquetado nutricional implicaría un importante beneficio para los pacientes con ERC. Sin embargo, ante la ausencia de dicha información, es útil la lectura de los ingredientes en las etiquetas de los alimentos y la elección de alimentos sin aditivos alimentarios a base de fósforo2,8.
Las técnicas de sumergir los alimentos en agua o el hervido podrían reducir el contenido de fósforo de los alimentos8,28.
El paciente con ERC debe ser informado de la presencia de «fuentes ocultas» de fósforo, como en el caso de las «carnes precocinadas con aditivos». Para ello, se puede proporcionar una lista de marcas de uso local27. En las salas de espera, se pueden exponer materiales educativos que indiquen dónde hay fósforo oculto. Las listas de alimentos y las imágenes ofrecen una alternativa útil en la educación alimentaria de los pacientes con ERC22. Cuanto más se sabe acerca de lo que se está comiendo, mejores elecciones se pueden hacer27.
La limitación de las presentes tablas radica en que, al no disponer del análisis del fósforo de los aditivos, se desconoce el contenido real del mineral en alimentos que podrían tener «aditivos». Sin embargo, son de utilidad en la selección de «alimentos naturales» no procesados y sin aditivos. El análisis de alimentos procesados y el posterior desarrollo de tablas con el ratio fósforo/proteína será de utilidad para los enfermos renales, en especial en el momento de seleccionar alimentos para situaciones especiales (salidas a comer, reuniones sociales etc.).
La alimentación del paciente con ERC debe ser individualizada en función de sus necesidades nutricionales, gustos y hábitos alimentarios y de sus actividades cotidianas29. Los esfuerzos para lograr la restricción de fósforo deben concentrarse en limitar los alimentos con aditivos con fósforo, en lugar de limitar los alimentos proteicos4,20.
Actualmente, para un adecuado control del fósforo en los planes alimentarios se precisa un programa de educación y de monitorización del cumplimiento en la restricción dietética de este. Hay una evidente necesidad de equipos multidisciplinares con una participación más activa del nutricionista en el cuidado del paciente con ERC5. El nutricionista especializado en ERC debería educar y estimular al paciente en la lectura de los componentes en relación con el fósforo en las etiquetas alimentarias10.
En conclusión, para los pacientes con ERC, una dieta de composición mixta con aporte de proteínas de origen animal y vegetal sería recomendable, limitando al máximo los alimentos industrializados que contengan aditivos alimentarios7. Cuanto más «natural» sea la dieta, más fácil es que se alcance un ratio fósforo/proteína más aceptable y mayor probabilidad de que sea menor de 16 mg/g.
La prescripción dietética de los pacientes con ERC debería tener en consideración no solo el valor absoluto de fósforo del alimento en cuestión, sino también el ratio fósforo/proteína de cada alimento y el total de la dieta7,13.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Nolan CH, Qunibi WY. Treatment of hyperphosphatemia in patients with chronic kidney disease on maintenance hemodialysis. Kidney Int Suppl 2005;(95):S13-20. [ Links ]
2. Sherman RA, Mehta O. Dietary phosphorus restriction in dialysis patients: potential impact of processed meat, poultry, and fish products as protein sources. Am J Kidney Dis 2009;54:18-23. [ Links ]
3. Sullivan C, Sayre SS, Leon JB, Machekano R, Love TE, Porter D, et al. Effect of food additives on hyperphosphatemia among patients with end-stage renal disease. A randomized controlled trial. JAMA 2009;301:629-35. [ Links ]
4. Sullivan CM, Leon JB, Sehgal AR. Phosphorus containing foods additives and the accuracy of nutrient databases: implications for renal patients. J Ren Nutr 2007;17(5):350-4. [ Links ]
5. National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003;42(4 suppl 3):S1-202. [ Links ]
6. Torregrosa JV, Bover J, Cannata Andía J, Lorenzo V, de Francisco ALM, Martínez I, et al. Recomendaciones de la Sociedad Española de Nefrología para el manejo de las alteraciones del metabolismo óseo mineral en los pacientes con enfermedad renal crónica (S.E.N-MM). Nefrologia 2011;31 (Suppl 1):3-32. [ Links ]
7. Noori N, Sims J, Kopple JD, Shah A, Colman S, Shinaberger CS, et al. Organic and inorganic dietary phosphorus and its management in chronic kidney disease. Iran J Kidney Dis 2010;4(2):89-100. [ Links ]
8. Uribarri J. Phosphorus homeostasis in normal health and in chronic kidney disease patients with special emphasis on dietary phosphorus intake. Semin Dial 2007;20(4):295-301. [ Links ]
9. K/DOQI nutrition in chronic renal failure. Am J Kidney Dis 2000;35(6 Suppl 2):1-140. [ Links ]
10. Murphy Gutekunst L. Hidden phosphorus in popular beverages: Part 1. J Ren Nutr 2005;15(2):1-6. [ Links ]
11. Carvalho AB, Cuppari L. Controle da hiperfosfatemia na DRC. J Bras Nefrol 2011;33(2):191-6. [ Links ]
12. Kalantar-Zadeh K,Gutekunst L, Mehrotra R, Kovesdy CP, Bross R, Shinaberger CS, et al. Understanding sources of dietary phosphorus in the treatment of patients with chronic kidney disease. Clin J Am Soc Nephrol 2010;5:519-30. [ Links ]
13. Noori N, Kalantar-Zadeh K, Kovesdy CP, Bross R, Benner D, Kopple JD. Association of dietary phosphorus intake and phosphorus to protein ratio with mortality in hemodialysis patients. Clin J Am Soc Nephrol 2010;5:683-92. [ Links ]
14. Lou LM, Caverni A, Gimeno JA, Moreno R, Pérez J, Alvarez R, et al. Dietary intervention focused on phosphate intake in hemodialysis patients with hyperphosphatemia. Clin Nephrol 2012;77(6):476-83. [ Links ]
15. Sherman RA, Mehta O. Phosphorus and potassium content of enhanced meat and poultry products: implications for patients who receive dialysis. Clin J Am Soc Nephrol 2009;4:1370-3. [ Links ]
16. Castro González MI, MaafsRodríguez AG, Galindo Gómez G. La dieta del paciente renal. ¿Se puede incluir pescado? Nutr Hosp 2012;27(5):1489-95. [ Links ]
17. Peñalba A, Alles A, Aralde A, Carreras R, Del-Valle E, Forrester M, et al. Consenso metabolismo óseo y mineral. Sociedad Argentina de Nefrología. Versión 2010. Capítulo IV. Tratamiento de la hiperfosfatemia y mantenimiento del calcio en pacientes con enfermedad renal crónica estadio 5 en diálisis. Dial Traspl 2011;32(1):32-8. [ Links ]
18. Bedca.net (Internet). España: Red BEDCA Ministerio de Ciencia e Innovación Agencia Española de Seguridad Alimentaria y Nutrición Ministerio de Sanidad y Política Social; (actualizada 26 agosto 2010).Available at: http://www.bedca.net [ Links ]
19. Mataix Verdú J. Instituto de Nutrición y Tecnología de los Alimentos. Tabla de Composición de Alimentos. Granada: Universidad de Granada; 2011. [ Links ]
20. Sherman RA. Dietary phosphate restriction and protein intake in dialysis patients:a misdirected focus. Semin Dial 2007;20(1):16-8. [ Links ]
21. Murphy Gutekunst L, Barnes K. Hidden phosphorus at breakfast: Part 2. J Ren Nutr 2005;15(3):1-6. [ Links ]
22. Murphy Gutekunst L. Hidden phosphorus: where do we go from here? J Ren Nutr 2007;17(4):31-6. [ Links ]
23. Raines Bell R, Draper HH, Tzeng DYM, Shin HK, Schmidt GR. Physiological responses of human adults to foods containing phosphate additives. J Nutr 1977;107:42-50. [ Links ]
24. Uribarri J. Phosphorus additives in food and their effect in dialysis patients. Clin J Am Soc Nephrol 2009;4:1290-2. [ Links ]
25. Chien-Wei Kung. Milk alternatives. J Ren Nutr 2010;20(2):7-15. [ Links ]
26. Suárez López MM, Kizlansky A, López LB. Evaluación de la calidad de las proteínas en los alimentos calculando el escore de aminoácidos corregido por digestibilidad. Nutr Hosp 2006;21(1):47-51. [ Links ]
27. Murphy Gutekunst L, Uribarri J. Hidden phosphorus-enhanced meats: Part 3. J Ren Nutr 2005;15(4):1-4. [ Links ]
28. Cupisti A, Comar F, Benini O, Lupetti S, D'Alessandro C, Barsotti G, et al. Effect of boiling on dietary phosphate and nitrogen intake. J Ren Nutr 2006;16:36-40. [ Links ]
29. DePue K. A review of packaged snack foods.J Ren Nutr 2011;21(4):18-20. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Guillermina Barril-Cuadrado
Unidad de Nefrología
Hospital Universitario de la Princesa
Diego de León, 62
28006, Madrid
gbarril43@gmail.com
Enviado a Revisar: 15 Ene. 2013
Aceptado el: 10 Feb. 2013














