Introducción
Las máquinas de hemodiálisis (HD) son capaces de producir un líquido de diálisis (LD) que contiene sales de calcio y magnesio y, al mismo tiempo, bicarbonato. Para mantener la solubilidad de esas sales es necesario añadir un ácido que mantenga un pH concreto, entre 7,1 y 7,61. El que se ha venido añadiendo al LD es el ácido acético, generalmente en concentraciones de 3 o 4 mmol/L. El paso del ácido acético a acetil-coenzima-A y su metabolización en el círculo del ácido cítrico produce de forma equimolar bicarbonato. En la HD con bicarbonato y 3-4 mmol/L de acetato, hasta un 25% de la alcalinización que se produce proviene del acetato. En la mayoría de los pacientes la acetatemia se incrementa durante la sesión de HD, dado que la transferencia de acetato del LD a la sangre es superior a la capacidad de su metabolización en el organismo. Este aumento de la acetatemia es mayor con técnicas de alta eficacia, como la hemodiafiltración en línea (HDF-OL)2, y también es mayor en las personas con menor capacidad de metabolizar acetato, por ejemplo, personas con menor masa muscular, edad avanzada o insuficiencia hepática3.
El incremento de la acetatemia durante la sesión de HD se ha asociado a una serie de alteraciones: aumento del estrés oxidativo, de las citocinas proinflamatorias y de la síntesis de óxido nítrico4-8. Hasta un 50% de los pacientes en HD presentan una situación de inflamación crónica de bajo grado. La hiperacetatemia sería un coadyuvante de esta situación, junto a la exposición a sustancias pirogénicas o a materiales bioincompatibles. La hiperacetatemia se ha asociado a la intolerancia hemodinámica a las HD9.
Por lo anterior, se ha intentado sustituir el acetato del LD por otro ácido, o eliminarlo sin más. Esto último se logró mediante la técnica de hemodiafiltración denominada, «acetate free biofiltration» (AFB), en la que el LD no contiene acetato ni bicarbonato, y este se infunde de manera intravenosa. La retirada del acetato en la AFB implicaba que desapareciera la activación de los polimorfonucleares y monocitos10 o el aumento de la síntesis de óxido nítrico6. Por otro lado, el acetato se ha logrado sustituir en el LD por ácido clorhídrico o cítrico8,11,12.
El ácido cítrico puede jugar un papel alternativo al acetato como estabilizante del LD. El citrato, en comparación con el acetato, tiene un patrón diferente en cuanto a la activación leucocitaria y del complemento13. El citrato como anticoagulante regional (RCA) en HD, respecto a la heparina, ha demostrado efectos favorables sobre la inflamación14-16, bien es verdad que las concentraciones de citrato en la RCA son sustancialmente mayores que las de los LD con citrato. En una HD con 1 mmol/L de citrato en el LD, la sangre que retorna al paciente tiene una concentración de 0,58 mmol/L, mientras que la normal es 0,1 mmol/L. Al cabo de 4 h de HD, la concentración sistémica de citrato estaría en 0,25-0,3 mmol/L17. Con 0,8 mmol/L de citrato en el LD, la citratemia al final de la HD estaría entre 0,2 y 0,25 mmol/L, en HDF-OL llegaría a 0,3 mmol/L17. En estas concentraciones, y respecto al acetato, se reduciría la activación del complemento y de los granulocitos13. La HDF-OL con citrato lograría niveles más bajos de PCR y β2-microglobulina respecto a la de acetato17.
En los trabajos referidos, es difícil separar los efectos beneficiosos sobre la inflamación de la retirada del acetato del LD de los de la inclusión del citrato.
En la actualidad disponemos de 2 tipos de LD con citrato. El primero contiene 1 mmol/L de citrato y no contiene acetato; el segundo lleva 0,8 mmol/L de citrato y 0,3 mmol/L de acetato. El LD estándar de HD que utilizamos contiene 3 o 4 mmol/L de acetato.
En este trabajo hemos querido valorar in vitro el estrés oxidativo, las moléculas de adhesión y las micropartículas totales en las células de pacientes urémicos expuestas a LD solo con citrato, con citrato + acetato y solo con acetato, en concentraciones de 3 o 4 mmol/L. El objetivo de este estudio es comparar el acetato con el citrato en el LD respecto a su efecto inflamatorio en las células inmunocompetentes de la sangre.
Material y métodos
El efecto del acetato y del citrato fue investigado en sangre completa de pacientes urémicos y controles sanos in vitro. La sangre se extrajo de pacientes que no habían recibido medicación antiinflamatoria en los días anteriores.
Tipos de muestras de sangre
Se obtuvieron 2 pool de sangre conservada en el biobanco de la RED de Investigación Renal (REDinREN, Madrid). El primer pool corresponde a sangre de 12 pacientes con enfermedad renal crónica (ERC) en HD: en estos se han hecho 3 experimentos y los resultados de cada experimento son la media de 3 pocillos. El otro pool procede de 4controles sanos, con características semejantes de edad (media de 60 años), y género (50% hombres). Dos de los pacientes de HD eran diabéticos. Las muestras de sangre se extrajeron pre-HD. Con estas muestras se han hecho 3 experimentos y los datos son la media de 3 pocillos.
Líquidos de hemodiálisis
Se fabricó líquido de HD (LD) de 4 tipos:
El LD 1, con 1 mmol/L de citrato y libre de acetato: SelectBag Citrate® producido en máquinas de HD AK200-ultra-S.
El LD 2, con 0,8 mmol/L de citrato y 0,3 mmol/L de acetato: Citrasate® 323C producido en Sistemas Terapéuticos 5008 FMC®.
El LD 3, con 3 mmol/L de acetato sin citrato: SoftPac® producido en máquinas de HD AK200-ultra-S.
El LD 4, con 4 mmol/L de acetato sin citrato: producido en Sistemas Terapéuticos 5008 FMC®.
La composición de los LD utilizados se muestra en la tabla 1. Se ordenan de menor a mayor concentración de acetato en el LD. El LD cumple las características de LD ultrapuro18. Las muestras se tomaron del hansen a la entrada del dializador, una vez que la máquina se había estabilizado (conductividades y temperatura). Las muestras se manejaron de forma estanca.
Tabla 1 Composición de los líquidos de diálisis utilizados
| Fórmula | Referencia | Na | Ca | Mg | K | Cl | Citrato | Acetato | Bicarbonato | Glucosa | Osmolaridad |
|---|---|---|---|---|---|---|---|---|---|---|---|
| mM/L | mM/L | mM/L | mM/L | mM/L | mM/L | mM/L | mM/L | mOsm/L | |||
| LD1 Citrato Gambro® | CX 265 G | 140 | 1,65 | 0,5 | 2 | 109,3 | 1 | 0 | 34 | 8,33 | |
| LD 2 Citrasate® | 303-C (A + B) | 139,3 | 1,665 | 0,475 | 1,9 | 104,37 | 0,8 | 0,3 | 35 | 8,33 | 287,22 |
| LD 3 Acetato Gambro® | G295 | 140 | 1,5 | 0,5 | 2 | 109 | 0 | 3 | 35 | 8,33 | 294 |
| LD 4 Acetato FMC® | ACF 3A5 | 140 | 1,5 | 0,5 | 2 | 107 | 0 | 4 | 35 | 8,33 | 296 |
Cultivo de monocitos humanos (THP-1)
Las monocitos humanos (células THP-1; línea celular THP-1, Sigma, n.° de catálogo 88081201) fueron cultivados en el medio RPMI 1640 con el 10% de penicilina-estreptomicina, ambos suministrados por Lonza (Basilea, Suiza) y al 10% de suero fetal bovino FBS de Sigma (St. Louis, Estados Unidos).
Células mononucleares de sangre periférica
Las células mononucleares de sangre periférica (PBMC) se obtuvieron a partir de 10 ml de sangre recogida en tubos de EDTA mediante gradiente de densidad utilizando Lymphocytes Isolation Solution (Rafer, Zaragoza, España).
Determinación de moléculas de adhesión
Se determinaron moléculas de adhesión (intercellular adhesion molecule 1, CD54/ICAM-1) tanto en células THP-1 como en PBMC siguiendo el mismo protocolo.
Las células se sembraron a una densidad de 106 células/ml en placas de 6 pocillos (Nunclon™ Delta, NUNC® Thermo Fisher Scientific, Waltham, Massachusetts, Estados Unidos). Se incubaron durante la noche con los distintos LD y utilizando un buffer salino tamponado en fosfato (PBS, Sigma, Sant Louis, Missouri, Estados Unidos) como control. La determinación de moléculas de adhesión se realizó mediante técnicas de inmunofluorescencia utilizando el anticuerpo monoclonal MEM-111 conjugado con FITC frente a la molécula CD54, adquirido en Thermo Fisher Scientific (Waltham, Massachusetts, Estados Unidos). Se utilizó el citómetro de flujo FACSCalibur de Becton Dickinson (San José, California, Estados Unidos) y el software Cyflogic para analizar el canal medio de fluorescencia.
Cuantificación de los niveles de especies reactivas de oxígeno
La medida de la actividad de las especies reactivas de oxígeno (ROS) se realizó mediante el método descrito por Wang y Josep (Wang y Joseph, 1999) que se basa en la fluorescencia emitida por la 2′,7-diclorodihidrofluoresceína al oxidarse en 2′,7-diclorofluoresceína.
Las PBMC fueron sembradas en placas de 6 pocillos a una densidad del 106 células/ml. Las células fueron tratadas con los correspondientes líquidos durante la noche. Transcurrido este tiempo, las células se lavaron con solución salina tamponada con fosfato PBS (Sigma, Sant Louis, Missouri, Estados Unidos) y se incubaron a una concentración de 5 μM de H2DCFDA (Thermo Fisher Scientific, Waltham, Massachusetts, Estados Unidos) en medio fresco durante 30 min. El análisis se realizó por citometría de flujo FACSCalibur (Becton Dickinson) y se analizó el canal medio de florescencia con el software Cyflogic.
Cuantificación de microvesículas
Las microvesículas se cuantificaron en el sobrenadante recogido del cultivo de las PBMC tratadas con los distintos líquidos durante la noche. Una alícuota fue marcada con annexin V conjugada con FITC suministrada por Becton Dickinson. El análisis se realizó mediante citometría de flujo FACSCalibur (Becton Dickinson). Primero se seleccionó la población de microvesículas en función del tamaño (FSC/forward scatter) y complejidad (SSC/side scatter) utilizando el kit Flow Cytometry Sub-Micron Size Reference Kit, Green Fluorescent (Life Technologies, Paisley, Estados Unidos) como referencia y, a continuación, se seleccionaron las microvesículas anexina V positivas. Para poder cuantificar la concentración de microvesículas se utilizó un número conocido de microesferas de látex flow count (Beckman Coulter, Brea, California, Estados Unidos).
Unidades de los resultados y estadística
Al determinar la expresión de moléculas de adhesión, o niveles de ROS en las células PBMC, se observaron niveles basales muy variables, por lo que decidimos expresar los resultados atribuyendo un valor arbitrario de uno a la muestra control, y determinando el incremento o decremento respecto a este valor cuando las células eran cultivadas en presencia de los diferentes líquidos objeto del estudio. Las unidades son tantos por uno o veces el control.
Los resultados se expresan como la media ± DE de los experimentos; cada uno realizado por triplicado. Se empleó el análisis de varianza de un paso para comparar los resultados de los 5 grupos, en cada una de las pruebas; previamente, se realizó el test de Levene. Si era necesario, se recurrió a una prueba no paramétrica: Kruskal-Wallis. Para la comparación entre 2 de los grupos entre sí se utilizó la t de Student pareada o el test de Mann-Whitney, según correspondía. Se consideró como significativa una p < 0,05. El análisis estadístico se realizó con el paquete SPSS 15.0 Inc. (Chicago, Illinois, Estados Unidos).
Resultados
Caracterización de la activación de la línea monocitaria THP-1 inducida por los diferentes líquidos de diálisis
Los estudios realizados sobre la expresión de la molécula de adhesión (ICAM-1) en la línea celular monocitaria THP-1 mostraron que los LD que contenían acetato (L3 y L4) indujeron un incremento en la densidad de expresión de ICAM-1 en las células THP-1 (fig. 1). El canal medio de fluorescencia para la molécula mostró un incremento de 2,61 ± 0,79 y 2,97 ± 0,81 veces, respectivamente, para L3 y L4 respecto a la densidad media observada en las células control (1 ± 0,11). Por el contrario, los líquidos que contenían citrato (L1 y L2) no modificaron la expresión de ICAM-1 en células THP-1 (canal medio de fluorescencia de 0,73 ± 0,27 y 0,86 ± 0,23, respectivamente para L1 y L2).

Figura 1 THP-1 ICAM. En esta figura se muestran las diferencias (media ± DE) en la expresión de ICAM-1 en la línea celular monocitaria THP1 cultivada en solución isotónica control o con los diferentes líquidos de hemodiálisis. Las células THP-1 que se cultivaron con líquidos que contenían acetato mostraron un incremento significativo en el canal medio de fluorescencia respecto al control y a las células tratadas con líquidos con citrato.
Activación de células inmunocompetentes de sujetos sanos
Como puede observarse en la figura 2, en la expresión de ICAM-1, no se observaron diferencias significativas respecto al control cuando las células fueron cultivadas con los diferentes líquidos. Sin embargo, al comparar la expresión en células cultivadas con líquidos que contenían citrato (L1 y L2) y la de los líquidos que contenían solo acetato (L3 y L4), sí observamos un incremento en la expresión de ICAM-1 inducida por los líquidos con acetato.

Figura 2 ICAM-1 y ROS en células de sujetos sanos. En esta figura se muestran las diferencias observadas (media ± DE) en la expresión de ICAM-1 y en la actividad ROS en células inmunocompetentes de sangre periférica de sujetos sin enfermedad renal conocida cultivadas en solución isotónica control o con los diferentes líquidos de hemodiálisis. Respecto al control, no se observaron diferencias en la expresión de ICAM-1; sin embargo, al comparar entre los diferentes líquidos, los que contenían acetato indujeron un incremento significativo de esta molécula (*p < 0,05). Respecto a la expresión de ROS, cuando las células se cultivaron con líquidos que contenían acetato, se observaron diferencias significativas con relación al control y con respecto a las células tratadas con líquidos con citrato (*p < 0,05).
El estudio de la expresión de ROS como indicador de estrés oxidativo reveló que los líquidos con acetato indujeron mayor actividad que los líquidos que contenían citrato. Como se puede ver en la figura 2, los líquidos L3 y L4 indujeron una actividad significativamente mayor de ROS en PBMC vs. control (p < 0,05), y en las células tratadas con L1 y L2 (p < 0,05).
Al igual que ocurría en las determinaciones de ROS, los líquidos L3 y L4 indujeron un incremento en la producción de microvesículas (Δ = 2,73 ± 0,62 y 2,84 ± 0,59, respectivamente, respecto al control, p < 0,01) (fig. 3). Sin embargo, no se observaron diferencias en las células cultivadas con los líquidos L1 y L2 (Δ = 0,94 ± 0,233 y 1,19 ± 0,31, respectivamente, respecto al control).
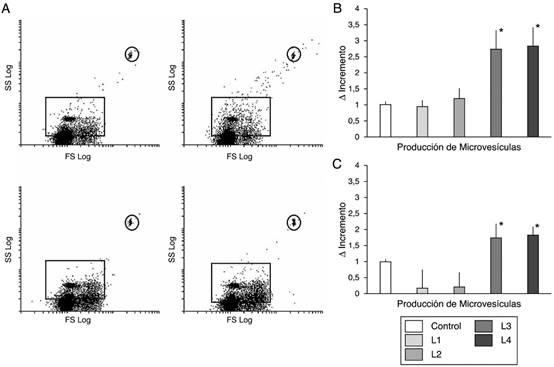
Figura 3 Microvesículas circulantes. A) Histogramas representativos de la distribución de microvesículas producidas por células de sujetos sanos con líquidos con citrato (imágenes superiores), y con líquidos con acetato (figuras inferiores). B) Cuantificación del incremento de microvesículas (media ± DE) en células inmunocompetentes de sangre periférica de sujetos control en cultivo con líquidos con acetato, que se incrementaron de manera significativa respecto al control y a las células tratadas con líquidos con citrato (*p < 0,01). C) Cuantificación del incremento de las microvesículas producidas por célula inmunocompetentes de enfermos con enfermedad renal crónica en tratamiento de hemodiálisis en respuesta a los diferentes líquidos de hemodiálisis Los líquidos con acetato produjeron un incremento significativo de microvesículas en comparación con control o con líquidos con citrato (p < 0,05).
Activación de células inmunocompetentes de sujetos con insuficiencia renal crónica
Encontramos un paralelismo entre lo observado en las células de sujetos sanos y lo observado en las células de enfermos en lo referente a expresión de ROS, o producción de microvesículas. Como se recoge en la figura 4, al igual que ocurría en las células de sujetos sanos, los líquidos que contenían acetato indujeron mayor actividad ROS (p < 0,005, vs. control y células tratadas con L1 y L2); o en la producción de microvesículas (fig. 3). Mientras que el incremento en el número de microvesículas con L1 y L2 fue de 0,16 ± 0,61 y 0,21 ± 0,48, respectivamente, respecto al control (ns), con L3 y L4 se observó un incremento de 1,73 ± 0,46 y 1,82 ± 0,29 (p < 0,05).

Figura 4 ICAM-1 y ROS en células de pacientes en hemodiálisis. Análisis comparativo (media ± DE) de la expresión de ICAM-1 y ROS en células inmunocompetentes de sangre periférica de enfermos con enfermedad renal crónica en tratamiento de hemodiálisis. No se observaron diferencias en la expresión de ICAM-1 entre las diferentes muestras. Con relación a la expresión de ROS, cuando las células se cultivaron con líquidos con acetato se observaron diferencias significativas respecto al control y a las células tratadas con líquidos cont citrato (*p < 0,05).
Discusión
En este estudio in vitro el acetato, en concentraciones de 3 y 4 mmol/L en el LD, induce en las células inmunocompetentes de la sangre un aumento de ICAM-1, ROS y microvesículas circulantes. El citrato no induce esa respuesta inflamatoria.
Entre un 50 y un 60% de los pacientes en HD presentan un estado de inflamación crónica de bajo grado, que se ha relacionado con la desnutrición, amiloidosis, ateroesclerosis, susceptibilidad a las infecciones y con la elevada morbimortalidad de estos pacientes19,20. Esta situación inflamatoria crónica es multifactorial: en parte se debe a la uremia y en parte a factores propios de la técnica de diálisis21-23. Entre los factores proinflamatorios propios de la HD está la presencia de acetato en el LD en una concentración de 20 a 40 veces superiror a la del plasma. La transferencia de acetato al paciente durante la HD se ha asociado a aumento del estrés oxidativo, de las citocinas proinflamatorias y de la síntesis de óxido nítrico4-8. Durante la sesión de HD hay otros factores proinflamatorios, como la membrana del dializador, las líneas, endotoxinas y otras sustancias pirogénicas, que hacen difícil valorar el papel de uno de ellos individualmente, como es el caso del acetato. Por ello, se ha recurrido a un experimento in vitro para dilucidar ese efecto proinflamatorio.
La inducción de inflamación del acetato del LD no depende solo del tipo de molécula, sino de su concentración. El acetato es una molécula fisiológica: sería su concentración entre 30 y 40 veces superior a la normal lo que provocaría la respuesta inflamatoria. Por el contrario, el citrato, aunque también está en concentraciones muy elevadas, no provoca ese efecto. Las concentraciones de una y otra molécula no son arbitrarias ni fácilmente modificables. Son las necesarias para estabilizar el LD y para contribuir al balance ácido-base adecuado durante la HD. En este estudio hemos utilizado las concentraciones habituales en el LD.
Como primera aproximación experimental para determinar una posible actividad diferencial de los LD sobre células inmunocompetentes, determinamos la expresión de ICAM-1 en la línea celular monocitaria THP-1. Esta línea ha sido utilizada habitualmente como modelo en estudios de daño vascular inducido asociado a la actividad inflamatoria y, más concretamente, los cambios en la expresión de ICAM-1 en estas células se han considerado un reflejo de las modificaciones que sufren las células de estirpe monocitaria para favorecer su interacción con el endotelio vascular24. Los LD con acetato incrementaron la expresión de ICAM-1 respecto a los controles, mientras que los LD con citrato no lo hicieron.
Dado que los LD que contienen acetato habían inducido activación en células THP-1, quisimos comprobar si este efecto era debido a alguna característica específica que mostrasen las células transformadas, por lo que decidimos cultivar PBMC de sujetos sin enfermedad previa conocida con los diferentes LD, incluyendo en este estudio otros biomarcadores asociados a activación celular que pudiesen ser de interés clínico como elementos de ayuda al diagnóstico para determinar la activación celular inducida por LD. En sangre de sujetos sanos no encontramos diferencias en cuanto a la expresión de ICAM-1 con los LD con acetato respecto al control, pero sí respecto a los LD con citrato. En el estudio de ROS se observó que los LD con acetato indujeron mayor actividad que el control y que los LD que contenían citrato. Junto a la determinación de marcadores asociados a activación celular, decidimos incluir en este estudio la determinación de microvesículas totales producidas por los PBMC, dada la relevancia señalada en los últimos años para estas estructuras en la etiopatogenia de diferentes enfermedades, incluidas las enfermedades cardiovasculares desarrolladas en un entorno de respuesta inflamatoria alterada25. Al igual que ocurría en las determinaciones de ROS, los LD con acetato indujeron un incremento de la producción de microvesículas.
El proceso de inflamación crónica de los pacientes con ERC se suele asociar a la presencia de células inmunocompetentes activadas en sangre periférica. En este estudio, hemos confirmado este hecho y, comparadas con las células de los sujetos control, en las de pacientes con ERC observamos mayor densidad de expresión de ICAM-1 o de niveles basales de ROS (datos no aportados).
Cuando comparamos la expresión de los diferentes marcadores de activación celular, a diferencia de lo observado en células de sujetos control, la expresión de ICAM-1 no se modificó con ninguno de los LD. Aunque no se ha podido determinar de forma precisa esta diferencia, una posible explicación viene asociada a la observación descrita anteriormente: al estar las células activadas, la expresión de esta molécula es tan alta que no se puede producir un aumento de su densidad de expresión ante un nuevo estímulo.
Se ha descrito un efecto inhibitorio directo del citrato sobre la activación de los granulocitos, contrarrestando la adherencia inducida por el leucotrieno-B4 e interfiriendo con su activación26,27. También la activación del complemento estaría reducida, incluso en concentraciones de 0,25 mmol/L de citrato13. Estos efectos antiinflamatorios del citrato vendrían condicionados por la concentración de calcio, por lo que podrían depender de la concentración de calcio en el LD. Alguno de nuestros resultados avalan este papel beneficioso del citrato, que se añade al de la eliminación del acetato, aunque este último sería el fundamental.
El estudio tiene limitaciones como el pequeño número de controles sanos y la limitada información de la situación de las células de los pacientes en HD. Al comparar el efecto de los 5 grupos en las mismas células, disminuye el efecto negativo de esa limitación. La diferente composición de los LD respecto a algunos electrólitos es muy pequeña, pero no se puede excluir que tenga algún efecto.
Podemos concluir que el acetato en el LD, en las concentraciones que se utilizan habitualmente en la práctica clínica, aumenta el estrés oxidativo y las microvesículas totales, y puede actuar como coadyuvante de los otros estímulos proinflamatorios a los que están sometidos los pacientes urémicos en HD. Los LD con citrato no producen esta activación, por lo que podrían ser una alternativa en la clínica. El objetivo debería ser eliminar al máximo todos los elementos de la HD bioincompatibles, como lo es el acetato en estas concentraciones. Esto tendría especial interés en los pacientes mayores de 70 años en HD, generalmente metabolizadores más lentos de acetato. En estos, la eliminación del acetato en el LD podría contribuir a una mejor supervivencia independientemente de sus comorbilidades28.














