Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.21 supl.3 Madrid may. 2006
ARTÍCULO
Consecuencias clínicas de la disfunción muscular en la enfermedad pulmonar obstructiva crónica
Clinic consequences of the muscle dysfunction in chronic obstructive pulmonary disease
J. Sauleda Roig
Servei Pneumologia. Hospital Son Dureta. Palma de Mallorca.
Dirección para correspondencia
RESUMEN
La función de los músculos respiratorios, y principalmente los inspiratorios, está alterada en pacientes con EPOC. La mayoría de estas alteraciones se deben fundamentalmente a la hiperinsuflación pulmonar que deja en situación desventajosa a estos músculos. La principal consecuencia de esta disfunción es la fatiga muscular respiratoria que puede provocar disnea, intolerancia al ejercicio, hipoventilación con aparición de insuficiencia respiratoria hipercápnica. Dicha función puede medirse en el laboratorio de función pulmonar a través de pruebas inespecíficas (espirometría, volúmenes pulmonares) y específicas (presiones respiratorias máximas [PIM-PEM], presión transdiafragmática, índice tensión tiempo del diafragma, electromiografía o pruebas de resistencia). El tratamiento debe ir encaminado principalmente a mejorar la hiperinsuflación con tratamiento broncodilatador, mejorar la fuerza muscular con rehabilitación y en casos graves se requiere reposo muscular con ventilación mecánica.
La disfunción muscular periférica es una complicación frecuente en la EPOC moderada-severa y puede ser consecuencia de la inactividad crónica, hipoxemia, alteraciones electrolíticas, desnutrición, corticoides, estrés oxidativo e inflamación sistémica. Además, puede contribuir a que estos pacientes asocien empeoramiento en su calidad de vida, discapacidad e incluso a un aumento en la morbi-mortalidad. Se puede evaluar con impedanciometría, pruebas de fuerza muscular (dinamometría), pruebas de imagen e incluso con biopsia muscular en estudios de investigación. La disfunción muscular periférica es potencialmente tratable con rehabilitación, suplementos nutricionales y fármacos anabolizantes. No obstante, a menudo el éxito terapéutico es incompleto por lo que es necesario desarrollar nuevos estudios con nuevas estrategias terapéuticas.
Palabras clave: Cuadríceps. Desnutrición. Diafragma. Ejercicio. EPOC. Fatiga muscular. Hiperinsuflación dinámica. Músculos respiratorios. Músculo periférico. Rehabilitación.
ABSTRACT
The function of respiratory muscles, and mainly inspiratorymuscles, is impaired in COPD patients. Most of these impairments are essentially due to pulmonary hyperinflation that puts these muscles in a disadvantageous situation. The main consequence of this dysfunction is respiratory muscle fatigue that may cause shortness of breath, exertion intolerance, and hypoventilation with onset of hypercapnic respiratory failure. This function may be measured at the pulmonary function laboratory by means of unspecific (spirometry, pulmonary volumes) or specific tests (maxim respiratory pressures [MIP - M], transdiaphragmatic pressure, tension-time index of the diaphragm, electromyography, or endura tests). Therapy should aim at improving hyperinflation with bronchodilator therapy, improving muscular strength with rehabilitation, and in severe cases muscle rest with mechanical ventilation.
Peripheral muscle dysfunction is a common complication in moderate-severe COPD, and it may be the result of chronic inactivity, hypoxemia, electrolytic impairments, under nutrition, steroids, oxidative stress, and systemic inflammation. Besides, it may contribute to patients' quality of life worsening, disability, and even an increase in morbimortality. It may tested by impedanciometry, muscle strength tests (dynamometry), imaging tests, and even muscle biopsy in research studies. Peripheral muscle dysfunction is potentially manageable with rehabilitation, nutritional supplementation, and anabolic drugs. However, therapeutic success is often incomplete, so that further studies with new therapeutic strategies are needed.
Key words: Quadriceps. Under nutrition. Diaphragm. Exercise. COPD. Muscle fatigue. Dynamic hyperinflation. Respiratory muscles. Peripheral muscle. Rehabilitation.
Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) se define por obstrucción crónica al flujo aéreo poco reversible y producida fundamentalmente por una reacción inflamatoria anómala al humo del tabaco1. Las últimas definiciones de la enfermedad incorporan un aspecto novedoso que son los efectos sistémicos1. Entre ellos destaca la afectación de los músculos esqueléticos respiratorios y periféricos2. La alteración de estos músculos puede ser debida a factores locales y sistémicos. Los locales con repercusión negativa en los músculos respiratorios son principalmente la hiperinsuflación pulmonar3 y en los periféricos la atrofia por desuso4. Los sistémicos son la inflamación sistémica, estrés oxidativo, hipoxia, alteraciones electrolíticas y malnutrición5. En este capítulo se abordarán las consecuencias clínicas negativas de las alteraciones de los dos compartimentos musculares (central o respiratorio, y periférico) en la EPOC y su evaluación en la práctica clínica diaria.
Músculos respiratorios
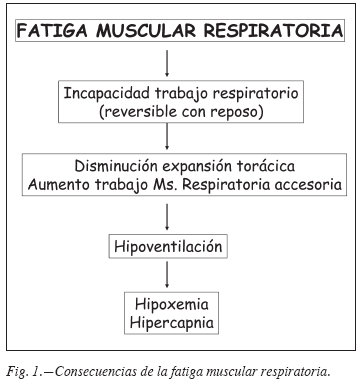
Los músculos respiratorios son básicos ya que su contracción produce la expansión de la caja torácica. Los más importantes son los inspiratorios (diafragma, intercostales externos, intercostales paraesternales y músculos inspiratorios accesorios del tronco (pectorales, esternocleido-mastoideo, serratos, etc.). El músculo inspiratorio más importante es el diafragma que desarrolla casi toda la fuerza necesaria para la expansión de la caja torácica6. El principal factor que repercute negativamente en la función de los músculos respiratorios en la EPOC es la hiperinsuflación dinámica que deja en situación desventajosa a las fibras musculares acortándolas disminuyendo su fuerza7. Además existe un aumento del trabajo respiratorio para vencer la obstrucción de la vía aérea. Todo ello puede producir fatiga muscular respiratoria que tiene como consecuencias negativas la disminución de los movimientos de la caja torácica con aparición de hipoventilación con hipoxemia e hipercapnia8 (fig. 1). En la EPOC también se han descrito alteraciones en la función de los músculos espiratorios abdominales que deben ayudar a vencer la resistencia espiratoria de la vía aérea9. Las consecuencias negativas derivadas de la fatiga muscular respiratoria en la semiología así como en la función respiratoria y en la de los músculos respiratorios se exponen a continuación.
Síntomas y signos de disfunción muscular respiratoria
Los síntomas son inespecíficos siendo los principales la disnea e intolerancia al ejercicio6. Los signos también son inespecíficos con aparición de taquipnea, tiraje intercostal y de los músculos accesorios inspiratorios, cianosis (que traduce hipoxemia severa) y en casos graves obnubilación y coma6. También se puede producir descoordinación toracoabdominal que se caracteriza por desacoplamiento entre los movimientos de la caja torácica y el abdomen: mientras el tórax se expande el abdomen se retrae. Este fenómeno también es conocido como el signo de Hoover6. Ello es debido a que el diafragma débil o fatigado es succionado hacia la caja torácica por la presión negativa producida por la contracción de los músculos respiratorios accesorios durante la inspiración. En la RX tórax se observa un aplanamiento de los hemidiafragmas como consecuencia de la hiperinsuflación pulmonar que comporta una mecánica defectuosa del diafragma.
Métodos de evaluación de la disfunción muscular respiratoria
Las pruebas que se alteran en la EPOC como consecuencia de esta disfunción son las siguientes:
Espirometría. La capacidad vital disminuye, como consecuencia de la disminución en la expansión de la caja torácica, y se eleva el cociente FEV1/FVC10. Este descenso en la capacidad vital se hace más evidente en decúbito objetivándose caídas de más de un 20% de la misma10.
Volúmenes pulmonares. La disminución de los movimientos de la caja torácica provoca un descenso en la capacidad de expansión del pulmón y, por tanto, disminuye la capacidad pulmonar total (TLC) (fig. 2)10. Sin embargo, este fenómeno puede no hacerse evidente debido a que los pacientes con EPOC pueden presentar de base aumento de la TLC por la obstrucción crónica al flujo aéreo. Además, como consecuencia del descenso de la capacidad vital el volumen residual (RV), que de base está elevado, se incrementa.
Gasometría arterial. Es característica la hipoxemia con hipercapnia y gradiente alveolo-arterial de oxígeno normal que traduce el origen extrapulmonar de la hipoxemia10. No obstante, debido a que los pacientes con EPOC tienen patología pulmonar puede observarse un gradiente ligeramente aumentado. En pacientes con exacerbación de la EPOC la normalización del gradiente es un signo de gravedad ya que traduce un fracaso de los músculos respiratorios con probable necesidad de ventilación11.
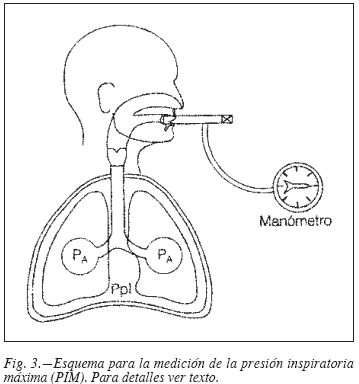
Presiones máximas en boca. Son dos: la presión inspiratoria máxima (PIM) y la espiratoria máxima (PEM)6. Son una de las formas más sencillas de medir la función de los músculos inspiratorios (PIM) y espiratorios (PEM). Se miden solicitando una maniobra de inspiración o espiración forzada contra un circuito ocluido que está conectado a un manómetro (fig. 3). De esta manera se consigue que la presión en boca se iguale con la alveolar. Estas presiones son reflejo de la pleural y abdominal máxima. Los pacientes con EPOC suelen presentar valores por debajo del 75% que indican disfunción muscular respiratoria10. Ello es debido principalmente a la hiperinsuflación pulmonar que condiciona un acortamiento de las fibras musculares y por tanto según ley de Starling disminución de la fuerza contráctil6.
Valoración de la fatiga muscular diafragmática. Una de las principales consecuencias negativas de la disfunción muscular respiratoria es la fatiga diafragmática. Se entiende por fatiga la incapacidad de realizar un trabajo reversible con reposo12. Este concepto debe diferenciarse de la debilidad en que la incapacidad es irreversible12. Los límites de la reserva muscular respiratoria los marcan fundamentalmente dos variables: la fuerza desarrollada durante la contracción (medida por el cociente presión durante la respiración respecto la presión máxima que puede generar) y el ciclo respiratorio representado por el cociente Tiempo inspiratorio/Tiempo total de la respiración. Uno de los mejores métodos para la valoración de la función diafragmática es el índice tensión tiempo del diafragma (TTdi) que es el producto entre la relación entre presión transdiafragmática basal (Pdi) y máxima (Pdimax) por la relación tiempo inspiratorio respecto al total6. Este concepto se plasma en la siguiente fórmula: TTdi = (Pdi/Pdimax) x Ti/Ttot. La Pdi se consigue al restar la presión pleural de la abdominal. Debido a que es muy complicado obtener la presión pleural y abdominal se puede realizar una estimación de ambas presiones con una sonda esofágica y gástrica respectivamente. La Pdimax se obtiene después de una maniobra de inspiración forzada como por ejemplo de esnifado brusco. El Ti es el tiempo inspiratorio y el Ttot el tiempo total de cada respiración.
El valor de TTdi debe ser inferior a 0,15 para que no haya fatiga8. Si este valor es inferior a 0,15 se puede sostener el trabajo muscular respiratorio indefinidamente8. Por tanto conviene que este factor esté sea lo menor posible. Ello se puede conseguir principalmente aumentando la Pdimax o disminuyendo el Ti. En la EPOC en fase de estabilidad clínica este valor es menor que 0,15. Sin embargo en pacientes con limitación severa al flujo aéreo pueden acercarse a cifras de 0,10 y en fase de agudización de la enfermedad pueden sobrepasar el límite de 0,158 con aparición de fatiga muscular, hipoventilación, insuficiencia respiratoria hipercápnica, acidosis respiratoria y necesidad de ventilación mecánica.
Resistencia o "endurance". La endurance es la capacidad de un músculo para mantener un esfuerzo. El atrapamiento aéreo aumenta durante el esfuerzo lo que se denomina hiperinsuflación dinámica. La hiperinsuflación dinámica es uno de los principales factores limitantes del esfuerzo en estos pacientes ya que a medida que avanza el esfuerzo, el atrapamiento aéreo y la capacidad residual funcional (FRC) aumentan alterando la mecánica muscular respiratoria con un diafragma cada vez más aplanado e incapaz de sostener el esfuerzo durante un periodo de tiempo determinado13.
La endurance de los músculos respiratorios puede medirse haciendo respirar al paciente a través de unas resistencias que le obligan a generar una presión inspiratoria determinada14. Se puede cuantificar analizando el tiempo en que el paciente puede resistirlo o la resistencia máxima que puede tolerar el paciente. Un valor normal de PIM (fuerza muscular puntual conservada) no significa endurance normal (capacidad de resistencia). Clínicamente es más relevante mantener un determinado trabajo muscular (endurance) que la de generar un determinado nivel de presión inspiratoria (PIM).
Electromiografía. Consiste en evaluar la actividad eléctrica generada por el diafragma durante su contracción. Los electrodos pueden ser externos (superficie externa de caja torácia) o internos (tercio distal de esófago).En situación de fatiga la relación entre complejos de alta frecuencia y baja está alterada15.
Función muscular respiratoria durante el ejercicio
Una de las principales consecuencias de la disfunción muscular respiratoria en los pacientes con EPOC es la limitación al ejercicio. Hasta hace pocos años se aceptaba que la principal causa de dicha limitación era la disminución de la capacidad ventilatoria secundaria a la enfermedad parenquimatosa16. Uno de los factores que repercute negativamente en dicha limitación es la disfunción de los músculos respiratorios debido principalmente a la presencia de hiperinsuflación dinámica que se produce durante el esfuerzo. La fuerza muscular respiratoria es un determinante importante de la tolerancia al ejercicio en pacientes con EPOC17. Durante el ejercicio se producen cambios significativos en la presión intratorácica durante la ventilación como resultado de incrementar el volumen pulmonar. La relación entre la presión necesaria para respirar y la reserva funcional a estos volúmenes altos es muy baja y es un factor limitante en estos pacientes. A medida que la EPOC evoluciona esta situación empeora y se produce un cambio en el reclutamiento de los músculos respiratorios predominando la acción de los músculos inspiratorios accesorios18 que generan la mayor parte de la presión para una ventilación efectiva19.
Además del papel limitante de la hiperinsuflación dinámica en la función de los músculos respiratorios durante el ejercicio hay otro factor que es la desnutrición. Muchos pacientes con EPOC asocian desnutrición. Las causas no están muy claras pero podrían incluir estado hipermetabólico, disminución de la ingesta calórica a medida que progresa la enfermedad e inflamación sistémica5. Parece que hay relación entre el tratamiento nutritivo con suplementos calóricos y la mejoría de la fuerza y resistencia de los músculos respiratorios en algunos pacientes con EPOC20. Otros estudios han demostrado que la desnutrición contribuía de forma independiente a la intolerancia al esfuerzo en pacientes con EPOC21.
Implicaciones terapéuticas
El mejor conocimiento de la fisiopatología de las consecuencias negativas de la disfunción muscular respiratoria de los pacientes con EPOC ha ayudado a plantear estrategias terapéuticas de los músculos respiratorios:(1) Disminuir la carga de los músculos respiratorios reduciendo la resistencia de la vía aérea con broncodilatadores22; (2) Mejorar la mecánica y disminuir la hiperinsuflación dinámica también con broncodilatadores o en casos de enfisema severo y si procede con cirugía de reducción de volumen, o con rehabilitación (entreno de los músculos respiratorios)23,24; (3) Mejorar la contractibilidad con fármacos por ejemplo, teofilina22; y, (4) Reposo muscular con ventilación mecánica (invasiva o no) en casos graves25.
Músculos periféricos
Entre los efectos sistémicos de la EPOC destaca la disfunción de los músculos de las extremidades. Diferentes estudios han objetivado atrofia de las fibras musculares26, disminución de la proporción de fibras de tipo I26, disminución del número de capilares27, alteración del metabolismo oxidativo28, y disminución de la fuerza y de la resistencia4. Se han postulado varias causas que la pueden provocar como la inactividad crónica, hipoxemia, alteraciones electrolíticas, desnutrición, corticoides, estrés oxidativo e inflamación sistémica29. Las consecuencias negativas derivadas de la afectación muscular sistémica en la clínica así como su evaluación se exponen a continuación.
Consecuencias clínicas
La disfunción muscular periférica se ha asociado principalmente con intolerancia al ejercicio29. Esta afirmación se basa en estudios que observaron que muchos pacientes con EPOC dejaron de realizar ejercicio por fatiga en las piernas30 y que después de corregir la patología respiratoria con trasplante pulmonar tampoco se normalizó la capacidad de ejercicio31,32. Posteriormente diversos autores han confirmado los hallazgos de estos estudios objetivando alteraciones bioquímicas en biopsias musculares de quadríceps31,32. La debilidad muscular periférica de los pacientes con EPOC contribuye a la percepción de la fatiga en extremidades inferiores. En este sentido, para un determinado grado de obstrucción al flujo aéreo, los pacientes con músculos más fuertes toleran mayor grado de ejercicio29.
También se ha podido objetivar un músculo menos eficiente. Se observa aumento en la acidosis láctica que acompaña al esfuerzo y que condiciona un aumento en las necesidades ventilatorias para eliminar el CO2 que se produce en el metabolismo del ácido láctico33. Ello supone una carga adicional para los músculos respiratorios, que como ya se ha comentado anteriormente están alterados, dificultando el trabajo necesario para eliminar el CO2. Por ello, estos pacientes presentan característicamente hipercapnia durante el esfuerzo34. También la acidosis producida puede estimular los cuerpos carotídeos actuando como estímulo adicional para la ventilación agravándose el cuadro clínico y la disnea29.
La disfunción se localiza fundamentalmente en extremidades inferiores (cuadríceps) aunque también se ha objetivado disminución de la fuerza y alteraciones estructurales en los músculos de las extremidades superiores35.
La disfunción muscular periférica también se ha asociado con empeoramiento en la calidad de vida que puede ser reversible con rehabilitación36, mayor uso de recursos sanitarios37 y baja supervivencia38.
Métodos de evaluación
Las variables que se alteran como consecuencia de la disfunción muscular periférica son las siguientes:
Índice de masa corporal (BMI). Es el procedimiento más sencillo al abasto de cualquier profesional pero poco sensible para valorar la masa libre de grasa. Es un parámetro que indica más el estado nutricional. En pacientes con disfunción muscular y pérdida de masa puede estar disminuido (< 21 kg/m2)39.
Impendaciometría. Es un procedimiento poco disponible en la práctica clínica diaria. Se suele utilizar en protocolos de investigación. El procedimiento es realizado mediante la aplicación de una corriente eléctrica alterna de bajo voltaje al cuerpo del individuo que actúa como conductor, obteniéndose de esta forma el contenido de agua y masa libre de grasa. Es muy específica para calcular la pérdida de masa muscular que se produce en algunos pacientes con EPOC40.
Dinamometría. Es una exploración que se utiliza para medir la fuerza y otros parámetros (Potencia, Trabajo, Resistencia,...) de los diferentes grupos musculares (Piernas, Brazos, Columna,...)41.
Pruebas de imagen. A través de la TAC o resonancia nuclear magnética de las extremidades se puede observar el volumen de masa muscular (fig. 4)4.
Biopsia muscular. Los músculos de las extremidades son fácilmente accesibles y pueden ser biopsiados con relativa facilidad. Sin embargo esta prueba sólo se utiliza a nivel asistencial para descartar miopatías primarias. En estudios de investigación puede dar mucha información sobre el estado metabólico y estructural muscular42,43.
Implicaciones terapéuticas
Es muy importante tratar las alteraciones de los músculos periféricos de pacientes con EPOC ya que como se ha comentado anteriormente son factores importantes en la limitación al ejercicio, calidad de vida y supervivencia. Se dispone de varios sistemas: (1) Entreno físico (rehabilitación). Es bien conocido el efecto positivo de la rehabilitación en el músculo periférico.Hay varios estudios que demuestran sus efectos beneficiosos en la tolerancia al ejercicio en pacientes con EPOC44,45. Además se ha demostrado que la rehabilitación mejora la calidad de vida46 y aunque no se ha demostrado todavía un impacto en la mortalidad es probable que en un futuro se llegue a esta conclusión al igual que en otras enfermedades crónicas47. El efecto positivo se basa por un lado en aumentar la masa muscular y por otro mejorar la oxigenación periférica con lo que no hay que aportar más O2 a los tejidos sin necesidad de aumentar la frecuencia respiratoria que es lo que produce hiperinsuflación dinámica en estos pacientes29. Aunque en la EPOC todavía no se ha demostrado, en sujetos sanos48 y en otras enfermedades crónicas47 sí se ha demostrado un efecto antiinflamatorio del ejercicio que eventualmente puede disminuir el estado inflamatorio basal sistémico que presentan estos pacientes siendo un mecanismo que también puede mejorar la función muscular5. (2) Suplementos nutricionales. Se ha demostrado que con suplementos nutricionales orales o enterales entre 2 y 12 semanas puede conseguirse un aumento en el peso corporal aunque los resultados son modestos29. Los pacientes con EPOC que mejoran de peso después de este tratamiento presentan mejor pronóstico que los pacientes que no presentan dicha mejoría38.Tiene que tenerse en cuenta que el incremento en el peso que resulta del tratamiento con suplementos nutricionales es típicamente atribuible al aumento en la masa grasa sin impacto en la masa muscular. Por tanto, no es de extrañar que haya una mejoría escasa en la fuerza muscular después del tratamiento con estos suplementos. Es recomendable utilizar esta estrategia terapéutica conjuntamente con la rehabilitación y con fármacos29. (3) Fármacos anabolizantes. Estos fármacos aumentan la masa muscular especialmente cuando se combinan con entreno en sujetos sanos. Sin embargo, este efecto en pacientes con EPOC combinando tratamiento farmacológico y entreno es escaso49. (4) Oxigenoterapia. Aumenta la tolerancia al ejercicio y el metabolismo aeróbico a corto plazo aunque se desconoce si estos efectos se mantienen a largo plazo50.
En resumen, debido a que la etiología de la disfunción muscular periférica en la EPOC es multifactorial se recomienda una estrategia terapéutica global29.
Referencias
1. Celli BR, MacNee W, Agusti AG y cols.: Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J 2004; 23:932-946. [ Links ]
2. Marchand E, Decramer M: Respiratory muscle function and drive in chronic obstructive pulmonary disease. Clin Chest Med 2000; 21(4):679-692. [ Links ]
3. Sinderby C, Spahija J, Beck J, Kaminski D, Yan S, Comtois N, Sliwinski P: Diaphragm activation during exercise in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 163(7):1637-1641. [ Links ]
4. Bernard S, Leblanc P, Whittom F, Carrier G, Jobin J, Belleau R, Maltais F: Peripheral muscle weakness in patient with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998; 158:629-634. [ Links ]
5. Agusti AG, Noguera A, Sauleda J, Sala E, Pons J, Busquets X: Systemic effects of chronic obstructive pulmonary disease. Eur Respir J 2003; 21(2):347-360. [ Links ]
6. Sauleda J, Maimo A: Musculos respiratorios; in: Agusti AGN, (ed): 1994. pp. 25-30. [ Links ]
7. Polkey MI, Kyroussis D, Hamengard C-H, Mills GH, Green M, Moxham J: Diaphragm strength in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1996; 154:1310- 1317. [ Links ]
8. Grassino A, Clanton T: Respiratory muscle fatigue. Sem Respir Med 1991; 12:305-321. [ Links ]
9. Ninane V: "Intrinsic" PEEP(PEEPi): role of expiratory muscles. Eur Respir J 1997; 10:516-518. [ Links ]
10. Polkey MI, Green M, Moxham J: Measurament of respiratory muscle stregnth. Thorax 1995; 50:1131-1135. [ Links ]
11. Gray BA, Blalock JM: Interpretation of the A-a O2 difference in patients with hypercapnia. Am Rev Respir Dis 1991; 143:4-8. [ Links ]
12. NHLBI Workshop Summary: Respiratory muscle fatigue: report of the respiratory muscle fatigue workshop group. Am Rev Respir Dis 1990; 142:474-480. [ Links ]
13. Gea J, Sauleda J, Orozco-Levi M, Aguar MC, Barreiro E, Broquetas JM: Función diafragmática durante el ejercicio en pacientes con EPOC severa. Arch Bronconeumol 1999; 35(6):280-286. [ Links ]
14. Martyn JB, Moreno RH, Paré PD, Pardy RL: Measurement of inspiratory muscle performance with incremental threshold loading. Am Rev Respir Dis 1987; 135:919-923. [ Links ]
15. Rochester DF: Tests of respiratory muscle function. Clin Chest Med 1988; 9:241-261. [ Links ]
16. Nici L: Mechanisms and measures of exercise intolerance in chronic obstructive pulmonary disease. Clin Chest Med 2000; 21(4):693-704. [ Links ]
17. Bauerle O, Chrusch CA, Younes M: Mechanisms by which COPD affects exercise tolerance. Am J Respir Crit Care Med 1998; 157(1):57-68. [ Links ]
18. Marin JM, Hussain SN, Gibbons WJ, Polverino M, Levy RD, Cosio MG: Relationship of resting lung mechanics and exercise pattern of breathing in patients with chronic obstructive lung disease. Chest 1993; 104(3):705-711. [ Links ]
19. Montes de OM, Celli BR: Respiratory muscle recruitment and exercise performance in eucapnic and hypercapnic severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2000; 161(3 Pt 1):880-885. [ Links ]
20. Nava S, Fuccella LM, Viglianti B: Physiological effects of intravenous fructose 1.6-diphosphate on diaphragmatic function in malnourished patients with COPD. Monaldi Arch Chest Dis 2004; 61(4):203-208. [ Links ]
21. Palange P, Forte S, Felli A, Carlone S: Nutritional status and exercise perfomance in chronic obstructive pulmonary disease (COPD). Monaldi Arch Chest Dis 1993; 48:543-545. [ Links ]
22. Grazzini M, Stendardi L, Rosi E, Scano G: Pharmacological treatment of exercise dyspnoea. Monaldi Arch Chest Dis 2001; 56(1):43-47. [ Links ]
23. Martínez FJ, Montes de Oca M, Whte RI, Stetz J, Gay SE, Celli BR: Lung-volume reduction improves dyspnea, dynamic hyperinflation,and respiratory muscle function. Am J Respir Crit Care Med 1997; 155:1984-1990. [ Links ]
24. Beckerman M, Magadle R, Weiner M, Weiner P: The effects of 1 year of specific inspiratory muscle training in patients with COPD. Chest 2005; 128(5):3177-3182. [ Links ]
25. Nava S, Ambrosino N, Bruschi C, Confalonieri M, Rampulla C: Physiological effects of flow and pressure triggering during non-invasive mechanical ventilation in patients with chronic obstructive pulmonary disease. Thorax 1997; 52(3):249-254. [ Links ]
26. Whittom F, Jobin J, Simard PM, Leblanc P, Simard C, Bernard S, Belleau R, Maltais F: Histochemical and morphological characteristics of the vastus lateralis muscle in patients with chronic obstructive pulmonary disease. Med Sci Sports Exerc 1998; 30(10):1467-1474. [ Links ]
27. Whittom F, Jobin J, Simard PM, Leblanc P, Simard C, Bernard S, Belleau R, Maltais F: Histochemical and morphological characteristics of the vastus lateralis muscle in patients with chronic obstructive pulmonary disease. Med Sci Sports Exerc 1998; 30(10):1467-1474. [ Links ]
28. Sauleda J, García-Palmer FJ, Wiesner R, Tarraga S, Harting I,Tomás P, Gómez C, Saus C, Palou A, Agustí AGN: Cytochrome oxidase activity and mitochondrial gene expression in skeletal muscle of patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998; 157(5):1413-1417. [ Links ]
29. Maltais F, Leblanc P, Jobin J, Casaburi R: Peripheral muscle dysfunction in chronic obstructive pulmonary disease. Clin Chest Med 2000; 21(4):665-677. [ Links ]
30. Killian KJ: Limitation to muscular activity in chronic obstructive pulmonary disease. Eur Respir J 2004; 24(1):6-7. [ Links ]
31. Wang XN, Williams TJ, McKennna MJ, Li JL, Fraser SF, Side EA, Snell GI, Walters EH, Carey MF: Skeletal muscle oxidative capacity, fiber type, and metabolites after lung transplantation. Am J Respir Crit Care Med 1999; 160:57-63. [ Links ]
32. Rabinovich RA, Ardite E, Troosters T, Carbo N, Alonso J, González de Suso JM, Vilaro J, Barberá JA, Polo MF, Argilés JM, Fernández-Checa JC, Roca J: Reduced muscle redox capacity after endurance training in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 164(7):1114-1118. [ Links ]
33. Maltais F, Simard AA, Simard C, Jobin J, Desgagnés P, Leblanc P, Janvier R: Oxidative capacity of the skeletal muscle and lactic acid kinetics during exercise in normal subjects and in patients with COPD. Am J Respir Crit Care Med 1996; 153:288-293. [ Links ]
34. Casaburi R, Patessio A, Ioli F, Zanaboni S, Donner CF, Wasserman K: Reductions in exercise lactic acidosis and ventilation as a result of exercise training in patients with obstructive lung disease. Am Rev Respir Dis 1991; 143:9-18. [ Links ]
35. Hernández N, Orozco-Levi M, Belalcázar V, Pasto M, MinguellaJ, Broquetas JM, Gea J: Dual morphometrical changes of the deltoid muscle in patients with COPD. Respir Physiol Neurobiol 2003; 134(3):219-229. [ Links ]
36. Simpson K, Killian K, McCartney N, Stubbing DG, Jones NL:Randomised controlled trial of weightlifting exercise in patients with chronic airflow limitation. Thorax 1992; 47(2):70-75. [ Links ]
37. Decramer M, Gosselink R, Troosters T, Verschueren M, Evers G: Muscle weakness is related to utilization of health care resources in COPD patients. Eur Respir J 1997; 10(2):417-423. [ Links ]
38. Schols AM, Slangen J, Volovics L, Wouters EF: Weight loss is a reversible factor in the prognosis of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998; 157(6 Pt 1):1791-1797. [ Links ]
39. Celli BR, Cote CG, Marín JM, Casanova C, Montes de OM,Méndez RA, Pinto P, V, Cabral HJ: The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med 2004;350(10):1005-1012. [ Links ]
40. Baarends EM, Marken Lichtenbelt WD, Wouters EF, Schols AM: Body-water compartments measured by bio-electrical impedance spectroscopy in patients with chronic obstructive pulmonary disease. Clin Nutr 1998; 17(1):15-22. [ Links ]
41. Engelen MP, Schols AM, Does JD, Wouters EF: Skeletal muscle weakness is associated with wasting of extremity fatfree mass but not with airflow obstruction in patients with chronic obstructive pulmonary disease. Am J Clin Nutr 2000;71(3):733-738. [ Links ]
42. Dubowitz V, Brooke MH: The procedure of muscle biopsy; in: Dubowitz V, Brooke MH, (eds): Muscle biopsy: a modern approach. London, Philadelphia, W.B. Saunders Company, 1973, pp 5-19. [ Links ]
43. Maltais F, Leblanc P, Whittom F, Simard C, Marquis K, Belanger M, Breton MJ, Jobin J: Oxidative enzyme activities of the vastus lateralis muscle and the functional status in patients with COPD. Thorax 2000; 55(10):848-853. [ Links ]
44. Berry MJ, Rejeski WJ, Adair NE, Zaccaro D: Exercise rehabilitation and chronic obstructive pulmonary disease stage. Am J Respir Crit Care Med 1999; 160(4):1248-1253. [ Links ]
45. Lacasse Y, Wong E, Guyatt GH, King D, Cook DJ, Goldstein RS: Meta-analysis of respiratory rehabilitation in chronic obstructive pulmonary disease. Lancet 1996; 348(9035):1115-1119. [ Links ]
46. Troosters T, Casaburi R, Gosselink R, Decramer M: Pulmonary Rehabilitation in Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2005. [ Links ]
47. Piepoli MF, Davos C, Francis DP, Coats AJ: Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH). Brit Med J 2004; 328(7433):189. [ Links ]
48. Das UN: Anti-inflammatory nature of exercise. Nutrition 2004; 20(3):323-326. [ Links ]
49. Ferreira IM, Verreschi IT, Nery LE, Goldstein RS, Zamel N, Brooks D, Jardim JR: The influence of 6 months of oral anabolic steroids on body mass and respiratory muscles in undernourished COPD patients. Chest 1998; 114(1):19-28. [ Links ]
50. Mannix ET, Boska MD, Galassetti P, Burton G, Manfredi F,Farber MO: Modulation of ATP production by oxygen in obstructive lung disease as assessed by 31P-MRS. J Appl Physiol 1995; 78(6):2218-2227. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
J. Sauleda Roig.
Servei Pneumologia.
Hospital Universitario Son Dureta.
07014 Palma de Mallorca.
E-mail: jsauleda@hsd.es