INTRODUCCIÓN
El cáncer de mama (CM) se define como una proliferación celular maligna que puede iniciarse en distintos tejidos mamarios, principalmente ductos (90%) y lobulillos (10%). Esta patología es el quinto tipo de cáncer más común a nivel mundial y el más frecuente en mujeres.
Como dato positivo cabe destacar que hasta hace poco más de la mitad de los diagnósticos de CM eran tumores de gran tamaño/avanzados. Sin embargo, actualmente, más del 85% de diagnósticos se hace en etapas precoces, en las que no existe afectación ganglionar o es muy limitada.
El desarrollo del CM es un proceso multifactorial en el que intervienen factores genéticos, ambientales y hormonales 1.
Entre los factores ambientales, la influencia de la dieta en el desarrollo del CM está siendo ampliamente estudiada. El mantenimiento de dietas hipercalóricas, ricas en azúcares refinados, carnes y grasas saturadas y pobres en frutas y vegetales y, por consiguiente, en fibra y vitaminas, se relaciona con mayor riesgo de desarrollar CM 2,3. También se ha establecido una sólida asociación entre la ingesta de alcohol y el riesgo de padecer CM 4. Otro factor importante de riesgo es el sedentarismo 5. Por último, todos los factores descritos tienen en común promover la ganancia de peso y, por tanto, desarrollar obesidad, lo que se considera uno de los principales factores de riesgo asociados al CM. De hecho, algunos autores han establecido que la obesidad podría incrementar la incidencia un 30% 6.
Actualmente se está generando una creciente masa científica que promueve la idea de que ciertos alimentos, sus nutrientes o compuestos bioactivos podrían no solo contribuir a la prevención de la tumorogénesis, sino que también podrían ejercer efectos sobre el desarrollo tumoral una vez diagnosticado el cáncer 7. En este sentido, algunos autores señalan que algunos componentes de la dieta podrían emplearse como tratamientos adyuvantes a los tratamientos antineoplásicos habituales con el objetivo de aumentar la supervivencia 7,8. Por otro lado, aunque actualmente el CM sea una patología curable en la mayoría de casos, las pacientes sufren deterioro de su calidad de vida, aumento del riesgo cardiovascular 9 y problemas asociados a los distintos tratamientos (como linfedema) 10. En este sentido, también puede encontrase en la bibliografía gran número de publicaciones que relacionan el consumo de determinados alimentos o compuestos bioactivos con mejoras en la calidad de vida de este colectivo 11.
Sin embargo, muchas veces resulta difícil discernir entre aquellos alimentos o compuestos bioactivos con mayor evidencia científica de aquellos con menor respaldo científico. Por esta razón, el objetivo del presente trabajo es exponer los efectos de aquellos nutrientes o compuestos bioactivos de alimentos con mayor evidencia científica para su utilización como adyuvantes a los tratamientos habituales del CM, lo que puede aumentar la supervivencia y/o mejorar la calidad de vida del colectivo.
MÉTODOS
Se ha llevado a cabo una búsqueda bibliográfica utilizando el sistema de búsqueda PubMed introduciendo como palabras clave: breast cancer, nutrition, bioactive compounds, functional food y dietary intake.
Se han revisado 185 artículos. De la lectura de resúmenes se seleccionaron aquellos que arrojaban resultados positivos, que asociaban el empleo de un componente dietético, ya sea alimento completo, nutriente o compuesto bioactivo, con algún tipo de efecto beneficioso sobre el desarrollo o evolución del CM o sobre un parámetro indirectamente relacionado. Los "efectos beneficiosos" se interpretaron en un sentido amplio, incluyendo la disminución de parámetros de proliferación celular en células tumorales mamarias, la reducción de la tasa metastásica en pacientes, la sinergia con algún tipo de tratamiento antitumoral o la reducción de efectos secundarios asociados a terapias antineoplásicas.
Entre los trabajos con resultados positivos se eligieron aquellos compuestos bioactivos que contaban con mayor número de publicaciones (> 10) y que incluían estudios in vitro e in vivo así como estudios epidemiológicos y ensayos clínicos. Finalmente, fueron seleccionados 106 artículos que incluían información de los siguientes compuestos: catequinas del té verde, isoflavonas de la soja, vitamina E, vitamina D, β-glucanos de levaduras, setas y cereales, lípidos marinos (DHA, EPA), ácido α-linolénico y lignanos de linaza y compuestos sulfurados de crucíferas.
Todos los artículos fueron sometidos a una lectura crítica, y para el presente trabajo se ha prestado especial atención a los artículos de los 2 compuestos con mayor respaldo científico: vitamina D y omega-3. El resto de compuestos ha sido detallado en otro artículo 12.
RESULTADOS
VITAMINA D
La vitamina D (VD) o calciferol es de vital importancia para el mantenimiento de la salud ósea y del sistema inmunológico. La VD contribuye al mantenimiento de órganos y sistemas, ya que interviene en la regulación de los niveles de calcio y fósforo en sangre, promoviendo su absorción intestinal y la reabsorción de calcio en el riñón. De este modo, participa en la formación y en la mineralización ósea, y es esencial para el desarrollo esquelético 13.
Preservar la resistencia de los huesos es vital para contribuir al mantenimiento de la calidad de vida de mujeres que padecen o han padecido CM 14, especialmente con tratamientos antiestrogénicos en tumores hormonodependientes, que promueven la disminución de la densidad mineral ósea 15. Por esta razón, parece importante garantizar niveles adecuados de VD en sangre en las mujeres con CM.
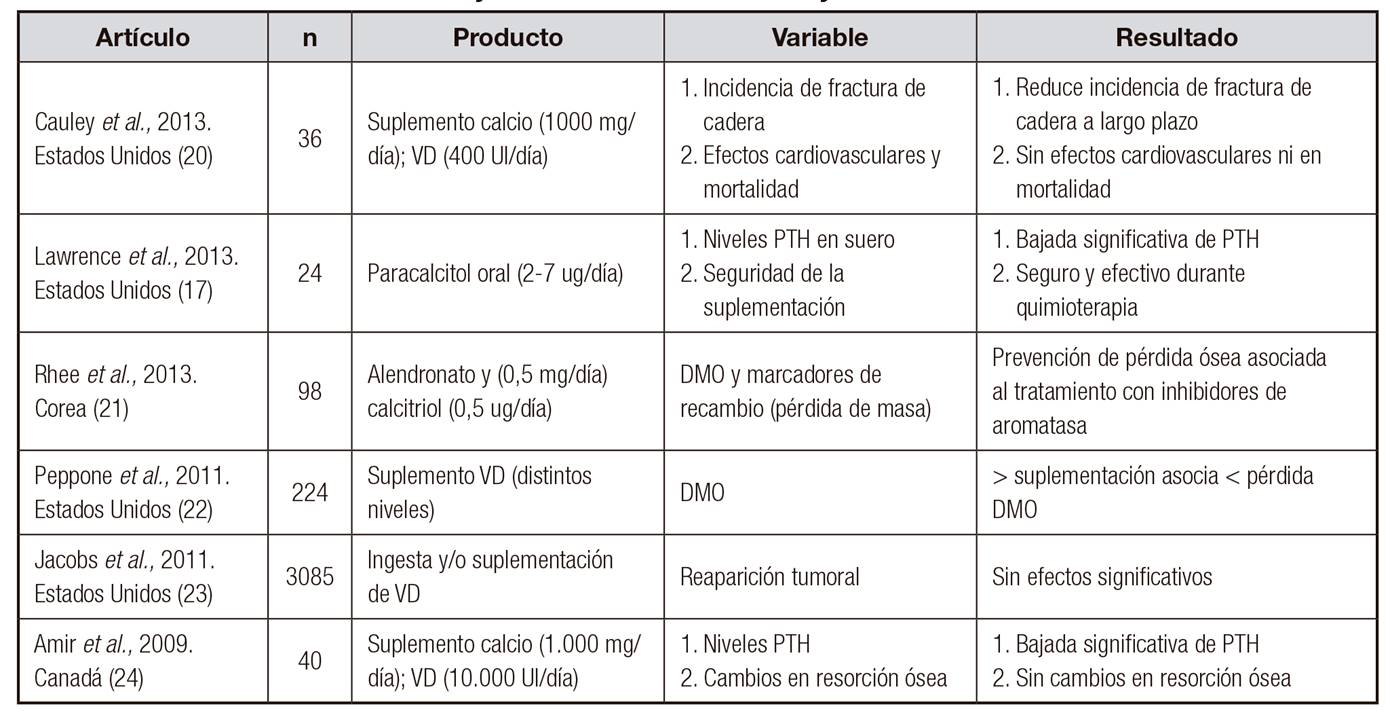
Por otro lado, tanto en estudios in vitro como en ensayos clínicos ha podido observarse que niveles bajos de VD en suero están relacionados con una sobreestimulación de la hormona paratifoidea (PTH) y con mayores tasas metastásicas en hueso, lo que se asocia a un peor pronóstico de la enfermedad. Por el contrario, altos niveles séricos de VD se asocian con una mayor supervivencia y una menor reaparición tumoral 16,17.
En este sentido, algunos autores han observado una posible causalidad inversa, y plantean la posibilidad de que, en casos graves de CM, la concentración sérica de la vitamina disminuiría significativamente, dando lugar a peores pronósticos. Si así fuera, el valor de VD en suero podría utilizarse como biomarcador indicador del grado de gravedad del cáncer en lugar de como un factor relacionado con una mayor supervivencia 18,19. Sin embargo, la mayoría de células tumorales de CM tienen receptores de VD (> 90%), y esto se asocia con menor supervivencia de dichas células, dados los efectos de la vitamina en diferenciación celular, actividad antiproliferativa, parada del ciclo celular y regulación de proteínas apoptóticas 20.
En la mayoría de ensayos clínicos realizados hasta el momento 17,20,21,22,23,24 (Tabla 1), se ha asociado la suplementación con VD con disminución de niveles de PTH, lo que podría asociarse con fenotipos tumorales menos proliferativos. Por otro lado, también se han observado mejoras en distintos parámetros óseos que, aunque no puedan ser reportados como efectos antineoplásicos, sí pueden considerarse beneficiosos para la salud general. De este modo, teniendo en cuenta tanto los efectos observados a nivel tumoral como otros factores asociados a la calidad de vida, se considera que la suplementación con VD durante el tratamiento del CM podría ser recomendada, con especial énfasis en pacientes con bajos niveles.
Aun así, hay que tener en cuenta que un incremento demasiado acusado en los niveles de VD podría elevar el riesgo de hipercalcemia. Por esta razón, algunos autores proponen utilizar análogos de VD menos calcémicos como el Paricalcitol, cuya suplementación está recomendada en combinación con tratamientos de quimioterapia 21, para que los sujetos puedan ver aumentados sus niveles de VD en suero de forma más segura.
En resumen, dentro de todos los compuestos bioactivos relacionados con efectos antineoplásicos y de mejora del pronóstico asociado al CM, podemos concluir que la VD es uno de los ingredientes funcionales que actualmente puede ser recomendable como adyuvante en distintas terapias -especialmente con tratamientos antiestrogénicos en tumores hormonodependientes-. Por ello, la mayoría de las guías de práctica clínica (ESMO, SEOM, etc.) recomiendan controlar los niveles de VD como parte de la atención médica oncológica de rutina en mujeres en tratamiento o seguimiento de un CM, ya que en aquellas que presenten niveles de VD bajos estaría indicado pautar suplementación y promover un aumento del consumo de alimentos ricos en esta vitamina (pescados grasos, lácteos enriquecidos, huevos y setas) hasta alcanzar niveles normales en sangre 25,26.
OMEGA-3 (DHA, EPA)
El ácido eicosapentaenoico (EPA) y el ácido docosahexaenoico (DHA) son ácidos grasos poliinsaturados de cadena larga (PUFA) de la familia omega-3 que se encuentran en grandes cantidades en productos de origen marino, como algas y pescados. Las células de mamíferos no pueden sintetizar PUFA de novo, por lo que su ingesta es la única vía de presencia en el organismo.
Varios grupos de investigación han demostrado que el DHA tiene, experimentalmente, la capacidad de aumentar la eficacia de hasta 15 agentes anticancerígenos 27,28,29. Este compuesto altamente insaturado se incorpora a los fosfolípidos de la membrana celular con mayor afinidad a células de rápido crecimiento o proliferación, tales como las células tumorales 30. Así, se estima que producen un aumento de la sensibilización del tejido tumoral frente agentes anticancerígenos, mientras que en los tejidos normales no producen efecto adverso alguno 31. Además de este efecto, otros estudios relacionan su presencia con procesos apoptóticos, control de factores de crecimiento asociados a la oncogénesis, tales como EGFR y Her2+, y cambios en la expresión génica asociada a procesos metastásicos, proliferativos y de diferenciación celular 32. Por último, también se han observado evidencias que relacionan el consumo de omega-3 con una reducción del riesgo de padecer CM, ya que en algunos casos este cáncer se asocia con una alta ingesta de ácidos grasos de la serie omega-6 33,34.
En los ensayos clínicos revisados 35,36,37,38 (Tabla 2) se han observado mejoras significativas en efectos adversos del tratamiento sobre la resorción ósea, los síntomas de la menopausia, la fatiga, el estado inflamatorio, etc. Por otro lado, otros estudios relacionan su ingesta con un aumento de la quimiosensibilización de tejidos tumorales, lo que les otorga un importante potencial como adyuvantes en tratamientos de quimioterapia. Así, se ha encontrado un aumento de supervivencia en mujeres con CM metastásico 35.
Tabla II. Ensayos clínicos omega-3 y cáncer de mama

EPA: ácido eicosapentaenoico; DHA: ácido docosahexaenoico.
De este modo, las pruebas in vitro y los distintos ensayos clínicos nos llevan a pensar que la suplementación e ingesta de PUFA de origen marino podría promover efectos beneficiosos recomendables durante el tratamiento de CM, así como la disminución de efectos secundarios de los tratamientos (pérdida de masa magra, fatiga...) y la sensibilización de las células tumorales frente a los tratamientos antineoplásicos, por lo que su uso como adyuvante en las distintas terapias podría ser de gran utilidad.
Hasta la fecha no existe ninguna recomendación específica incluida en las guías de práctica clínica de mujeres con tratamiento o seguimiento de CM de suplementar con omega-3. Sin embargo, la mayoría de estas guías recogen la necesidad de recomendar el incremento del consumo de pescado azul en la dieta de las pacientes 25,26.
CONCLUSIÓN
Durante años se ha descrito en estudios epidemiológicos la existencia de una asociación entre el consumo de determinados componentes alimentarios y el riesgo de desarrollar algunos tipos de tumores. Una dieta sana, baja en grasas saturadas y azúcares refinados y rica en productos integrales y vegetales podría relacionarse con un mejor pronóstico de pacientes con diferentes tipos de tumores 39. Se ha evidenciado que los supervivientes de cáncer con estilos de vida más saludables (mantenimiento de peso corporal óptimo, práctica de actividad física y, por supuesto, el seguimiento de una dieta saludable) tienen menor riesgo de mortalidad por cualquier causa y, en el caso concreto de las mujeres supervivientes de CM, menor mortalidad como consecuencia del cáncer 40.
Estas observaciones han aumentado el interés por investigar las propiedades antitumorales de los compuestos bioactivos contenidos en los alimentos que forman parte de una dieta saludable con el objetivo de explorar su potencial aplicación como tratamientos anticancerígenos que pudieran resultar complementarios a los tratamientos habitualmente utilizados.
Muchos compuestos bioactivos han mostrado resultados prometedores en estudios in vitro. Sin embargo, en la mayoría de los casos los resultados en ensayos clínicos son contradictorios, por lo que no es posible confirmar una relación directa entre el consumo de muchos compuestos y la evolución tumoral en las pacientes con CM 12. Estas discrepancias podrían asociarse a diferentes factores de confusión: falta de estudios enfocados al avance tumoral, elección de muestras poco representativas, problemas en la absorción de algunos de los compuestos estudiados (como β-glucanos), falta de condiciones controladas a la hora de llevar a cabo los ensayos clínicos o la gran heterogeneidad en el tipo de tumor que origina el CM de las participantes de ensayos clínicos. De hecho, este último factor puede ser de gran importancia, ya que el CM engloba una gran variedad de tumores diferentes, que pueden diferenciarse por el tipo celular que originó el tumor y por la expresión tumoral de determinadas moléculas como receptores de estrógenos (ER+), receptores de progesterona (PR+) o factor de crecimiento epidérmico (Her2+). Además, existen otros condicionantes, como, por ejemplo, el estado fisiológico de la mujer antes o después de la menopausia, que suponen un "ambiente" concreto para el crecimiento tumoral y que también sería necesario controlar. Todo esto determina que cada CM presente una entidad única. De este modo, teniendo en cuenta que cada compuesto bioactivo puede tener un mecanismo de acción diferente, podrían existir compuestos que ejerzan efectos específicos en un determinado tipo tumoral y no en otros, y compuestos que actúen de forma más genérica y sean efectivos en varios tipos tumorales.
Por otro lado, la detección temprana y el uso de terapias antineoplásicas más eficaces han dado lugar a un número cada vez mayor de supervivientes de CM. Estos éxitos presentan un nuevo desafío a la comunidad médica, que debe hacer frente a complicaciones a largo plazo de los tratamientos, con el consiguiente deterioro de la calidad de vida en este colectivo 40. De este modo, aunque no pueda afirmarse que los compuestos bioactivos revisados puedan, en su mayoría, producir mejoras en el pronóstico y en el avance tumoral, sí podemos asegurar que la mayoría promueven, en mayor o menor medida, mejoras en la calidad de vida y un mejor "ambiente fisiológico" que participe activamente en la reducción de problemáticas asociadas con la enfermedad después de los tratamientos quimio/radioterápicos o incluso en alargar la supervivencia de estas pacientes. En este contexto, la VD y los lípidos marinos son los compuestos bioactivos que actualmente cuentan con mayor evidencia científica en base a los estudios revisados.
En cuanto a la VD, parece ser un nutriente esencial para reforzar la salud ósea en pacientes con CM que siguen tratamientos antiestrogénicos, ya que los estrógenos tienen efecto protector sobre el hueso, y niveles reducidos de la hormona se traducen en mayores tasas de pérdida ósea. Por ello, la mayoría de guías de práctica clínica (por ejemplo, ESMO y SEOM) recomiendan pautar suplementación con VD y aumentar el consumo de alimentos ricos en esta vitamina (pescados grasos como salmón, atún y caballa, lácteos enriquecidos, huevos, setas...) en mujeres con CM y niveles bajos de VD en sangre.
En cuanto a los lípidos marinos, su ingesta podría promover efectos beneficiosos durante el tratamiento de CM, como la disminución de efectos secundarios de los tratamientos (pérdida de masa magra, fatiga...) y la sensibilización de células tumorales frente a los tratamientos antineoplásicos, por lo que su uso como adyuvante en las distintas terapias podría ser de utilidad. Sin embargo, no existe aún ninguna recomendación específica incluida en las guías de práctica clínica de mujeres con tratamiento o seguimiento de CM. Aún así, la mayoría de guías recogen la necesidad de recomendar el incremento del consumo de pescado azul en la dieta de las pacientes.
Por tanto, el uso de algunos compuestos bioactivos como tratamiento adyuvante en mujeres diagnosticadas de CM podría ser una herramienta con potencial para contribuir a la disminución de efectos indeseados derivados del tumor y de los tratamientos y a mejorar su calidad de vida. Sin embargo, este trabajo pone de manifiesto la necesidad de incrementar el número de ensayos clínicos mejor controlados enfocados a evaluar el efecto del empleo de compuestos bioactivos sobre el pronóstico, la calidad de vida y los efectos secundarios asociados a los tratamientos antitumorales para poder contar con evidencias suficientes que demuestren el beneficio de su uso como tratamiento adyuvante para la enfermedad.