INTRODUCCIÓN
La enfermedad crítica alude generalmente a situaciones médico-quirúrgicas graves, que amenazan la vida y requieren ingreso en la Unidad de Cuidados Intensivos (UCI). En estos casos suele presentarse disfunción de, al menos, un órgano/sistema, hipermetabolismo/hipercatabolismo, estrés metabólico y ayuno, con la consiguiente depleción de masa magra. En este contexto clínico, con la terapéutica nutritiva se pretende, fundamentalmente, modular el catabolismo y fomentar el anabolismo.
Las consecuencias de la desnutrición en el paciente crítico son muchas y, habitualmente, resultan clínicamente muy importantes. Entre otros resultados, se produce un aumento en las infecciones (sepsis) e inmunocompromiso, la curación de las heridas es inadecuada, se registran cambios en la masa y/o función de los órganos vitales, se pueden llegar a producir fallos orgánicos y, en general, se documenta un incremento en la morbimortalidad.
Tal y como se recoge en las guías de la European Society for Clinical Nutrition and Metabolism (ESPEN) sobre nutrición clínica en la UCI (1), se distinguen varias fases tras infección/estrés/lesión. Después de la lesión, la fase aguda se compone de un periodo temprano (días 1-2, caracterizado por inestabilidad metabólica y aumento severo en el catabolismo) y otro tardío (días 3-7, definido por una pérdida muscular significativa y una estabilización de los trastornos metabólicos). Posteriormente, la fase posaguda puede ir progresando hacia la convalecencia y la rehabilitación o hacia la cronicidad, la hospitalización prolongada, y al síndrome inflamatorio y catabólico persistente.
En cuanto a los aspectos metabólicos de la pérdida muscular durante la enfermedad crítica, un trabajo de Van Gassell y cols. (2) apunta ideas de interés respecto al metabolismo de proteínas en la enfermedad crítica y su impacto en la función y en la masa muscular. Los cambios a lo largo del tiempo en el metabolismo, la masa y la función de las proteínas musculares evidencian una breve fase catabólica durante la estancia en la UCI, con un impacto persistente posterior en la masa y en la función muscular. En conjunto, esta evolución temporal enfatiza aún más el impacto duradero del periodo relativamente corto de alteración del metabolismo de las proteínas y pone de relieve la importancia de manejar adecuadamente en su momento este problema.
BENEFICIOS DEL TRATAMIENTO NUTRICIONAL
En este contexto cabe plantearse tres preguntas fundamentales sobre el papel de la terapéutica nutricional óptima: a) ¿promueve la masa/función muscular?; b) ¿previene o atenúa el “wasting” muscular o, incluso, la aparición y evolución de la debilidad asociada al paciente grave -Intensive Care Unit-acquired weakness (ICU-AW)-; c) ¿favorece la recuperación tras la enfermedad crítica (en lo que respecta a la fuerza y función física)?
Recientemente se ha publicado un libro de normogramas/algoritmos que recoge los requerimientos de macronutrientes en pacientes críticos (3). En relación con las proteínas, se distingue entre la fase aguda (1,2-1,5 g/kg peso habitual/día), estable (1,5-2,0 g/kg peso habitual/día), la obesidad (con índice de masa corporal [IMC] de 30-40 kg/m2, 2 g/kg peso ideal/día; con IMC > 40 kg/m2, 2,5 g/kg peso ideal/día) y cuando el paciente está sometido a técnicas de reemplazo renal (> 2,0 g/kg peso habitual/día si IMC ≤ 30 kg/m2).
En cuanto al aporte calórico, en la fase aguda lo ideal es un aporte del 70 % del resultado de la calorimetría indirecta y, si esto no es posible, se aconsejan 20-25 Kcal/peso habitual/día; en fase estable, se recomiendan 20-25 Kcal/peso habitual/día; y en situaciones de obesidad, depende del IMC (IMC 30-50 kg/m2: 14 Kcal/kg peso habitual/día; IMC > 50 kg/m2: 22-25 Kcal/peso ajustado/día).
Respecto a los requerimientos de micronutrientes en pacientes críticos (elementos traza y vitaminas), se debe tener en cuenta que las necesidades se incrementarán en determinadas situaciones clínicas especiales: pacientes con requerimientos de técnicas de reemplazo renal, fístulas digestivas de alto débito (AD), larga estancia, edad superior a los 70 años, sarcopenia, etc.
Un aspecto crucial a valorar en el momento de confeccionar el tratamiento nutricional en los pacientes críticos es que no todos ellos son iguales; es esencial diseñar un tratamiento nutricional individualizado en estos casos, atendiendo sobre todo a la fase evolutiva en UCI; pero, además, se deben considerar también factores tales como la edad, el peso, el sexo, la calidad de vida, la presencia de sarcopenia (si es primaria o secundaria) o la patología de base del enfermo. De este abordaje individualizado dependerá el tratamiento específico que se recomendará a cada paciente y, consecuentemente, durante su evolución.
Una posible evolución del paciente crítico, especialmente preocupante, es hacia el desarrollo de un síndrome de enfermedad crítica crónica. El denominado PICS (persistent inflammation, immunosuppression, and catabolism syndrome) es un trastorno que, generalmente, no provoca el fallecimiento del paciente en la UCI, pero que en muchos casos termina por causarle la muerte cuando aún permanece ingresado en el hospital (4).
La valoración del estado nutricional del paciente crítico se debe efectuar al ingreso y durante el seguimiento; así, se aconseja una valoración inicial (antropometría, parámetros bioquímicos), la prevención del síndrome de realimentación y el seguimiento nutricional (general y del compartimento muscular). El objetivo de la valoración del estado nutricional del paciente al ingreso en la UCI tiene por objetivo identificar a pacientes desnutridos o en peligro de desarrollar este trastorno. En los pacientes en situación de riesgo nutricional y en los que se va a introducir nutrición artificial se debe poner una atención especial para prevenir el síndrome de realimentación y, para ello, se aconseja introducir la nutrición de forma progresiva, alcanzando requerimientos nutricionales en varios días, así como realizar controles diarios de electrolitos (sodio, potasio, fósforo y magnesio) (Fig. 1).
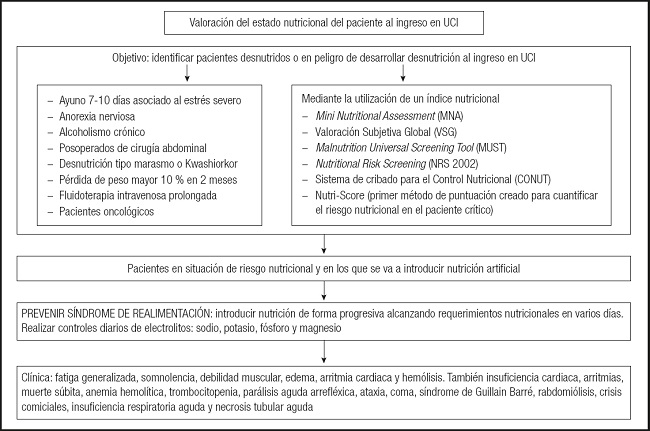
Fuente: cita 3.
Figura 1. Algoritmo de valoración del estado nutricional en UCI (UCI: Unidad de Cuidados Intensivos).
CRIBADO Y UTILIDAD DE LOS SCORES
En los últimos años se ha tratado de averiguar si debe hacerse cribado nutricional al ingreso en la UCI y si tienen valor los índices y scores pronósticos nutricionales. En una publicación de Zamora-Elson y cols. (5), donde se incorporan recomendaciones para el tratamiento nutrimetabólico especializado del paciente crítico del Grupo de Trabajo de Metabolismo y Nutrición de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICyUC), se comenta que en la UCI no sería necesario el cribado nutricional porque todos los enfermos por definición están en riesgo nutricional. Sin embargo, no todos los enfermos tienen el mismo riesgo y, por ello, deben ser valorados para poder identificarlo. La valoración del estado nutricional es el primer eslabón de la terapia nutricional… Una evaluación nutricional correcta requiere una historia clínica completa que incluya la ingesta previa, los días de ayuno o de fluidoterapia intravenosa prolongada antes de ingresar y la severidad del proceso actual que motivó el ingreso en la UCI.
Una de las pruebas de referencia para hacer la valoración nutricional del paciente crítico es la Subjective Global Assessment (SGA). A partir de datos de la historia clínica (cambio ponderal; cambio de ingesta; síntomas gastrointestinales; capacidad funcional; enfermedad y requerimientos nutricionales) y datos de la exploración física (pérdida grasa subcutánea; pérdida de masa muscular; edema maleolar/sacro; ascitis) se efectúa una valoración global subjetiva: no desnutrido A); moderadamente desnutrido (B); y severamente desnutrido (C) (6).
Por su parte, el Nutri-Score está diseñado para cuantificar el riesgo de eventos adversos en el paciente crítico que pueden ser modificados por terapia nutricional agresiva. La puntuación, de 1-10, está basada en 6 variables. Presenta el gran inconveniente de que sustenta gran parte de su puntuación en las escalas SOFA y APACHE II, que son scores de gravedad; así, aunque muchos pacientes con una puntuación elevada coinciden en que están graves y presentan desnutrición, este score no consigue una diferenciación clara (7).
En un estudio observacional, Theilla y cols. (8) han logrado validar los criterios Global Leadership Initiative on Malnutrition (GLIM) para el diagnóstico de la desnutrición en pacientes críticos. Los criterios de desnutrición de GLIM se correlacionaron significativamente con la evaluación SGA (estándar), así como con un bajo FFMI (fat-free mass index) y con la puntuación de PANDORA (patient- and nutrition-derived outcome risk assessment score). Por lo tanto, se concluye que la evaluación de desnutrición por medio de GLIM parece ser aceptable en el entorno de la UCI.
MONITORIZACIÓN
Se dispone en estos momentos de diversas técnicas para la monitorización evolutiva de la enfermedad crítica. La tomografía axial computarizada (TAC) a la altura de L3 ofrece información sobre la composición corporal (permite valorar grasa subcutánea/visceral/ intermuscular). La BIA (bioelectric impedance analysis) en los pacientes graves plantea dudas sobre su capacidad para dirigir y monitorizar la fluidoterapia; se emplea también para la medición de BCM –body cell mass–/ FFM–fat free mass– (biomarcador sarcopenia/requerimientos proteicos…). La resonancia magnética (RM) nivel L2-L3 muestra una buena correlación con los ultrasonidos (95 %), aunque su disponibilidad es menor. Los ultrasonidos (diafragma/cuádriceps femoral) permiten valorar área, grosor y perfusión muscular.
Un grupo de investigación holandés ha evaluado la composición corporal de los pacientes con COVID-19 admitidos en UCI, tratando de hallar posibles vinculaciones con la gravedad de la enfermedad (9). No se encontraron asociaciones significativas entre la composición corporal (incluida la masa grasa, el área de grasa visceral y la masa libre de grasa) y la gravedad de la enfermedad en esta población de pacientes con COVID-19 (que, en general, mostraban sobrepeso). Un ángulo de fase más bajo aumentó las probabilidades de COVID-19 grave. Se considera que otros factores, además de la composición corporal, juegan un papel más crítico en el desarrollo de COVID-19 grave.
Tal y como reflexionan estos mismos autores (10), actualmente hay demasiadas incertidumbres y discrepancias respecto a la interpretación de la BIA en enfermedades críticas para justificar las consecuencias terapéuticas. Sin embargo, existen varias áreas de investigación prometedoras, relacionadas con algunos de los problemas clínicos más urgentes en UCI, lo que enfatiza la necesidad de evaluar más a fondo el uso y la interpretación de la BIA en el entorno de cuidados intensivos.
Un trabajo de García-Martínez y cols. (11) ha profundizado sobre la debilidad muscular y plantea qué hacer en el paciente de UCI. Si no presenta un estado de debilidad muscular antes de ingresar en esta unidad, se opta de rutina por hacerle un MRC-SS (Medical Research Council sum score) antes de las primeras 48 h si coopera, o por efectuarle una ecografía muscular y un electromiograma si no colabora.
Hernández-Socorro y cols. (12) publicaron en 2018 los resultados obtenidos con un nuevo protocolo de ultrasonido para la evaluación de la sarcopenia en pacientes de larga estancia en la UCI. Con este nuevo protocolo de ultrasonidos se evaluó la calidad del músculo recto femoral del cuádriceps (QRF) y el grosor del tendón central intramuscular del cuádriceps del recto femoral, el área transversal y el grosor del músculo. La regresión logística se realizó como un análisis multivariante en 29 casos y 19 controles. Se demostró que el área y el grosor del músculo QRF disminuyeron significativamente (p ≤ 0,001), y el grosor del tendón central aumentó (p = 0,047) en los casos frente a los controles. La ecogenicidad del músculo QRF, las fasciculaciones, el edema subcutáneo y el líquido intramuscular también fueron significativamente diferentes entre los dos grupos (p < 0,001). Las variables seleccionadas en el análisis multivariante fueron el área muscular y el grosor del tendón central (Fig. 2).
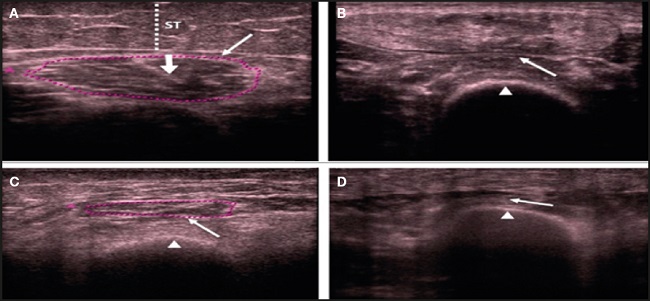
Fuente: cita 12.
Figura 2. Ultrasonografía transversal que muestra la ecogenicidad muscular del cuádriceps del recto femoral. A. Control sano equiparable: categoría 1 (hipoecogenicidad normal) con tendón central (flecha gruesa). B. Categoría 2 (heterogénea). C. Categoría 3 (infiltración grasa). D. Categoría 4 (atrofia debida a fascitis y necrosis muscular). RFC: recto femoral del cuádriceps (flechas); fémur (puntas de flecha); TS: tejido celular subcutáneo (línea de puntos); Eco: ecografía.
ABORDAJE TERAPÉUTICO
Diferentes estudios han evaluado en los últimos años el impacto del β-hidroxi-β-metilbutirato (HMB) en la pérdida muscular y el metabolismo proteico en pacientes críticos. En uno de ellos (13) se concluye que este tratamiento no redujo significativamente la pérdida muscular durante los 10 días de observación (criterio de valoración principal), pero procuró una mejora significativa en el metabolismo de los aminoácidos, una reducción de la descomposición neta de proteínas, un ángulo de fase más alto y una mejor salud global.
En esta misma línea de investigación, Nakamura y cols. (14) han observado que en pacientes críticos la suplementación con HMB durante la fase aguda en cuidados intensivos no inhibe la pérdida de volumen muscular. Sin embargo, en aquellos pacientes menos graves la administración de 3 g de HMB, 14 g de arginina y 14 g de glutamina al día (además de la terapia nutricional estándar) sí que mostraron beneficios en este ámbito; en concreto, en un subgrupo de pacientes con un SOFA < 10, la pérdida de volumen del músculo femoral fue de 14,0 ± 6,9 % para los controles y de 8,7 ± 6,4 % para el grupo que recibió HMB (p = 0,0474).
Supinski y cols. (15) han llevado a cabo un ensayo clínico controlado y aleatorizado para determinar si HMB y/o el ácido eicosapentaenoico mejoran la fuerza del diafragma y el cuádriceps en pacientes críticamente enfermos sometidos a ventilación mecánica. Los resultados indican que un curso de 10 días de HMB y/o EPA no mejora la fuerza del músculo esquelético en estos pacientes, corroborando también que la fuerza del diafragma y de las piernas en estos pacientes es muy baja.
En un estudio retrospectivo se ha evaluado el gasto energético en reposo, así como el consumo de calorías y proteínas, en pacientes críticos (16). El estudio sugiere que tanto la alimentación insuficiente como la sobrealimentación son perjudiciales para los pacientes en estado crítico, de modo que lograr un cociente de calorías administradas-gasto de energía en reposo del 70 % se asoció a una ventaja significativa en términos de supervivencia. Por lo tanto, la forma óptima de definir los objetivos calóricos requiere una estimación exacta, que idealmente se realiza mediante calorimetría indirecta.
Los resultados a seis meses del estudio TARGET (17), después de aportar el 100 % o el 70 % de los requerimientos calóricos enterales durante una enfermedad grave, pone de relieve cómo aportar el 100 % en comparación con el 70 % de la ingesta calórica recomendada durante una enfermedad crítica no mejora la calidad de vida o los resultados funcionales, ni tampoco aumenta el número de supervivientes 6 meses después.
Unos hallazgos similares se obtienen en un estudio de Arabi y cols. (18), determinando que la alimentación enteral para administrar una cantidad moderada de calorías no proteicas a adultos gravemente enfermos no se asoció con una menor mortalidad en comparación con la administración planificada de una cantidad completa de calorías no proteicas.
También se ha comparado el posible efecto beneficioso que deriva de una alimentación continua o intermitente sobre la debilidad muscular en pacientes críticos (19), no apreciándose que la alimentación intermitente en la enfermedad crítica temprana preserve la masa muscular, a pesar de que se asocia con unos mejores logros en los objetivos nutricionales que la alimentación continua.
En los supervivientes del ensayo EDEN (20) se registraron valores inferiores a los previstos en el rendimiento físico y cognitivo a los 6 y 12 meses, con algunas leves mejoras con el paso del tiempo. En esta población, la alimentación enteral trófica inicial versus la alimentación enteral completa durante los primeros 6 días después de la aleatorización no afectó el rendimiento físico y cognitivo.
En cuanto a las posibles diferencias entre la nutrición parenteral temprana (48 horas) versus tardía (día 8) en adultos críticamente enfermos, se ha visto que el inicio tardío se asocia con una recuperación más rápida y con menos complicaciones, en comparación con el inicio temprano (21).
El incremento de la administración de calorías/proteínas en la primera semana del paciente en la UCI no previene la debilidad muscular, y se han sugerido varios mecanismos posibles implicados en esta resistencia anabólica. También se ha sugerido que una intervención intravenosa precoz puede inducir debilidad muscular y no mejora los resultados funcionales a largo plazo, posiblemente debido a la supresión de la autofagia y a la acumulación de daño intracelular (22).
En nuestra propuesta de algoritmos del Grupo Metabólico de la SEMICyUC (3), se parte de la determinación de si es posible o no la nutrición oral en los pacientes críticos. Si es posible, se inicia la terapia oral y se plantea una reevaluación de la adecuación de la ingesta oral y la valoración de la posible incorporación de suplementos orales. En cambio, si no es posible la nutrición oral y no está contraindicada la nutrición enteral, se apuesta por iniciar este tipo de nutrición, valorando al 4 día desde el inicio si es adecuado o no el aporte (> 60 % requerimientos; > 80 % en pacientes desnutridos); en caso de ser adecuado, se mantiene la nutrición enteral y se inicia la dieta oral cuando sea posible, mientras que si el aporte no es el óptimo se tiende a mantener la nutrición enteral y añadir nutrición parenteral complementaria (con el objetivo de alcanzar el 80-100 % de los requerimientos) (Fig. 3).
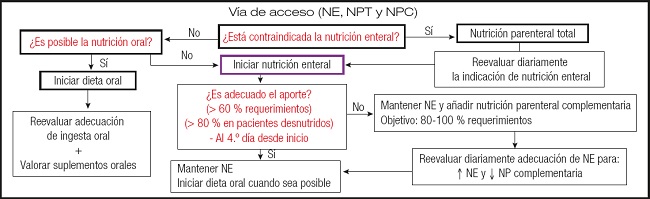
Figura 3. Propuesta de algoritmo de manejo de la nutrición en pacientes críticos (NE: nutrición enteral; NP: nutrición parenteral; NPT: nutrición parenteral total; NPC: nutrición parenteral complementaria).
El manejo de la hiperglucemia en este tipo de pacientes resulta de extraordinaria importancia, sobre todo por los efectos que este trastorno metabólico causa en la circulación y los electrolitos (depleción de fluidos, hipoperfusión, pérdida de electrolitos), por sus efectos celulares (lesión mitocondrial, disfunción de los neutrófilos, disfunción endotelial) y por sus efectos moleculares (daño oxidativo, glicación de las proteínas, inhibición del complemento). En los pacientes críticos, cuando presentan una glucemia superior a 180 mg/dl y/o se determinan dos glucemias (2 horas) superiores a 140 mg/dl, se opta por iniciar el tratamiento con insulina en perfusión continua (con el objetivo de mantener la glucosa entre 80-150 mg/dl); en pacientes con nutrición parenteral se procede al ajuste del aporte de glucosa (máximo 250 g/d o no más de 4 g/kg/d) y en pacientes sujetos a una nutrición enteral se podría prescribir una dieta específica para hiperglucemia (excepto si requiere otra dieta órgano específica).
Un estudio de reciente publicación (23) ha empleado técnicas de estimulación magnética para evaluar la fuerza del cuádriceps femoral y del diafragma en pacientes críticos sometidos a ventilación mecánica. Se observa cómo la debilidad de los músculos anteriormente mencionados en pacientes con enfermedades agudas es más grave y generalizada de lo que se reconoce en estudios previos que utilizan la RM (ya en la primera semana, la fuerza de las extremidades se redujo un 6 % en comparación con los valores normales y disminuyó en un 19 % la fuerza del diafragma). También se concluye que la debilidad muscular de las extremidades se correlaciona con la duración de la ventilación mecánica, mientras que la reducción de la fuerza del diafragma se correlaciona con la edad y la presencia de infección. Se encuentra una pobre correlación entre el tamaño muscular y la fuerza y, en particular, el tamaño muscular subestima la debilidad.
Hernández-Socorro y cols. (24) han publicado un estudio donde se han evaluado nuevos métodos ecográficos de alta calidad para diagnosticar el wasting muscular en pacientes críticos de larga estancia hospitalaria; en concreto, se ha valorado el posible beneficio derivado del empleo de elastografía por ondas de corte, un software nuevo que determina la microvascularización(superb micro-vascular imaging) y el contraste ultrasonográfico. A tenor de los resultados obtenidos, se recomienda que estos novedosos métodos ecográficos musculares sean utilizados por su excelente capacidad diagnóstica a la hora de evaluar los procesos sarcopénicos asociados a este grupo de pacientes críticos.














