INTRODUCCIÓN
La evaluación del estado nutricional de los pacientes, así como la monitorización de su evolución durante el tratamiento, constituye actualmente un verdadero reto clínico. La Real Academia Española define la palabra “reto” como un objetivo o empeño difícil de llevar a cabo y que constituye por ello un estímulo y un desafío para quien lo afronta.
EL PROBLEMA: LA DESNUTRICIÓN RELACIONADA CON LA ENFERMEDAD
La desnutrición es una situación clínica resultante de la falta de ingesta o absorción de nutrientes que determina la aparición de cambios en la composición corporal de quien la padece (disminución de la masa libre de grasa), así como en la masa celular, y que conlleva el deterioro de la función física y mental y una peor evolución clínica del enfermo (25).
En la práctica clínica diaria adquiere especial relevancia por su prevalencia y su implicación pronóstica entre otras, la desnutrición relacionada con la enfermedad (DRE). La DRE constituye un tipo específico de desnutrición causada por una enfermedad concomitante. Se trata de una condición catabólica desencadenada por una respuesta inflamatoria (que incluye anorexia y destrucción tisular) y provocada por una enfermedad subyacente. En este contexto la inflamación se erige como un factor importante en la etiología de la desnutrición (26,27).
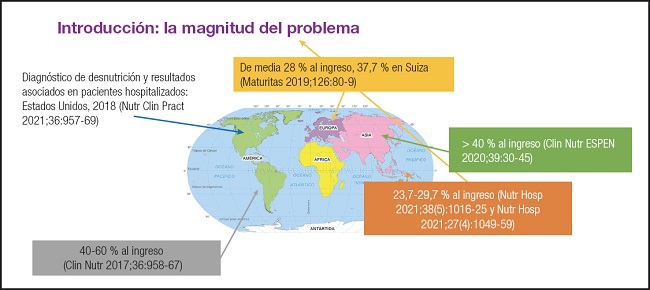
En los últimos años se han publicado numerosos estudios epidemiológicos que evidencian la alta prevalencia de la desnutrición relacionada con la enfermedad a nivel mundial, con tasas que se sitúan entre el 20-50 % a nivel hospitalario (Fig. 4).
Pero el problema de la DRE no solo viene determinado por su alta prevalencia, sino también por sus variadas e importantes consecuencias clínicas. Así, por ejemplo, se ha observado que el desarrollo de DRE determina un incremento de la morbimortalidad y de las complicaciones infecciosas y no-infecciosas, una peor cicatrización de heridas, mayor necesidad de tratamientos, estancia hospitalaria y peor calidad de vida. Todo ello repercute asimismo en los costes sanitarios (28,29).
Sin embargo, a pesar de estos datos desalentadores, hay margen para la esperanza. Y es que el principio de la solución de este problema parte, necesariamente, de su reconocimiento. Recientemente, gracias a la incorporación de los criterios GLIM, se ha dado un paso importante hacia la estandarización y homogenización de criterios para el diagnóstico clínico de la DRE. La aplicación de estos criterios GLIM permite sistematizar el diagnóstico de la DRE, establecer su severidad y posibilitar la clasificación etiológica (30).
Además, asistimos a una incorporación constante de tratamientos para el manejo individualizado de la DRE con recursos innovadores y guías de práctica clínica consensuadas y apoyadas en la evidencia (31). El cuerpo de evidencia en torno a coste-efectividad del tratamiento médico nutricional también ha sido convenientemente estudiado, y pone en valor la intervención nutricional en los pacientes desnutridos (32,33).
En resumen, hay herramientas diagnósticas nuevas y ampliamente aceptadas ASPEN, ESPEN, Federación Latinoamericana de Terapia Nutricional, Nutrición Clínica y Metabolismo [FELANPE], Parenteral and Enteral Nutrition Society of Asia [PENSA]) por lo que hay evidencia suficiente en torno a la relevancia del diagnóstico nutricional y de la intervención nutricional, así como de la su coste-efectividad. Entonces, ¿por qué la desnutrición asociada con la enfermedad continúa siendo un reto para los clínicos?
EL RETO DIAGNÓSTICO
A pesar de que la publicación reciente de los criterios GLIM para el diagnóstico de la DRE ha facilitado la sistematización y homogenización del proceso de valoración del estado nutricional, persiste cierta “dificultad” en su realización.
Como se refleja en una revisión de los estudios realizados tras la publicación de los criterios GLIM por parte de Correia y cols. (34), son necesarios más estudios de validación en pacientes con diferentes patologías y escenarios clínicos, metodológicamente sólidos, y con el poder estadístico adecuado. En esta misma revisión se observó que el criterio fenotípico que con más frecuencia permitió el diagnóstico de desnutrición fue el bajo IMC. En el grupo de los etiológicos la disminución de la ingesta o la presencia de componente inflamatorio asociado a la enfermedad llevaron al diagnóstico de manera similar. Sin embargo, únicamente un 10 % de los estudios evaluados explicaban cómo habían combinado los criterios y solo 1 de cada 4 estudios que aseguraban utilizar los criterios GLIM, realmente seguían las indicaciones expuestas en la publicación original (34) (Tabla I).
Tabla I. Aplicación diagnóstica de los criterios GLIM en la práctica clínica.

Fuente: cita 34
ECA: ensayos clínicos aleatorizados..
Pero, ¿están validados los GLIM en la DRE? En el caso del paciente hospitalizado, un estudio holandés (35) observó que la concordancia entre los criterios GLIM y la valoración global subjetiva generada por el paciente (PG-SGA) fue baja para el diagnóstico de desnutrición. Además, observó que los dos métodos no identifican a los mismos pacientes. Así, los criterios GLIM fueron capaces de predecir la mortalidad a 1 año en pacientes hospitalizados y la PG-SGA no.
En el caso concreto del paciente oncológico, se ha observado que los criterios PG-SGA y GLIM son herramientas de detección y evaluación de desnutrición precisas, sensibles y específicas en el entorno de atención ambulatoria del cáncer (36). Por otra parte, se ha determinado que los criterios GLIM, en comparación con PG-SGA y los criterios ESPEN en 2015, permiten identificar una tasa de prevalencia más alta de desnutrición, y parece ser el método óptimo para predecir complicaciones posoperatorias en pacientes con cáncer esofágico sometidos a esofagectomía (37). Ya en el paciente oncológico sometido a radioterapia también se ha confirmado la validez predictiva de los criterios GLIM en cuanto a los resultados relacionados con el tratamiento (toxicidad asociada, interrupciones, etc.) en comparación con PG-SGA, siendo una herramienta válida para diagnosticar la DRE (38). En pacientes con edad avanzada, según una amplia revisión de Cederholm y cols. (39), se concluye que los criterios y la validez predictiva de GLIM parecen ser aceptables en adultos mayores, aunque se precisan más estudios para poder extraer conclusiones definitivas, dado que solo se pudieron incluir 14 estudios y que estos presentaban algunas limitaciones metodológicas.
Un aspecto que podría limitar los resultados de la aplicación de los criterios GLIM es la posible dificultad que puede surgir a la hora de establecer los distintos criterios.
En lo que respecta a los criterios fenotípicos, aparentemente son relativamente fáciles de establecer, pero es muy importante conocer y aplicar los umbrales establecidos. Así, no sería válida cualquier pérdida de peso en cualquier periodo de tiempo. El criterio se daría como presente en caso de que la pérdida de peso fuera superior al 5 % del peso habitual en los últimos 6 meses. Del mismo modo ocurre con el bajo IMC, que cambia con la edad del paciente según esté o no por encima de los 70 años.
Para el estudio de la baja masa muscular, la publicación original de los criterios GLIM proponía valores de referencia para bioimpedancia y absorciometría dual de rayos X (DEXA), y como técnicas recomendaba también la RM y la TAC. Sin embargo, la accesibilidad a estos es limitada y, en muchos casos, no están disponibles para la práctica clínica habitual. Por otro lado, cabe señalar que los umbrales indicados en GLIM son los propuestos por el European Working Group on Sarcopenia in Older People (EWGSOP) lo que lleva a preguntarse si serían válidos para su aplicación a pacientes más jóvenes. En ausencia de estas técnicas avanzadas, se recomendaba la realización de la antropometría o de la dinamometría o fuerza de prensión de la mano como marcador subrogado de masa muscular, aunque no es lo mismo masa muscular que fuerza o capacidad funcional.
En una publicación reciente de este mismo grupo se revisa la valoración del criterio fenotípico de baja masa muscular (40). En este se recoge la siguiente información: se recomienda usar las técnicas avanzadas siempre y cuando se disponga de personal experto en su realización e interpretación clínica, así como valores de referencia para la población a estudio. En caso contrario, remiten a la exploración física y a la circunferencia de la pantorrilla aportando valores de referencia. La ecografía aparece como una técnica reconocida de medición de la masa muscular y se considera de utilidad en la monitorización. Por último, la dinamometría deja de ser recomendada como marcador alternativo de baja masa muscular y se plantea como un marcador de baja fuerza; se recomienda su realización en aquellos pacientes con baja masa muscular para la mejor caracterización de la sarcopenia.
En cuanto al empleo de la ecografía nutricional® a nivel muscular en el QRF para medir la masa muscular, es muy importante destacar la necesidad de sistematizar la técnica de medición y de disponer de niveles de normalidad y por patologías concretas para la población. A falta de estos valores, puede servir de orientación guiarse por los valores del grosor muscular y su área en los estudios publicados (24,41). Pero, sobre todo, la ecografía tiene el valor de aportar la imagen, lo que permite visualizar el estado de la masa muscular y su capacidad contráctil. Reportar en el informe de consultas otro tipo de alteraciones, como la infiltración grasa o la edematización del mismo, entraña más dificultad.
Aunque en los criterios GLIM, la grasa o sus cambios parecen no tener relevancia, sin duda, la grasa es importante para el diagnóstico nutricional. En el trabajo de Pérez Miguelsanz y cols. (42) se presenta la clasificación anatómica del tejido adiposo y se pone en valor la utilidad de las técnicas de imagen para la localización y medida de los depósitos de grasa a nivel corporal. En esta línea se enfatiza la idea de que la localización anatómica precisa puede ser de gran utilidad en tanto que algunos compartimentos muestran una asociación con procesos fisiológicos, pero también patológicos, de gran interés de cara a la valoración del estado nutricional, así como al planteamiento del tratamiento médico nutricional.
Establecer los criterios etiológicos dentro de los criterios GLIM para la DRE también entraña cierta dificultad. Y en este sentido tienen cabida algunas preguntas como: ¿se evalúa la ingesta oral de forma rutinaria a los pacientes?; ¿se tabula?; ¿se comparan los resultados de ingesta con los requerimientos calórico-proteicos estimados para establecer el porcentaje de cobertura de estos? El criterio de reducción de la ingesta precisa de una reducción de la ingesta o de la asimilación de nutrientes ≥ 50 % de los requerimientos energéticos calculados para el paciente (y no en relación con su ingesta habitual). Este criterio no debiera evaluarse de forma trivial, y para ello es necesaria la realización de una exhaustiva encuesta alimentaria. Ante esta situación, lo que se suele hacer es acogerse al otro criterio que se propone, que alude a cualquier reducción de la ingesta oral de más de dos semanas de duración, lo que no deja de ser una simplificación. Por ello, hay que reivindicar una evaluación adecuada de la ingesta oral y el cálculo de los requerimientos energético-proteicos, ya que, de no hacerlo, se termina perdiendo mucha información relevante.
También cabría plantearse si se hace rutinariamente una adecuada evaluación sobre la posible presencia de circunstancias gastrointestinales crónicas que puedan afectar a la capacidad absortiva (como los síndromes malabsortivos, intestino corto, insuficiencia pancreática, etc.).
Pero lo que en realidad resulta especialmente complejo en el establecimiento de los criterios etiológicos es lo que atañe a la inflamación relacionada con la enfermedad (aguda o crónica). La inflamación, según los criterios GLIM, se evalúa a partir de criterios clínicos (fiebre, balance nitrogenado negativo, requerimientos aumentados), se fijan diferentes escenarios (agudos, crónicos) y se plantean determinaciones de soporte como la proteína C reactiva (PCR). Todo esto abre un amplio abanico de dificultades, controversias y dudas en la práctica clínica rutinaria (43). En cualquier caso, en relación a la evaluación del componente inflamatorio, la opción más habitual es interpretar este criterio en base al valor y cambios de la determinación de PCR.
Actualmente, la inflamación y su caracterización se han ubicado en el centro del árbol diagnóstico de la desnutrición y, sin embargo, este criterio se maneja de forma dicotómica (hay o no inflamación) e incluso en ocasiones, se asume en base a la naturaleza de la enfermedad que determina o condiciona la desnutrición. Sin duda, mejorar su caracterización, así como la repercusión metabólica en función de la intensidad de la misma sería de gran utilidad para el diagnóstico, pero también para sentar las bases del tratamiento médico nutricional más adecuado.
Otro desafío diagnóstico surge de la dificultad para establecer el componente calórico, proteico o mixto de la desnutrición, especialmente teniendo en cuenta que los criterios GLIM no establecen estas categorías diagnósticas. En este sentido, es por todos conocido el reciente posicionamiento de la ASPEN sobre las proteínas viscerales, albúmina y prealbúmina, clásicamente utilizadas en la valoración del estado nutricional (44). En este posicionamiento se desaconseja usar el valor de las proteínas plasmáticas en el contexto del paciente inflamado como aproximación al pool proteico corporal o la masa corporal muscular, pues correlacionan más con el pronóstico clínico que con el estado nutricional.
Ante esta situación, para establecer ahora el componente proteico de la desnutrición, ¿qué se puede hacer?: ¿medir masa muscular?, ¿medir componente inflamatorio? (asumiendo proteólisis), ¿función muscular?, ¿baja ingesta proteica? Lo cierto es que con la ecografía se dispone de “una ventana” a la masa muscular y a la masa grasa que, unidas a la historia clínica, podrían ser de utilidad. Pero ¿cómo evaluar el componente calórico?: ¿por medio de la pérdida de peso?, ¿con la baja ingesta en relación a los requerimientos energéticos?, ¿por los pliegues cutáneos? En definitiva, la codificación de la DRE, tal y como se define actualmente, constituye un reto más en la valoración del estado nutricional.
EL RETO TERAPÉUTICO
A día de hoy, las barreras y dudas también están presentes cuando se habla del tratamiento médico nutricional (TMN), respecto al cual se agolpan las preguntas: ¿han cambiado los objetivos del TMN?, ¿ sirve el peso para evaluar la respuesta al TMN?, o por el contrario, ¿se debe buscar la normalización de las alteraciones de la composición corporal secundarias a la desnutrición?, ¿se deben asumir objetivos de control metabólico relacionados o dependientes de patologías de base?, ¿es un objetivo prioritario la reducción de las complicaciones relacionadas con la desnutrición?
También surgen cuestiones importantes sobre a la monitorización de los efectos del TMN: ¿se puede considerar un éxito terapéutico la ganancia ponderal?, ¿es un éxito terapéutico la cobertura de requerimientos calórico-proteicos?, ¿el éxito del tratamiento se basa en la disminución de las complicaciones, mortalidad, estancia hospitalaria, etc.?, ¿cuánta masa muscular tendría que recuperar el paciente?, ¿bastaría con que no cumpliese criterios de masa muscular y función muscular disminuidas?, ¿tiene interés la localización en la recuperación de grasa corporal? (Tabla II).
También la composición y/o formulación de TMN en sus diferentes modalidades genera preguntas sin resolver. De manera similar al consejo dietético, la composición nutricional del TMN para un paciente dado debería estar ligada no solo a sus requerimientos nutricionales, sino también a los objetivos y las circunstancias clínicas individuales que pudieran ser relevantes para su evolución.
Partiendo de esta premisa, ¿las fórmulas de nutrición oral/enteral deberían adaptarse a la situación metabólica que conlleva la respuesta inflamatoria? De ser así, cabe plantearse si se debería contemplar que el perfil de carbohidratos fuera de bajo índice glucémico, por la insulinorresistencia que se genera el contexto de la respuesta inflamatoria. Y en la misma línea, perfiles de grasas con acción más antiinflamatoria, perfiles proteicos muy alineados con la recuperación de la masa muscular perdida o reforzar el aporte de micronutrientes con un papel relevante en el estrés oxidativo (Fig. 5).
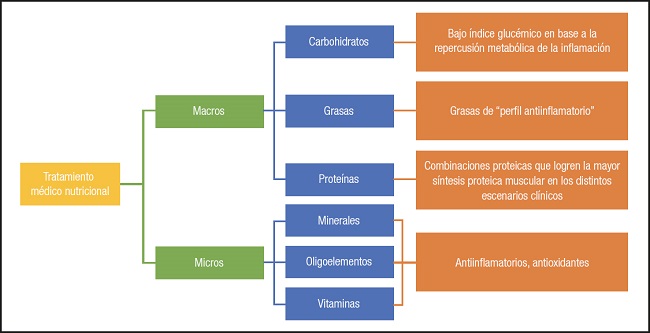
Figura 5. Reto en el tratamiento médico nutricional: ¿se deben buscar perfiles de macro y micronutrientes específicos para el tratamiento de la desnutrición relacionada con la enfermedad y componente inflamatorio?.
Por último, cabe preguntarse si a la hora de instaurar el tratamiento médico nutricional se debería tener en cuenta no solo la cantidad de grasa corporal total sino también su localización y su significado clínico. Porque, aunque en los criterios GLIM el tejido adiposo y sus cambios parecen no tener relevancia, es fundamental tenerlo en cuenta en la toma de decisiones en relación al TMN, así como en la monitorización y consecución de objetivos.
PUNTOS CLAVE
- La DRE constituye un verdadero desafío en el día a día de las unidades de nutrición clínica y dietética.
- Los criterios GLIM surgen del interés común por facilitar el diagnóstico de la desnutrición, pero su aplicación debería ceñirse a la metodología recogida en la publicación original.
- La evaluación de la baja masa muscular es, dentro de los criterios fenotípicos, probablemente el más complejo de determinar. Las nuevas guías establecen la utilidad de las técnicas siempre y cuando se disponga de ellas, de personal cualificado y de valores de normalidad.
- Para establecer los criterios etiológicos se necesita evaluar tanto la ingesta oral y el cálculo de requerimientos, como caracterizar mejor el componente inflamatorio y su repercusión metabólica.
- La clasificación de la DRE ha cambiado tras la publicación de los criterios GLIM, pero su caracterización (calórica, proteica o mixta) es útil para el tratamiento y la codificación mientras se sigan empleando la Clasificación Internacional de Enfermedades, 10.ª edición (CIE-10).
- Los objetivos del TMN en los grandes metaanálisis y revisiones hasta ahora estaban más centrados en la ganancia de peso, la disminución de las complicaciones y los costes. En estos momentos se necesitan más estudios que evalúen la normalización de los cambios en la composición corporal y su relación con la morbimortalidad y costes sanitarios.
- Hay comercializadas numerosas alternativas para el TMN de la DRE; quizás, se precisen más ensayos clínicos para conocer sus efectos específicos sobre los cambios en la composición corporal, la inflamación o la capacidad funcional en los diferentes escenarios clínicos.