Caso clínico 2
Interconsulta a la Unidad de Nutrición: paciente varón de 58 años con cirrosis hepática (Child-Pugh C). Ingresa por descompensación hidrópica. Datos de encefalopatía grado I. Índice de masa corporal > 34 kg/m2. Solicitamos valoración nutricional y tratamiento si precisa.
INTRODUCCIÓN
La desnutrición es una de las complicaciones más importantes de los pacientes con cirrosis. Su prevalencia depende de la población evaluada y de la herramienta utilizada para el diagnóstico, con tasas que oscilan desde el 13 al 100 %. La edad avanzada, la evolución de la enfermedad hepática, la etiología alcohólica y la hospitalización son los principales factores de riesgo para el desarrollo de desnutrición en pacientes con cirrosis; en el caso de la hospitalización, se estima que multiplica por cuatro este riesgo.
CAUSAS Y CONSECUENCIAS
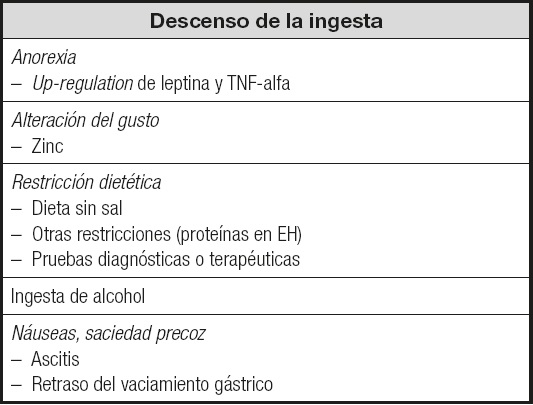
Las causas más importantes de desnutrición en los pacientes con cirrosis hepática son la disminución de la ingesta, la malabsorción y las alteraciones metabólicas propias de la enfermedad o bien originadas por el tratamiento que precisa. La disminución de la ingesta es uno de los factores más importantes, debido sobre todo a la presencia de anorexia (up-regulation de leptina y factor de necrosis tumoral alfa, TNF-alfa); también puede deberse a otros factores, como la alteración del gusto (a veces favorecida por la deficiencia de zinc), la restricción dietética (dieta sin sal, otras restricciones o por determinadas pruebas diagnósticas o terapéuticas), por la ingesta de alcohol o por la presencia de náuseas y/o saciedad precoz (por ascitis, retraso del vaciamiento gástrico, etc.).
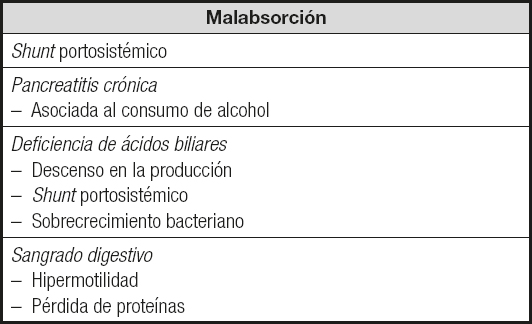
La malabsorción es otra de las causas implicadas en la aparición de desnutrición en el paciente cirrótico. A ello pueden contribuir, entre otros factores, el shunt portosistémico, la pancreatitis crónica (asociada al consumo de alcohol), la deficiencia de ácidos biliares (descenso en la producción, shunt portosistémico), el sobrecrecimiento bacteriano y el sangrado digestivo (hipermotilidad, pérdida de proteínas) (Tabla I).
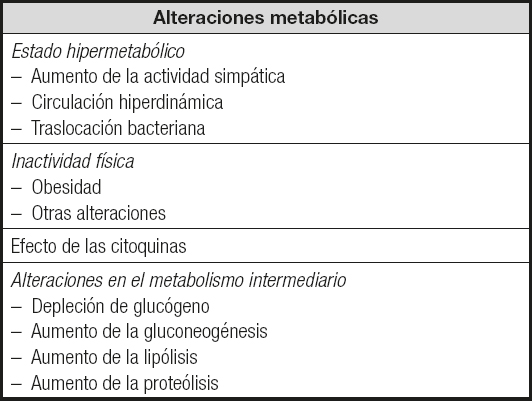
Las alteraciones metabólicas propias de la cirrosis también están implicadas en el desarrollo de desnutrición. Esto puede deberse, entre otros factores, al estado hipermetabólico (aumento de la actividad simpática, circulación hiperdinámica, traslocación bacteriana), la inactividad física (obesidad, otras alteraciones), el efecto de las citoquinas y/o alteraciones en el metabolismo intermediario (depleción de glucógeno, aumento de la gluconeogénesis, de la lipólisis, de la proteólisis, del gasto energético) (Tabla II).
La disminución de la ingesta es una de las causas más importantes de desnutrición en las personas cirrosis y con frecuencia no alcanzan las recomendaciones nutricionales que se definen para esta patología, independientemente del estadio de evolución de la enfermedad. El estudio de Sharma y cols. (1) observa desnutrición en el 65 % de los pacientes con cirrosis evaluados, con una ingesta total de calorías y proteínas significativamente baja en comparación con la recomendación, incluso en pacientes con enfermedad menos evolucionada (Child A). Los síntomas digestivos, las ideas erróneas sobre la dieta y el bajo contenido de sodio fueron factores clave que afectaron la ingesta dietética en pacientes con cirrosis y desnutrición (Tabla III).
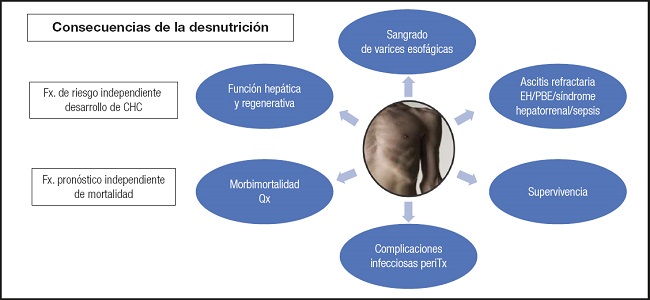
La enfermedad hepática es un factor pronóstico independiente de mortalidad y de desarrollo de hepatocarcinoma. Esto se agudiza con la presencia de desnutrición que, además, favorece mayores complicaciones asociadas con la cirrosis: altera la función hepática y regenerativa, aumenta el sangrado de varices esofágicas, favorece la ascitis refractaria y la encefalopatía, empeora la supervivencia, eleva las complicaciones infecciosas peritrasplante y aumenta la morbimortalidad quirúrgica (2-3-4) (Fig. 1).
SARCOPENIA
En este contexto, también es fundamental subrayar la importante vinculación que se establece entre sarcopenia y desnutrición. La sarcopenia se caracteriza por una acusada reducción tanto de la masa como de la función muscular. Los principales factores que conducen a la sarcopenia son la pérdida de masa muscular relacionada con la edad, el efecto de la enfermedad, la inactividad y la desnutrición.
En el caso de la cirrosis, la sarcopenia está favorecida por factores propios de la enfermedad hepática. Son muchos los factores que contribuyen a la sarcopenia en la cirrosis (5). Entre ellos destacan las complicaciones de la hipertensión portal, las citoquinas proinflamatorias, la hiperamonemia, los diuréticos de asa, el descenso de los niveles de testosterona, la inactividad física, la gluconeogénesis hepática elevada, la señalización alterada de insulina/factor de crecimiento similar a la insulina 1 (IGF-1) y la cirrosis alcohólica. Varias vías de señalización, incluida la degradación de ubiquitina-proteosoma, la activación de la miostatina, la función mitocondrial alterada, la señalización de factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NFκB), la inhibición de la diana de rapamicina en células de mamífero (mTOR, por sus siglas en inglés mammalian Target of Rapamycin), la apoptosis y la fosforilación elevada de eIF2 (factor de iniciación eucariota 2) están involucradas con la sarcopenia en la cirrosis (Fig. 2).
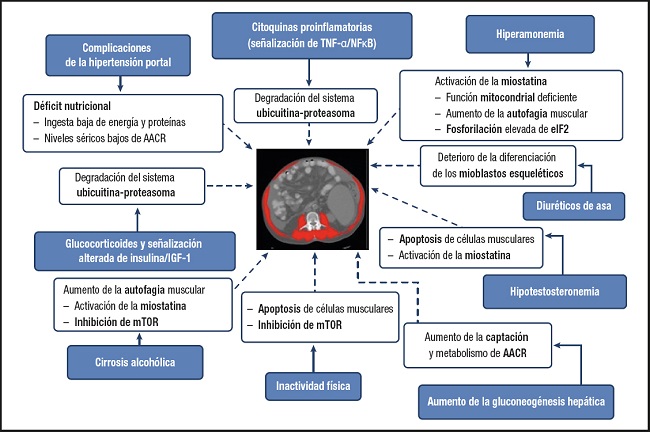
Fuente: cita 5.
Figura 2. Resumen de los principales factores y vías que se asocian con la sarcopenia en la cirrosis (AACR: aminoácidos de cadena ramificada; IGF-1: factor de crecimiento similar a la insulina 1; mTOR: diana de rapamicina en células de mamífero; TNF-alpha: factor de necrosis tumoral alfa; NFκB: cadenas ligeras kappa de las células B activadas; eIF2: factor de iniciación eucariota 2).
La sarcopenia es un trastorno muy prevalente en los pacientes con cirrosis (40-70 %) y que se asocia generalmente con un aumento del riesgo de mortalidad y de complicaciones, como la ascitis, la encefalopatía hepática (EH) o las infecciones. La obesidad sarcopénica, presente en el paciente que nos ocupa, condiciona un peor pronóstico (6).
VALORACIÓN DEL ESTADO NUTRICIONAL
CRIBADO NUTRICIONAL
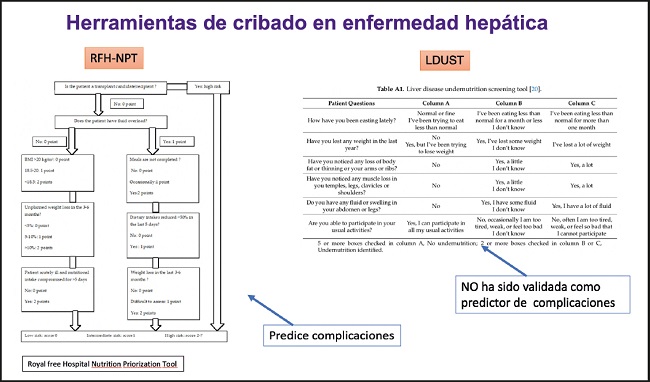
Partiendo de estas consideraciones, y teniendo como referente el caso clínico expuesto, se aconseja realizar una valoración nutricional en todos los pacientes con cirrosis como parte de la evaluación clínica que debería iniciarse con un cribado nutricional. Existen actualmente algunas herramientas específicas para los casos de enfermedad hepática, como la Royal Free Hospital Nutrition Priorization Tool (RFH-NPT) (7), que predice complicaciones, o la Liver Disease Undernutrition Screening Tool (LDUST) (8), que aún no ha sido validada como predictor de complicaciones (Fig. 3).
En el estudio KIRRHOS (9) se concluye que la valoración subjetiva global (SGA) predice de manera adecuada la mortalidad, mucho mejor que cualquier otra herramienta general de cribado, como el NRS-2002 (Nutritional Risk Screening); sin embargo, las herramientas de cribado específicas para cirrosis (RFH-NPT, LDUST) ofrecen mejores resultados que el SGA, en cuanto a sensibilidad y especificidad. Y, además, se ha confirmado que RFH-NPT es mejor que NRS-2002 en cuanto a la predicción de la supervivencia en los pacientes con cirrosis (10).
La herramienta de cribado Mini Nutritional Assessment-Short Form (MNA-SF) también ha demostrado ser útil en estos pacientes. La sensibilidad y especificidad es mayor que la que presentan las herramientas diseñadas específicamente para pacientes con cirrosis (11).
EVALUACIÓN NUTRICIONAL Y DE LA SARCOPENIA
En el momento actual disponemos de muy pocos estudios que hayan evaluado la prevalencia de desnutrición en los pacientes con cirrosis empleando los criterios Global Leadership Initiative on Malnutrition (GLIM), que requiere que el paciente presente al menos un criterio etiológico (descenso de la ingesta, malabsorción o enfermedad que aumente los requerimientos) y un criterio fenotípico (descenso de peso, índice de masa corporal –IMC– bajo o descenso en la masa muscular).
Para evaluar la sarcopenia existen actualmente varias guías europeas y asiáticas de referencia que recientemente han difundido recomendaciones específicas (12,13). En el caso concreto de la obesidad sarcopénica se aconseja hacer un cribado, establecer un diagnóstico y evaluar la gravedad de la situación. Por lo tanto, la evaluación clínica debe comenzar con la detección, utilizando el IMC y la circunferencia de la cintura, y parámetros sustitutos de la sarcopenia, como síntomas clínicos o cuestionarios en pacientes ancianos. Si ambos están presentes, el diagnóstico se realizará en dos pasos: la evaluación de los parámetros funcionales del músculo esquelético alterados, y si están alterados, la evaluación de la composición corporal, por absorciometría de rayos X de energía dual (DEXA) o, en su defecto, por impedancia bioeléctrica (BIA). En los pacientes con obesidad, se aconseja que los parámetros de composición corporal se ajusten al peso corporal. Y, finalmente, es necesario evaluar la presencia de complicaciones, tales como trastornos metabólicos, discapacidades funcionales, enfermedades respiratorias, etc., que pueden influir de manera directa en los parámetros que se evalúan para valorar el estado nutricional.
La evaluación del estado nutricional se basa en herramientas y recursos clásicos, como la historia clínica (donde se deben también tener en cuenta las alteraciones en el estado funcional y en los requerimientos, la utilización de suplementos nutricionales o la historia social), la exploración física, la antropometría, las técnicas de composición corporal, las determinaciones analíticas y el análisis de micronutrientes, y los estudios de capacidad funcional (dinamometría de mano, up&go, 5 min test). En el caso concreto del paciente con cirrosis, resulta también de interés evaluar otros aspectos como el efecto de la ascitis y la paracentesis, los tratamientos (interacción fármaco-nutriente), las alteraciones metabólicas (como la diabetes) y las alteraciones hormonales (como el hipercortisolismo o el hipogonadismo).
Las herramientas para la evaluación del estado nutricional que se emplean con más frecuencia en los pacientes con cirrosis son la SGA, la dinamometría de mano, la impedancia bioeléctrica, la tomografía computarizada (TC) y la ecografía nutricional.
La SGA es una herramienta asequible que tiene una gran utilidad en la evaluación nutricional del paciente con cirrosis, pero requiere experiencia. Es un buen predictor de complicaciones y mortalidad, y permite identificar problemas específicos. El valor predictivo de mortalidad y complicaciones es menor que en el caso de la dinamometría de mano o la evaluación de la sarcopenia por TC (14,15).
La dinamometría de mano (fuerza prensil) es un predictor de mortalidad en cirrosis, con un punto de corte de 30 kg en varones (16). Sin embargo, y haciendo referencia al caso clínico que nos ocupa, esta técnica se debería llevar a cabo cuando el paciente tenga estabilidad clínica, y no presente hipotensión, fiebre o trastornos hidroelectrolíticos.
La antropometría puede resultar de utilidad, especialmente si no se dispone de otras herramientas para evaluar la composición corporal. Se ha demostrado que la circunferencia media muscular del brazo es un predictor de mortalidad en las personas con cirrosis (17). Y también se ha confirmado que la circunferencia media del brazo (CMB) y la pantorrilla (CP) parecen útiles como marcadores simples para la detección de sarcopenia (diagnosticada mediante TC) en pacientes con enfermedad hepática crónica (18). Los puntos de corte utilizados en este estudio son CMB: 25/23 cm y CP: 33/32 cm, en varones y mujeres respectivamente. En una amplia cohorte de pacientes también se ha observado cómo la fuerza de prensión (punto de corte de 26/18 kg en varones y mujeres) combinada con la medición de la circunferencia de la pantorrilla es un factor pronóstico de mortalidad en pacientes con cirrosis (19). En este estudio se definió un punto de corte de CP predictor de mortalidad de 34,6 cm en varones y 32,8 cm en mujeres.
Actualmente hay numerosas técnicas para analizar la composición corporal, aunque la DEXA es considerada como el método de referencia. Diferentes técnicas, e incluso diferentes dispositivos, pueden ofrecer resultados bastante variables, especialmente en el caso de la bioimpedancia. Es fundamental que los puntos de corte y los criterios de diagnóstico se validen por sexo, edad y etnia.
El ángulo de fase, obtenido por medio de análisis de impedancia bioeléctrica, predice de forma independiente la mortalidad en pacientes con cirrosis. Se ha definido un punto de corte 4,9° que duplica el riesgo de mortalidad (20).
Por su parte, la ecografía nutricional aporta algunas ventajas destacadas: se puede realizar a pie de cama y permite evaluar la evolución del paciente. Actualmente, se cuenta con pocos estudios en cirrosis, y está pendiente de validación y de definir su valor pronóstico (21,22).
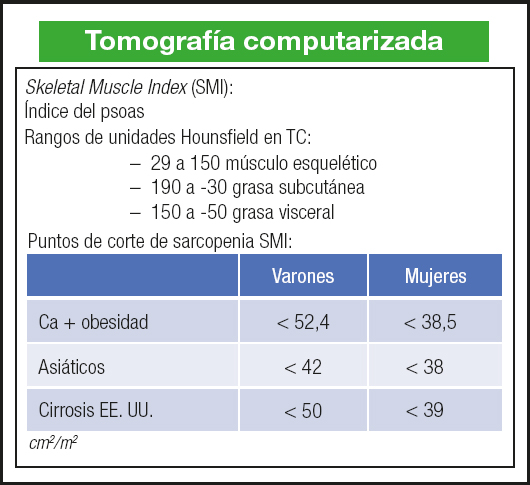
La TC también aporta una información muy relevante. El índice muscular esquelético (Skeletal Muscle Index, SMI) y el índice del psoas son unos indicadores de la masa muscular global, ajustada a la talla, y tienen un valor pronóstico en el paciente con cirrosis (23,24). Las guías de la ESPEN (European Society for Clinical Nutrition and Metabolism) aconsejan emplear esta técnica en el diagnóstico de la sarcopenia en estos pacientes. En el caso de la cirrosis se recomienda un punto de corte como predictor de mortalidad de 50 y 39 cm2/m2 en varones y mujeres respectivamente (25) (Fig. 4).
CÁLCULO DE LOS REQUERIMIENTOS
En las guías ESPEN de nutrición clínica en enfermedad hepática se establecen orientaciones y recomendaciones específicas en el abordaje de la desnutrición en pacientes con cirrosis hepática (26).
En los pacientes con cirrosis se ha descrito tanto hiper- como hipometabolismo (27). Dadas las dificultades para estimar los requerimientos energéticos, puede ser útil realizar una calorimetría indirecta, aunque esta técnica, en general, no está disponible. Se recomienda un aporte calórico de 30-35 kcal/kg/día. En pacientes con cirrosis y obesidad, la pérdida de peso en situación de estabilidad tiene efectos beneficiosos, especialmente sobre la hipertensión portal. Se recomienda en estos casos un aporte de 20-25 kcal/kg de peso ideal.
Las recomendaciones de proteínas dependen del estado nutricional: en pacientes sin desnutrición se aconsejan 1,2 g/kg/día, en pacientes desnutridos 1,5 g/kg/día, y en casos de obesidad y sarcopenia que requieren tratamiento médico nutricional se recomiendan hasta 2-2,5 g/kg de peso ideal/día (26). Para estimar el peso, se pueden emplear herramientas sencillas, útiles y accesibles (28). En el caso concreto del caso clínico seleccionado, lo adecuawdo sería emplear el “peso seco” (29) para el cálculo calórico y el peso ideal para el cálculo proteico.
Las deficiencias de micronutrientes son frecuentes en los pacientes con cirrosis (Tabla IV); se recomienda evaluar el estado nutricional y suplementar en caso necesario.
Tabla IV. Micronutrientes en la cirrosis hepática.
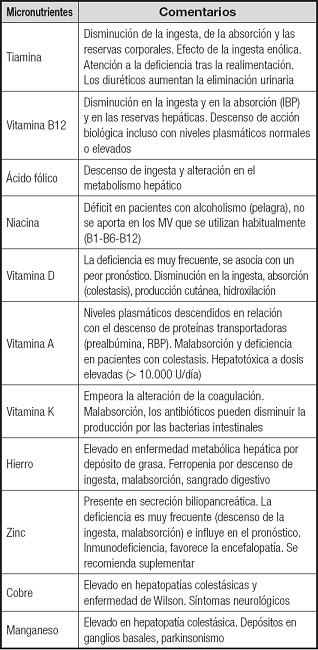
IBP: inhibidores de la bomba de protones. MV: multivitamínicos; RBP: proteína de unión al retinol.
De acuerdo con las recomendaciones actuales, no es necesario hacer restricción de proteínas en la EH. En cuanto a la utilización de aminoácidos de cadena ramificada (AACR), clásicamente se indican para pacientes con “intolerancia” a las proteínas, es decir, en aquellos pacientes que no pueden alcanzar los requerimientos proteicos por el riesgo de desarrollar encefalopatía.
Estudios recientes han observado que la utilización de AACR presenta beneficios en los pacientes con cirrosis; pueden mejorar la sarcopenia, el riesgo de hepatocarcinoma y de complicaciones en pacientes con Child A (30,31). Se debe considerar la utilización de manera crónica (0,25 g/kg/día) para mejorar la calidad de vida y disminuir las complicaciones.
CONCLUSIONES
En definitiva, la evaluación nutricional de los pacientes con cirrosis hepática debe ser muy detallada, atendiendo a aspectos tales como: la valoración clínica (que debe ser el primer paso en la evaluación nutricional), la evaluación de la ingesta, el peso y el IMC, la fuerza muscular, la composición corporal, la evaluación funcional, la evaluación metabólica y de los micronutrientes (Fig. 5).
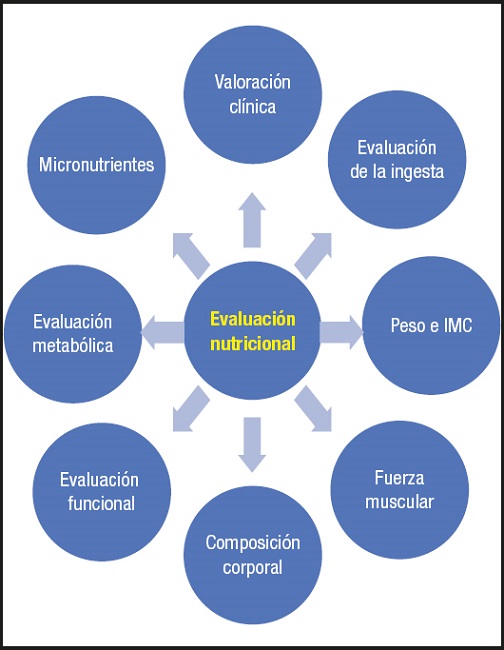
Figura 5. Aspectos básicos a considerar en la evaluación nutricional del paciente con cirrosis (IMC: índice de masa corporal).
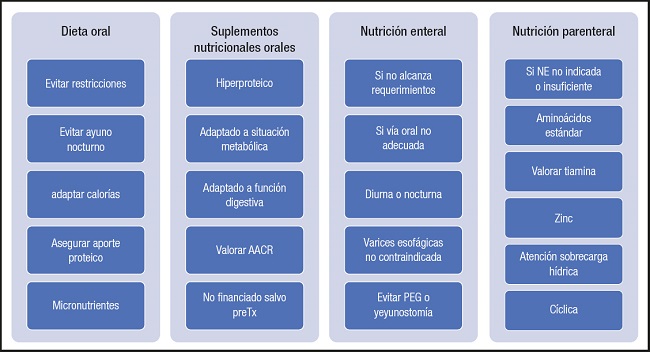
Una vez realizada esta labor, se deberá determinar el mejor tratamiento nutricional a seguir en cada caso, valorando la indicación de la dieta oral, los suplementos nutricionales orales, la nutrición enteral y la nutrición parenteral (Fig. 6).