INTRODUCCIÓN
En el paciente seleccionado (varón de 58 años con cirrosis hepática –Child-Pugh C–, que ingresa por descompensación hidrópica, con datos de encefalopatía grado I, e IMC > 34 kg/m2) llaman la atención dos aspectos clínicos importantes: presenta un Child-Pugh C, lo que se asocia con una supervivencia al cabo de un año del 45 % (del 25 % al cabo de 2 años) y, además, tiene una EH grado I, lo que sumado al Child-Pugh C es un predictor del desarrollo de más episodios de EH (aumentando considerablemente el riesgo de mortalidad).
Junto a ello, y a la hora de establecer la dietoterapia a seguir, se debe asumir también que es difícil la valoración nutricional en este contexto y que trasladar las recomendaciones dietéticas a la práctica diaria con el paciente con cirrosis avanzada puede resultar complicado.
PAPEL DE LA DIETOTERAPIA
Según la define la Real Academia Española (RAE), la dietoterapia es el tratamiento basado en la utilización de la dieta alimentaria para la regulación del organismo de una persona o de un animal. En una definición más “casera” se puede considerar como la disciplina que estudia el arte de combinar los alimentos y las recomendaciones dietéticas, según las situaciones fisiológicas y patológicas de cada persona, atendiendo a necesidades socioeconómicas, culturales, ideológicas, religiosas y medioambientales.
La dietoterapia se sitúa al final del algoritmo de acciones y decisiones que se deben adoptar para abordar la desnutrición. Tras el correspondiente cribado y valoración nutricional, se establece un plan nutricional y dietético completo y personalizado, donde se incorpora la dietoterapia (Fig. 7).

Figura 7. Cribado nutricional, valoración nutricional y dietética: pasos a seguir (DX: diagnóstico).
En la enfermedad hepática avanzada la dietoterapia tiene un papel importante, y es que con un adecuado consejo dietético es posible: disminuir los episodios de ascitis y edemas; reducir la frecuencia o prevenir la aparición de EH; mejorar la calidad de vida, los hábitos dietéticos y el estado nutricional de forma global; y mejorar la capacidad funcional. En cambio, no es posible revertir la enfermedad en fase avanzada por medio de la dietoterapia, aunque se sabe que en fase compensada los malos hábitos dietéticos pueden tener implicaciones negativas, lo que abre una ventana de oportunidad en esos estadios de la enfermedad.
OPTIMIZACIÓN DE LA DIETA HOSPITALARIA
Una de las controversias que se plantean en relación con la dietoterapia radica en las dificultades que suelen existir actualmente en los hospitales para optimizar la dieta de los pacientes. Sin duda, es un reto difícil, pero no imposible.
Para tratar de alcanzar este objetivo se dispone de algunas herramientas útiles, como intervenir en las dietas hospitalarias que se establecen en cada centro hospitalario y mantener una buena relación y comunicación con la hostelería/cocina de cada hospital. En el Hospital Universitari Vall d'Hebron hay aproximadamente 120 dietas, con distintas versiones (con o sin sal). En las guías ESPEN de nutrición hospitalaria se identifica el perfil de dietas que debe estar disponible en los centros hospitalarios y sus indicaciones (32).
Hay muchos factores individuales que van a dificultar la optimización de la dieta en cada paciente dentro de un entorno hospitalario. Se deben tener en cuenta muchos aspectos esenciales que pueden suponer limitaciones u obstáculos como: la orexia, los síntomas del paciente (saciedad precoz, estreñimiento, náuseas…), el estado de ánimo y entorno familiar, los gustos y preferencias, la disponibilidad, calidad y variedad de dietas terapéuticas hospitalarias (que dependen mucho de los recursos de cada centro), la presentación y palatabilidad de las comidas, los hábitos previos en domicilio, las posibilidades de adaptación o personalización de cada centro, etc.
A pesar de todo, siempre que sea posible, se debe intentar optimizar o personalizar la dieta hospitalaria. Para ello, se aconseja:
- Conocer la composición cuantitativa y cualitativa de nuestras dietas hospitalarias.
- Estimar/medir los requerimientos nutricionales de cada paciente y tener claros cuáles serán los objetivos dietéticos en cada caso. Asumiendo esto, se indicará la dieta hospitalaria que creamos más adecuada (¿baja en grasa?, ¿rica en fibra?, ¿sin sal?, ¿hipocalórica?, ¿hiperproteica?, etc.). Y una vez instaurada, resulta indispensable valorar la ingesta, admitiendo que: será difícil llegar a cubrir el 100 % de los requerimientos con dieta hospitalaria sin modificaciones dietéticas.
- Personalizar/optimizar la dieta hospitalaria; si solo se llega a cubrir un 50-75 % de los requerimientos, habrá que añadir soporte nutricional oral (fórmula o módulo), y si se cubre < 50 %, se deberá plantear un abordaje mediante sonda si la vía digestiva está viable.
ADAPTACIÓN DE LA TEXTURA DE LA DIETA
Dada la presencia de EH grado I en el caso clínico seleccionado, surge la controversia de si será o no necesario adaptar la textura de la dieta en este tipo de situaciones.
Habitualmente, la EH se asocia con una serie de síntomas característicos, como alteraciones leves del estado de consciencia y sueño, cambios de personalidad (euforia, depresión), falta de concentración, problemas de capacidad de cálculo, apraxia, y discurso alterado y confusión ligera (33). En base a esto, y teniendo en cuenta el caso clínico, se debe tener en cuenta lo siguiente: si los reflejos de la tos y la deglución están intactos, existe actualmente la opinión consensuada de que se puede alimentar por vía oral en estos casos; no hay riesgo de seguridad ni eficacia de la deglución en la EH grado I; se debe adaptar la textura solo cuando haya problemas en las piezas dentales, por fatiga en la ingesta o por preferencia del paciente (fácil masticación, fácil propulsión, triturada); en caso de duda o de que haya algún síntoma de alerta, se puede realizar un test de cribado (EAT-10, Eating Assessment Tool-10). Por lo tanto, en el caso clínico evaluado, no se aconseja, a priori, una adaptación específica de la textura de la dieta.
CARACTERÍSTICAS DE LA DIETA
Otra controversia que surge a raíz de este caso clínico guarda relación con las características de la dieta y, en concreto, sobre el aporte de calorías, de proteínas y de sodio.
En lo que respecta al aporte calorías, durante el ingreso no está indicada una dieta hipocalórica. Se deben evitar largos periodos de ayuno. Las calorías calculadas se deben distribuir de forma fraccionada en 5-6 ingestas diarias (34). Se aconseja instaurar un snack nocturno para evitar el uso de proteínas como fuente energética (35).
Sobre este último aspecto, se sabe que el patrón metabólico del ayuno nocturno en el paciente cirrótico es similar al patrón metabólico del individuo sano tras 3 días de ayuno (utilizándose grasa y proteínas como fuente de energía, promoviendo un peor estado nutricional y la pérdida de masa muscular) (36). Por lo tanto, en el caso clínico propuesto sería necesario incorporar este snack nocturno, ya que induciría efectos positivos a nivel metabólico y sobre su calidad de vida. En un reciente metaanálisis (37) se estima que las características del snack nocturno son: rango calórico: 200-310 kcal; 13-15 g de proteínas; carbohidratos 30-40 g (Fig. 8).

Fuente: cita 37.
Figura 8. Beneficios y características del snack nocturno (CHO: carbohidratos; ESPEN: European Society for Clinical Nutrition and Metabolism; EASL: European Association for the Study of the Liver).
En cuanto al aporte proteico en el caso clínico evaluado, se recomienda no hacer restricción proteica. Diferentes estudios y consensos (38,39) concluyen que deben evitarse las restricciones proteicas en pacientes con cirrosis hepática (compensados, descompensados, obesos cirróticos descompensados sarcopénicos). También se ha demostrado que pacientes con EH aguda y recurrente toleran bien dietas normoproteicas y no hay efecto beneficioso de aportes bajos en proteínas: no mejoran el curso de la EH ni la previenen y, además, tienen efectos negativos a nivel nutricional.
Sobre la decisión de emplear o no aminoácidos ramificados (AACR) en este caso clínico, es preciso señalar que en pacientes cirróticos avanzados la proporción de (AACR) es menor a la de aromáticos (AAA), a diferencia de lo que sucede en el individuo sano. Por lo tanto, se debe promover la aportación de AACR en los cirróticos avanzados (sobre todo en los descompensados con EH); se aconseja su suplementación en forma de módulos, con fórmulas completas enriquecidas en (AACR) y mediante consejo dietético. Esto se asocia con una mejor calidad de vida del paciente, además de procurar efectos beneficiosos sobre la capacidad cognitiva y la sarcopenia.
¿Y qué fuente proteica dietética emplear: animal o vegetal? Disponemos de muchos estudios que concluyen que los pacientes cirróticos avanzados toleran mejor la proteína de origen vegetal y láctea que la de origen animal (pescado y carne), algo que se ha observado específicamente en los pacientes con EH recurrente. Sin embargo, solo con proteína vegetal es difícil llegar a cubrir los requerimientos de este tipo de pacientes. El consejo actual es que en personas que han padecido episodios de EH o con EH recurrente, la proteína de origen vegetal y láctea debería estar presente de forma habitual dentro de su dieta, por sus efectos beneficiosos. Con todo, en el caso clínico expuesto no está contraindicado el consumo de pollo, o ternera o tortilla, asumiendo que es difícil cubrir requerimientos solo con proteína de origen vegetal; eso sí, la fuente proteica deberá ser variada, con una especial presencia de legumbres, cereales integrales, lácteos y derivados (Fig. 9).
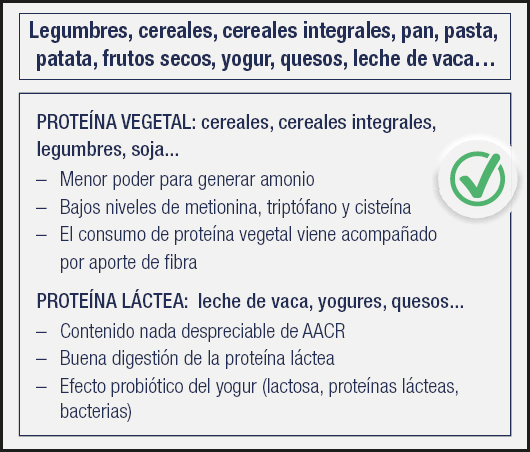
Fuente: cita 39.
Figura 9. Efectos beneficios de las proteínas de origen vegetal y lácteo (AACR: aminoácidos ramificados).
¿SAL O NO?
El aporte de sodio en pacientes con cirrosis es un asunto de especial controversia y lograr un balance de aporte de sal a lo largo de las diferentes etapas de la cirrosis es fundamental (40).
La clasificación de las dietas hiposódicas distingue tres tipos:
- Hiposódica amplia (900-2000 mg de sodio).
- Hiposódica moderada (500-900 mg de sodio).
- Hiposódica estricta (no sobrepasar los 500 mg de sodio).
En el caso clínico (paciente cirrótico obeso avanzado, descompensado, con ascitis + EH grado I, Child-Pugh C), la decisión de restringir o liberalizar la sal de la dieta depende de su estado nutricional y de su pronóstico a corto-medio plazo. Además, debe considerarse que una de las indicaciones de una dieta hiposódica es en el tratamiento de la ascitis y los edemas en las cirrosis hepáticas avanzadas (Fig. 10).

Figura 10. Ventajas e inconvenientes de dietas hiposódicas y de la liberalización de la ingesta de sal en la dieta (Na: sodio; EH: encefalopatía hepática).
Las guías en enfermedad hepática más actuales siguen indicando el control de la sal como uno de pilares del tratamiento en la ascitis de los pacientes cirróticos avanzados, pero no especifican el consumo de sodio recomendado. En cualquier caso, subrayan las implicaciones negativas de las restricciones de sal sobre el estado nutricional. No se recomienda una restricción de sal por debajo de los 5 g (2 000 mg de sodio) (40,41).
En definitiva, en nuestro paciente, la restricción dependerá de varios factores:
- La valoración nutricional.
- La entrevista dietética para saber el consumo habitual de sodio: valorar la calidad de vida del paciente global y en relación con la alimentación, y valorar orexia y su relación con la sal y la ingesta de alimentos.
- Comentar con el equipo médico evolución a corto-medio plazo.
- Valorar conjuntamente si durante el ingreso la descompensación hidrópica debe tratarse con restricción de sodio temporal.
- En caso de instaurar dieta hiposódica estricta, valorar la ingesta en pocos días y replantearse el aporte de sodio.
- Con toda la información, valorar modificaciones en el aporte de sodio de cara a domicilio.
- No menos de 5 g sal (2 000 mg de sodio/día).
REFLEXIONES FINALES
A modo de conclusiones, y teniendo en consideración el caso clínico expuesto, destacar que:
- La dietoterapia forma parte importante del tratamiento en el paciente con cirrosis.
- Debemos optimizar la dieta hospitalaria en función de las necesidades de nuestro paciente: situación clínica, preferencias y aversiones.
- En el paciente con obesidad, valorar cambios en estilo de vida y aspectos dietéticos globales si sus hábitos son mejorables (pensando en domicilio). Durante el ingreso no está indicada una dieta hipocalórica.
- El aporte calórico estimado debe repartirse en 5-6 ingestas, evitando largos periodos de ayuno.
- Recomendar un snack nocturno de unas 250-300 kcal, aunque en el hospital será complicado.
- No hacer restricción proteica.
- Asegurar una fuente proteica variada, con presencia de proteína de origen vegetal (menor poder de generar amonio, fuente de fibra) y presencia de proteína de alto valor biológico (carnes, pescados, huevos y lácteos).
- Las restricciones de sal pueden impactar de forma negativa en el estado nutricional.
- Debe individualizarse cada caso en función de estado nutricional de base, la ingesta de sodio habitual, la relación del paciente con la sal, la calidad de vida y la evolución a corto-medio plazo.
- Es razonable no bajar de 5 g de sal/día (2 000 mg de sodio).
- Si con la dietoterapia no es suficiente para cubrir requerimientos nutricionales, se debe contemplar el apoyo con nutrición artificial.
- Debe evitarse que pacientes con cirrosis compensada lleguen a un estado de obesidad.














