Caso clínico 3
Mujer de 64 años con enfermedad renal crónica avanzada (ERCA) 3b (filtrado glomerular basal 35 ml/min). Ingresa por sepsis urinaria. Fracaso multiorgánico con traslado a la Unidad de Cuidados Intensivos (UCI), donde está requiriendo tratamiento sustitutivo renal.
INTRODUCCIÓN
En nuestra práctica habitual, cuando nos enfrentamos a un paciente crítico, el primer paso para pautar la nutrición es reconocer en qué escenario nos encontramos. Ante un paciente renal crónico agudizado (como puede considerarse al caso clínico seleccionado), el objetivo de la nutrición debe ser mantener el estado nutricional, disminuir la toxicidad urémica y retardar la necesidad de técnicas de diálisis. En el caso de tratarse de un paciente que ya ha entrado en programa de diálisis, el objetivo será doble: mejorar la síntesis de proteínas viscerales y optimizar la inmunocompetencia. Finalmente, en el paciente renal crítico se deben cubrir los requerimientos aumentados, prevenir la pérdida de masa magra, estimular la cicatrización y optimizar la inmunocompetencia. En definitiva, el sello metabólico del paciente con afectación renal es el catabolismo de las proteínas y el objetivo final en todos estos escenarios clínicos es optimizar la nutrición para mejorar la calidad de vida del paciente.
En las guías de la European Society for Clinical Nutrition and Metabolism (ESPEN) (1) se señala que la nutrición enteral (NE), la nutrición parenteral (NP), o la combinación de ambas, se deben administrar a pacientes hospitalizados en estado crítico y no crítico con lesión renal aguda (LRA)/enfermedad renal aguda (ERA), enfermedad renal crónica (ERC), y en ERC con terapia de reemplazo renal (TRR), que no pueden alcanzar al menos el 70 % de los requerimientos de macronutrientes con nutrición oral, con un grado de recomendación A y un fuerte consenso (95,7 % de acuerdo). En cualquier caso, es fundamental establecer una nutrición ajustada al estado del paciente y a la fase de evolución de la enfermedad crítica, considerando la situación renal.
ALTERACIONES METABÓLICAS
Varios factores, como la enfermedad crítica prolongada, las comorbilidades crónicas y el desgaste proteico-energético asociado al hospital, predisponen a la desnutrición. Si le sumamos el retraso en el inicio de la nutrición y/o el apoyo nutricional insuficiente, combinado con la alta tasa de catabolismo, la LRA lo agrava aún más. En caso de LRA/ERA crítica existen una serie de alteraciones metabólicas características, como el elevado catabolismo de las proteínas y una síntesis proteica insuficiente, con la consecuente disminución de las reservas, una alteración del metabolismo de los aminoácidos (AA) específicos, el agotamiento de los sistemas antioxidantes, la inducción de un estado proinflamatorio y una competencia inmunológica alterada (2). Además, como otras alteraciones metabólicas asociadas, suele presentarse hiperglicemia por resistencia periférica a la insulina y activación de la glucogénesis hepática, así como hipertrigliceridemia por reducción de la lipólisis y de la eliminación de grasas. Si el paciente presenta una ERC previa debemos considerar que partimos de una situación metabólica alterada, incluido un estrés oxidativo sistémico y una inflamación mantenida de bajo grado que al sumar la situación aguda va a provocar presumiblemente peores alteraciones metabólicas. Sin olvidar que los pacientes con ERC presentan una alta prevalencia de desnutrición (30-70 % según las series) (3).
Si a esta situación basal crítica se le añade la necesidad de una terapia continua de reemplazo renal (TCRR), se plantea un problema todavía más complejo. El catabolismo proteico será mucho mayor, con una mayor pérdida de masa magra y, por consiguiente, con mayor riesgo de mortalidad (4).
CONSIDERACIONES SOBRE LAS TERAPIAS CONTINUAS DE REEMPLAZO RENAL
Con todo, las TCRR no solo nos ayudan a mantener a los pacientes con vida, sino que también aportan algunas otras ventajas importantes: minimizan los problemas hidroelectrolíticos y de mantenimiento del equilibrio ácido-base, controlan las toxinas urémicas, ayudan a manejar la hipervolemia del paciente y el edema de los órganos, de manera que pueden reducir el edema intestinal y facilitar la tolerancia a la nutrición enteral. Sin embargo, las TCRR conllevan problemas asociados: puede generarse una pérdida calórica, se produce una pérdida de nutrientes (principalmente glucosa, AA y oligoelementos) a través de la membrana semipermeable y, de otra parte, aunque se trate de membranas biocompatibles, siempre se puede generar cierto componente de inflamación al contactar la sangre con los materiales extracorpóreos. Además, las TRR no pueden reemplazar la función secretora y de reabsorción del túbulo, ni la función endocrina del riñón. Por lo tanto, las TCRR pueden empeorar la situación metabólica y nutricional del paciente crítico.
Cuando se utilizan TCRR en el paciente crítico hay algunas premisas que son especialmente relevantes a la hora de pautar la dosis de proteínas, como son la situación nutricional previa del paciente y la situación catabólica actual, el tipo de técnica utilizada y la dosis de tratamiento depurativo. Pero no resulta nada fácil, cuando no suelen ser útiles en el manejo de estos pacientes, interpretar los parámetros analíticos habituales para determinar la situación nutricional, ni tampoco los que valoran la función renal (urea/creatinina), dado que la colocación de un hemofiltro “maquilla” estos parámetros analíticos y “falsea” la realidad.
¿Y, ENTONCES, DE QUÉ DEPENDE LA DOSIS DE PROTEÍNAS A PAUTAR EN ESTOS CASOS?
Básicamente depende del tipo de membrana, del tamaño del poro de la membrana del hemofiltro y, sobre todo, del tipo y la dosis de terapia depurativa. Respecto al tamaño de las moléculas, se sabe que a menor peso molecular mayor facilidad de paso, y que la unión a proteínas se asocia con un paso más difícil. Resultan especialmente sensibles a eliminarse la glucosa, los AA (peso molecular entre 140-215 D), que tienen un “sieving coefficient” (potencial de diferentes solutos para atravesar una membrana particular del dializador) de aproximadamente 1 (sobre todo, cisteína, arginina, alanina y glutamina) y los micronutrientes. Por eso, es fundamental saber qué tipo de modalidad de TCRR es la que se está utilizando (difusión, convección) y la dosis de tratamiento (mL/kg/h) pautada. Parece evidente que las técnicas intermitentes prolongadas de reemplazo renal presentan pérdidas menores de proteínas y del resto de nutrientes. En TCRR, son más los AA que se pierden en convección que cuando se emplea solo difusión. También se produce un fenómeno de agotamiento nutricional gradual cuanto más se mantiene el tratamiento, por lo que debemos ser dinámicos en individualizar el tratamiento nutricional, así como la dosis de terapia sustitutiva renal (5) (Fig. 1).
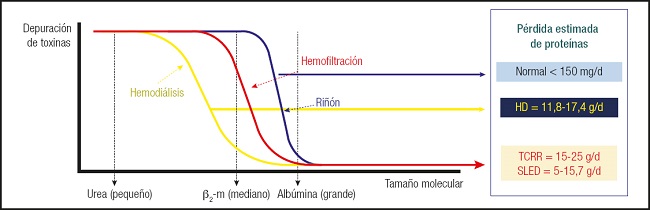
Fuente: cita 5.
Figura 1. Pérdida de proteínas según la modalidad de depuración renal (HD: hemodiálisis; TCRR: técnica continua de reemplazo renal; SLED: diálisis sostenida de baja eficiencia).
TERAPIA NUTRICIONAL
En base a estas consideraciones, y poniendo el foco en la elección de la terapia nutricional para el caso clínico presentado, el objetivo del aporte proteico debe ser cuantitativamente suficiente para mitigar la atrofia del músculo esquelético mientras proporciona los AA necesarios para la respuesta de fase aguda; pero, además, debe asegurarse que ese aporte de proteínas que se le proporciona al enfermo realmente lo pueda aprovechar al máximo, de ahí la importancia de instaurar un programa de ejercicio físico precoz para estos enfermos críticos y las TCRR no deben ser una limitación.
De acuerdo con las guías ESPEN (1), la prescripción de proteínas no debe reducirse en pacientes con cualquier grado de insuficiencia renal; es más, en pacientes críticos sería aconsejable un mayor aporte proteico (que, quizás, debería ser aún mayor si el paciente lleva TCRR) con un grado de recomendación A y fuerte consenso (95,5 % de acuerdo). Por lo tanto, el aporte de proteínas se debe pautar en función de la enfermedad de base y se debe considerar que el hecho de recibir una TRR puede ejercer una influencia negativa en el balance de proteínas y es por ello que se debería considerar incrementar la dosis de estas. Según se defiende en estas guías (1), un enfoque médico conservador, que consiste en regímenes proteicos moderadamente restringidos, puede considerarse solo en el caso de pacientes metabólicamente estables con LRA o ERC, sin ninguna condición catabólica/enfermedad crítica y que no se sometan a TRR (100 % de acuerdo).
¿CÓMO PODEMOS CALCULAR EL APORTE PROTEICO QUE SE DEBE OFRECER AL PACIENTE DEL CASO CLÍNICO?
Teniendo en cuenta estas consideraciones expuestas anteriormente, en primer lugar es imprescindible realizar una evaluación nutricional general a todo paciente crítico con LRA o ERC en riesgo de desnutrición, basada en una buena anamnesis e historia clínica del paciente hasta que no se haya validado una herramienta específica, como indica la recomendación 7 de las guías ESPEN (1), grado de recomendación de guía de práctica clínica (GPP) y fuerte consenso (91,3 % de acuerdo). Los parámetros bioquímicos y antropométricos no son de utilidad en este tipo de pacientes, porque el exceso de agua libre que presentan, genera grandes problemas de interpretación.
En este contexto clínico, resulta especialmente esperanzadora la aportación de la ecografía para valorar el estado morfofuncional del paciente crítico, aunque se precisa estandarización. Algunos estudios (6,7) muestran que este método simple, ampliamente disponible, económico y no invasivo, podría ser confiable y reproducible para evaluar la masa muscular esquelética, independientemente de los cambios agudos en el peso corporal debido a la eliminación de líquidos.
En la práctica habitual carecemos de herramientas sencillas y fáciles de aplicar que nos permitan individualizar las dosis de proteínas para cada paciente. En las guías ESPEN (1) se recomienda utilizar la tasa catabólica de proteínas para el cálculo de la prescripción proteica en pacientes hospitalizados con fallo renal que reciben tratamiento médico nutricional, en lugar de usar solo factores predictores normalizados por el peso corporal. En condiciones de equilibrio metabólico, resulta muy fácil de aplicar: la tasa catabólica es igual a la ingesta de proteínas. De manera habitual en pacientes con fracaso renal, se utiliza la tasa catabólica de proteínas normalizada (PCR/peso seco del paciente) pero resulta difícil pensar su utilidad en pacientes críticos, dada la dificultad que supone determinar el peso en estos enfermos.
Algunos estudios (8) han apuntado que la estimación del catabolismo utilizando la tasa catabólica, es una posible herramienta para el seguimiento nutricional de pacientes con daño renal agudo; sin embargo, puede ser un método impreciso en TCRR dado que el cálculo se basa en la cinética de la urea y recogida total del dializado (lo cual no siempre es fácil) con un estricto análisis del ultrafiltrado y sujeto a un amplio margen de error.
Por el momento parece imposible disponer de la medición exacta que nos facilite el cálculo de las dosis de proteínas a administrar en estos pacientes, pero sí tenemos claro que a mayor grado de estrés debemos aportar más dosis de proteínas. En las guías de consenso SEMICyUC (Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias)-SENPE (Sociedad Española de Nutrición Clínica y Metabolismo) 2011 para la insuficiencia renal aguda en pacientes críticos (9), se asocia la cantidad de nitrógeno ureico (en orina, en el dializado y retenido por falta de aclaramiento) generado por el proceso catabólico, con la dosis de proteínas a aportar; así en los enfermos con catabolismo normal (cantidad de nitrógeno ureico inferior a 5 g/día) y diuresis conservada se puede intentar un tratamiento conservador, apostándose por realizar un soporte nutricional relativamente hipoproteico (0,6-0,8 g de proteína/kg/día), con proteínas de alto valor biológico y limitaciones hidroelectrolíticas individualizadas. Los pacientes con cantidad de nitrógeno ureico entre 5 y 10 g/día requieren aportes proteicos de 0,8-1,2 g/kg/día. En función de la diuresis y de los trastornos electrolíticos recibirán tratamiento conservador o depuración extrarrenal. Cuando la cantidad de nitrógeno ureico es > 10 g/día, estos pacientes deben recibir 1,2-1,5 g (y a veces hasta 2,5 g) de proteínas/kg/día dependiendo de si reciben hemodiálisis o TCRR, y también en función de su estabilidad hemodinámica.
Esta es la corriente que hemos seguido durante los últimos años, porque tal y como se desprende de algunos estudios clásicos, se aprecia una relación entre una mayor aportación de proteínas y un balance nitrogenado menos negativo (10). Este balance positivo parece que se consigue cuando se aportan > 2 g proteínas/kg/día.
Por otro lado, no debemos dejar de vigilar los requerimientos calóricos que se aportan, ya que la infranutrición puede aumentar el catabolismo proteico y la sobrealimentación puede causar una disminución del balance nitrogenado positivo. En la recomendación 17 de las guías ESPEN (1) se aconseja evitar la sobrealimentación para lograr un balance nitrogenado positivo o minimizar un balance nitrogenado negativo existente (grado de recomendación B y fuerte consenso –95,7 % de acuerdo–).
¿Y CON QUÉ REALIZAR ESTE CÁLCULO ENERGÉTICO?
Entre las herramientas disponibles, destaca la calorimetría indirecta (CI) (11). En las guías ESPEN (1) se asegura que la CI se puede realizar durante las TCRR, teniendo en cuenta las limitaciones intrínsecas del método; en caso de diálisis intermitente se debe esperar un intervalo mínimo de 2 h después de una sesión para mejorar la precisión de la medición.
Otra recomendación importante que señalan las guías ESPEN (1), para los pacientes que se someten a TRR, es que se debe incluir en el cálculo de requerimientos la provisión de calorías adicionales proporcionadas en forma de citrato, lactato y glucosa de las soluciones de diálisis/hemofiltración para determinar la provisión de energía diaria total y evitar los efectos deletéreos de la sobrealimentación (12).
SEGÚN LA EVIDENCIA ACTUAL, ¿QUÉ APORTACIÓN PROTEICA SE DEBE OFRECER AL PACIENTE SUJETO DEL CASO CLÍNICO?
En general, la literatura científica sobre el apoyo nutricional en la LRA con TCRR es escasa y está representada principalmente por estudios antiguos (probablemente muy alejados de la práctica actual), de baja calidad, que se han resumido en revisiones más recientes. Se trata de estudios que tienen un tamaño muestral pequeño, la mayoría prospectivos no randomizados, con una gran heterogeneidad, donde se evalúan aportes proteicos demasiado dispares; además, las TCRR y la dosis de terapia empleadas son muy diferentes (13), por lo cual es muy difícil obtener una evidencia clara.
Aunque con algunas diferencias, las guías de referencia recomiendan unos valores de aporte proteico semejantes en pacientes con LRA con o sin TRR. De mayor interés y novedad son las últimas guías ESPEN (1) que apuestan por una nutrición individualizada, estratificando el aporte según la situación clínica del paciente. Sin embargo, es discutible la dosis de proteínas recomendadas en el caso de pacientes sometidos a TCRR, apostando a la baja respecto las guías anteriores. Los autores se basan, principalmente, en que la mayoría de los estudios utilizaban el peso real en el cálculo de requerimientos, por lo que se considera que sobrestimaban el aporte. Otra limitación de esta recomendación es que argumentan el cambio en estudios no dirigidos a medir dosis óptimas de proteínas en este grupo de pacientes. En un estudio de los que referencian se compara el cálculo de requerimientos por CI con ecuaciones predictivas, así que su objetivo queda lejos del cálculo de proteínas. Se trata de un grupo específico de pacientes que reciben exclusivamente terapias de reemplazo renal intermitente prolongado (PIRRT), en concreto diálisis sostenida de baja eficiencia (SLED) sin incluir TCRR y además, presenta otras limitaciones metodológicas, como es su pequeño tamaño muestral, que utiliza el peso corporal real en las mediciones, que no se mide la cantidad de AA perdidos durante la TRR en el cálculo de la tasa catabólica de proteínas y que no tiene en cuenta las calorías aportadas por el citrato, con lo cual adolece del riesgo de un cálculo inadecuado de requerimientos nutricionales (11). Otro estudio que referencian las guías es el estudio EPaNIC (14) (con limitaciones ampliamente discutidas en la literatura), que tampoco fue diseñado para el cálculo del objetivo proteico. En dicho estudio se observa que el inicio de la NP precoz se asocia con niveles más altos de urea en plasma y, aunque no aumenta la incidencia de LRA, podría explicar la duración más prolongada de la TCRR. No parece un argumento contundente de peso para disminuir las dosis de proteínas que se deben administrar en estos pacientes (Tablas I y II).
Tabla I. Recomendaciones de aporte proteico en las guías: lesión renal aguda con y sin terapia de reemplazo renal.
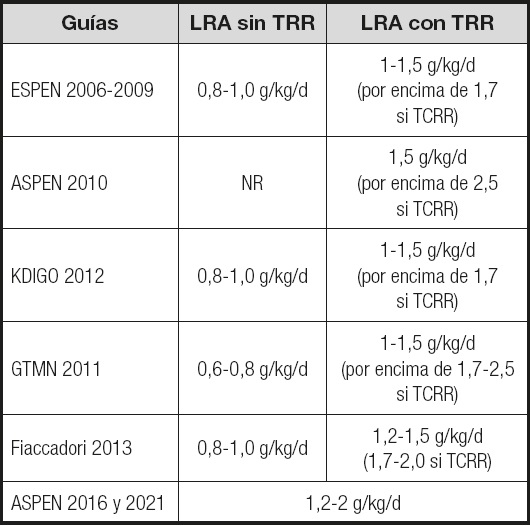
ESPEN: European Society for Clinical Nutrition and Metabolism; ASPEN: American Society of Parenteral and Enteral Nutrition; KDIGO: Kidney Disease: Improving Global Outcomes; GTMN: Grupo de Trabajo de Metabolismo y Nutrición. NR: no respuesta. LRA: lesión renal aguda; TRR: terapia de reemplazo renal; TCRR: técnica continua de reemplazo renal.
Tabla II. Recomendaciones individualizadas Guías ESPEN (1).
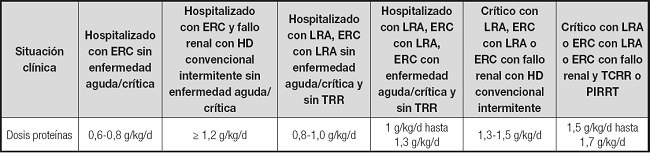
ERC: enfermedad renal crónica; HD: hemodiálisis; LRA: lesión renal aguda; TRR: terapia de reemplazo renal; TCRR: terapia continua de reemplazo renal; PIRRT: terapia de reemplazo renal intermitente prolongado.
Si revisamos la literatura más reciente, Kritmetapak y cols. (15) realizan un estudio observacional con una muestra pequeña donde se recogen efluentes y se calcula la tasa catabólica, además lo miden de forma dinámica en tres puntos de la evolución del paciente. Observan que los pacientes en estado crítico sometidos a TCRR tienen un catabolismo muy alto según la tasa catabólica normalizada. Y aunque no realizan ninguna intervención, y el aporte proteico es insuficiente, siguen apuntando que el mayor aporte proteico es un buen predictor de la supervivencia del paciente y que la albúmina sérica es un marcador pronóstico de resultado renal y de dependencia de diálisis.
Por su parte, un estudio clásico de Bellomo y cols. (16) ya evidenciaba que el aporte elevado de proteínas (2,5 g prot/kg/d en forma de AA por vía endovenosa) aumentaba las concentraciones séricas de la mayoría de los AA, y que en pacientes extremadamente catabólicos se conseguía un balance nitrogenado levemente negativo con un control azotémico adecuado.
Considerando todas las evidencias y recomendaciones actuales, aunque no disponemos de una fuerte evidencia, no parece lógico en el momento actual disminuir las dosis de proteínas en pacientes que reciben TCRR. Quizás se debería mantener el aporte en torno a 2 g/kg/d hasta que dispongamos de estudios dirigidos a disipar todas estas cuestiones.
La propuesta de abordaje nutricional, en el caso clínico seleccionado, se fundamenta en una nutrición individualizada y ajustada a la situación metabólica en cada fase de su evolución. Y debe hacerse de manera dinámica con el objetivo de alcanzar el objetivo calórico-proteico calculado (si puede ser por CI). Así, se propone empezar con dosis bajas de calorías y un aporte alto de proteínas (máximo coincidiendo con la fase aguda y la utilización de TCRR), para posteriormente, en fase de salida de la situación crítica, aumentar el aporte calórico e ir reduciendo el aporte proteico, que debe ajustarse según el paciente recupere la situación basal de ERC o acabe entrando en hemodiálisis intermitente (HDI). En cualquier caso, deben mantenerse dosis más altas de proteínas en fase de anabolismo para favorecer la formación de masa magra y así obtener mejores resultados clínicos (Fig. 2).
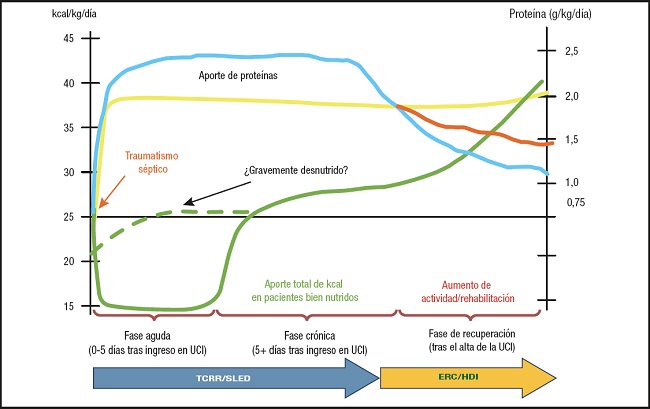
Fuente: cita 17.
Figura 2. Propuesta de abordaje nutricional en el caso clínico seleccionado según situación renal y fase de evolución (UCI: Unidad de Cuidados Intensivos; TCRR: terapia continua de reemplazo renal; ERC: enfermedad renal crónica; HDI: hemodiálisis intermitente; SLED: diálisis sostenida de baja eficiencia).
CALIDAD DE LAS PROTEÍNAS
Pero no solo es importante determinar la cantidad de proteínas a aportar, sino también su calidad. Dependiendo de los AA que se administren, se generarán unas proteínas u otras (18).
Son escasos los estudios que miden niveles de AA de forma individualizada. Analizando las características de eliminación y contenido total de glutamina y otros AA en pacientes críticos con insuficiencia renal aguda sometidos a diálisis prolongada (19), se ha estimado una pérdida de 10 g de AA en cada sesión, siendo la glutamina el AA más dializado. Sería importante poder medir dichos AA en la práctica clínica. Si los niveles de AA en plasma se mantienen estables es porque se está produciendo proteólisis, es decir, los niveles no disminuyen porque se produce una depleción gradual del músculo para compensar la pérdida, y a la larga, las reservas merman.
Por otra parte, hay que recordar que no todos los AA se comportan igual y esto depende de la TRR utilizada (5). Ello nos invita a evaluar de forma individual los AA si disponemos de la posibilidad y de la tecnología adecuada para determinarlos. La que más se ha estudiado es la pérdida de glutamina en TRR, la cual es mucho mayor cuando se utilizan técnicas convectivas y con mayor dosis de diálisis. Se ha observado que al suplementar con glutamina no aumenta la concentración de este AA en el ultrafiltrado (20) y mejoran sus niveles en sangre. Como en el resto de AA, todavía nos faltan estudios que confirmen los beneficios de su administración a las dosis adecuadas.
En conclusión, en el enfermo crítico la LRA es una complicación de la enfermedad aguda, pero no debe limitar la terapia nutricional ajustada a la gravedad de cada paciente, siendo esencial cuidar la salud del músculo. Sin duda, el cálculo del aporte resulta mucho más complejo si se indican TCRR. En este contexto clínico, se deben optimizar las dosis de calorías-proteínas administradas, utilizando dosis más altas de proteínas para evitar la proteólisis y el desgaste muscular gradual. Es indispensable valorar el estado nutricional del que parten estos pacientes, y nuestra asignatura pendiente es poder medir los requerimientos proteicos de forma sencilla y dinámica, con el fin de individualizar el aporte en cada fase de evolución de la enfermedad crítica. En este sentido, las nuevas tecnologías nos deberían resultar de gran ayuda. Se debe conceder especial importancia tanto a la cantidad como a la calidad de las proteínas que se administran, así como al ejercicio físico, que pasa a ocupar un papel protagonista en estos casos y que se debe iniciar casi de forma simultánea a la terapia nutricional precoz. Nuestro objetivo no solo debe ser mantener con vida a estos pacientes, sino que consigan recuperar su situación funcional previa al ingreso con una calidad de vida adecuada.














