Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.20 no.12 dic. 2003
| Incorporación de estudios de calidad de vida J. SOTO ÁLVAREZ Unidad de Farmacoeconomía e Investigación de Resultados en Salud. Departamento de Medicina. Pharmacia, S.A. Madrid.
|
| INCLUSION OF HEALTH-RELATED QUALITY OF LIFE STUDIES ALONGSIDE CLINICAL TRIALS: BASIS AND PRACTICAL RECOMMENDATIONS. UTILIZATION OF A CHECK-LIST FOR THEIR CORRECT DESIGN AND EVALUATION
|
Soto Álvarez J. Incorporación de estudios de calidad de vida relacionada con la salud en los ensayos clínicos: bases y recomendaciones prácticas. Uso de una lista-guía para su correcto diseño y/o evaluación. An Med Interna (Madrid) 2003; 20: 633-644.
Trabajo aceptado: 27 de marzo de 2003
Correspondencia: Javier Soto Álvarez. C/ Arturo Soria, 148, 1ª-1ª. 28043 Madrid
INTRODUCCIÓN
La salud, según la definición de la OMS, es un estado de bienestar completo, tanto físico como mental y social, y no simplemente la ausencia de enfermedad o incapacidad. De esta definición multidimensional de la salud, podría derivarse el concepto de calidad de vida relacionada con la salud (CVRS).
La CVRS agrupa tanto los elementos que forman parte del individuo como aquellos externos que interaccionan con él y pueden llegar a cambiar su estado de salud, y por lo tanto es un parámetro multidimensional (1). La evaluación de la CVRS supone ir más allá de la mera recopilación y gradación de la presencia y severidad de los síntoma de la enfermedad evaluada o de los efectos adversos causados por el tratamiento administrado, y significa investigar como el paciente percibe y experimenta estas manifestaciones a diario, y como le afectan en el desarrollo de su vida habitual (2). Así, los instrumentos que nos van a valorar la CVRS, van a reflejar cuál es la percepción subjetiva del paciente en cuanto al impacto de la propia enfermedad y el tratamiento administrado en las dimensiones de su estado de salud.
Teniendo en cuenta el incremento en la prevalencia de las enfermedades crónicas, la creciente necesidad de evaluar las nuevas opciones terapéuticas con relación al valor añadido que aportan al paciente (no sólo en eficacia y seguridad), la necesidad explícita de reconocer el valor que representan las percepciones de cambio de la CVRS que experimenta cada paciente y el hecho bien comprobado de que, en múltiples patologías y en distintos grupos de pacientes, la correlación entre los marcadores analíticos y funcionales y la CVRS que percibe el paciente es baja (o no existe), la evaluación de la CVRS es incluida en los protocolos de ensayo clínico controlado (ECC) con medicamentos (y otras intervenciones terapéuticas) cada vez con más asiduidad, en un intento por conocer como su empleo va a interferir con la vida diaria de los pacientes, y como van a modificar los parámetros de morbi-mortalidad de las enfermedades estudiadas (3,4).
Sin embargo, y a pesar de un crecimiento en el número de ECC que incluyen una evaluación de CVRS en su protocolo, la calidad metodológica con la que son realizados deja mucho que desear, especialmente en la parte del protocolo destinado a la planificación del estudio de CVRS, la recolección de los datos y el análisis e interpretación de los resultados (5-7).
Por este motivo, y dado que en nuestro país cada día se diseñan más ECC que llevan parejos un estudio de CVRS, el objetivo de este trabajo es delimitar cuándo debería incorporarse un estudio de CVRS en un ECC, así como elaborar unas recomendaciones que ayuden, tanto a evaluar estudios ya efectuados como a diseñar, efectuar, analizar e interpretar estudios de CVRS de novo, a través de la creación de una lista-guía que ayude es este cometido.
¿CUÁNDO INCLUIR UN ESTUDIO DE CVRS EN UN ECC?
Cualquier ECC va acompañado de una exhaustiva recogida de datos y de visitas programadas, con una importante carga de trabajo para el investigador y de consumo de tiempo para el paciente. Por este motivo, antes de incorporar una evaluación de la CVRS en cualquier ECC, es necesario valorar, cuidadosamente, sí su inclusión nos va a dar datos relevantes e importantes, o simplemente va a ser una tarea adicional para el investigador y paciente, sin aportar datos que ayuden, posteriormente, en la toma de decisiones.
Por lo tanto, va a ser importante incorporar un estudio de CVRS en un protocolo de ECC, en las siguientes situaciones (8-10):
En aquellas patologías, básicamente, crónicas, donde la CVRS sea un aspecto importante para valorar la bondad de los tratamientos (artritis reumatoide, cáncer, artrosis, depresión, EPOC, ICC, etc.).
En aquellas enfermedades donde no exista un marcador clínico objetivo y bien validado que refleje su afectación en el paciente (migraña, epilepsia, ansiedad, asma, etc.).
Cuando se vayan a evaluar intervenciones terapéuticas que, a priori, van a desencadenar muchos efectos adversos, los cuales van a influir negativamente en la calidad de vida de los pacientes.
Cuando se prevea que la mejoría en la CVRS va a ser el principal y más significativo resultado clínico de los tratamientos administrados (antieméticos, tratamientos paliativos, etc.).
Cuando se piense que las alternativas en evaluación van a presentar una eficacia y seguridad similar, y es posible que haya diferencias en la CVRS.
En aquellas patologías de severidad moderada (hipertrofia prostática, incontinencia urinaria, etc.) en las que los tratamientos existentes son sintomáticos, para asegurar que su uso no disminuye, de forma importante, la CVRS de los pacientes
En enfermedades que cursan sin sintomatología, y en las que los tratamientos son, primordialmente, preventivos (hipertensión arterial, hipercolesterolemia, hiperuricemia, etc.), para asegurar que su utilización no disminuye la CVRS de los sujetos.
En aquellas situaciones en las que se van a evaluar tratamientos encaminados a una patología aguda (infecciones, infartos, ictus, dolores agudos, etc.), o en aquellos ECC en los que se piense que la duración del mismo no sea lo suficientemente largo como para poder valorar cambios en la CVRS, será necesario sopesar detenidamente si merece la pena incluir evaluaciones de la CVRS, ya que es posible que los datos que nos proporcionen no sean de una gran utilidad práctica.
PASOS A SEGUIR A LA HORA DE DISEÑAR Y/O EVALUAR UN ESTUDIO DE CVRS EN EL SENO DE UN ECC
Los ECC son la metodología en la que se basan los datos que van a servir para el registro de un nuevo medicamento, y para obtener una nueva indicación de un fármaco ya comercializado. Por este motivo, es uno de los vehículos más idóneos para efectuar un estudio de CVRS, dada la excelente validez, precisión y credibilidad de sus resultados para todo tipo de agentes decisores sanitarios.
Sin embargo, como ya ha sido comentado en este trabajo, la calidad metodológica de los estudios de CVRS incorporados a los ECC hasta ahora no ha sido la deseada, existiendo aún lagunas metodológicas importantes en su diseño, realización, análisis e interpretación.
Con el fin de intentar minimizar estas carencias, es necesario seguir unas recomendaciones cuando se vaya a incluir un estudio de CVRS en un ECC, lo que nos permitirá ensamblar perfectamente ambas metodologías y obtener resultados validos y relevantes para la toma de decisiones. Estas mismas recomendaciones deberían ser seguidas en el caso de querer evaluar un estudio de CVRS que ya haya sido efectuado, con el fin de estar seguros que los resultados obtenidos son fiables y utilizables.
Para facilitar este trabajo a los analistas, revisores y todo tipo de lectores (clínicos, gestores, proveedores y, otros agentes decisores ), en este trabajo se propone una lista-guía que sirva de hilo conductor a la hora de evaluar y/o elaborar un estudio de CVRS incorporado a un protocolo de ECC (Tabla I). Entre los pasos a seguir, sería necesario tener en mente los siguientes puntos:
OBJETIVO Y FUNDAMENTO DEL ESTUDIO DE CVRS
Basándose en los conocimientos existentes sobre la enfermedad diana y de las alternativas de tratamiento existentes, debería ser expuesto con detalle cuál es el objetivo y la finalidad del ECC, y si es lógico y conveniente incluir una evaluación de CVRS.
Según la historia natural de la patología de interés y los tratamientos existentes, debería explicitarse lo que se va a medir con el estudio de CVRS, y que dimensiones serán consideradas como objetivo final del estudio, razonando si es lo más adecuado acorde con el tipo de enfermedad diana y las características intrínsecas del ECC, y si es esperable una diferencia entre los tratamientos evaluados en el mismo. Al final, será necesario formular una hipótesis a demostrar con el estudio desde el punto de vista de la CVRS.
Con el fin de que todos los participantes en el ECC tengan claro el objetivo y el propósito del estudio de CVRS, cómo hay que realizarlo y analizarlo, y cuáles van a ser sus aplicaciones prácticas, será totalmente necesario que dentro del protocolo del ECC exista una parte especifica destinada a explicar este cometido. Su existencia facilitará la resolución de dudas y ayudará a poner en marcha las medidas que se consideren importantes.
De la misma manera, en este apartado del protocolo deberá definirse la diferencia que se va a considerar en este estudio como la mínima diferencia clínicamente relevante en la puntuación de los instrumentos de CVRS empleados, así como expresar que tamaño del efecto es previsible encontrar y a qué valor se considerará como importante y significativo en los grupos de tratamiento en estudio (11,12).
SELECCIÓN DEL INSTRUMENTO A EMPLEAR PARA MEDIR LA CVRS
La selección del instrumento que va a ser utilizado deberá estar basada en la hipótesis a demostrar en el estudio CVRS. Siempre será necesario comprobar que el instrumento elegido contiene aquellas dimensiones esenciales para evaluar la enfermedad diana (acorde a su naturaleza y severidad) y que, a priori, es esperable que sean modificadas por los efectos beneficiosos y las reacciones adversas de los tratamientos evaluados en el ECC (13).
Además, deberán poseer una suficiente sensibilidad a los cambios y ser capaces de reflejar el nivel de salud de la población a estudiar (14,15).
A la hora de decidir que instrumento emplear en cada estudio, vamos a poder elegir entre instrumentos genéricos (índices de salud, perfiles de salud y las medidas de utilidad o preferencia) y los cuestionarios específicos, cada uno con sus ventajas e inconvenientes.
Los genéricos van a medir diferentes dimensiones de la CVRS (función física, función cognitiva, función social, función psicológica, bienestar general) y van a permitir comparar estados de salud entre pacientes con diferentes patologías y distintas co-morbilidades y factores de riesgo asociados. Este tipo de instrumentos van a ser menos sensibles a la hora de poder detectar pequeños cambios (pero a veces clínicamente importantes) en la evolución de la enfermedad inducidos por los tratamientos instaurados.
Los específicos incluyen dimensiones que van a ser afectados por una enfermedad específica o en un tipo de pacientes particulares, y por lo tanto, es esperable que presente una mayor sensibilidad al cambio que los genéricos, aunque a consta de no poder efectuar comparaciones en CVRS entre pacientes con diferentes patologías (16,17).
Aunque no esta claro si, de forma sistemática, debería siempre incluirse un instrumento genérico y uno específico a la hora de evaluar la CVRS en un ECC (ya que nos proporcionarían información complementaria de diferentes aspectos de la CVRS) (18), en aquellas situaciones en las que se pueda prever que los cambios de CVRS producidos por las opciones en estudio van a ser de pequeña intensidad, el uso de un instrumento específico (conjuntamente con uno genérico) podría ser una opción adecuada y recomendable. De todas formas, siempre será necesario explicar en el protocolo porque se han escogido los cuestionarios elegidos para el estudio, y no otros existentes (19,20).
Una vez decidido el/los instrumento/s que se van a emplear en el estudio, será necesario comprobar que presentan unas excelentes propiedades psicométricas en poblaciones de similares características e idéntica cultura y lengua (que los grupos que van a ser valorados en el estudio), tales como fiabilidad (medida de consistencia de la actuación de un instrumento cuando es utilizado por distintos observadores o en diferentes períodos de tiempo), validez (el grado con el que el instrumento mide lo que se entiende que tiene que medir) y sensibilidad al cambio (habilidad de un instrumento para detectar pequeños, pero importantes, cambios a lo largo del tiempo en un grupo o diferencias entre distintos tratamientos en un momento dado). Además, será necesario comprobar que el instrumento presenta unas excelentes propiedades lingüísticas con respecto a la lengua de la versión original (validación lingüística), en el caso de que se vaya a emplear en otra lengua distinta. Por este motivo, será necesario aportar extensa bibliografía (o información obtenida de los autores que desarrollaron los instrumentos), que permita poder valorar, fehacientemente, sus propiedades lingüísticas y psicométricas (21).
La fiabilidad se mide a través de la consistencia interna u homogeneidad del cuestionario (la cual se valora mediante el coeficiente de Cronbach, que debería ser superior a 0,70 para comparación de grupos y de 0,90-0,95 para comparaciones individuales o bien a través de la fórmula de Kuder-Richardson, si se trata de respuestas dicotómicas) (22,23) y mediante la estabilidad o prueba de reproducibilidad test-retest, la cual se evalúa mediante el coeficiente de correlación intraclase o el coeficiente Kappa para números ordinales (que deberán ser superiores a 0,70 para comparaciones de grupos y de 0,90-0,95 para las comparaciones individuales) (24), y cuando el instrumento es administrado por un entrevistador, a través de la fiabilidad inter-entrevistador (cuya correlación deberá ser superior a 0,80 (25).
La validez va a ser evaluada por medio de la validez de contenido (todas las dimensiones importantes de la CVRS son incorporadas con preguntas inteligibles y el cuestionario cubre todos los puntos relevantes), siendo determinado preguntando a pacientes y expertos sobre la claridad, comprensibilidad y aceptabilidad de las preguntas y obteniéndose el índice de acuerdo interjueces de Hambleton y Rovinelli, la validez de constructo o de concepto (evalúa si el instrumento presenta una estructura adecuada para medir el concepto o variable que quiere medir y si los items están agrupados en las dimensiones adecuadas), se comprueba mediante el análisis factorial de las respuestas de los encuestados, evaluándose los componentes principales y rotaciones varimax (ortogonal) y oblimin (oblicua sobre los items del cuestionario) con el fin de poder estudiar la estructura de las respuestas dadas por los pacientes la validez convergente (realizar una medición simultánea del cuestionario con otro cuestionario comúnmente aceptado por otros investigadores), la validez discriminante (establecer grupos de sujetos en los que se piensa que las puntuaciones deben diferir, medirlos por separado y comparar sus puntuaciones) y la validez de criterio (que nos va a medir la correlación entre un nuevo instrumento y otro de referencia), debiendo presentar un coeficiente de correlación entre 0,40 y 0,70 (26,27).
Existe otro tipo de validez, la predictiva que va a explorar la correlación de la medición de la CVRS con la evolución de la enfermedad en el futuro (predecir morbi-mortalidad o consumo de recursos), y que ha sido probada con muy pocos instrumentos, aunque esta es una de las áreas de la CVRS que más futuro tiene y en la que se investigará más en los próximos tiempos, dado el gran interés que tiene para la práctica médica diaria y para la toma de decisiones en política sanitaria (28,29).
La sensibilidad al cambio se corresponde con la propiedad que va a permitir detectar cambios de la CVRS a lo largo del tiempo, como resultado de aplicar una intervención terapéutica . De alguna manera, es la habilidad del cuestionario para discriminar entre grupos de pacientes que difieren en la gravedad de su enfermedad o en la presencia de sintomatología específica. Se van a necesitar dos tipos de estudios para poder evaluar la sensibilidad al cambio: uno, que evalúe la variabilidad en aquellos sujetos estables, y otro, que demuestre los cambios habidos en la puntuación cuando tienen lugar cambios reales en la salud de los pacientes, para lo que será necesario administrar el cuestionario a los pacientes antes y después de la administración de un tratamiento, del cual se conoce su eficacia. Siempre será necesario notificar los métodos que se han aplicado para evaluar la sensibilidad al cambio, tales como el tamaño del efecto y la correlación de los cambios del instrumento con otras medidas clínicas (30).
Un aspecto crucial a la hora de emplear un instrumento para medir la CVRS en el seno de un ECC, es verificar que la población diana de este es de similares características que el grupo poblacional incluido en su proceso de validación. Si no fuera así, antes de su inclusión en el ECC, sería necesaria su validación para la población que será incluida en este.
Además, siempre debería considerarse la factibilidad y practicabilidad del instrumento, o sea su longitud, el tiempo que se tarda en rellenar y si son fáciles de entender las preguntas.
En el caso de que una vez decidido el instrumento a emplear, se comprobase que no está validado y adaptado en el país donde se va a realizar el ECC, sería necesario efectuar la validación y adaptación a la lengua y cultura de ese país. Aunque es posible encontrar ECC donde, simplemente, se ha efectuado una traducción del instrumento a la lengua del país receptor, esta práctica es un gran error metodológico, ya que puede conducir a obtener resultados muy poco validos y fiables.
Por este motivo, siempre será necesario efectuar una rigurosa validación lingüística (lo que lleva una traducción-retrotraducción por personas bilingües, una evaluación por un grupo de expertos y una prueba piloto con el cuestionario final en un grupo de pacientes), una validación psicométrica y una adaptación a la cultura de cada país participante en el ECC. De esta manera, el instrumento tendrá un baremo propio en cada país, ya que sería totalmente erróneo aplicar el baremo de un país a otro sin más, ya que el peso de cada contestación podría ser, sustancialmente, muy diferente (31-33). A veces lo que se hace, con el fin de no demorar el inicio del ECC, es efectuar una validación lingüística, y posteriormente realizar la validación psicométrica a lo largo del desarrollo del ECC, en una muestra de pacientes del global de participantes, lo que no demora el inicio del estudio y permite disponer de los datos de validación al final del ECC.
DISEÑO DEL ESTUDIO DE CVRS
Solamente debería incluirse un estudio de CVRS en un ECC que haya sido diseñado siguiendo los más altos estándares en cuanto a la calidad metodológica, esto es comparativo, doble o simple ciego, y el método de aleatorización deberá ser totalmente explícito.
Si la técnica del ciego no fuera posible (p. ej. sí interviene un entrevistador para rellenar el cuestionario), el protocolo deberá reflejar que el entrevistador será ciego en relación al tratamiento recibido por los pacientes. Si el cuestionario es auto-administrado (lo más recomendable), los investigadores principales u otras personas participantes (investigadores secundarios, enfermeras, etc.) no deberán influenciar en el paciente a la hora de rellenar el cuestionario (34).
La mejor práctica sería que todos los centros y pacientes que van a intervenir en el ECC participasen en el estudio de CVRS, con el fin de evitar sesgos en la inclusión de los pacientes. Sin embargo, en muchas ocasiones van a existir pacientes que no pueden leer ni escribir o que son incapaces de entender la manera de completar los cuestionarios, y que a menudo tienen que ser excluidos. En estos casos, siempre será necesario verificar que no existen diferencias importantes en co-morbilidades, estadio de la enfermedad y factores pronóstico entre esta submuesta de pacientes y el global de los pacientes que, finalmente, si realizarán el estudio de CVRS, con el fin de poder inferir los resultados a toda la población que ha participado en el ECC.
En algunas ocasiones, y en pacientes que padezcan enfermedades que les imposibilita rellenar los cuestionarios por si solos sin ayuda (parapléjicos, parkinson, ciegos, etc.) se puede plantear su inclusión en el estudio de CVRS y que un entrevistador les ayude a completar el cuestionario, ya que será mejor esto que no disponer de ningún tipo de información sobre CVRS. En este caso, será esencial que el entrevistador sea el mismo a lo largo de todo el ECC (35).
Acorde a la legislación española sobre la realización de un ECC, siempre deberá recogerse el consentimiento informado de los participantes, y siempre habrá que elaborar una información sobre la evaluación de la CVRS incluida en el ECC (con sus objetivos, necesidades y aplicaciones) en la hoja de información que se administra a todos los pacientes a la hora de recoger el consentimiento, lo que facilitará que estos puedan preguntar dudas sobre el estudio de CVRS.
Con el fin de no tener al final del estudio pacientes que no hayan rellenado los cuestionarios correctamente, y todas las veces fijadas en el protocolo (datos perdidos), será esencial explicar a los participantes (pacientes e investigadores) la necesidad de rellenar debidamente, y en el momento oportuno todos los cuestionarios. La mejor manera de manejar los datos perdidos es evitar su aparición, para lo cual es deseable seguir las siguientes premisas y recomendaciones (36):
Estandarizar los procedimientos de recogida de los cuestionarios en el protocolo.
El tiempo que tenga que emplear el paciente que lo rellena y el personal del estudio que vigila, deberá ser el menor posible, por lo que es deseable emplear instrumentos cortos y fáciles de entender.
Explicar detenidamente a los pacientes el objetivo y la finalidad del estudio de CVRS y clarificar cualquier aspecto dudoso.
Las instrucciones para rellenar los cuestionarios deberán estar bien claras en la primera página de los mismos
Es necesario convencer de la utilidad práctica y de la aplicabilidad de los resultados del estudio de CVRS al investigador principal y al resto del personal participante.
Los pacientes que abandonen prematuramente el ECC deberían completar el cuestionario en el momento del abandono, e incluso en muchas ocasiones será pertinente evaluar la CVRS a los tiempos fijados en el protocolo original, aunque los pacientes ya no estén en el estudio.
No deberían realizarse muchas mediciones de la CVRS a lo largo del ECC, ya que un número excesivo contribuye a incrementar el mal cumplimiento por parte de los pacientes.
Los estudios de CVRS deberán ser analizados con la misma rigurosidad que se manejaría a otra variable clínica de eficacia y/o seguridad, y por lo tanto debería estar descrito en el protocolo el cálculo del tamaño muestral necesario para poder mostrar ventajas en CVRS de una alternativa sobre otra, si realmente existiesen. Por lo tanto, es necesario que el estudio tenga suficiente poder estadístico que evite la aparición de falsos negativos.
A la hora de calcular el tamaño muestral, se pueden dar dos situaciones diferentes:
a) La CVRS es el objetivo principal del ECC
En este caso, es mandatorio efectuar una predeterminación del tamaño muestral con el fin de tener suficiente poder estadístico y que el estudio sea capaz de demostrar diferencias estadísticamente significativas, si las hubiese. Esto ayudaría a evitar la inclusión de grupos amplísimos de pacientes (varios cientos o miles de pacientes), sin una justificación clara, lo que podría conducir a que pequeñas diferencias en CVRS ya fuesen estadísticamente significativas, aunque clínicamente fuesen muy poco importantes (37).
Para efectuar el cálculo del tamaño muestral, se necesitará fijar de antemano la diferencia en las puntuaciones de las dimensiones que se va a considerar como clínicamente relevante, o a que tamaño del efecto se va a considerar como clínicamente importante entre los grupos en evaluación, siempre razonando la elección. Además, el cálculo del tamaño muestral va a depender también del error tipo I (α) y del error tipo II (ß), y de la varianza de las puntuaciones de las dimensiones de la CVRS (38).
Si se emplea el tamaño del efecto para efectuar la predeterminación del tamaño muestral cuando se van a comparar dos alternativas (situación más habitual), si se fija un valor _ de 0,05 y un valor ß de 0,80, sería necesario 400 pacientes por rama para detectar un tamaño de efecto de 0,2, 64 pacientes por rama para encontrar un tamaño del efecto de 0,5 y 26 pacientes por grupo para detectar un tamaño del efecto de 0,8 (39).
De forma adicional, e independientemente de la variable que se utilice para efectuar la predeterminación del tamaño muestral, siempre será necesario aportar el poder estadístico que tendrá el estudio en base a esos cálculos (40).
b) La CVRS es un objetivo secundario del ECC
Normalmente, en este caso no se suele estimar el cálculo del tamaño muestral basado en este parámetro, sino en aquél que va a ser el objetivo principal del ECC. Si éste fuera muy amplio, se podrían detectar pequeñas diferencias en CVRS (aunque no sean clínicamente relevantes), y en caso contrario, si el tamaño muestral fuese muy reducido, probablemente no se podrían detectar diferencias significativas, aunque clínicamente fueran importantes.
De cualquier forma, si el tamaño muestral fuera muy amplio, y claramente innecesario para detectar diferencias en CVRS, se podría realizar una selección de los pacientes y centros a los que se recogería los datos de CVRS (y no a todos los participantes), lo que ahorraría tiempo y esfuerzo en el desarrollo del ECC. Sin embargo, esta estrategia debería estar especificada de antemano y razonada suficientemente en el protocolo, y la selección de la muestra de pacientes a los que medir la CVRS debería efectuarse sin sesgos, y debería ser representativa del total de pacientes incluidos en el ECC.
En el apartado del estudio de CVRS dentro del protocolo del ECC, debería especificarse las pruebas estadísticas que se van a efectuar con los datos de CVRS, y éstas deberían ser las más pertinentes y adecuadas para su correcto análisis. Solamente aquellas variables elegidas a priori como principales en el protocolo deberían ser incluidas, describiéndose el valor de la p hallado y el intervalo de confianza de las diferencias encontradas entre los tratamientos en estudio.
De igual manera, la metodología y las pruebas estadísticas que se van a emplear para manejar los datos perdidos deberán estar claramente descrita en el protocolo. Por estas razones, es conveniente que en la fase de diseño del estudio de CVRS se consulte con un estadístico experto en estas áreas.
Es necesario también indicar sí el análisis se va a efectuar por intención de tratar (todos los pacientes aleatorizados son incluidos en el análisis final, incluidos aquéllos que no llegaron a completar todo el estudio), o bien por protocolo. Siempre que sea posible, se recomienda efectuar el análisis por intención de tratar, ya que en muchas ocasiones los pacientes que no finalizan el estudio son los más interesantes con respecto a la CVRS (peor CVRS que el resto) (41).
Si se realizan múltiples análisis es posible que aparezca una alta incidencia de error tipo I, y es posible que se encuentren diferencias significativas simplemente debido a las múltiples comparaciones efectuadas a lo largo del tiempo (es lo que se denomina ir de pesca). Solamente deberían efectuarse las comparaciones descritas de antemano en el protocolo, y las posibles comparaciones entre otras variables deberían servir únicamente como generadoras de hipótesis, que tendrán que ser comprobadas en nuevos estudios. Además, será necesario incorporar procedimientos para mantener un error tipo I a un nivel a un nivel de 0,05, y estas técnicas deberían estar especificadas claramente en el protocolo (42,43).
REALIZACIÓN DE UN ESTDIO DE CVRS
Dado que la CVRS es una dimensión totalmente subjetiva, su evaluación debería efectuarse, primordialmente, empleando cuestionarios de auto-administración, manteniendo la confidencialidad al máximo. Cuando no sea posible, se podrá utilizar la ayuda de un entrevistador, aunque en este caso se introducirá un sesgo que será difícil (o imposible) de controlar, y por lo tanto, la validez y fiabilidad de los resultados podría ser puesta en entredicho.
Las ayudas por parte del investigador principal, enfermeras y familiares a la hora de rellenar los cuestionarios por los pacientes, deberían ser las menos posibles con el fin de no interferir en la respuesta del paciente, aunque si éste es incapaz de entender alguna pregunta si que se le puede ayudar a su comprensión, pero intentando no interferir con sus respuestas (44). En el caso de que se empleen entrevistadores en el estudio, debería intentarse que fueran siempre los mismos a lo largo de todo el ECC.
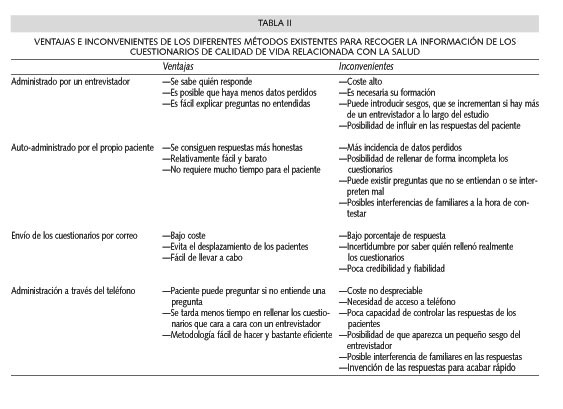
Aunque es posible emplear entrevistas telefónicas para recoger la información de los cuestionarios, o bien enviarlos por correo para que los pacientes los rellenen en sus domicilios, en nuestro medio no suelen utilizarse dado que es difícil controlar los posibles sesgos y factores de confusión, y que los pacientes son fácilmente influenciables por la situación, el entorno y los familiares. En la Tabla II, se describen las ventajas e inconvenientes de cada uno de los métodos existentes para recoger la información de los pacientes.
Deberá dejarse constancia en el protocolo que la valoración de la CVRS deberá efectuarse con la misma calidad metodológica que la evaluación del resto de variables clínicas a estudiar. Con el fin de lograr que todos los participantes en el ECC tengan claro la necesidad de recoger datos de CVRS con el máximo de garantía, será necesario explicar detenidamente a los pacientes la manera de rellenar los cuestionarios, y concienciarlos de lo importante que va a ser contestar correctamente a todas las preguntas, todas las veces especificado a lo largo del estudio. Además, si en el estudio van a intervenir entrevistadores, habrá que entrenarlos y sería conveniente elaborar un manual del entrevistador con pautas a seguir para resolver las dudas que surjan a lo largo del estudio.
Por otra parte, deberían ser elaborados unos procedimientos normalizados de actuación sobre la forma de administrar y recoger la información de los cuestionarios de CVRS, donde se especificase como el investigador debería actuar con los datos perdidos de pacientes y que medidas se podrían adoptar para incrementar el cumplimiento correcto de todos los cuestionarios por parte de cada uno de los participantes en el estudio. Además, el hecho de disponer de un folleto donde se recopilasen todas las recomendaciones sobre la mejor manera de medir la CVRS en el estudio, podría servir de guía al investigador y demás participantes en el estudio e incrementar la tasa de cuestionarios bien rellenos (45).
En el protocolo debería estar bien descrito el momento en el que va a recogerse información sobre la CVRS a lo largo del tiempo que dure el seguimiento del ECC. Además, habrá que explicitar que se va a hacer con los abandonos y cuándo se les va a medir la CVRS (en el momento del abandono, o también periódicamente durante un tiempo después, si fuera posible).
El número preciso de veces en las que habrá que medir la CVRS a lo largo del ECC, va a depender de la enfermedad diana (agua o crónica) y su severidad, del riesgo de los pacientes en sufrir un abandono del estudio, del tiempo que se espera para que aparezca la respuesta a los tratamientos administrados, de la duración del ECC y del número de respuestas de los instrumentos utilizados para su medición (o sea, de lo largo que sea el instrumento). En la mayoría de los ECC, se suele efectuar una medición de la CVRS antes de empezar el ECC (medición basal) y luego se deben incluir mediciones en los momentos que se prevea que van a ocurrir los cambios en la evolución de la enfermedad. Si se realizan evaluaciones de la CVRS con demasiada frecuencia, se incrementará el número de datos perdidos y se aumentará el error tipo I debido a la realización de múltiples pruebas estadísticas. Sin embargo, una cuantificación de la CVRS demasiado espaciada en el tiempo o no efectuada al final del ECC podría poner en peligro la validez y relevancia de las conclusiones del estudio de CVRS (46).
Aunque en muchas ocasiones va a ser suficiente efectuar una valoración de la CVRS en el momento de la asignación aleatoria (antes de recibir ninguna terapia) y otra al finalizar el ECC o cuando el paciente abandone éste o sea retirado, en otras muchas ocasiones será deseable administrar el cuestionario más veces, siendo suficiente en la mayoría de los casos una medición cada 3-6-12 meses, dependiendo de la duración del ECC.
A la hora de rellenar los cuestionarios por parte de los pacientes, habrá que disponer de un sitio tranquilo en el lugar donde son vistos y seguidos por el investigador, con el fin de asegurar su privacidad y confidencialidad, y estos deberían rellenar los cuestionarios solos sin la presencia de familiares o personal investigador (y sin ningún tipo de presión por el tiempo que necesiten para ello), aunque siempre es deseable que alguna persona que participa en el estudio este disponible por si apareciesen dudas sobre alguna pregunta del cuestionario o no se entendiese bien su significado.
Por otra parte, siempre debería preferirse que los cuestionarios fueran completados por los pacientes antes del examen físico u otras pruebas que tengan que realizarse, y antes de ser visto por el investigador, ya que de esta manera se evitarán posibles interferencias e influencias en la contestación de los cuestionarios por parte de los pacientes.
ANÁLISIS E INTERPRETACIÓN DE LOS RESULTADOS DEL ESTUDIO DE CVRS
Todos los participantes en el estudio de CVRS deberán ser evaluados, notificándose los siguientes datos: el número de centros participantes, porcentaje de pacientes que fueron incluidos en cada centro, proporción de los que no fueron elegidos (aportando las razones), porcentaje de pacientes que rehusaron participar, proporción de pacientes que no pudieron rellenar correctamente el cuestionario, etc. Será necesario intentar dilucidar sí, a priori, existen diferencias significativas en distintas variables entre el grupo de pacientes que ha participado en el estudio y aquéllos que inicialmente fueron elegidos (pero que finalmente no participaron en el mismo), aspecto clave a la hora de poder generalizar los hallazgos del estudio.
En cada grupo de tratamiento del ECC, habrá que recoger la siguiente información de los pacientes incluidos en el estudio de CVRS (47):
Número de pacientes incluidos.
Proporción de pacientes excluidos (incluyendo las causas).
Número de pacientes con datos perdidos.
Relación de pacientes adecuadamente seguidos.
Proporción de pacientes que abandonaron o fueron retirados antes de finalizar el estudio.
Porcentaje de pacientes tratados acorde al protocolo.
Número de pacientes con violaciones menores y mayores del protocolo.
Por otra parte, habrá que evaluar el grado de cumplimiento de los pacientes con los cuestionarios, dividiendo en número de cuestionarios rellenos a lo largo del estudio entre el número de cuestionarios que deberían haberse completado, acorde al protocolo.
Los datos de CVRS que habría que comunicar, deberían incluir todas las mediciones efectuadas a lo largo del estudio de los cuestionarios (fijándose especialmente en las dimensiones que se haya decidido que son las más importantes) conjuntamente con sus distribuciones, evaluadas a través de la media, desviación estándar y rango. También es posible emplear gráficos e histogramas para presentar los datos de CVRS, aunque no es una práctica muy frecuente.
Además, deberían presentarse los procedimientos por los que se ha hecho la corrección de las puntuaciones de las distintas dimensiones en los instrumentos empleados, el posible rango de las puntuaciones y la dirección del cambio. En aras de aportar el máximo de información posible, e intentar incrementar la credibilidad y aplicabilidad de los resultados, sería conveniente notificar y discutir no sólo las diferencias significativas encontradas en distintas dimensiones, sino también aquellas dimensiones en las que no se obtuvieron diferencias.
A la hora de comunicar los resultados del estudio de CVRS, será vital explicitar las pruebas estadísticas efectuadas para contrastar la hipótesis del estudio, y habrá que focalizarse especialmente en las empleadas para evaluar las dimensiones que se consideraron como más relevantes al inicio del estudio.
Si en el ECC, solamente se va a medir la CVRS basalmente y al finalizar el estudio (o sea sólo dos mediciones), se utilizará la prueba de la t de Student para datos apareados o relacionados, y en el caso que se sospeche que los datos no van a seguir un patrón de normalidad, se usará el test de Wilcoxon.
Cuando existan varias mediciones de la CVRS a lo largo del ECC, lo más común es emplear análisis univariantes, utilizando un análisis de la varianza factorial mixto (ANOVA) que incluya un factor de comparación intergrupo y un factor de comparación intragrupo, y si los grupos en comparación son pequeños, existe una clara asimetría entre los grupos o se sospecha que puedan seguir una distribución no paramétrica, se empleará la prueba de Fridman. También se puede emplear un análisis multivariante de la varianza (MANOVA), sobre todo si la proporción de pacientes con datos perdidos no es muy elevada.
Con el fin de poder comparar todas las dimensiones de un cuestionario entre los diferentes grupos en estudio, sin que se incremente el nivel global de error tipo I, se pueden emplear las siguientes técnicas:
1. Un nivel de significación puede ser corregido al número de comparaciones estadísticas efectuadas, por ejemplo usando la corrección de Bonferroni, dónde α = 0,05/K, siendo K el número de comparaciones globales (42).
2. Efectuar un análisis multivariante incluyendo todas las dimensiones de los cuestionarios, medidos varias veces a lo largo del estudio.
3. Emplear un análisis de la curva de crecimiento.
4. Intentar utilizar un único valor que refleje la puntuación global de todas las dimensiones del cuestionario, aunque esta práctica puede enmascarar cambios sucedidos en distintas dimensiones, especialmente cambios ocurridos en diferentes direcciones.
Si se utiliza el análisis de supervivencia para representar la evolución de la puntuación de las dimensiones de CVRS, habrá que documentar claramente los mecanismos empleados para manejar los datos obtenidos a diferentes períodos de seguimiento del estudio (censored data) .
A continuación, se debería expresar las diferencias encontradas en las dimensiones de CVRS evaluadas entre los grupos en comparación a través de la media, desviación estándar, junto con el valor de la p obtenido y el intervalo de confianza al 95% (48). Una vez que se haya demostrado una diferencia estadísticamente significativa entre dimensiones en los grupos en estudio, el siguiente paso será evaluar si esta diferencia es clínicamente relevante o no, dependiendo si se sitúa por encima o no de la mínima diferencia importante fijada de antemano.
Para poder realizar este cometido, existen dos diferentes aproximaciones a la hora de valorar los cambios encontrados en distintas dimensiones de CVRS. La primera se basa en la distribución de los cambios y se deriva de la lógica estadística, denominándose tamaño del efecto (y, a veces, se denomina como sensibilidad interna al cambio). La segunda se basa en el contenido de los cambios y se obtiene de su comparación con las modificaciones de otras variables, bien comunicadas por el propio pacientes (estado de salud, satisfacción, nivel de bienestar, etc.) o bien variables clínicas externas (también se conoce como sensibilidad externa al cambio) (49).
El tamaño del efecto, que compara la diferencia de la puntuación media pre y postratamiento de una dimensión o un instrumento (si se resume en un índice de salud) con la variabilidad de sus puntuaciones pretratamiento, es un parámetro útil para poder comparar puntuaciones en diferentes estudios, decidir la importancia del efecto de un tratamiento dentro de un estudio de CVRS o comparar distintos cuestionarios entre si. Se acepta que un valor de 0,2 significa un tamaño de efecto pequeño, 0,5 un tamaño de efecto moderado e igual o mayor a 0,8 un tamaño de efecto elevado (50).
Hay autores que han criticado este parámetro, ya que su valor depende del tamaño muestral del estudio, y sobretodo de la variabilidad de la población incluida (pequeñas diferencias numéricas con baja varianza y una muestra amplia producen un elevado tamaño del efecto). Por otra parte, no proporciona una estimación de la diferencia clínicamente significativa, ya que no es una interpretación directa de la magnitud de los cambios observados (51). Una alternativa plausible sería el empleo del error estándar, de la medición de la CVRS (standard error of measurement) (SEM), ya que se ha visto, que podría definir la relevancia clínica, debido a que un cambio en este parámetro se correspondería bastante bien con la percepción del cambio por el propio paciente. El error estándar de la medición se define como la variabilidad entre la puntuación individual observada y la verdadera puntuación, y se obtiene multiplicando la desviación estándar de la puntuación basal por la raíz cuadrada de uno menos la fiabilidad de la medición de la CVRS, siendo independiente su valor del tamaño muestral (52).
La aproximación basada en el contenido de los cambios, también denominada basada en anclajes (anchor-based methods) , examina la relación entre la puntuación del instrumento empleado y diferentes medidas independientes o anclajes. Por ejemplo, se podría evaluar la relación entre las puntuaciones de un instrumento específico que mide CVRS en pacientes con insuficiencia cardiaca y la medida de la clasificación funcional de la New York Heart Association (NYHA).
Van a existir dos tipos diferentes de metodologías en esta aproximación: a) aquella focalizada en la población, en la que se necesita varios tipos de anclajes, y en la que al final se va a obtener la relación entre la medida de la CVRS en evaluación y los múltiples anclajes elegidos; y b) aquella orientada en el individuo, en la cual sólo se va a necesitar un anclaje y en la que al final se va a obtener un valor umbral que representa la mínima diferencia importante (diferencia entre cambios triviales y cambios importantes en la CVRS) (53).
Esta metodología va a requerir que los anclajes elegidos sean interpretables y que exista una asociación apreciable entre el grupo de pacientes evaluados y la patología que padecen, el instrumento empleado y el anclaje escogido.
A la hora de analizar los resultados de estas técnicas de anclaje, se emplean diferentes métodos, siendo los más habituales las curvas ROC (receiver operating characteristic curve) (que proporcionan una información extensa sobre la relación existente entre el cambio de medición de una variable y la modificación de un indicador externo), el análisis de correlación y los modelos de regresión, en los que se comparan las puntuaciones obtenidas en los instrumentos de CVRS con las distintas variables clínicas elegidas (54).
Recientemente, se ha comprobado que a la hora de definir la diferencia en CRVS que se puede considerar como clínicamente importante, es diferente sí los pacientes ganan o pierden CVRS. En el primer caso, pequeñas ganancias suelen tener un valor significativo y relevante, mientras que cuando se disminuye en CVRS las perdidas suelen ser menos relevantes, quizás debido a que los pacientes tienden a minimizar evoluciones negativas de su enfermedad. Este aspecto será necesario tenerlo en mente a la hora de definir lo que se va a considerar como mínima diferencia clínicamente relevante, cuando se vaya a realizar un estudio de CVRS en el seno de un ECC (55).
Por otra parte, en algunas circunstancias (especialmente, en patologías graves como cáncer, sida, lesiones medulares, etc.), se ha visto que el significado de las preguntas cambia para los pacientes a lo largo del tiempo, lo que se ha denominado como un cambio en la respuesta (response shift). Este hecho puede motivar que se distorsione la interpretabilidad de los resultados, y que se extraigan conclusiones poco precisas y fiables (56).
A la hora de analizar e interpretar los resultados del estudio de CVRS, la existencia de datos perdidos (datos que faltan en alguna dimensión de un cuestionario o cuestionarios enteros que no se han rellenado) es un problema grave, ya que va a producir una disminución importante del poder estadístico del estudio y a introducir sesgos difíciles de manejar, lo que dificultará la interpretación de los resultados.
De forma general, en los estudios de CVRS el porcentaje de datos perdidos suele ser más alto que cuando la variable de evaluación es clínica o fisiológica, ya que los cuestionarios para medir la CVRS contienen varias preguntas y consumen tiempo en rellenarlos. Sin embargo, hay que tener bien claro que aquellos pacientes que efectúan una mala cumplimentación de los intrumentos de CVRS, probablemente van a ser diferentes del resto, y por lo tanto, será necesario emplear técnicas específicas para su análisis (57).
Cuando la proporción de evaluaciones perdidas es pequeña (<5%), el potencial impacto en el poder del estudio, o en generar sesgos, es muy bajo. Si ésta se sitúa entre el 10-20% de datos perdidos, el impacto dependerá del tipo de estudio, y existirán unos dónde éste será alto y otros dónde no. Cuando la proporción de datos perdidos se encuentra alrededor del 50%, las conclusiones del estudio deberán ser muy restrictivas, limitadas y conservadoras.
Dependiendo de si la razón de la perdida está en relación o no con la CVRS del paciente, se pueden considerar tres tipos diferentes de datos perdidos:
1. Si la probabilidad de datos perdidos solamente depende de las puntuaciones de las mediciones más recientes de la CVRS, y éstos se distribuyen igualmente entre todas las dimensiones del cuestionario, o los cuestionarios que faltan se asignan igualmente entre los grupos en estudio, se considera que son datos perdidos aleatorizados (missing at random) (MAR).
2. Se considera datos no perdidos por aleatorización o no ignorables (not missing at random) (NMAR), cuando la perdida es dependiente de la CVRS en el momento en que los datos se pierden (por ej., no se rellena el cuestionario), y también de covariables y factores asociados. Este tipo de datos perdidos se da con más frecuencia cuando los pacientes experimentan efectos adversos, se produce una progresión de la enfermedad o fallecen. Contrariamente, también pueden aparecer cuando se produce una mejoría importante en la sintomatología de los pacientes, ya que estarían menos deseosos de volver a las visitas de seguimiento y de rellenar los cuestionarios de CVRS.
3. Si las causas de que se hayan producido datos perdidos son completamente ajenas a las puntuaciones de la CVRS de los pacientes, enfermedad de base u otros factores asociados (p. ej. si la enfermera y/o el investigador olvidan pedir al paciente que rellene el cuestionario, o si el paciente se cambia de lugar de residencia) se considera que son datos perdidos completamente aleatorizados (missing completely at random) (MCAR).
Aunque cada estudio presenta sus peculiaridades, en general es difícil pensar que los datos perdidos van a ser del último tipo, y por consiguiente no podrán ser ignorados sin introducir sesgos importantes en el análisis de los datos (58).
A la hora de efectuar el análisis, si lo que faltan son algunos datos de determinadas dimensiones, lo que suele emplearse es una simple imputación del valor medio, empleando los datos del propio paciente (los datos perdidos se reemplazan con la media de todos los datos bien recogidos en la dimensión evaluada) o bien datos de otros pacientes (los datos que faltan son reemplazados por el valor medio de los pacientes que respondieron bien a estas preguntas). También puede emplearse la imputación a través de un modelo de regresión, donde se realiza una regresión entre los datos perdidos y los datos bien recogidos de los mismos pacientes. Posteriormente, el valor de los datos que faltan se estima usando la información que nos proporcionan los datos bien recogidos de los sujetos en los que existen los datos perdidos (59).
Cuando lo que faltan son cuestionarios enteros o dimensiones completas de un cuestionario, el método de la última observación llevada adelante (last observation carried forward) (LOCF) es una de las técnicas que más se emplean en la actualidad, aunque a veces es necesario emplear otras más sofisticadas, tales como la imputación basada en modelos de regresión, el análisis de la curva de crecimiento o los modelos de efectos mixtos (60,61).
En aquellas ocasiones donde exista una alta proporción de datos perdidos debido a toxicidad, morbilidad o mortalidad, se debería efectuar un análisis de sensibilidad para explorar la posibilidad de que los datos que faltan no sean aleatorizados (62).
Por otra parte, e independientemente del método empleado para analizar los datos perdidos, siempre debería comunicarse y hacerse explícito el número de cuestionarios perdidos o de los datos que faltan (y sus posibles razones) en cada grupo de pacientes en estudio, lo que ayudaría a los lectores a poder evaluar los resultados finales con mayor profundidad.
Una de las maneras más útiles para presentar los datos, y de fácil e intuitiva interpretación, es facilitar el número de pacientes que es necesario tratar (NNT). El NNT se obtiene del recíproco de la reducción del riesgo absoluto, y en la práctica significa el número de pacientes que tienen que ser tratados durante un período definido para que un paciente incremente su puntuación en CVRS (63). Así, si en un ECC se hubiese encontrado una diferencia de 0,25 por encima de la mínima diferencia clínicamente importante (fijada con antelación) entre las puntuaciones de una dimensión en los grupos comparados (o entre las puntuaciones globales de un cuestionario), el NNT sería de cuatro, o sea que sería necesario tratar a cuatro pacientes para que uno mostrase mejoría en la CVRS. Este parámetro cada día se emplea más a la hora de notificar los resultados de ECC, ya que da una aproximación muy buena de la magnitud del efecto obtenido con las alternativas terapéuticas en estudio, y por lo tanto es útil para tomar decisiones acertadas (64).
DISCUSIÓN Y CONCLUSIONES DE LOS RESULTADOS
Siempre será necesario discutir la generabilidad de los resultados encontrados en el estudio de CVRS, y si es posible extrapolar éstos a toda la población (lo que requerirá una alta validez externa). Además, deberían compararse los resultados encontrados con los hallados en otros estudios ya efectuados, viendo las semejanzas y las divergencias. Si las discrepancias fuesen muy importantes, quizás habría que proponer nuevos estudios, intentando evitar los aspectos más negativos de los diseños anteriores.
Aunque no existen directrices claras al respecto, para poder decir que un tratamiento produce una mejoría en la CVRS respecto a otro, sería necesario que al menos en dos o tres de las dimensiones mayores de un cuestionario genérico (por ej. función física, fisiológica y funciones sociales) se hubieran obtenido diferencias estadísticamente significativas o bien que en un instrumento específico se hubiera detectado una diferencia significativa y relevante entre los grupos en estudio, en una dimensión muy importante para la patología diana.
Cuando se encuentre una diferencia estadísticamente significativa en sólo una o dos dimensiones del cuestionario de CVRS (y éste tenga varias dimensiones), no se podrá concluir que existen diferencias relevantes en CVRS entre los grupos en estudio. En este caso, lo único que podrá concluirse es que un tratamiento presenta una diferencia significativa frente al otro en una ó dos dimensiones del cuestionario, pero no globalmente, siendo difícil de interpretar y de graduar en cuanto a su posible relevancia clínica.
Aunque no existe ningún tipo de consenso ni directrices en este sentido, a la hora de evaluar si la diferencia encontrada es clínicamente relevante, habría que fijarse especialmente en tres variables, siendo recomendable que presenten unos valores determinados: el tamaño del efecto (que debería estar por encima de 0,5), el NNT (que debería ser menor de 10) y el coste derivado de obtener cada unidad de incremento en CVRS (que debería tener un valor que fuese lógico y razonable) (65,66).
Por otra parte, si en el estudio de CVRS un tratamiento produce una diferencia significativa en una dimensión, mientras que el tratamiento comparador la produce en otra dimensión, no se podrán sacar conclusiones claras y validas, y probablemente, lo mejor sería efectuar otro estudio, intentando corregir los fallos cometidos en el anterior.
Si, por el contrario, no encontrásemos diferencias significativas en ninguna dimensión entre los tratamientos en estudio, es posible que no se hayan elegido bien a los pacientes participantes (no estén demasiado enfermos), que el instrumento escogido para medir la CVRS no presente la suficiente fiabilidad, validez y sensibilidad al cambio, que el tamaño muestral no sea el adecuado (bajo poder estadístico del estudio) o que realmente el tratamiento en estudio no produce mejoría en la CVRS cuando se compara con el comparador. Siempre que nos encontremos con un resultado negativo en un estudio de CVRS, habrá que preguntarse cuál de las causas (expuestas anteriormente) es la responsable, ya que será importante a la hora de proponer nuevas investigaciones en el futuro.
Además, es posible que se encuentren divergencias entre la medida de variables clínicas y CVRS, lo que puede indicar que se están midiendo diferentes conceptos, aunque también podría ser que se haya empleado un instrumento poco apropiado, que se hayan seleccionado las dimensiones principales de forma equivocada o que el momento en que se han medido no es el más correcto para uno de ellos
Antes de pasar a expresar las conclusiones del estudio, siempre debería existir una pequeña parte destinada a discutir posibles limitaciones del mismo, y los autores deberían ser lo suficientemente honestos como para intentar explicitar y discutir, abiertamente y desde su punto de vista, estas posibles restricciones y sus posibles causas.
Finalmente, las conclusiones extraídas del estudio deberán ser coherentes con los resultados, y dentro de lo posible deberá proponerse nuevas líneas de trabajo para el futuro, en aras de esclarecer puntos que no hayan quedado suficientemente claros.
CONCLUSIONES
La importancia de estudiar la CVRS ha aumentado en los últimos años, habiendo adquirido una enorme relevancia como medida de resultado de los nuevos medicamentos y otras intervenciones sanitarias. Su evaluación va a aportar información a los clínicos, gestores y otros agentes decisores sobre el impacto de la enfermedad y de su tratamiento en el propio paciente, así como en su sensación última de bienestar con la vida.
De alguna manera, su medición nos va a proporcionar aquellos aspectos subjetivos que van a permitir evaluar la percepción del paciente sobre su propia enfermedad y el tratamiento administrado y a conocer como le afecta en su felicidad, satisfacción con la vida y sensación de bienestar. En el siglo XXI, el paciente va a ser el actor emergente más importante y con mayor poder de decisión en todos los sistemas sanitarios, y como tal, será crucial conocer como las diferentes enfermedades y los distintos tratamientos administrados van a influir en su CVRS. Para el clínico, conocer la CVRS de sus pacientes le va a permitir poder identificar problemas funcionales y/o emocionales inesperados, monitorizar la progresión de la enfermedad y su respuesta al tratamiento y mejorar la relación y comunicación médico-paciente (67,68).
Cada día se valora más que un nuevo medicamento aporte, además de eficacia, seguridad y calidad, otros valores terapéuticos añadidos, tales como mayor efectividad clínica, más ventajas farmacoeconómicas y una mayor CVRS y grado de satisfacción para el paciente. Por este motivo, es esencial disponer de estos datos en el momento en que el nuevo medicamento llega al mercado, con el fin de que se puedan tomar las decisiones más acertadas en cuanto a su uso rutinario en la práctica médica diaria.
Es por estas razones, que el ECC se erige como la fórmula más apropiada para recoger datos de CVRS antes de que el nuevo medicamento llegue al mercado, y tenga que competir con las alternativas terapéuticas ya existentes.
Los estudios de CVRS se deben efectuar, tanto durante la fase II como durante la fase III del desarrollo clínico de un nuevo medicamento, así como tras su comercialización en la fase IV, cuando se busque una nueva indicación o extender su uso a grupos de pacientes no estudiados anteriormente. De hecho, tanto la Agencia Reguladora de Medicamentos en USA (FDA) como la Agencia Europea del Medicamento (EMEA) consideran que los datos de CVRS pueden ser incluidos en las fichas técnicas de los productos, y de alguna manera pueden ser considerados como datos adicionales de efectividad de los nuevos medicamentos, especialmente en aquellos destinados a patologías crónicas con un gran componente de implicación subjetiva del paciente, como por ej. cáncer, sida, epilepsia, parkinson, etc. (69-71).
Sin embargo, hay que tener bien presente que sí queremos que la medición de la CVRS haga una contribución importante a la hora de evaluar los nuevos medicamentos, va a ser necesario que los estudios de CVRS que se efectúen en el seno de un ECC, sean de una calidad excepcional. Por este motivo, será crucial adoptar en su diseño, realización, análisis e interpretación la mejor metodología y las mejores prácticas, incluyendo lo que se podría denominar como las buenas prácticas en calidad de vida relacionada con la salud.
Para que esto sea una realidad, se hace imprescindible elaborar unas recomendaciones que ayuden a todos los participantes en los estudios de CVRS, a que se efectúen de la mejor manera y con los más altos estándares de calidad. Esta es la gran aportación de este trabajo, al proporcionar tanto a quién diseña, realiza y analiza el estudio, como al clínico, gestor y otros agentes decisores, unos pasos que hay que seguir al elaborar y/o evaluar estudios de CVRS, de novo o ya efectuados, en nuestro país.
La evaluación de la CVRS ha llegado a nuestro entorno sanitario para quedarse, como un valor terapéutico cada día más relevante a la hora de tomar decisiones coherentes y apropiadas en política de medicamentos. En nuestra mano está que este criterio sea cada vez de mayor peso e importanciay para todo tipo de agente decisor en nuestro sistema nacional de salud, que es de todos y para todos.
Bibliografía
1. Casa Anguita J, Repullo Labrador JR, Pereira Candal J. Medidas de calidad de vida relacionada con la salud. Conceptos básicos, construcción y adaptación cultural. Med Clin (Barc) 2001; 116: 26-33. [ Links ]
2. Farsides B, Dunlop RJ. Is there such a thing as a life not worth living? BMJ 2001; 322: 1481-1483. [ Links ]
3. Cella DF, Wiklund I, Shumaker SA, Aaronson NK. Integrating health-related quality of life into cross-national clinical trials. Qual Life Res 1993; 2: 433-440. [ Links ]
4. Lee CW, Chi KN. The standard of reporting of health-related quality of life in clinical cancer trials. J Clin Epidemiol 2000; 53: 451-458. [ Links ]
5. Sanders C, Egger M, Donovan J, et al. Reporting on quality of life in randomized clinical trials: bibliographic study. BMJ 1998; 317: 1191-1194. [ Links ]
6. Chassany O, Bergmann JF, Caulin C. Reporting on quality of life in randomized controlled trials. BMJ 1999; 38: 1142. [ Links ]
7. Kong SX, Gaudhi SK. Methodologic assessments of quality of life measures in clinical trials. Ann Pharmacother 1997; 31: 830-836. [ Links ]
8. Revicki DA, Rothman M, Luce B. Health-related quality of life assessments and the pharmaceutical industry. PharmacoEconomics 1992; 1: 394-408. [ Links ]
9. Coons SJ, Kaplan RM. Assessing health-related quality of life: application to drug therapy. Clin Ther 1992; 14: 850-858. [ Links ]
10. Pocock SJ. A perspective on the role of quality of life assessment in clinical trials. Control Clin Trials 1991; 12 (Suppl): 257-265. [ Links ]
11. Jaeschke R, Singer J, Guyatt G. Measurement of health status: ascertaining minimal clinically important difference. Control Clin Trials 1989; 10: 407-415. [ Links ]
12. Lydick E, Epstein RS. Interpretation of quality of life changes. Qual Life Res 1993; 2: 221-226. [ Links ]
13. Gill TM, Feinstein AR. A critical apparaisal of the quality of quality of life instruments. JAMA 1994; 272: 619-626. [ Links ]
14. Guyatt GH, Kirshner B, Jaeschke R. Measuring health status: what are the necessary measurement properties? J Clin Epidemiol 1992; 45: 1341-1345. [ Links ]
15. Hays R, Hadorn D. Responsiveness to change: An aspect of validity, not a separate dimension. Qual Life Res 1992; 1: 73-75. [ Links ]
16. Coons SJ, Rao S, Keininger DL, Hays RD. A comparative review of generic quality of life questionnaires. Pharmacoeconomics 2000; 17: 13-35. [ Links ]
17. Guyatt GH, Bombadier C, Tugwell PX. Measuring disease-specific quality of life in clinical trials. Can Med Assoc J 1986; 134: 889-895. [ Links ]
18. Dowie J. Decisión validity should determine whether a generic or condition-specific HRQOL measure is used in health care decisions. Health Econ 2002; 11: 1-8. [ Links ]
19. Fletcher A, Gore S, Jones D, Fiztpatrick R, Spiegelhalter D, Cox D. Quality of life measures in health care II: Design, analysis, and interpretation. Br Med J 1992; 305: 1145-1148. [ Links ]
20. Guyatt G, Feeny D, Patrick D. Issues in quality of life measurement in clinical trials. Control Clin Trials 1991; 12: 81S-90S. [ Links ]
21. Scientific Advisory Committee of the Medical Outcomes Trust. Assessing health status and quality-of-life instruments: Attributes and review criteria. Qual Life Res 2002; 11: 193-205. [ Links ]
22. Kirschner B, Guyatt GH. A methodologic framework for assessing health indices. J Chronic Diseases 1985; 38: 27-36. [ Links ]
23. Lohr KN, Aaronson NK, Alonso J, Burnam MA, Patrick DL, Perrin EB, et al. Evaluating quality-of-life and health status instruments: development of scientific review criteria. Clin Ther 1996; 18: 979-992. [ Links ]
24. Testa MA, Nackley JF. Methods for quality-of-life studies. Ann Rev Public Health 1994, 15: 535-559. [ Links ]
25. Bergner M, Rothman ML. Health status measures: an overview and guide for selection. Ann Rev Public Health 1987; 8: 191-210 . [ Links ]
26. Cramer JA for the ILAE Subcomission on Outcome Measurement in clinical trials. Epilepsia 2002; 43: 1084-1095. [ Links ]
27. Fitzpatrick R, Fletcher A, Gore S, Jones D, Spiegelhalter D, Cox D. Quality of life measures in health care I: Applications and issues in assessment. Br Med J 1992; 305: 1074-1077. [ Links ]
28. Rumsfeld JS, Whinney SM, McCarthy M, Shroyer AL, Villanueva CB, O'Brien M, et al. Health-related quality of life as a predictor of mortality following coronary artery bypass graft surgery. JAMA 1999; 281: 1298-1303. [ Links ]
29. Alonso J. La medida de la calidad de vida relacionada con la salud en la investigación y la práctica clínica. Gac Sanit 2000; 14: 163-167. [ Links ]
30. Deyo RA, Diehr P, Patrick DL. Reproducibility and responsiveness of health status measures. Statistics and strategies for evaluation. Control Clin Trials 1991; 12: S142-S158. [ Links ]
31. Badia X, Carné X. La evaluación de la calidad de vida en el contexto del ensayo clínico. Med Clin (Barc) 1998; 110: 550-556. [ Links ]
32. Bullinger M, Anderson R, Cella D, Aaronson N. Developing and evaluating cross-cultural instruments from minimum requirements to optimal models. Qual Life Res 1993; 2: 451-459. [ Links ]
33. Guillemin F, Bombardier C, Beaton D. Cross-cultural adaptation of health-related quality of life measures: Literature review and proposed guidelines. J Clin Epidemiol 1993; 46: 1417-1432. [ Links ]
34. Spilker B. Quality of life trials. In: Spilker B, ed. Guide to clinical trials. New York, NY. Raven Press; 1991: 370-378. [ Links ]
35. Simes RJ, Greatorex V, Gebski VJ. Practical approaches to minimize problems with missing quality of life data. Stat Med 1998; 17: 725-737. [ Links ]
36. Bernhard J, Cella DF, Coates CA, Fallowfield L, Ganz PA, Moinpour CH, et al. Missing quality of life data in cancer clinical trials: serious problems and challenges. Stat Med 1998; 17: 517-532. [ Links ]
37. Juniper EF. Quality of life questionnaires: does statistically significant = clinically important? J Allergy Clin Immunol 1998; 102: 16-17. [ Links ]
38. Lydick E, Epstein RS. Clinical significance of quality of life data. In: Spilker B, ed. Quality of life and pharmacoeconomics in clinical trials. Philadelphia, PA: Lippincott-Raven Publishers; 1996: 461-465. [ Links ]
39. Kazis LE, Anderson JJ, Meenan RF. Effect sizes for interpreting changes in health status. Med Care 1989; 27 (Supl. 3): S1278-S189. [ Links ]
40. Fletcher A. Quality-of-life measurements in the evaluation of treatment: proposed guidelines. Br J Clin Pharmac 1995; 39: 217-222. [ Links ]
41. Offerhaus L. Measurement of the quality of life in clinical trials: in pursuit of the unapproachable. Eur J Clin Pharmacol 1991; 40: 205-208. [ Links ]
42. Fairclough DL, Gelber RD. Quality of life: Statistical issues and analysis. In: Spilker B, ed. Quality of life and pharmacoeconomics in clinical trials. Philadelphia, PA. Lippincott-Raven Publishers 1996; 427-435. [ Links ]
43. Guyatt GH, Juniper EF, Walter SD, Griffith LE, Goldstein RS. Interpreting treatment effects in randomised trials. BMJ 1998; 316: 690-693. [ Links ]
44. Fletcher AE, Hunt BM, Bulpitt CJ. Evaluation of quality of life in clinical trials in cardiovascular disease. J Chron Dis 1987; 40: 557-566. [ Links ]
45. Cella DF, Wiklund I, Shumaker SA, Aaronson NK. Integrating health-related quality of life into cross-national clinical trials. Qual Life Res 1993; 2: 433-440. [ Links ]
46. Wiklund I. Practical issues in the design and inclusion of quality of life in multicenter clinical trials. Br J Med Econ 1993; 6C: 45-48. [ Links ]
47. Staquet M, Berzon R, Osoba D, Machin D. Guidelines for reporting results of quality of life assessments in clinical trials. Qual Life Res 1996; 5: 496-502. [ Links ]
48. Schumaker M, Olschewski M, Schulgen G. Assessment of quality of life in clinical trials. Stat Med 1991; 10: 1915-1930. [ Links ]
49. Husted JA, Cook RJ, Farewell VT, Gladman DD. Methods for assessing responsiveness: a critical review and recommendations. J Clin Epidemiol 2000; 53: 459-468. [ Links ]
50. Samsa G, Edelman D, Rothman ML, Williams GR, Lipscomb J, Matchar D. Determining clinically important differences in health status measures. Pharmacoeconomics 1999; 15: 141-155. [ Links ]
51. Wyrwich KW, Tierney WM, Wolinsky FD. Using the standard error of measurement to identify important changes on the asthma quality of life questionnaire. Qual Life Res 2002; 11: 1-7. [ Links ]
52. Wyrwich KW, Tierney WM, Wolinsky FD. Further evidence supporting a SEM-based criterion for identifying meaningful intra-individual changes in health-related quality of life. J Clin Epidemiol 1999; 52: 861-873. [ Links ]
53. Guyatt G, Osoba D, Wu A, Wyrwich K, Norman GR and the clinical significance consensus meeting group. Methods to explain the clinical significance of health status measures. Mayo Clin Proc 2002; 77: 371-383. [ Links ]
54. Revicki DA, Osoba D, Fairclough D, Barofsky I, Berzon R, Leidy NK, et al. Recommendations on health-related quality of life research to support labeling and promotional claims in the United States. Qual Life Res 2000; 9: 887-900. [ Links ]
55. Cella D, Hahn EA, Dineen K. Meaningful change in cancer-specific quality of life scores: Differences between improvement and worsening. Qual Life Res 2002; 11: 207-221. [ Links ]
56. Schwartz CE, Sprangers MAG. Methodological approaches for assessing response shift in longitudinal health-related quality-of-life research. Soc Sci Med 1999; 48: 1531-1548. [ Links ]
57. Curran D, Fayers PM, Molenperghs G, Machin D. Analysis of incomplete quality of life data in clinical trials. In: Staquet MJ, Hays RD, Fayers PM, eds. Quality of life assessment in clinical trials. New York, NY. Oxford University Press; 1998: 249-280. [ Links ]
58. Troxel AB, Fairclough DL, Curran D, Hahn EA. Statistical analysis of quality of life with missing data in cancer clinical trials. Stat Med 1998; 17: 517-532. [ Links ]
59. Fairclough DL, Gelber RD. Quality of life: Statistical issues and analysis. In: Spilker B, ed. Quality of life and pharmacoeconomics in clinical trials. Philadelphia, PA. Lippincott-Raven Publishers; 1996: 427-435. [ Links ]
60. Jennrich R, Schluchter M. Unbalanced repeated-measures models with structured covariance matrices. Biometrics 1986; 42: 805-820. [ Links ]
61. Laird NM, Ware JH. Random-effects models for longitudinal data. Biometrics 1982; 38: 963-974. [ Links ]
62. Fairclough DL, Peterson HF, Cella D, Bonomi P. Comparison of several model-based methods for analyzing incomplete quality of life data in cancer clinical trials. Stat Med 1998; 17: 781-796. [ Links ]
63. Cook RJ, Sackett DL. The number needed to treat: a clinically useful measure of treatment effect. Br Med J 1995; 310: 452-454. [ Links ]
64. Juniper EF. The value of quality of life in asthma. Eur Resp Rev 1997; 49: 333-337. [ Links ]
65. Hays RD, Woolley JM. The concept of clinically meaningful difference in health-related quality-of-life research. How meaningful is it? Pharmacoeconomics 2000; 18: 419-423 . [ Links ]
66. Goldstein RS, Gort EH, Guyatt GH, Feeny D. Economic analysis of respiratory rehabilitation. Chest 1997; 112: 370-379. [ Links ]
67. Esparllargues M, Valderas JM, Alonso J. Provisión of feedback on perceived health status to health care professionals: a systematic review of its impact. Med Care 2000; 38: 175-186. [ Links ]
68. Detmar SB, Muller MJ, Schornagel JH, Wever LDV, Aaronson NK. Health-related quality-of-life assessments and patients-physician communication. A randomized controlled trial. JAMA 2002; 288: 3027-3034 . [ Links ]
69. Revicki DA, Leidy NK, Geneste B. Recommendations for evaluating the validity of quality of life claims for labeling and promotional. Value Health 1999; 2: 113-127. [ Links ]
70. Smith N. Quality of life studies from the perspective of an FDA reviewing statistician. Drug Inf J 1993; 27: 617-623. [ Links ]
71. Chassany O, Sagnier P, Marquis P, Fullerton S, Aaronson N fot the European regulatory issues on quality of life assessment group. Patient-reported outcomes: the example of health-related quality of life – A European guidance document for the improved integration of health-related quality of life assessment in the drug regulatory process. Drug Inf J 2002; 36: 209-238. [ Links ]