Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.25 no.4 abr. 2008
Efectividad de Cetuximab en monoterapia en el tratamiento de cánceres de cabeza y cuello avanzado refractario
Effectivity of Cetuximab monotherapy in the treatment of refractory advanced cancer of the head and neck
Y. Escobar Álvarez, P. Khosravi Shahi, S. Encinas García, Y. Izarzugaza Perón
Servicio de Oncología Médica. Hospital General Universitario Gregorio Marañón. Madrid
Dirección para correspondencia
RESUMEN
Introducción: más del 90% de los cánceres de cabeza y cuello (CCC) presentan una sobreexpresión del gen EGFR, y dicha sobreexpresión se asocia a un peor pronóstico. Cetuximab es un anticuerpo monoclonal dirigido contra EGFR.
Pacientes y métodos: hemos llevado a cabo un estudio retrospectivo de una serie de 10 casos consecutivos de CCC metastáticos y/o recurrentes a los que hemos tratado con cetuximab en monoterapia en segundas líneas de tratamiento, con el objetivo principal de analizar la supervivencia libre de progresión (SLP), así como la tasa de respuestas, la supervivencia global (SG) y la toxicidad como objetivos secundarios.
Resultados: la mediana de edad fue de 55 años, y el 100% de los pacientes eran varones. El 40% de los pacientes recibió cetuximab en segunda línea, y el 60% en tercera línea de tratamiento. Con una mediana de seguimiento de 13,5 meses, la mediana de SLP fue de 4 meses (IC95%: 3,4-4,6 meses), y la mediana de SG de 9,7 meses (IC95%: 2,9-16,6 meses). La tasa de respuestas objetivas fue del 10%, y la tasa de beneficio clínico fue del 60% (Remisión parcial = 10% y estabilización > 16 semanas = 50%). El 30% de los pacientes presentaron toxicidad cutánea grado 3.
Conclusiones: cetuximab en monoterapia tiene una efectividad discreta en el tratamiento de CCC refractarios, pero con una toxicidad escasa. Los futuros estudios deberían de encaminarse hacia la combinación de cetuximab con otros agentes quimioterápicos eficaces en el tratamiento de CCC, como los taxanos.
Palabras clave: EGFR. Cisplatino. Cetuximab. Escamoso.
RESUMEN
Introduction: More than 90% of carcinoma of the head and neck (CHN) have an overexpression of the EGFR gene, and that overexpression is associated with a worse prognosis. Cetuximab is a monoclonal antibody against EGFR.
Patients and methods: We have conducted a retrospective study of 10 consecutive cases with metastatic and/or recurrent CHN treated with cetuximab monotherapy as second line therapy, with the main objective of analyzing the progression-free survival (PFS); we also analyzed the response rate, the overall survival (OS), and toxicity profile as second end points.
Results: The median age was 55 years, and 100% of patients were males. Fourty percent of the patients received cetuximab as second line, and 60% as third line therapy. With a median follow-up of 13.5 months, the median PFS was 4 months (95%CI: 3.4-4.6 months), with a median OS of 9.7 months (95%CI: 2.9-16.6 months).The objective response rate was 10%, and the disease control rate was 60% (Partial response = 10% and stable disease for > 16 weeks = 50%). Thirty percent of patients had grade 3 rash.
Conclusions: Cetuximab monotherapy has a modest effectivity in the treatment of refractory CHN, but with a limited toxicity. Future studies should use combinations of cetuximab with others effective chemotherapeutic drugs in the treatment of CHN, such as taxanes.
Key words: EGFR. Cisplatin. Cetuximab. Squamous.
Introducción
Los cánceres de cabeza y cuello (CCC) constituyen un amplio número de tumores localizados en diferentes regiones anatómicas del área cérvico-facial. La mayoría de los CCC son de estirpe escamoso, y presentan una asociación estrecha con el consumo crónico de tabaco y alcohol (90% de los casos). En Estados Unidos se diagnostican aproximadamente 50.000 casos por año, que producen 12.000 muertes anuales, y en el mundo se registran más de 500.000 casos cada año (1).
La quimioterapia paliativa, con regímenes basados en cisplatino, es la principal estrategia terapéutica en la enfermedad metastática y/o recurrente. En pacientes con enfermedad avanzada, la utilización de cisplatino asociado a otros agentes produce una tasa de respuesta del 24% al 76%. Sin embargo, los resultados de tratamientos de segunda línea son muy desalentadores. En el estudio llevado a cabo por León et al. que incluía 151 pacientes con CCC avanzados que habían progresado al cisplatino obtuvieron una mediana de supervivencia de 3,6 meses (2). Por tanto, existe una clara necesidad de desarrollar nuevas estrategias terapéuticas en la enfermedad avanzada refractaria.
El 90% de los CCC presentan una sobreexpresión del gen del receptor del factor de crecimiento epidérmico (EGFR). Dicha sobreexpresión se debe fundamentalmente a una mayor transcripción del gen de EGFR, aunque también puede deberse a una mutación de dicho gen. La sobreexpresión de EGFR se relaciona con un peor pronóstico (menor respuesta al tratamiento, mayor tasa de recidivas y menor supervivencia) (3-5).
El EGFR es una glicoproteína (GP) transmembrana de la superfamilia de erb-B, con actividad tirosin-kinasa (TK), que regula la diferenciación y proliferación celular. Esta GP presenta tres dominios principales: a) extracelular, que actúa como receptor de ligandos específicos como el factor de crecimiento de transformación alfa (TGF-α) y el factor de crecimiento epidérmico (EGF); b) transmembrana; y c) intracelular, con actividad TK. Cuando TGF-α y el EGF se unen a la porción extracelular del EGFR y se produce una dimerización de la TK intracelular que activa la vía de RAS-RAF-MAP Kinasas, produciendo la proliferación celular. Además, se produce la activación de las proteínas STAT-3, las cuales intervienen en la protección de la apoptosis. Por ello, cuando se estimula el EGFR, la célula empieza a proliferar y se previene la apoptosis natural (6). La activación de EGFR también lleva a la estimulación de la fosfatidilinositol-3-kinasa y de la vía del AKT, que también contribuyen a la progresión del ciclo celular (7,8).
Cetuximab es un anticuerpo quimérico humanizado (IgG1) del anticuerpo murino 225 que bloquea el EGFR con una alta afinidad, interrumpiendo la actividad TK (9,10).
Existen dos ensayos clínicos fase II que han evaluado la eficacia de cetuximab en combinación con un derivado de platino en pacientes con un CCC avanzado, en los que se había objetivado una progresión de la enfermedad durante la administración de una quimioterapia basada en platino (11,12). En estos estudios se obtuvieron una tasa de respuestas objetivas (TRO) del 10-11%, y una mediana supervivencia de 5-6 meses. Otro estudio fase II demostró que la administración de cetuximab en monoterapia obtenía los mismos resultados que su combinación con un platino en pacientes con CCC refractario al platino (13).
Con este estudio nosotros pretendemos evaluar la efectividad de cetuximab en monoterapia en pacientes con CCC metastático y/o recurrente refractario a un esquema de quimioterapia basada en platino.
Pacientes y métodos
Hemos llevado a cabo un análisis de nuestra experiencia institucional de una serie retrospectiva de casos consecutivos de pacientes con CCC metastático y/o recurrente en los que se había objetivado una progresión de la enfermedad tras la administración de una quimioterapia basada en platino.
Todos los pacientes del estudio nos dieron su consentimiento informado por escrito para el inicio del tratamiento con cetuximab, y el presente estudio se llevo a cabo conforme a la declaración de Helsinki.
Todos los pacientes incluidos en este estudio presentaban un CCC demostrado histológicamente, y en fase metastática y/o recurrente tras la administración de una o más líneas de quimioterapia paliativa, incluida una línea basada en platino (cisplatino o carboplatino). Se excluyeron a todos aquellos pacientes tratados con cetuximab en un contexto diferente a segundas líneas de rescate.
RÉGIMEN DEL TRATAMIENTO
Los pacientes del estudio fueron tratados con cetuximab en monoterapia con el esquema estándar de 400 mg/m2 IV como dosis de carga, seguido de 250 mg/m2 IV semanal, hasta la aparición de toxicidad inaceptable o progresión de la enfermedad. La administración de un antihistamínico previo al cetuximab no se hizo de forma sistémica.
OBJETIVOS DEL ESTUDIO
El objetivo principal del estudio fue la determinación de la supervivencia libre de progresión (SLP), definida como el período de tiempo que transcurre desde la fecha del consentimiento informado hasta la progresión tumoral o último contacto. Los objetivos secundarios del estudio fueron la determinación de:
-La tasa de respuestas (TR) según los criterios RECIST modificado, definiéndose la tasa de beneficio clínico (TBC) como la proporción de pacientes que alcanzaron una respuesta igual o superior a la estabilización con una duración > 16 semanas.
-La supervivencia global (SG): Definida como el período de tiempo que transcurre desde la fecha del consentimiento informado hasta la fecha de muerte o último contacto.
-La toxicidad debida al cetuximab: definida según los criterios de toxicidad de National Cancer Institute Common Toxicity Criteria (versión 2).
ANÁLISIS ESTADÍSTICOS
Para el análisis estadístico del presente estudio se recurrió al empleo del paquete estadístico SPSS versión 12.0, utilizando el método de Kaplan y Meier para el análisis de las curvas de supervivencia (SLP y SG).
Resultados
En este estudio hemos incluido un total de 10 pacientes consecutivos con CCC metastático y/o recurrente que había progresado a un esquema de quimioterapia basada en cisplatino, y que recibieron el tratamiento con cetuximab en monoterapia.
CARACTERÍSTICAS DEL ESTUDIO
La edad mediana de los pacientes incluidos en el estudio fue de 55 años, y el 100% de los mismos eran varones. La mayoría de los pacientes presentaron un CCC de estirpe epidermoide, frente al 10% con adenocarcinoma. El 40% de los pacientes habían sido tratados en una fase inicial con cirugía radical seguida de radioterapia adyuvante, 20% con cirugía sola y 20% con radio-quimioterapia concomitante. El 30% de los pacientes tenían el tumor primario localizado en la cavidad oral, 30% en la laringe y 20% en la hipofaringe. Las localizaciones más frecuente de las metástasis fueron el pulmón (60%), adenopatías cervicales (50%), y huesos 20%. La mayoría de los pacientes fueron tratados en primea línea de quimioterapia paliativa con el esquema cisplatino/5-Fluoruracilo (80%). El 60% de nuestros pacientes recibió cetuximab en tercera línea de tratamiento, frente al 40% que lo recibió en segunda línea. En la tabla I se detalla las características generales de los pacientes del estudio.
OBJETIVO PRINCIPAL
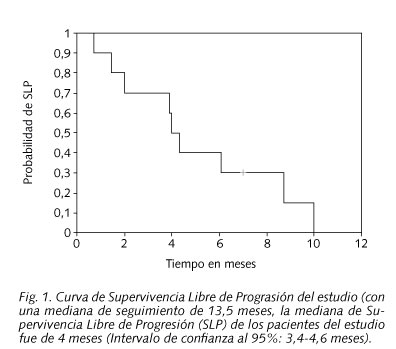
Los pacientes del estudio recibieron una mediana de 21 dosis semanales de cetuximab [Intervalo de confianza al 95% (IC95%): 1-40 dosis]. Con una mediana de seguimiento de 13,5 meses (IC95%:10,4-16,5 meses), la mediana de SLP del estudio fue de 4 meses (IC95%:3,4-4,6 meses) (Fig. 1).
OBJETIVOS SECUNDARIOS
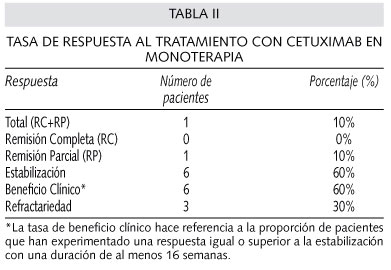
La tasa de remisión parcial (RP) del estudio fue del 10%, con una tasa de estabilizaciones con una duración > 16 semanas del 50%, lo que daba lugar a una TBC del 60% (Tabla II).
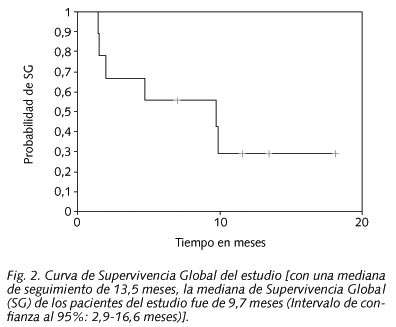
La mediana de SG alcanzada en este estudio fue de 9,7 meses (IC95%: 2,9-16,6 meses). En la figura 2 se puede observar la curva de SG del estudio.
El tratamiento con cetuximab produjo como única toxicidad destacable rash acneiforme, presente en un 30% de los pacientes en grado 3, y no hubo ningún caso de toxicidad grado 4.
Discusión
Cetuximab es un anticuerpo monoclonal humanizado quimérico de tipo IgG1 que se une con alta afinidad al EGFR, interrumpiendo la actividad TK intracelular, de manera que es capaz de inhibir la proliferación celular e inducir la apoptosis en las células neoplásicas.
Nuestro estudio viene a poner de manifiesto una vez más la seguridad y la buena tolerancia al tratamiento con cetuximab, puesto que su toxicidad es fácilmente predecible, siendo la reacción cutánea y la reacciones de hirpersensibilidad prácticamente los únicos efectos adversos limitantes de dosis. Sólo el 30% de nuestros pacientes presentaron lesiones acneiformes grado 3, que fueron fácilmente manejables con el tratamiento de soporte con antihistamínicos y corticoides, sin necesidad de interrumpir el tratamiento. Ningún paciente presentó una toxicidad grado 4 o reacción alérgica. Estos hallazgos están acorde con los resultados obtenidos en diversos estudios publicados (11-13).
En este estudio con una mediana seguimiento de 13,5 meses de los pacientes vivos obtuvimos una mediana SLP de 4 meses, resultado superior a los publicados por Herbst RS y cols. (11) (2,2 meses), Baselga J y cols. (12) (2,8 meses), y Trigo JM (13) (2,3 meses); y una mediana de SG de 9,7 meses también muy superior a los publicados en estos tres estudios mencionados (5,2-6,1 meses). Las posibles explicaciones pueden radicar en el pequeño tamaño muestral de nuestro estudio en comparación con los tres estudios anteriores; así como en la heterogeneidad de la población en estudio, y tratamientos recibidos.
La TRO de nuestro estudio fue baja (remisión completa = 0%, RP = 10%), siendo muy similar a las TRO publicadas en los tres estudios anteriores (10-13%). El 30% de los pacientes de nuestro estudio fueron refractarios a tratamiento con cetuximab en monoterapia, y el beneficio clínico alcanzado fue del 60%.
En un estudio fase II recientemente publicado por Vermorken y cols. (14) que incluía pacientes con cáncer de cabeza y cuello avanzado platino resistentes tratados con cetuximab en monoterapia, se obtuvieron unos resultados similares a los nuestros en cuanto a la tasa de respuestas objetivas se refiere (13%), obteniendo un tiempo hasta la progresión de tan sólo 2,3 meses.
Como conclusión, nuestro estudio demuestra que cetuximab en monoterapia presenta una modesta efectividad en pacientes con CCC avanzado refractario a una quimioterapia basada en platino, pero con una toxicidad escasa y fácilmente manejable. En el futuro los ensayos clínicos deberían de basarse en la combinación de cetuximab con otros agentes quimioterápicos eficaces en el tratamiento de CCC como los taxanos (15) o en la combinación con el esquema cisplatino/5-Fluoruracilo en primera línea de tratamiento de la enfermedad metastática y/o recurrente.
Bibliografía
1. Greenlee RT, MurrayT, Bolden S, Wingo PA. Cancer Statistics, 2000. CA Cancer J Clin 2000; 50: 7-33. [ Links ]
2. León X, Hitt R, Constenla M, et al. A retrospective analysis of the outcome of patients with recurrent or metastatic squamous cell carcinoma of the head and neck who are progressing while on a platinum-based palliative chemotherapy. Proc Am Soc Clin Oncol 2003; 22: 502. [ Links ]
3. Grandis JR, Melhem MF, Gooding WE,et al. Levels of TGF-alpha and EGFR protein in head and neck squamous cell carcinoma and patient survival. J Natl Cancer Inst 1998; 90: 824-32. [ Links ]
4. Magne N, Pivot X, Bensadoun R,et al. The relationship of epidermal growth factor receptor levels to the prognosis of unresectable pharyngeal cancer patients treated by chemo-radiotherapy. Eur J Cancer 2001; 37: 2169-77. [ Links ]
5. Ang KK, Berkey BA, Tu X, et al. Impact of epidermal growth factor receptor expression on survival and pattern of relapse in patients with advanced head and neck carcinoma. Cancer Res 2002; 62: 7350-6. [ Links ]
6. Bonner JA, Raisch KP, Trummel HQ, et al. Enhanced apoptosis with combination C225/radiation treatment serves as the impetus for clinical investigation in head and neck cancers. J Clin Oncol 2000; 18: 47s-53s. [ Links ]
7. Albanell J, Codony-Servat J, Rojo F, et al. Activated extracellular signal-regulated kinases: Association with epidermal growth factor receptor/transforming growth factor alpha expression in head and neck squamous carcinoma and inhibition by antiepidermal growth factor receptor treatments. Cancer Res 2001; 61: 6500-10. [ Links ]
8. Mendelsohn J, Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer. J Clin Oncol 2003; 21: 2787-99. [ Links ]
9. Mendelsohn J. The epidermal growth factor receptor as a target for cancer therapy. Endocr Relat Cancer 2001; 8: 3-9. [ Links ]
10. Huang SM, Harari P. Modulation of radiation response after epidermal growth factor receptor blockade in squamous cell carcinomas: Inhibition of damage repair, cell cycle kinetics, and tumor angiogenesis. Clin Cancer Res 2000; 6: 2166-74. [ Links ]
11. Herbst RS, Arquette M, Shin DM, et al. Epidermal growth factor receptor antibody cetuximab for recurrent and refractory squamous cell carcinoma of the head and neck: a phase II, multicentre study. J Clin Oncol 2005; 23: 5578-87. [ Links ]
12. Baselga J, Trigo JM, Bourhis J, et al. A phase II multicenter study of the anti-epidermal growth factor receptor (EGFR) monoclonal antibody cetuximab in combination with platinum-based chemotherapy in patients with refractory metastatic and/or recurrent squamous cell carcinoma of the head and neck (SCCHN). J Clin Oncol 2005; 23: 5568-77. [ Links ]
13. Trigo JM, Hitt R, Koralewski P, et al. Cetuximab monotherapy is active in patients with platinum-refractory recurrent/metastatic squamous cell carcinoma of the head and neck. Proc Am Soc Clin Oncol 2004; 23: 488s. [ Links ]
14. Vermorken JB, Trigo J, Hitt R, et al. Open-Label, Uncontrolled, Multicenter Phase II Study to Evaluate Efficacy and Toxicity of Cetuximab As a Single Agent in Patients With Recurrent and/or Metastatic Squamous Cell Carcinoma of the Head and Neck Who Failed to Respond to Platinum-Based Therapy. J Clin Oncol 2007; 16: 2171-7. [ Links ]
15. Holsinger FC, Doan DD, Jasser SA, et al. Epidermal growth factor receptor blockade potentiates apoptosis mediated by paclitaxel and leads to prolonged survival in a murine model of oral cancer. Clin Cancer Res 2003; 9: 3183-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Parham Khosravi Shahi.
Hospital General Universitario Gregorio Marañón.
C/ Dr. Esquerdo, 46.
28007 Madrid.
e-mail: drkhosravi@hotmail.com
Trabajo aceptado: 11 de diciembre de 2007