Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.78 no.3 mar. 2003
ARTÍCULO ORIGINAL
NEUROPROTECCIÓN DE LAS CÉLULAS GANGLIONARES
DE LA RETINA
RETINAL GANGLION CELL NEUROPROTECTION IN CULTURE
GARCÍA M1, RUIZ EDERRA J2, HERNÁNDEZ-BARBÁCHANO E1, URCOLA JA3, BILBAO J4,
ARAIZ J5, DURÁN JA5, VECINO E1
| RESUMEN Objetivo: Estudiar la supervivencia de las células ganglionares de la retina (CGR) de cerdo en cultivo, analizando el posible efecto neuroprotector de las células de Müller de la retina (CMR) y del factor neurotrófico derivado del cerebro (BDNF). Palabras clave: Células ganglionares de la retina, células de Müller, neuroprotección, cerdo, BDNF. | SUMMARY Purpose: To study the pig retinal ganglion cell (RGC) survival in culture, analysing the possible neuroprotective effect of retinal Müller glia (RMG) and brain-derived neurotrophic factor (BDNF). Key words: Retina ganglion cells, Müller cells, neuroprotection, pig, BDNF.
|
Recibido:19/6/02. Aceptado: 11/2/03.
Departamento Biología Celular. Facultad de Medicina. Universidad del País Vasco. Lejona. Vizcaya. España.
1 Doctor en Biología.
2 Licenciado en Biología.
3 Licenciado en Medicina.
4 Doctor en Medicina. Dpto.. Medicina Preventiva y Salud Pública. Facultad Medicina. Universidad del País Vasco..
5 Doctor en Medicina. Dpto. Dermatología, Oftalmología y Otorrinolaringología. Facultad de Medicina. Universidad del País Vasco.
Presentado parcialmente como comunicación al Annual Meeting of the Association for Research in Vision and Ophthalmology, Fort Lauderdale, Florida; 5-10 de mayo de 2002.
Proyecto subvencionado: Univ. País Vasco (1/UPV00075.327-E-14887/2002) and European Community (Pro Age Ret QLK6-2000-00569).
Los autores manifiestan que no tienen interés comercial ni han recibido apoyo económico..
Correspondencia:
Elena Vecino
Dpto. Biología Celular e Histología
Facultad de Medicina. Universidad del País Vasco
48940 Leioa (Vizcaya)
España
E-mail: gcpvecoe@lg.ehu.es
INTRODUCCIÓN
Las células ganglionares de la retina (CGR) mueren por apoptosis durante la axotomía y el glaucoma (1,2), dicho proceso parece ser selectivo y no afecta por igual a los distintos tipos de CGR (3-5).
Se ha descrito que los factores neurotróficos como el BDNF, favorecen la supervivencia de las CGR tras la axotomía (3,4,6) y tras el incremento crónico de la presión intraocular (7).
Por otro lado, se ha demostrado que las células de Müller de la retina (CMR), que constituyen el tipo glial más representado en la retina, protegen contra el efecto excitotóxico del glutamato y aumentan la supervivencia de las CGR en cultivo (8). Estas células gliales sintetizan algunos factores neurotróficos como el factor de crecimiento de fibroblastos (9) y el factor neurotrófico ciliar (10), que podrían estar implicados en el efecto neuroprotector de estas células.
Teniendo en cuenta estos antecedentes nos planteamos estudiar la respuesta de las CGR de cerdo adulto en diferentes condiciones de cultivo, en concreto analizamos el efecto del BDNF y las CMR sobre la supervivencia y regeneración de las CGR. Hemos utilizado la retina de cerdo como modelo experimental por la gran similitud que tiene con la retina humana.
MATERIAL Y MÉTODO
Cultivo de las células de la retina
Toda la experimentación con animales se realizó siguiendo la normativa de ARVO para el uso de animales en la Investigación.
Los ojos de cerdo, procedentes del matadero, fueron procesados mediante el método descrito por Gaudin et al (11). La digestión del tejido se llevó a cabo utilizando papaína activada al 0,2% (Worthington, Lakewood, USA). Los fragmentos se disociaron mediante disgregaciones repetidas y las células aisladas se sembraron en DMEM/Hams-F12, al que se añadió un 5% de suero fetal bovino (FCS) y penicilina-estreptomicina (10 UI).
El número de células y su viabilidad se analizó utilizando la técnica del azul de tripano. Las células se cultivaron a una densidad de 5 x 105 células/cm2 sobre cubreobjetos estériles pretratados secuencialmente con poli-D-lisina (2 µg/cm2 durante 1 hora, Sigma-Aldrich) y laminina (1 µg/cm2 durante toda la noche; Sigma-Aldrich). Los cultivos celulares se mantuvieron en incubador humidificado en atmósfera de 5% CO2/95% O2.
Tratamientos in vitro
Las CGR de cerdo se cultivaron en diferentes condiciones.
Control: medio químicamente definido (MQD): Sobre sustrato de laminina/polilisina durante 24 horas en DMEM/5% FCS, tras lo cual se lavaron y mantuvieron en MQD durante 5 días antes de la fijación.
BDNF: Sobre sustrato de laminina/polilisina durante 24 horas tras lo cual se transfirieron a MQD al que se añadió 10 ng/ml de BDNF (R&D Systems, Abingdon, U.K.). Las células se mantuvieron en estas condiciones durante 5 días tras los cuales se procedió a su fijación.
Células de Müller confluentes (CoCMR): Las CGR se cultivaron sobre monocapas de CMR. Estas monocapas se prepararon previamente a partir de retina de cerdo, siguiendo el método de Guidry (12). Las células de Müller aisladas se cultivaron a una densidad final de 6 x 105 células/cm2, sobre cubreobjetos pretratados con laminina y polilisina. Tras 6 días en cultivo, las CMR son confluentes y pudieron ser utilizadas como sustrato para el cultivo de CGR.
Medio Condicionado (MC): Las CMR se cultivaron hasta que se hicieron confluentes (6d) y se mantuvieron en presencia de MQD durante 24 horas. El medio fue recogido y tras ser diluido 1:1 (v/v) con MQD fresco, se añadió a los cultivos controles de CGR tras 24 horas en DMEM/5% FCS.
Inmunocitoquímica
Tras 6 días in vitro, las células se fijaron con paraformaldehído al 4% y se permeabilizaron con 0,1% Triton X-100. Se incubaron con anticuerpo primario monoclonal anti-neurofilamento (NF) 68 kDa (10 µg/ml; Sigma-Aldrich) y a continuación con el anticuerpo secundario cabra anti-ratón IgG/Bodipy FL (10 µg/ml, Molecular Probes, Portland, OR). Los núcleos de las células se marcaron con 4,6-diaminodiphenyl-2-phenylindole (DAPI; 10 µg/ml; Sigma-Aldrich). Las preparaciones se lavaron con PBS, se montaron y se observaron en un microscopio de fluorescencia Axioskop 2 (Zeiss, Jena, Germany).
Los controles inmunocitoquímicos consistieron en la omisión del primer anticuerpo, la omisión del segundo anticuerpo y el uso del correspondiente suero no inmunorreactivo.
Análisis de la supervivencia celular
Con el fin de determinar el efecto de las distintas condiciones de cultivo sobre la supervivencia de las CGR se realizó el recuento de las CGR inmunopositivas a NF-68 en cultivos preparados de 10 retinas, el anticuerpo anti-NF68 marca específicamente las células ganglionares de la retina. Se determinó el porcentaje de CGR que sobrevivieron en las distintas condiciones de cultivo con respecto al control (MQD, 100%) El análisis estadístico de los resultados se llevó a cabo mediante el método de la X2 para comparar frecuencias, utilizando el software informático SPSS, SPSS Inc, USA (versión 10.0.6).
Análisis de la morfología celular
Para analizar la morfología de las CGR en cultivo se tomaron imágenes de todas las CGR localizadas en 182 campos, correspondientes a un área de 44,8 mm2. Las fotografías se realizaron utilizando una cámara digital Coolsnap (RS Photometrics, Tucson, USA). Un número total de 10.850 células fueron fotografiadas y medidas. Los parámetros analizados para cada tratamiento fueron: tamaño del soma, número de neuritas y longitud total de todas las neuritas. Las medidas se realizaron sobre las imágenes digitales utilizando los programas de análisis de imagen: Scion Image, Frederick, Maryland, USA (versión para Windows 95/98) y Spot, Diagnostic Instruments inc, USA (versión 2.2.2).
Las CGR se clasificaron en tres grupos dependiendo del tamaño del soma: a) pequeñas (diámetro del soma menor de 14 µm); b) medianas (somas de entre 15-20 µm de diámetro), y c) grandes (somas de diámetro superior a 21 µm).
El análisis estadístico de los resultados se llevó a cabo mediante el modelo lineal general univariante seguido del test de Tamhane. El nivel de significación se consideró p<0,05.
RESULTADOS
Efecto de las distintas condiciones sobre la supervivencia y la distribución por tamaños de las CGR
En la figura 1 se muestran los resultados obtenidos tras el análisis de la supervivencia de las CGR, observamos que las CMR confluentes y el MC aumentan la supervivencia de las CGR in vitro, los porcentajes con respecto al MQD son 110,4 D.E. (desviación estándar de la media) 3,4 (p<0,05) para CoCMG y 116,7 D.E. 4,8% (p<0,01) para MC. Sin embargo no observamos un aumento significativo de la supervivencia cuando el medio de cultivo se suplementó con BDNF (104,6 D.E. 6,2% respecto a control).
En cuanto a la clasificación de las CGR por tamaños, observamos que los tres tratamientos en estudio produjeron una disminución en el porcentaje de células pequeñas y un aumento en el número de células grandes con respecto a control (p<0,01 para todos los tratamientos) (fig. 1).
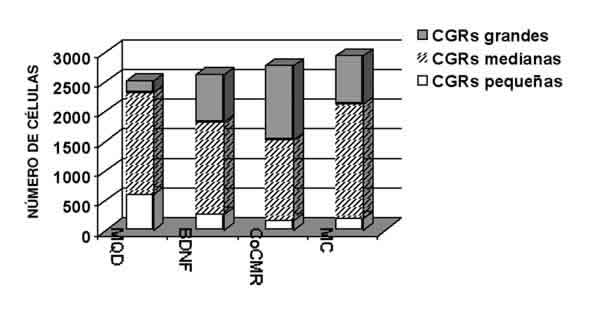
Fig. 1. Efecto de las distintas condiciones de cultivo sobre la supervivencia de los diferentes tipos
de células ganglionares de la retina (CGR). Se muestra el número total de CGR grandes,
medianas y pequeñas en las diferentes condiciones analizadas (n= 10 retinas). MQD: medio
químicamente definido; BDNF: MQD + 10 ng/ml BDNF, CoCMR: sustrato de células de Müller
confluentes; MC: medio condicionado procedente de las células de Müller.
Efecto de las distintas condiciones sobre el crecimiento de las neuritas
El porcentaje de CGR con neuritas aumentó significativamente en todas las condiciones experimentales (tabla I).
En cuanto a la longitud total media de las neuritas observamos que el BDNF incrementa la longitud de las neuritas de las CGR con respecto a control y que este crecimiento es mayor cuando las células crecen en presencia de CoCMR o con MC (tabla II).
Además de un aumento significativo en el número de neuritas y en la longitud de las neuritas en los tratamientos CoCMR y MC, nuestros resultados muestran que, cuando las CGR crecen sobre CMR confluentes las neuritas de las CGR se disponen paralelas al eje mayor de las células de Müller que constituyen la monocapa del sustrato (fig. 2 C).
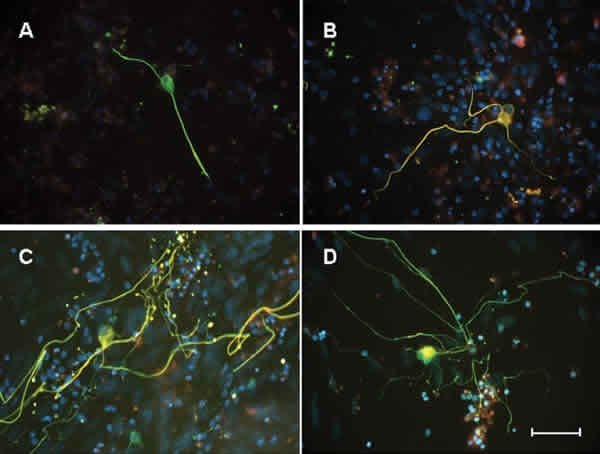
Fig. 2. Imágenes representativas de células ganglionares de la retina (CGR) creciendo en las diferentes
condiciones de cultivo. A) CGR creciendo sobre sustrato de lamininina-polilisina con medio de cultivo
químicamente definido (MQD); B) CGR cultivada sobre sustrato de laminina polilisina en MQD al que se añadió
BDNF (BDNF); C) CGR cultivadas sobre células de Müller confluentes (CoCMR); D) CGR en cultivo con medio
condicionado de las células de Müller (MC). Las fotografías fueron tomadas utilizando un filtro triple,
NF200 (verde), NF68 (rojo) y núcleos (DAPI). Escala 50 mm.
DISCUSIÓN
Efecto del BDNF
Se ha sugerido que el bloqueo en el transporte retrógrado de neurotrofinas desde el cerebro puede ser una de las causas de la muerte de las CGR durante el glaucoma (13). Sin embargo, algunos autores han sugerido que el BDNF que se encuentra en la retina no procede únicamente de los centros diana, sino que parte de esta neurotrofina se produce de forma local y actuaría de forma autocrina (14,15). Nuestro estudio demuestra que la administración de BDNF no modifica la supervivencia de las CGR de cerdo adulto en cultivo. Es posible que el BDNF producido por las CGR en cultivo sea suficiente para mantener la supervivencia de dichas células. Además el BDNF podría limitar su efecto neuroprotector a través de la inhibición del receptor TrkB tras la aplicación de dosis altas de la neurotrofina (16).
La muerte de las CGR durante el glaucoma es selectiva y no afecta de la misma forma a las células grandes, medianas y pequeñas (5). Además, in vitro se ha demostrado diferente susceptibilidad a la muerte en condiciones de hipoxia (17) o tras la administración de glutamato (18).
Nuestro trabajo demuestra que el BDNF aumenta el porcentaje de CGR grandes en cultivo. Se ha descrito que el BDNF tiene distintos efectos sobre la supervivencia de las CGR pequeñas y grandes en cultivos de retina de rata (19), y que las células grandes tienen una mayor afinidad por el BDNF que las medianas (3). La diferente respuesta de los distintos tipos celulares al BDNF podría deberse a diferencias en el número o tipo de receptores TrkB presentes en las células de distinto tamaño.
En el sistema visual las neurotrofinas estimulan el crecimiento de las neuritas (20). En nuestro estudio se demuestra que el BDNF incrementa la longitud y el número de neuritas en CGR de cerdo adulto. Este efecto del BDNF ha sido observado in vitro por otros autores (21) y parece estar mediado por receptores TrkB.
Efecto de las células de Müller de la retina
Las células gliales mantienen el funcionamiento normal del sistema nervioso principalmente a través de la liberación de metabolitos y factores de crecimiento. Nuestros resultados demuestran que la supervivencia de las CGR de cerdo es mayor cuando estas células crecen sobre CoCMR. Este efecto no parece estar mediado únicamente por el sustrato ya que observamos un efecto similar en presencia de MC. El efecto beneficioso de las CMR sobre las CGR ha sido demostrado in vitro en condiciones de hipoxia o tras la exposición a glutamato (8,17).
Además de un aumento en la supervivencia observamos que las CMR producen un incremento en el área media de las CGR, esto se corresponde con una disminución significativa en el número de células pequeñas y un incremento en el número de células grandes. Es posible que algún factor liberado por las CMR confluentes tenga un efecto selectivo sobre las distintas subpoblaciones de CGR. En este sentido se ha demostrado que las células gliales confluentes reducen la supervivencia sólo de las CGR pequeñas in vitro (22). Por otro lado, observamos que el efecto sobre la distribución de las CGR es menor en MC que en CoCMR lo que indicaría que el sustrato y el factor soluble presente en las CoCMR podrían tener un efecto sinérgico en cultivo. Otra hipótesis que explicaría el aumento del área media del soma cuando las CGR se cultivan en presencia de CoCMR o de MC se basa en un efecto trófico generalizado de estas dos condiciones sobre el tamaño de las células. Tanto el tratamiento CoCMR como el MC producen una disminución en los porcentajes de CGR pequeñas, lo que podría explicarse si la adhesión de las CGR produjera un aumento de tamaño de las células, haciendo que las células pequeñas y medianas pasaran a considerarse medianas y grandes respectivamente. Es posible que este aumento de tamaño de las CGR se produzca, ya que se ha descrito en rata que las CGR tienen la capacidad de aumentar de tamaño durante el glaucoma (23).
Por último, nuestros resultados muestran que cuando las CGR crecen sobre CoCMR presentan mayor número de neuritas y que estas neuritas son más largas. Parece que algún factor liberado desde las CMR es responsable del incremento del crecimiento de las neuritas en las CGR en cultivo. Este factor podría actuar asociándose con el sustrato y favoreciendo el crecimiento de las neuritas o directamente sobre las CGR a través de la estimulación de la transcripción de proteínas del citoesqueleto (24).
En conclusión nuestro estudio demuestra que las CMR confluentes tienen un efecto neuroprotector sobre las CGR de cerdo adulto en cultivo. Este efecto de las CMR no estaría mediado principalmente por la adhesión de las células al sustrato ya que el MC produce una respuesta similar. Esto sugiere que un/os factor/es producido/s y liberado/s al medio por las CMR es/son responsable/s de estos efectos. La caracterización e identificación de estas moléculas puede ser de gran interés desde el punto de vista terapéutico para proteger a las CGR de la degeneración producida por enfermedades como el glaucoma.
BIBLIOGRAFÍA
1. García-Valenzuela E, Egorczyca W, Darzynkiewicz Z, Sharma SC. Apoptosis in adult retinal ganglion cells after axotomy. J Neurobiol 1994; 25: 431-438. [ Links ]
2. Quigley HA, Nickells RW, Kerrian LA, Pease ME, Thibant DJ. Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis. Invest Ophthalmol Vis Sci 1995; 36: 774-786. [ Links ]
3. Chen H, Weber AJ. BDNF enhances retinal ganglion cell survival in cats with optic nerve damage. Invest Ophthalmol Vis Sci 2001; 42: 966-974. [ Links ]
4. Mey J, Thanos S. Intravitreal injections of neurotrophic factors support the survival of axotomized retinal ganglion cells in adult rats in vivo. Brain Res 1993; 602: 304-317. [ Links ]
5. Glovinsky Y, Quigley HA, Pease ME. Foveal ganglion cell loss is size dependent in experimental glaucoma. Invest Ophthalmol Vis Sci 1993: 34: 395-400. [ Links ]
6. Peinado-Ramón P, Salvador M, Villegas-Pérez MP, Vidal-Sanz M. Effects of axotomy and intraocular administration of NT-4, NT-3 and brain-derived neurotrophic factor on the survival of adult rat retinal ganglion cells. A cuantitative in vivo study. Invest Ophthalmol Vis Sci 1996: 37: 489-500. [ Links ]
7. Ko ML, Hu DN, Ritch R, Sharma SC. The combined effect of brain derived neurotrophic factor and a free radical scavenger in experimental glaucoma. Invest Ophthalmol Vis Sci 2000: 41: 2967-2971. [ Links ]
8. Heidinger V, Hicks D, Sahel J, Dreyfus H. Ability of retinal Müller glial cells to protect neurons against excitotoxicity in vitro depends upon maduration and neuron-glial interactions. Glia 1999; 25: 229-239. [ Links ]
9. Cao W, Wen R, Li F, Cheng T, Steinberg RH. Induction of basic fibroblast growth factor mRNA by basic fibroblast growth factor in Müller cells. Invest Ophthalmol Vis Sci 1997; 38: 1358-1366. [ Links ]
10. Chun MH, Ju WK, Kim KY, Lee MY, Hofmann HD, Kirsch M et al. Upregulation of ciliary neurotrophic factor in reactive Müller cells in the rat retina following optic nerve transection. Brain Res 2000; 868: 358-362. [ Links ]
11. Gaudin C, Forster V, Sahel JA, Dreyfus H, Hicks D. Survival and regeneration of adult human and other mammalian photoreceptors in culture. Invest Ophthalmol Vis Sci 1996; 37: 2258-2268. [ Links ]
12. Guidry C. Isolation and characterization of porcine Muller cells. Myofibroblastic dedifferentiation in culture. Invest Ophthalmol Vis Sci 1996; 37: 740-752. [ Links ]
13. Pease ME, McKinnon SJ, Quigley HA, Kerrigan-Baumrind LA, Zack DJ. Obstructed axonal transport of BDNF and its receptor TrkB in experimental glaucoma. Invest Ophthalmol Vis Sci 2000; 41: 764-774. [ Links ]
14. Herzog KH, von Bartheld CS. Contributions of the optic tectum and the retina as sources of brain-derived neurotrophic factor for retinal ganglion cells in the chick embryo. J Neurosci 1998; 18: 2891-2906. [ Links ]
15. Vecino E, Garcia-Crespo D, Garcia M, Martinez-Millan L, Sharma SC, Carrascal E. Rat retinal ganglion cells co-express brain derived neurotrophic factor (BDNF) and its receptor TrkB. Vision Res 2002; 42: 151-157. [ Links ]
16. Frank L, Ventimiglia R, Anderson K, Lindsay RM, Rudge JS. BDNF down-regulates neurotrophin responsiveness, trkB protein and trkB mRNA levels in cultured rat hippocampal neurons. Eur J Neurosci 1996; 8: 1220-1230. [ Links ]
17. Luo X, Lambrou GN, Sahel JA, Hicks D. Hypoglycemia induces general neuronal death, whereas hypoxia and glutamate transport blockade lead to selective retinal ganglion cell death in vitro. Invest Ophthalmol Vis Sci 2001; 42: 2695-2705. [ Links ]
18. Luo X, Heidinger V, Picaud S, et al. Selective excitotoxic degeneration of adult pig retinal ganglion cells in vitro. Invest Ophthalmol Vis Sci 2001: 42: 1096-1106. [ Links ]
19. Kashiwagi F, Kashiwagi K, Iizuka Y, Tsukahara S. Effects of brain-derived neurotrophic factor and neurotrophin-4 on isolated cultured retinal ganglion cells: evaluation by flow cytometry. Invest Ophthalmol Vis Sci 2000; 41: 2373-2377. [ Links ]
20. von Bartheld CS. Neurotrophins in the developing and regenerating visual system. Histol Histopathol 1998; 13: 437-459. [ Links ]
21. Takano M, Horie H, Ikjima Y, Dezawa M, Sawada H, Ishikawa Y. Brain-derived neurotrophic factor enhances neurite regeneration from retinal ganglion cells in aged human retina in vitro. Exp Eye Res 2002; 74: 319-323. [ Links ]
22. Kashiwagi K, Iizuka Y, Araie M, Suzuki Y, Tsukahara S. Effects of retinal glial cells on isolated rat retinal ganglion cells. Invest Ophthalmol Vis Sci 2001: 42: 2686-2694. [ Links ]
23. Ahmed FA, Chaudhary P, Sharma SC. Effects of increased intraocular pressure on rat retinal ganglion cells. Int J Dev Neurosci 2001; 19: 209-218. [ Links ]
24. Raju TR, Rao MS, Nagaraja TN, Meti BL, Schulz M. Retinal ganglion cell survival and neurite regeneration in vitro after cell death period are dependent upon target derived trophic factor and retinal glial factor(s). Brain Res 1994; 664: 247-251. [ Links ]
















