Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.78 no.5 may. 2003
ARTÍCULO ORIGINAL
EVISCERACIÓN CON DOBLE COBERTURA ESCLERAL
DOUBLE SCLERAL COVERING EVISCERATION
SANZ LÓPEZ A1, SALES SANZ M2
| RESUMEN Objetivos: Describir una técnica quirúrgica de evisceración que permitiendo colocar implantes de gran tamaño, disminuye el riesgo de exposición de los mismos. Palabras clave: Evisceración, implante de polietileno poroso, cobertura escleral, cavidad anoftálmica.
| SUMMARY Purpose: To describe a surgical technique for evisceration that allows the use of large size implants, reducing risk of exposure. Key words: Evisceration, Porous Polyethylene implant, scleral covering, anophthalmic cavity.
|
Recibido: 7/1/03. Aceptado: 10/4/03.
Hospital Oftalmológico Internacional de Madrid. Departamento de párpados, órbita y aparato lacrimal.
1 Doctor en Medicina.
2 Licenciado en Medicina.
Correspondencia:
Andrea Sanz López
C/. Puente Alto, 18
28770 Colmenar Viejo (Madrid)
España
E-mail: asanzlopez@terra.es
INTRODUCCIÓN
En 1985 comenzaron a utilizarse implantes biointegrables para reconstruir las cavidades anoftálmicas tras enucleaciones o evisceraciones. Con ellos se pretende conseguir los mejores resultados estéticos con el menor porcentaje de complicaciones.
Siempre que sea posible se realiza una evisceración en lugar de una enucleación, porque así se evita utilizar materiales de recubrimiento, lo cual acorta el tiempo quirúrgico si se obtienen del propio paciente, evita el riesgo de transmisión de enfermedades si se utilizan materiales de origen biológico, y disminuye el coste si se utilizan materiales sintéticos (1,2).
Para conseguir un buen resultado estético debemos colocar un implante del tamaño adecuado para que la proyección anteroposterior del contenido orbitario sea unos 2 mm menos que el ojo contralateral, de manera que queden iguales al colocar una prótesis del grosor óptimo (3). Esto es difícil de conseguir cuando la cavidad escleral del ojo eviscerado es pequeña. Para ello se han descrito diferentes técnicas en las que se realiza una esclerotomia posterior para poder adelantar cuanto queramos la esclera y cubrir la prótesis del tamaño deseado (4).
A continuación describiremos nuestra técnica, con la que, además de poder colocar un implante del tamaño deseado, se cubre la parte anterior del mismo con 2 capas de esclera, intentando disminuir, aún mas, las posibilidades de exposición.
MATERIAL Y MÉTODO
Se realizó una evisceración con la técnica que será descrita a continuación y se colocó un implante de MEDPOR (POREX, distribuidor en España AJL) a 22 pacientes entre enero de 1999 y julio de 2002. La media de seguimiento fue de 27 meses, con un rango entre 3 y 45 meses y una desviación estándar de 13 meses. Los implantes fueron de 20 mm en 17 pacientes, de 22 mm en 4 pacientes y de 18 mm en un paciente con microftalmos bilateral. Para calcular el tamaño del implante se hizo una biometría del ojo contralateral, y se colocó un implante de un diámetro 3 mm menos que la longitud axial obtenida.
La técnica quirúrgica se realiza mediante anestesia retrobulbar y sedación.
En primer lugar, se hace una peritomía conjuntival en limbo. Se separa mediante disección roma la Tennon y conjuntiva del globo ocular, llegando lo más atrás posible. Se individualizan con ganchos de estrabismo los cuatro músculos rectos, y se liberan las uniones fibrosas entre ellos y entre cada uno y la cápsula de Tennon para, luego, poder desplazar hacia delante los fragmentos esclerales con su músculo correspondiente sin dificultad.
Se realiza una queratectomía completa.
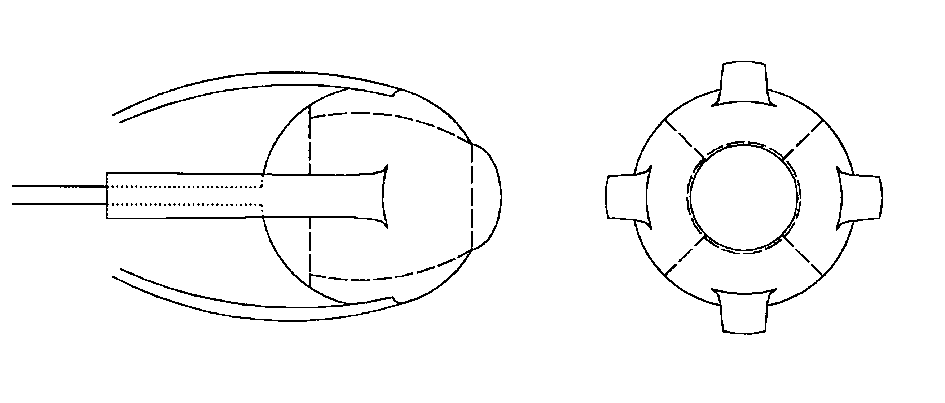
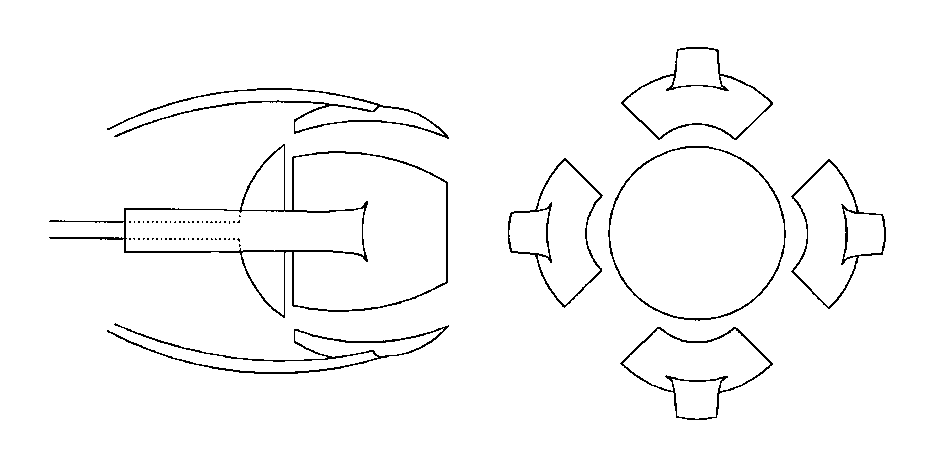
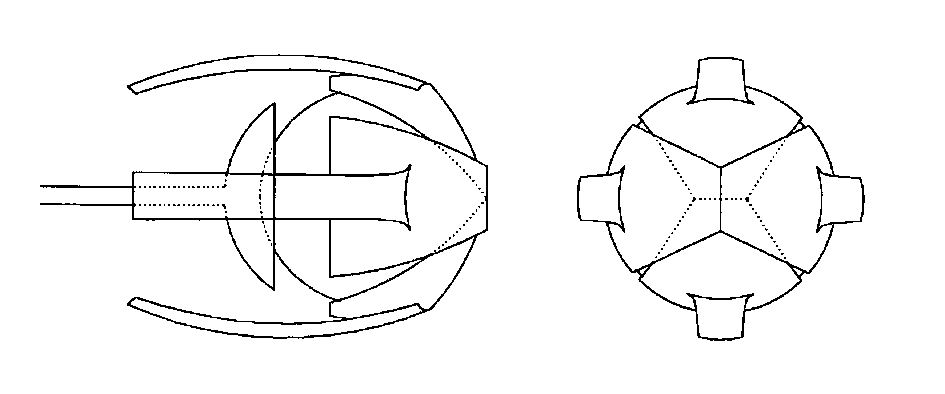
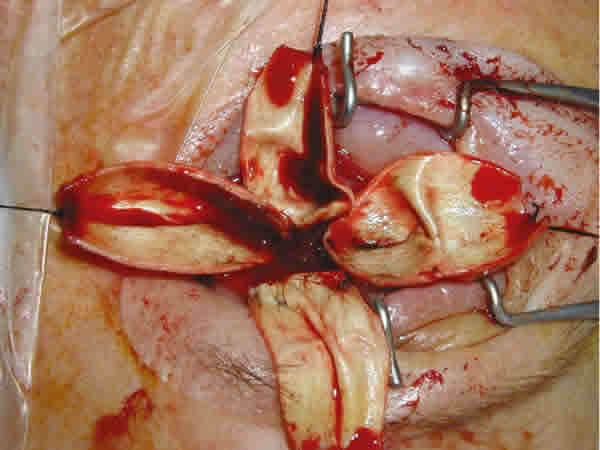
Se hacen 4 incisiones en dirección anteroposterior, que parten del borde anterior de la esclera justo en los vértices de los 4 cuadrantes (fig. 1). Estas incisiones se unen unas con otras lo más cerca posible del nervio óptico, de manera que dejamos dividida la esclera en 4 pétalos, cada uno de los cuales lleva insertado su músculo recto (figs 2 y 4). Se coloca una seda de 4/0 de tracción en la parte central del borde anterior de cada fragmento escleral, que nos ayuda a abrir la esclera y acceder directamente al espacio intracónico. Con ayuda de un inyector, introducimos el implante del tamaño deseado.
Fig. 1. Queratectomía y 4 esclerotomías anteroposteriores. Fig. 2. Unión posterior de las 4 esclerotomías, con formación de 4 pétalos esclerales, cada uno con sumúsculo recto correspondiente. Fig. 3. Doble cobertura escleral mediante sutura de los pétalos verticales en primer lugar y
horizontales encima. Fig. 4. Imagen intraoperatoria de los 4 pétalos esclerales tras completar las esclerotomías.
Colocamos los 4 fragmentos esclerales sobre el implante traccionando de ellos hacia delante ayudándonos con las sedas de tracción y pinzas sin dientes que presionen el implante y eviten que se venga hacia delante.
Suturamos, con Vicryl 5/0, en primer lugar los pétalos que llevan los músculos verticales y a continuación los que llevan los músculos horizontales, de esta manera se produce primero una herida horizontal, sobre ella una vertical y, por último, otra horizontal del cierre de la Tennon y conjuntiva, disminuyendo las posibilidades de exposición (fig. 3). Se hace una buena disección entre Tennon y conjuntiva, suturando siempre los dos planos por separado, con Vicryl 6/0 sutura continua.
Al finalizar la cirugía colocamos un conformador.
RESULTADOS
En este estudio se incluyen 22 pacientes a los que se ha realizado una evisceración, 12 mujeres y 10 hombres, con una media de edad de 42 años (entre 20 y 64).
Las indicaciones para la cirugía fueron ojos ciegos, dolorosos o que producían alteración estética (5).
La patología previa que condujo a su situación actual fue:
-
Traumatismos 8.
-
Cirugía de catarata o vítreo-retina 13.
-
Cirugía de catarata en ojo microftálmico 1.
Durante el seguimiento (entre 3 y 45 meses, con una media de 27 y una desviación estándar de 13), no ha habido ninguna complicación derivada de la cirugía. En ningún caso hubo exposición ni desplazamiento del implante. El resultado cosmético ha sido bueno sin enoftalmos ni hundimiento del surco palpebral superior significativos.
En ningún caso hemos perforado el implante para colocar vástago, los pacientes han quedado satisfechos, evitando todas las complicaciones derivadas de la perforación del implante (6-9).
DISCUSIÓN
Desde que en 1985 Perry comenzó a utilizar Hidroxiapatita como implante que sustituye al globo ocular en evisceraciones y enucleaciones, se han utilizado diferentes materiales (10-18) y diferentes técnicas quirúrgicas encaminadas a colocar un implante que produzca pocas complicaciones y con el que se consigan buenos resultados estéticos.
Cuando se realiza una evisceración en ojos con ptisis bulbi hemos de modificar y ampliar la cavidad escleral disponible porque si la prótesis colocada es muy pequeña se producirá un enoftalmos, un hundimiento del surco palpebral superior y una ptosis palpebral por falta de apoyo, y el resultado estético no será nada satisfactorio para el paciente (19). Cuando el volumen del implante es muy pequeño, el ocularista intenta compensarlo utilizando una epítesis más grande, pero esto produce por un lado una disminución importante en la movilidad de la misma, y a largo plazo una pérdida del fondo de saco inferior y una ptosis del párpado inferior debido al traumatismo producido por el exceso de peso de la prótesis.
Por ello, se debe colocar un implante cuya proyección anteroposterior sea 2 mm menor que el ojo contralateral, lo que, en ocasiones, obliga a colocar implantes de gran tamaño.
La complicación más temible es la erosión de los tejidos que cubren el implante con la consiguiente exposición del mismo y, si no se soluciona pronto, puede producirse una infección que obliga a su retirada (20,21).
La causa de esta complicación, generalmente, es una cobertura del implante a tensión o una erosión de la misma por un roce traumático (22,23).
Se han descrito diferentes técnicas de evisceración para poder colocar prótesis grandes sin que los tejidos que cubren la prótesis estén suturados a tensión. Se han descrito esclerotomias de descarga, esclerotomias posteriores completas que permiten avanzar la esclera todo lo necesario y secciones esclerales en 2 o en 4 fragmentos (24,25) como en nuestro caso. Pero nuestra técnica quirúrgica, igual que las anteriores, permite colocar un implante del tamaño deseado sin tensión en los tejidos que la cubren, pero, además, se consigue una doble cobertura escleral del implante, de manera que es muy poco probable que la superficie del implante llegue a erosionar por roce las 2 capas de esclera que le cubren.
BIBLIOGRAFÍA
1. Klapper SR, Jordan DR, Punja K, Brownstein S, Gilberg SM, Mawn LA et al. Hydroxyapatite implant wrapping materials: analysis of fibrovascular ingrowth in an animal model. Ophthal Plast Reconstr Surg 2000; 16: 278-285. [ Links ]
2. Kao LY. Polytetrafluoroethylene as a wrapping material for a hydroxyapatite orbital implant. Ophthal Plast Reconstr Surg 2000; 16: 286-288. [ Links ]
3. Kaltreider SA. The ideal ocular prosthesis: analysis of prosthetic volume. Ophtal Plast Reconstr Surg 2000; 16: 388-392. [ Links ]
4. Long JA, Tann III TM 3rd, Girkin CA. Evisceration: a new technique of trans-scleral implant placement. Ophthal Plast Reconsr Surg 2000; 16: 322-325. [ Links ]
5. Custer PL, Reistad CE. Enucleation of blind, painful eyes. Ophthal Plast Reconstr Surg 2000; 16: 326-329. [ Links ]
6. Jordan DR. Spontaneous loosening of hydroxyapatite peg sleeves. Ophthalmology 2001; 108: 2041-2044. [ Links ]
7. Jordan DR, Klapper SR. A new titanium peg system for hydroxyapatite o orbital implants. Ophthal Plast Reconstr Surg 2000; 16:380-387. [ Links ]
8. Hsu WC, Green JP, Spilker MH, Rubin PA. Primary placement of a titanium motility post in a porous polyethylene orbital implant: animal model with quantitative assessment of fibrovascular ingrowth and vascular density. Ophthal Plast Reconstr Surg 2000; 16: 370-379. [ Links ]
9. Choi JC, Iwamoto MA, Bstandig S, Rubin PA, Shore JW. Medpor Motility Coupling Post: a rabbit model. Ophthal Plast Reconstr Surg 1999; 15: 190-201. [ Links ]
10. Soparkar CN, Wong JF, Patrinely JR, Appling D. Epidermal and fibroblast growth factors enhance fibrovascular integration of porous polyethylene implants. Ophthal Plast Reconstr Surg 2000; 16: 337-340. [ Links ]
11. Soparkar CN, Wong JF, Patrinely JR, Davidson JK, Appling D. Porous polyethylene implant fibrovascularization rate is affected by tissue wrapping, agarose coating, and insertion site. Ophthal Plast Reconstr Surg 2000; 16: 330-336. [ Links ]
12. Jordan DR, Mawn LA, Brownstein S, McEachren TM, Gilberg SM, Hill V, et al. The bioceramic orbital implant: a new generation of porous implants. Ophthal Plast Reconstr Surg 2000; 16: 347-355. [ Links ]
13. Jordan DR, Hwang I, Brownstein S, McEachren T, Gilberg S, Grahovac S et al. The Molteno M-Sphere. Ophthal Plast Reconstr Surg 2000; 16: 356-362. [ Links ]
14. Jordan DR, Hwang I, McEachren T, Brownstein S, Gilberg S, Grahovac S et al. Brazilian hydroxyapatite implant. Ophthal Plast Reconstr Surg 2000; 16: 363-369. [ Links ]
15. Jordan DR, Bawazeer A. Experience with 120 synthetic hydroxyapatite implants (FCI3). Ophthal Plast Reconstr Surg 2001; 17: 184-190. [ Links ]
16. Jordan DR, Anderson RL. The universal implant for evisceration surgery. Ophthal Plast Reconstr Surg 1997; 13: 1-7. [ Links ]
17. Goldberg RA, Dresner SC, Braslow RA, Kossovsky N, Legmann A. Animal model of porous polyethylene orbital implants.Ophthal Plast Reconst Surg 1994; 10: 104-109. [ Links ]
18. Karesh JW, Dresner SC. High-density porous polyethylene (Medpor) as a successful anophthalmic socket implant. Ophthalmology 1994; 101: 1688-1695. [ Links ]
19. Custer PL. Enucleation: past, present, and future. Ophthal Plast Reconstr Surg 2000; 16: 316-321. [ Links ]
20. Kim JW, Kikkawa DO, Aboy A, Glasgow BJ. Choronic exposure of hydroxyapatite orbital implants: cilia implantation and epithelial downgrowth. Ophthal Plast Reconstr Surg 2000; 16: 216-222. [ Links ]
21. Buettner H, Bartley GB. Tissue breakdown and exposure associated with orbital hydroxyapatite implants. Am J Ophthalmol 1992; 113: 669-673. [ Links ]
22. Shields CL, Shields JA, De Potter P, Sing AD. Problems with the hydroxyapatite orbital implant: experience with 250 consecutive cases.Br J Ophthalmol 1994; 78: 702-706. [ Links ]
23. Kostick DA, Linberg JV. Evisceration with hydroxyapatite implant.Surgical tecnique and review of 31 case reports. Ophthalmology 1995; 102: 1542-1548. [ Links ]
24. Yang JG, Khwarg SI, Wee WR, Kim DM, Lee JH. Hydroxyapatite implantation with scleral quadrisection after evisceration. Ophthalmic Surg Lasers 1997; 28: 915-919. [ Links ]
25. Toledano N, Prada C. Manejo de la cavidad anoftálmica. Digi-Art. Madrid 2002; 31-42. [ Links ]