Introducción
El manejo de la cara quemada siempre es un reto para el cirujano, no sólo desde el punto de vista funcional, sino también desde el punto de vista estético, debido a que estas quemaduras con frecuencia dejan graves secuelas cicatriciales que conllevan además un rechazo social y cultural importante,
El tratamiento quirúrgico de las quemaduras faciales de espesor total habitualmente se orienta a retirar el tejido necrótico mediante la escisión tangencial de la quemadura y su cobertura inmediata.( 1 ) Para las quemaduras de espesor parcial se indica dermoabrasión y cobertura con apósitos biológicos o sintéticos hasta lograr la epitelización de todas las áreas comprometidas. Estos procedimientos son dolorosos y cuando la cobertura se realiza con la aplicación de tópicos y apósitos secundarios, implica curaciones y cambios frecuentes de los apósitos secundarios que resultan incómodos para el paciente y representan un mayor gasto de insumos y de tiempo del personal de enfermería.
Uno de los apósitos biológicos utilizado para la cobertura temporal de las quemaduras faciales de espesor parcial y profundo es la membrana amniótica, disponible en países que cuentan con bancos de tejidos,( 2 - 4 ) no sólo por sus efectos terapéuticos sino también por su bajo coste y por la no necesidad de curaciones frecuentes.( 5 , 6 )
Desde 1910, la membrana amniótica se ha empleado en múltiples patologías clínicas debido a sus efectos terapéuticos, ampliamente descritos en la literatura,( 7 - 9 ) entre los que se incluyen:
Evita la desecación de los tejidos.
Controla el dolor debido a su efecto analgésico al cubrir las terminaciones nerviosas expuestas. (10)
Estimula la epitelización debido a la presencia de factores de crecimiento.
Promueve la formación del tejido de granulación al estimular la angiogénesis. (11)
Produce un efecto antinflamatorio por su contenido en interleucina 10 e inhibidores de metaloproteínas.
Controla la proliferación bacteriana debido a su contenido en lisosomas e inmunoglobulinas E.
Inhibe la fibrosis y la cicatrización anormal. (12,13)
Además, la membrana amniótica ha sido utilizada en diferentes formas:( 14 ) fresca, no preservada (cuando se almacena a 4 °C en solución salina con o sin antibióticos), criopreservada (cuando se almacena a -80 °C o en nitrógeno líquido), y preservada en glicerol. Sin embargo, el uso de las formas frescas y no preservadas ha sido abandonado a nivel mundial debido al alto riesgo que implica para contraer enfermedades infectocontagiosas.( 15 )
Con el advenimiento de los bancos de tejidos en todo el mundo, la membrana amniótica volvió a ser una opción para el tratamiento de los pacientes quemados, ya fuera criopreservada o preservada en glicerol.( 16 - 18 )
En Colombia, entre los años 70 y 80, se empleó de forma fresca para la cobertura de quemaduras; sin embargo, cayó en desuso debido al comentado riesgo asociado de transmisión de enfermedades infectocontagiosas tales como el síndrome de inmunodeficiencia adquirida (SIDA). En el año 2011, con la creación del Banco de Tejidos del Instituto Distrital de Ciencia, Biotecnología e Innovación en Salud (IDCBIS) de la Secretaría de Salud de Bogotá, ha vuelto a ser, una vez más, una alternativa importante para el tratamiento del paciente quemado en nuestro medio. Se preserva en glicerol al 85%, se almacena a 4 °C y se empaqueta al vacío.
Después de un periodo de 20 años sin poder usarla al no contar con un banco de tejidos en Colombia, este estudio, hasta donde hemos podido investigar, es el primer trabajo que evalúa el uso de la membrana amniótica preservada en glicerol al 85%, como cobertura temporal en pacientes con quemaduras faciales de espesor parcial en nuestro país.
El banco de tejidos del IDCBIS de la Secretaría de Salud de Bogotá cumple con todas las normas internacionales de selección de donante tales como determinación del grupo sanguíneo y del antígeno D (Rh), prueba serológica para la sífilis, detección de anticuerpos contra el virus de la hepatitis C, detección del antígeno de superficie del virus de la hepatitis B (HBsAg), detección de anticuerpos totales contra el antígeno core del virus de la hepatitis B (Anti HBc), detección de anticuerpos contra el virus linfotrópico de células T humanas (HTLV 1 y 2), detección de anticuerpos contra el virus de la inmunodeficiencia humana (VIH 1 y 2), detección de anticuerpos contra el Trypanosoma cruzi (Chagas), detección de anticuerpos contra el citomegalovirus, detección de anticuerpos contra Toxoplasma gondii , y cumple además con las normas internacionales establecidas para el rescate, preparación, preservación, almacenamiento y distribución de los tejidos, garantizando así que la membrana amniótica esté libre de cualquier contaminación bacteriana o viral y pueda ser utilizada sin riesgo de infección para el receptor.
El objetivo del presente estudio es evaluar la utilización de la membrana amniótica preservada en glicerol como apósito biológico temporal en el tratamiento de las quemaduras faciales de espesor parcial superficial y profundo. Adicionalmente, evaluar el proceso de curación, dejando la membrana amniótica expuesta, sin el uso de tópicos adicionales u apósitos secundarios, la presencia o no de infección, la intensidad del dolor y el tiempo de curación del área tratada.
Material y método
Llevamos a cabo un estudio observacional, descriptivo y prospectivo en la Unidad de Quemados de la Unidad de Servicios de Salud Simón Bolívar Subred Norte de Bogotá (Colombia), durante un periodo de 2 años, en pacientes con quemaduras faciales de espesor parcial superficial y profundo a los que se realizó dermoabrasión quirúrgica en las primeras 72 horas después del incidente, previamente reanimados y que aprobaron la aplicación de membrana amniótica como tratamiento de sus quemaduras faciales.
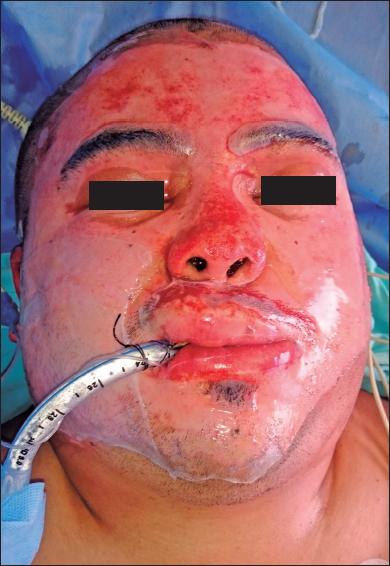
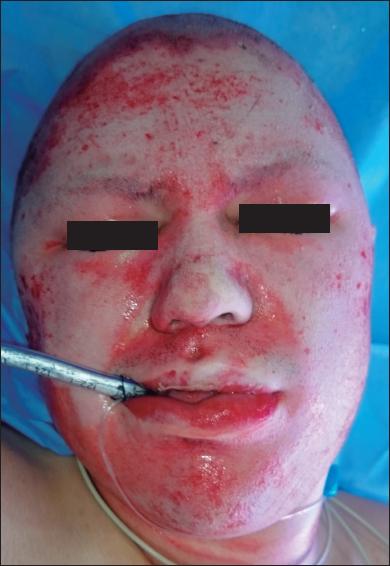
Establecimos un algoritmo para la aplicación del amnion en las quemaduras faciales que presentamos en la figura 1 . Después de firmar el consentimiento informado, el paciente es llevado a cirugía y bajo anestesia general se lavan las áreas quemadas con solución salina normal y jabón de clorhexidina. Posteriormente, se realiza la dermoabrasión mecánica en la cara con papel de lija de 100-120 gr. hasta obtener un sangrado puntiforme y uniforme como evidencia de la presencia de tejido viable. Se retira la membrana amniótica de su empaque y se lava 3 veces con solución salina empleando 10 minutos por cada lavado y a temperatura ambiente, hasta eliminar totalmente el glicerol y rehidratarla adecuadamente. Después de separar el amnion de su porción coriónica, se aplica la membrana amniótica en la cara, sobre las áreas sangrantes, facilitando su adherencia mediante el uso de un secador de cabello a temperatura media durante 15 minutos. No aplicamos ningún otro tipo de agente tópico o apósito secundario.
El seguimiento de los pacientes fue diario hasta el desprendimiento espontaneo de la membrana; evaluamos el dolor diariamente mediante escala visual analógica (EVA).
RESULTADOS
Tratamos mediante este método 52 pacientes con quemaduras faciales de espesor parcial superficial y profundo, empleando un total de 23.753 cm 2 de membrana amniótica (promedio de 456.8 cm 2 por paciente).
La muestra de pacientes contó con más hombres (67.3%, n=35) que mujeres (32.7%, n=17) ( Gráfico 1 ), en una proporción de 2:1. De los 52 pacientes, 46 presentaron quemaduras mixtas, de espesor parcial superficial y profundo. Seis de los 52 pacientes presentaron, además de sus quemaduras de espesor parcial superficial y profundo, pequeñas áreas de quemaduras de espesor total. Los agentes causantes fueron fuego (61.5%, n=32), sustancias químicas (11.5%, n=6), explosión en mina de carbón (1.9%, n=1), necrosis epidérmica tóxica (1.9%, n=1), pólvora (3.8%, n=2), electricidad (5.8%, n=3), aceite caliente (3.8%, n=2), y líquidos hirvientes (9.6%, n=5).
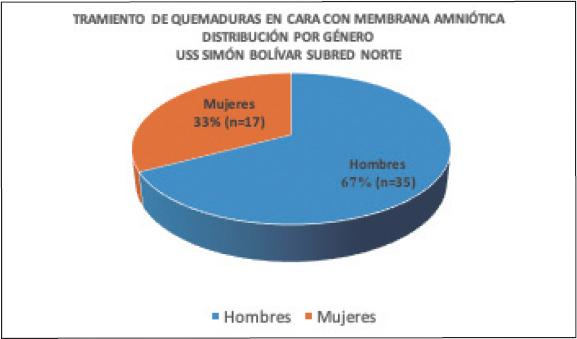
Gráfico 1. Tratamiento de las quemaduras faciales de segundo grado con membrana amniótica. Distribución por género.
En promedio, el total de superficie corporal quemada (SCT) fue del 19% (rango: entre el 2% y el 62%); 45 de los 52 pacientes presentaron compromiso de toda la cara, mientras que los 7 restantes presentaron daño parcial. Todos los pacientes mostraron una adecuada adherencia de la membrana inmediatamente después del proceso de secado y la transparencia del amnion permitió el examen diario hasta que se produjo su desprendimiento espontáneo, lo cual ocurrió en promedio a los 7 días (rango de 5 a 10 días). Además, al no tener vendajes secundarios, todos los pacientes manifestaron no haber tenido ninguna incomodidad durante la alimentación o el aseo de la boca ( Fig. 2 - 4 ).
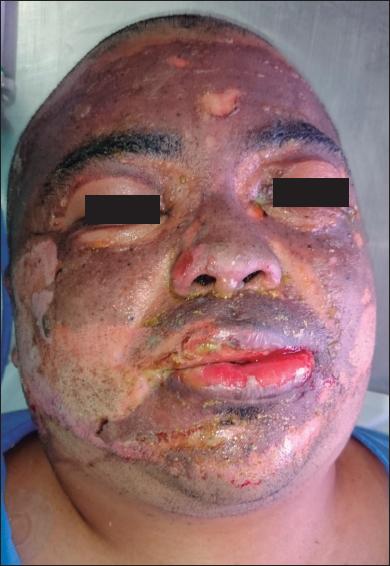
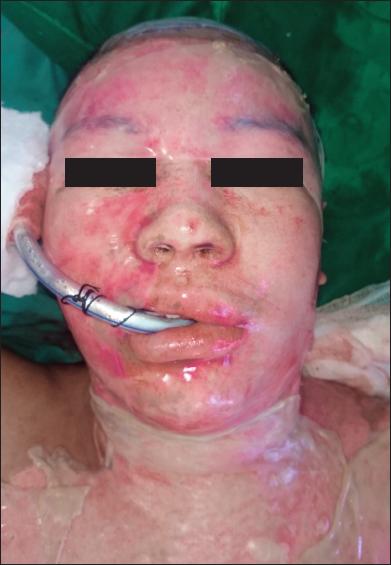
Fig. 2.A. Varón de 28 años con quemaduras por llama (gasolina) por agresión, con un 10% de SCT quemada. Quemaduras de segundo grado superficial y profundo.
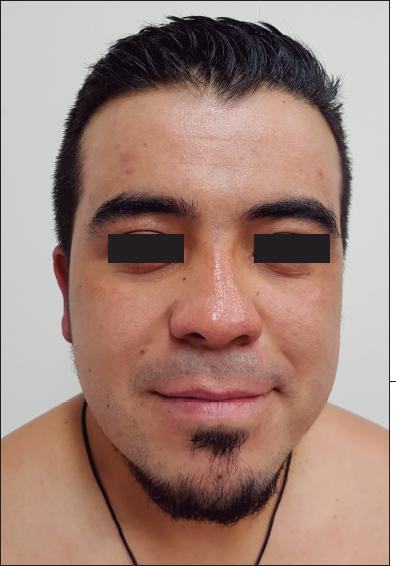
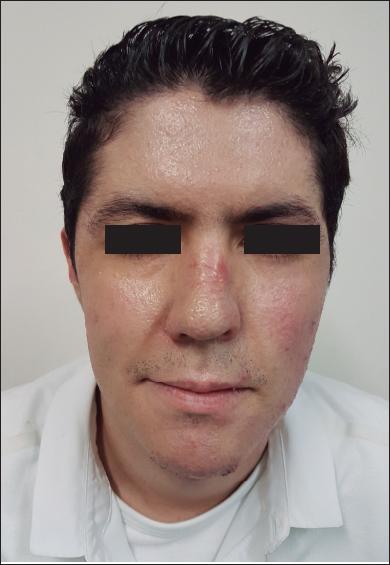
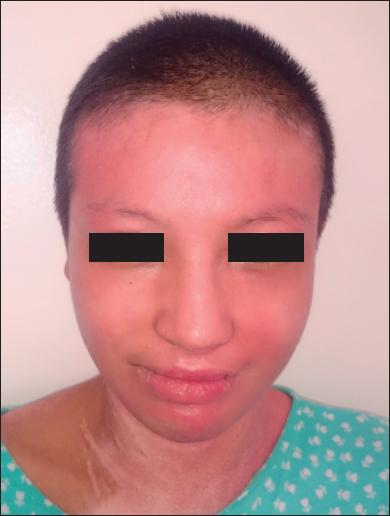
Fig. 2.D. Resultado a los 162 días de la cirugía. No se observan cicatrices hipertróficas ni queloides.
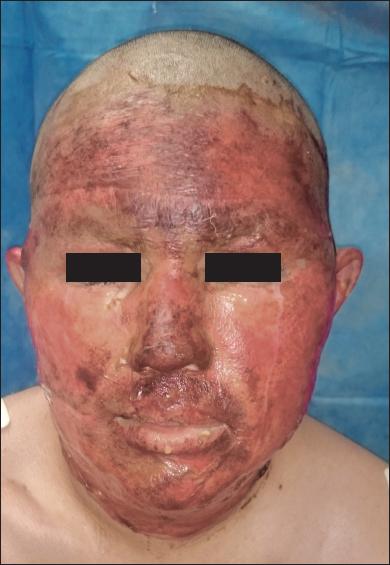
Fig. 3.D. El paciente requirió 25 cm2 de injertos de piel de espesor parcial en la región preauricular izquierda.
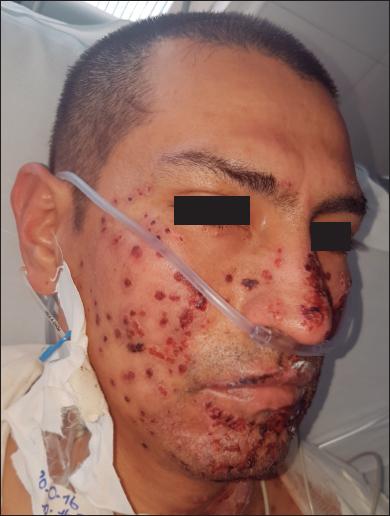
Todos los pacientes refirieron una disminución a cero según escala EVA en términos de dolor después de la aplicación de la membrana amniótica y durante el proceso de epitelización. Solo 1 paciente, que tenía antecedentes de 3 episodios de herpes oral previos a la quemadura, desarrolló herpes simple que fue controlado con Aciclovir ( Fig. 5 ), seguramente por reactivación del virus al estar sometido a una condición de inmunodeficiencia por la quemadura y el trauma quirúrgico de la dermoabrasión.( 19 ) Una vez que diagnosticamos este episodio de herpes simple, dimos aviso al banco de piel. De acuerdo a sus protocolos, de cada membrana procesada se guarda una muestra para realizar nuevos estudios en busca de algún tipo de contaminación en el caso de que se reporte alguna infección en los pacientes tratados, con el fin de determinar si la fuente de infección provino de la membrana amniótica. En este caso, las muestras fueron negativas. Al paciente también se le había aplicado amnion en el dorso de las manos sin que en estas zonas se hubiera producido infección. Adicionalmente, en la Unidad de Quemados se hicieron cultivos de la nevera donde se almacena la membrana amniótica antes de su utilización, y de los elementos de la sala de cirugía, que también fueron informados como negativos, demostrando así que no hubo ninguna relación entre el caso de herpes simple y la posibilidad de contaminación por la membrana amniótica aplicada.

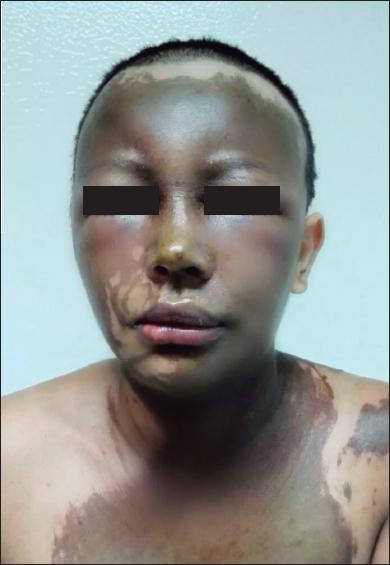
Fig. 5.C. Distribución de las lesiones del herpes simple en racimo y múltiples costras serohemáticas. La historia clínica del paciente incluía 3 episodios previos de herpes simple antes de la quemadura.
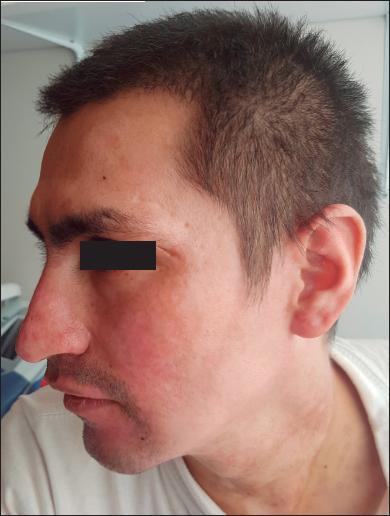
Fig. 5.D. Resultado clínico, sin secuelas, después de tratamieto con aciclovir. Epitelización completa de las quemaduras a los 25 días.
La estancia hospitalaria de los pacientes del grupo de estudio fue de 25 días de promedio (rango entre 5 y 34 días) debido al tratamiento requerido por las lesiones sufridas en otras partes del cuerpo. Las áreas de quemadura de segundo grado tratadas con la membrana amniótica no mostraron cicatrización anormal durante las siguientes 24 semanas. Finalmente, los 6 pacientes que presentaron áreas pequeñas de quemaduras de espesor total, estas fueron tratadas mediante la aplicación de injertos de piel parcial y desarrollaron leve cicatriz hipertrófica manejada a su vez con presoterapia y láminas de gel de silicona.
Discusión
En muchas unidades de quemados, el manejo de la cara quemada al igual que el de las manos, suele ser conservador. Los desbridantes enzimáticos como la bromelina son una nueva opción utilizada con éxito en las quemaduras, y permiten un rápido desbridamiento del tejido necrótico con conservación del tejido sano. Sampietro de Luis,( 20 ) en 2016, publica su experiencia en 10 pacientes con quemaduras faciales utilizando NexoBrid® (MediWound. Alemania), un desbridante enzimático a base de bromelaina, logrando el desbridamiento efectivo y selectivo con una única aplicación del gel desbridante por un periodo de 4 horas, con epitelización del área quemada en un promedio de 13.9 días y tras curaciones con Medihoney ® Wound Gel (Derma Sciences Ltd., EE.UU.) cada 72 horas, disminuyendo así la necesidad de autoinjertos y evitando las complicaciones postoperatorias. Su seguridad, efectividad en tiempo y buenos resultados ha llevado a incluir este desbridante enzimático dentro del protocolo de tratamiento de las quemaduras como una opción en aquellas de localización facial antes del tratamiento quirúrgico en varias unidades de quemados de España.( 21 ) Sin embargo, este producto aún no está disponible en nuestro país, y su alto costo lo hace poco accesible en nuestro medio.
Cuando se decide el tratamiento quirúrgico de este tipo de quemaduras, se realiza la escisión tangencial temprana, antes de las primeras 72 horas tras la quemadura, más cobertura inmediata con autoinjertos o homoinjertos de piel. En las quemaduras de espesor parcial se realiza la dermoabrasión y, de acuerdo con los recursos disponibles, se puede manejar con agentes tópicos o con apósitos biológicos o sintéticos;( 22 , 23 ) Sin embargo, en las quemaduras profundas, ya sea de segundo grado profundo o de tercer grado, quedan por lo general graves secuelas físicas y/o funcionales que requieren posteriormente múltiples procedimientos quirúrgicos reconstructivos durante largos periodos de tiempo, que incluso pueden durar años.
En nuestro Servicio, el protocolo de manejo para las quemaduras de espesor parcial depende de la profundidad de la lesión. Las quemaduras de espesor parcial superficial no requieren habitualmente dermoabrasión mecánica, y su tratamiento incluye limpieza de la herida y cobertura con gasas parafinadas y apósitos secundarios. Las quemaduras de espesor parcial profundo precisan dermoabrasión mecánica hasta evidenciar tejido viable mediante la presencia de un sangrado uniforme y puntiforme, conocido como rocío sangrante. La cobertura se hace con apósitos sintéticos o apósitos biológicos. El tratamiento de las quemaduras de espesor parcial mixtas dependerá de la profundidad predominante. En este trabajo, todos los pacientes mostraron quemaduras de espesor parcial de predominio profundo, y empleamos la dermoabrasión mecánica para eliminar rápidamente el tejido necrótico.
Aunque todos los pacientes presentaron quemaduras de espesor parcial profundo, no recogimos ningún caso de cicatrización anormal durante las siguientes 24 semanas de seguimiento, pese a que sabemos teóricamente que a este nivel de profundidad hay una pérdida de anexos y una red vascular insuficiente que permita la epitelización temprana. De tal forma, consideramos que este es precisamente el principal beneficio de la membrana amniótica,( 24 ) gracias a sus propiedades de neovascularización y a su efecto antinflamatorio y de reducción significativa de la fibrosis.( 25 , 26 ) Como resultado, logramos una epitelización sin cicatrización anormal en las áreas de quemaduras de espesor parcial profundo.
Por otro lado, aunque no era un objetivo del presente estudio, observamos que en los 6 pacientes con pequeñas áreas de quemaduras de espesor total que fueron tratadas mediante escarectomía y también cubiertas con membrana amniótica, presentaban al 7º día un lecho con formación de tejido de granulación rojo, uniforme, no friable, no hipertrófico, sin edema y sin secreciones, características ideales del tejido para aplicación de un injerto de piel de espesor parcial.( 27 , 28 )
En Colombia, desde 2011, el Banco de Tejidos de la Secretaría de Salud suministra los homoinjertos de piel y la membrana amniótica a las diferentes unidades de quemados del país. El amnion se preserva en glicerol al 85% y su proceso de preparación, almacenamiento y distribución cumple con todos los requisitos internacionales exigidos para los bancos de piel, haciéndolo un producto de alta calidad y seguro para el paciente. Su costo es de 0.50 dólares americanos por cm 2 , lo cual lo hace accesible para los hospitales públicos y privados.
El hospital Simón Bolívar es un hospital público, y como consecuencia no cuenta con suficientes recursos económicos que permitan la utilización permanente de los apósitos biológicos y sintéticos modernos o de desbridantes enzimáticos como la bromelina. Tradicionalmente, la cobertura de las quemaduras en cara después de la dermoabrasión se hace mediante la aplicación de gasas con nitrofurazona o gasas parafinadas más apósitos secundarios que requieren cambios día de por medio. Esto es un procedimiento doloroso, que se realiza sin anestesia o analgesia adecuada, por el personal de enfermería.( 29 ) Cada curación tiene un costo aproximado de 80 dólares americanos. El banco de tejidos del IDCBIS tiene convenios interinstitucionales con 3 hospitales con Servicios de Obstetricia que le permiten recolectar y procesar 8.000 cm 2 mensuales de membrana amniótica. Estas cantidades son suficientes para satisfacer la demanda de las unidades de quemados, permitiendo así tener una cantidad permanente de membranas amnióticas disponibles para su uso y a bajo costo.
Actualmente, en diferentes unidades de quemados del mundo que cuentan con bancos de tejidos se utiliza el amnion fresco o procesado para su cobertura temporal como apósito primario y cubierto con apósitos secundarios. En nuestra Unidad, la membrana amniótica se deja expuesta y su transparencia permite la evaluación diaria de la cara durante todo el proceso de curación, pudiendo de esta manera detectar tempranamente posibles complicaciones tales como sobreinfección, secreciones o colecciones tipo hematomas, que pueden ser drenados oportunamente a través de la misma. Además requiere sólo una aplicación, no amerita ningún recambio y no se necesitan agentes tópicos, vendajes o tratamientos adicionales, siendo por tanto más confortable para el paciente. También facilita la alimentación, el aseo y la rehabilitación temprana del paciente, además de aportar otras propiedades ya mencionadas como el control del dolor, la reducción de la inflamación, la estimulación de la epitelización, el control de la población bacteriana y la reducción de la fibrosis, que la hacen realmente costo-efectiva y muy eficiente en el tratamiento de las quemaduras faciales de segundo grado.
Por su disponibilidad inmediata, fácil utilización, sumadas a todo lo anteriormente expuesto, consideramos que la membrana amniótica preservada en glicerol al 85% es el apósito biológico ideal como cobertura temporal del paciente con quemaduras faciales de espesor parcial en nuestro medio. Además, gracias al Banco de Tejidos del IDCBIS, mantenemos un número de membranas amnióticas suficiente y disponible para su uso, a diferencia de los apósitos sintéticos modernos que dependen del gasto de la institución, motivo por el cual no siempre contamos con su disponibilidad durante todos los meses del año.
Esperamos que nuestra experiencia sirva como guía a otras Unidades de Quemados del país y de otros países de la región con limitaciones económicas similares a las nuestras.( 30 )
Conclusiones
La utilización de la membrana amniótica como apósito biológico temporal en el tratamiento de las quemaduras faciales de espesor parcial superficiales y profundas, es un recurso efectivo y accesible para aquellos sistemas de salud con poca disponibilidad de recursos económicos y de materiales, lo cual la hace ser un apósito ideal para el tratamiento del paciente quemado en países donde se cuente, al menos, con bancos de tejidos con estándares de alta calidad que garanticen la seguridad del paciente.