Introducción
La reconstrucción mamaria diferida mediante colgajo miocutáneo del músculo dorsal ancho puede plantearse en pacientes con antecedentes quirúrgicos de cáncer mamario en las que se ha realizado algún tipo de procedimiento quirúrgico axilar (linfadenectomía, biopsia selectiva del ganglio centinela). Tales procedimientos quirúrgicos axilares pueden acarrear ocasionalmente algunas complicaciones, que rara vez incluyen el daño a los vasos tóracodorsales, habitualmente en su ubicación proximal a la axila.(1, 2)
Puesto que la normal funcionalidad del eje vascular tóracodorsal resulta clave para plantear una reconstrucción con el colgajo de dorsal, los cirujanos plásticos necesitan conocer su estado antes de plantearse realizar este tipo de reconstrucción. Para la localización de la arteria tóracodorsal se puede puede recurrir a diversos métodos de imagen, como la angiografía,(3) la ecografía Doppler,(24) la angio-resonancia magnética (angio-RM)(5) o la angio-tomografía computarizada (angio-TC).(6,7,8) La decisión de utilizar un método u otro, de inicio, responde a los diversos protocolos de actuación que adopte cada grupo de modo multidisciplinar.
La ecografía Doppler/Dúplex es una técnica utilizada para evaluar preoperatoriamente la vascularización de los colgajos a utilizar en reconstrucción autóloga mamaria, tal y como describen entre otros, Pauchot y col., Ogino y col., y Tashiro y col. Se trata de una técnica muy accesible, con buenos resultados, que requiere básicamente un mínimo entrenamiento del operador. Consiste el localizar primero y evaluar el flujo vascular después, el eje tóracodorsal de interés.
En este trabajo presentamos nuestra experiencia con la ecografía Doppler/Dúplex (color) como procedimiento de inicio en la reconstrucción mamaria diferida con colgajo miocutaneo de dorsal ancho.
Material y método
Revisión retrospectiva unicéntrica de pacientes con antecedentes de cáncer de mama y manipulación axilar quirúrgica homolateral procedentes de Centros públicos y privados, que acuden a una única consulta de cirugía plástica privada y a las que el cirujano plástico considera candidatas para reconstrucción autóloga diferida con colgajo miocutáneo de dorsal ancho extendido.
De acuerdo con nuestro protocolo actual, el cirujano solicitó inicialmente una evaluación ecográfica de los vasos tóracodorsales correspondientes al lado afecto.
Se realizó ecografía Doppler-Dúplex con la paciente en decúbito lateral, sobre el lado contrario al que corresponde evaluar, con el brazo homolateral elevado y flexionado por encima de la cabeza (Fig. 1), utilizando como referencia principal el eje de la línea axilar posterior.

Figura 1. Protocolo de exploración con ecografía Doppler-Dúplex: A. Paciente en decúbito lateral izquierdo para explorar el lado derecho. B. LAA: línea axilar anterior; LAM: línea axilar media; LAP: línea axilar posterior. Habitualmente, se realizan barridos longitudinales verticales tomando como referencia la LAP, aunque puede ser necesario oblicuar ligeramente el transductor ecográfico.
El estudio Doppler-Dúplex se consideró positivo cuando se localizaron los vasos tóracodorsales en su ubicación habitual, entre los músculos dorsal ancho y serrato (Fig. 2) con un calibre y flujo arterial claramente identificados (Fig. 3). Estos casos fueron considerados como test verdadero positivo. El estudio se consideró negativo cuando no fue posible la localización de los vasos tóracodorsales en su ubicación habitual o bien dicha localización resultó dudosa (Fig. 4).
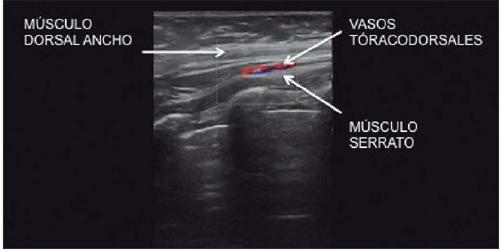
Figura 2. Referencias anatómicas habituales para la identificación de los vasos tóracodorsales. Aproximadamente a 6-8 cm de la región axilar (Angrigiani), tomando como eje la línea axilar posterior, se debe explorar el espacio entre el músculo dorsal ancho y el músculo serrato.
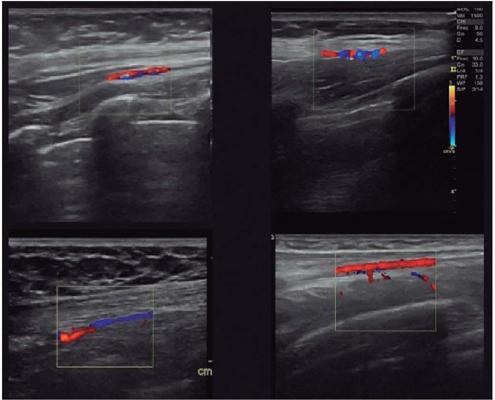
Figura 3. Exploración ecográfica positiva. Cuatro de nuestros casos de exploración positiva. Los vasos tóracodorsales resultan claramente visibles, con calibres y flujos normales.

Figura 4. Exploración ecográfica negativa. Cuatro de nuestros casos de exploración negativa. No se visualizan los vasos tóracodorsales en su ubicación habitual.
La ecografía Doppler-Dúplex fue realizada en todas las pacientes por el mismo radiólogo, En los casos considerados negativos se ofreció a la paciente la posibilidad de realizar angio-TC o angio-RM para intentar identificar los vasos tóracodorsales. Cuando se realizaron estos procedimientos, no fueron estudiados por el radiólogo que realizó previamente la ecografía, sino que fueron evaluados por otros radiólogos del mismo centro.
Los resultados de los casos en los que se dispuso de angio-TC/angio-RM se han considerado como test de referencia positivos, los que permitieron la identificación de los vasos tóracodorsales (ecografía Doppler/Dúplex falso negativo) y negativos cuando no permitieron la identificación de los mismos (ecografía Doppler-Dúplex verdadero negativo).
Resultados
Entre los años 2014 y 2023 recogimos 51 casos que cumplieron los criterios de inclusión en nuestro estudio, correspondientes a pacientes con una edad comprendida entre los 34 y 75 años (media de 52.47 años). El lado afecto más frecuente fue el izquierdo (29 casos, 56.86%) frente al derecho (22 casos, 43.13%). Entre los 51 casos, 39 (76.47%) y 12 (23.52%) mostraron una ecografía Doppler-Dúplex positiva y negativa, respectivamente.
Entre las 12 pacientes con resultados considerados negativos, sólo 8 aceptaron la realización de angio-TC o angio-RM. En 5 de ellas se logró identificar los vasos tóracodorsales y fueron considerados falsos negativos de la ecografía; y en 3 casos no se identificaron los vasos tóracodorsales, por lo que fueron considerados verdaderos negativos de la ecografía (6.38%).
Tras la intervención quirúrgica de reconstrucción mamaria con colgajo miocutaneo de dorsal ancho extendido, no hubo fenómenos de necrosis del colgajo en ninguna de las pacientes.
Se dispone de datos confirmados en 47 casos (39 casos con ecografía positiva y 8 con ecografía negativa y realización de angio-TC/RM), con los parámetros diagnosticos que resumimos a continuación y que figuran en la Tabla I:
– No pudo localizarse la arteria tóracodorsal, por ninguno de los métodos radiológicos realizados, en el 6.38% de casos.
– Los parámetros diagnósticos resultantes fueron: sensibilidad 88.63%; especificidad 100%; valor predictivo positivo 100%; y valor predictivo negativo 37.50%.
– La probabilidad de que el resultado de la ecografía Doppler-Dúplex prediga correctamente la presencia/ausencia de la arteria tóracodorsal (exactitud del test) fue en nuestro estudio del 89.36%.
Discusión
El colgajo miocutáneo de músculo dorsal ancho fue inicialmente descrito en la literatura por Tansini en 1896.(9) Si bien inicialmente fue descrito como un colgajo muscular puro, Bostwick fue el primero que incluyó una isla cutánea junto con el músculo para la reconstrucción de defectos postmastectomía.(10)
A partir de la descripción de dicho colgajo, la reconstrucción autóloga de la mama con colgajo del músculo dorsal ancho es ahora una práctica quirúrgica habitual, con buenos resultados estéticos y una amplia aceptación por parte de las pacientes afectas de cáncer de mama, especialmente cuando se realiza de forma inmediata.(11, 12, 13) De hecho, es considerado históricamente uno de los colgajos miocutáneos más seguros(14) y, complementado con grasa autóloga, constituye un método alternativo al uso de implantes mamarios en la reconstrucción mamaria postradioterapia, evitando las complicaciones derivadas del uso de implantes(15), con buenos resultados estéticos (Fig. 5).

Figura 5. Paciente de 61 años de edad con antecedentes de mastectomía izquierda y linfadenectomía axilar homolateral. A. Imagen a los 3 años de finalizar el tratamiento oncológico. Candidata a reconstrucción diferida con colgajo miocutáneo de dorsal ancho más lipoinfiltrado. B. Resultado a los 7 años.
Algunos autores encuentran preferible la reconstrucción mamaria inmediata.(11, 12, 13, 16, 17) Sin embargo, y por diversas razones, se plantea la reconstrucción diferida en pacientes que ya han sido sometidas a un esquema terapéutico completo (incluyendo posible radioterapia), habitualmente mastectomizadas y con procedimentos quirúrgicos axilares, circunstancias no ideales desde el punto de vista del cirujano plástico, que pueden condicionar la técnica quirúrgica y comprometer el resultado estético final. Esta situación es habitual en el contexto sanitario en el que hemos desarrollado nuestro estudio, con pacientes procedentes de varios centros sanitarios, tanto públicos como privados, sometidas a diversos protocolos de actuación en los que no se contempla, habitualmente, una reconstrucción autóloga inmediata.
Para llevar a cabo la reconstrucción diferida, se requiere verificar la presencia y correcto estado de los vasos tóracodorsales. Esto parece ser totalmente factible en personas sanas,(18) sin antecedentes quirúrgicos de cáncer mamario, mediante ecografía Doppler, conociendo la ubicación anatómica y las posibles, y al parecer no infrecuentes, variantes de posición y sistemas de ramificación arterial.(19, 20, 21) También parece resultar fácil en pacientes que se someten a reconstrucción inmediata, sin antecedentes quirúrgicos mamarios/axilares, tal y como reportan algunos autores.(22) Sin embargo, en pacientes tratadas quirúrgicamente por cáncer de mama, lo que habitualmente incluye una disección axilar, que van a someterse a una reconstrucción diferida, la tarea puede no ser tan sencilla dada la posibilidad de haber dañado/alterado el eje vascular tóracodorsal. Curiosamente, entre las complicaciones reportadas por diversos autores(23, 24, 25, 26, 27) relativas a la linfadenectomía axilar y/o la biopsia selectiva del ganglio centinela, no figura tal daño de dicha estructura vascular. Otros(1, 2) sin embargo, reportan daño vascular tóracodorsal en el 2.4% y 2.7% de los casos respectivamente, lo que suele contraindicar la reconstrucción autóloga con colgajo de dorsal ancho. En nuestra reducida serie, correspondiente fundamentalmente a pacientes con antecedentes de linfadenectomía axilar, se deduce un importante daño vascular en el 6.38% de los casos, porcentaje mayor que el reportado en la literatura hasta la fecha, aunque el verdadero porcentaje de daño vascular sólo podría estimarse tras evaluar todas las pacientes con antecedentes de linfadenectomía axilar/biopsia selectiva de ganglio centinela sean o no candidatas a reconstrucción con colgajo de dorsal, algo que, hasta donde hemos podido conocer, nunca ha sido llevado a la práctica.
La misión de localizar y evaluar los vasos tóracodorsales en la reconstrucción mamaria diferida recae principalmente sobre los métodos de diagnóstico por imagen. Están descritos varios al respecto, en especial los que utilizan técnicas radiológicas de adquisición volumétrica y reconstrucción tridimensional, como la angio-TC o la angio-RM, en general con muy buenos resultados.(5, 6, 7, 8) Sin embargo, no están exentos de algunos inconvenientes, entre los que destacamos los siguientes: requieren el uso de contraste intravenoso y seguir escrupulosamente determinados protocolos(5, 7) de posición del paciente / adquisición de imágenes; algunos de ellos (angio-TC) suponen administrar unas dosis de radiación nada desdeñables y consumen bastante tiempo de ocupación de sala radiológica; son largos, tanto para el paciente como para el técnico que adquiere las imágenes y para el radiólogo que debe emplear su tiempo en la estación de trabajo para las tareas del postproceso de imagen y reconstrucción. En definitiva, son métodos que requieren disponer de alta tecnología, consumen mucho tiempo, resultan caros y, por otro lado, pueden resultar negativos, como en algunos de nuestros casos, lo cual puede resultar algo decepcionante para prescriptores y pacientes dado el esfuerzo empleado.
La aportación de la ecografía Doppler-Dúplex en pacientes con antecedentes quirúrgicos de cáncer mamario no se ha descrito de manera exhaustiva, precisamente. Una de las escasas referencias bibliográficas corresponde a Pauchot y col.(2) que encuentran diferencias vasculares entre el lado operado y el sano (utilizan el término “alterado”, con dismunición vascular en el pedículo correspondiente) hasta en el 12.20% de todos sus pacientes (74 casos). En el 9.50% encuentran pedículos vasculares más pequeños en el lado operado y en el 2.70% graves estenosis que contraindican claramente el uso del pedículo para reconstrucción. Nosotros no hemos realizado tal diferenciación y observamos un 6.38% de pedículos vasculares no claramente presentes, porcentaje que tal vez quedaría comprendido dentro del 9.50% de pedículos vasculares “alterados” descrito por Pauchot.
La ecografía Doppler está incluida en el protocolo preoperatorio de diversos centros(28) con resultados satisfactorios que recogen hasta un 85% de localizaciones correctas de la arteria tóracodorsal, porcentaje superior al nuestro, aunque en casos de reconstrucción inmediata, sin manipulación quirúrgica axilar previa.
Se trata además de una técnica bastante más barata que la angiografía,(3) ya en desuso, y que el resto de técnicas radiológicas de adquisición volumétrica (angio-TC, angio-RM), sin efectos adversos/secundarios ya que no ocasiona radiación ionizante y no es necesario administrar contraste intravenoso. Basta con una adecuada experiencia.
Conclusiones
Aunque el número de casos que presentamos en nuestro estudio no es elevado y los parámetros diagnósticos no resulten perfectos (89.36% de exactitud), pensamos que la ecografía Doppler-Dúplex resulta ser la técnica inicial de elección para la identificación preoperatoria de los vasos tóracodorsales en pacientes mastectomizadas por carcinoma mamario con tratamiento quirúrgico de la axila que se someten a reconstrucción mamaria diferida con colgajo de dorsal ancho.
Se trata de una técnica inocua y más económica que otras más sofisticadas y de más difícil acceso.
Sólo cuando no se dispusiera de dicha técnica o de la experiencia necesaria para emplearla o sus resultados resultaran negativos o dudosos, debería recurrirse a angio-TC o angio-RM.















