Introducción
El desarrollo y perfeccionamiento de técnicas microquirúrgicas ha permitido que los colgajos libres se conviertan en una alternativa ampliamente utilizada en cirugía reconstructiva compleja.(1) Hay situaciones en las que se agregan dificultades adicionales a la complejidad de la reconstrucción con colgajos microquirúrgicos y que hay que saber enfrentar; tal es el caso del vasoespasmo.
El vasoespasmo es una contracción sostenida de la musculatura lisa en los vasos sanguíneos causada por diversos estímulos, tales como la manipulación/tracción directa de los vasos, frío local, sangrado, aumento del tono simpático, vasoconstrictores circulantes y alteraciones en la homeostasis metabólica.(2) Se presenta en el 5-10% de las intervenciones y puede producir fallo del colgajo por isquemia prolongada.(3) Entre las estrategias para el manejo del vasoespasmo existen algunas medidas quirúrgicas y farmacológicas (locales y sistémicas) destinadas a prevenir o reducir la contracción de la musculatura lisa de los vasos.(1) Diversos agentes terapéuticos han sido evaluados para el tratamiento y prevención del vasoespasmo en microcirugía, sin embargo, no existe un claro consenso respecto a los algoritmos para su uso y las opciones terapéuticas más eficientes.(4)
El objetivo de esta revisión es describir los mecanismos de acción y la evidencia sobre la efectividad de las diferentes intervenciones, así como generar una guía de recomendación para el manejo del vasoespasmo según la evidencia existente y la experiencia acumulada.
Material y método
Revisión bibliográfica de la literatura en PubMed, Scopus, Trip Database y SciELO para identificar estudios que evaluen el efecto de distintas intervenciones para el manejo del vasoespasmo en microcirugía. Incluimos trabajos experimentales sin restricción en la fecha de publicación, utilizando las siguientes estrategias de búsqueda: “Vasoconstriction” AND “Microsurgery”; “Vasoconstriction” AND “Free Tissue Flaps”; “Spasm” AND “Microsurgery”; “Spasm” AND “Free Tissue Flaps”; “Smoking” AND “Microsurgery”; “Nicotine” AND “Free Tissue Flaps”. También realiamos una revisión bibliográfica de estos artículos para capturar todos los datos disponibles.
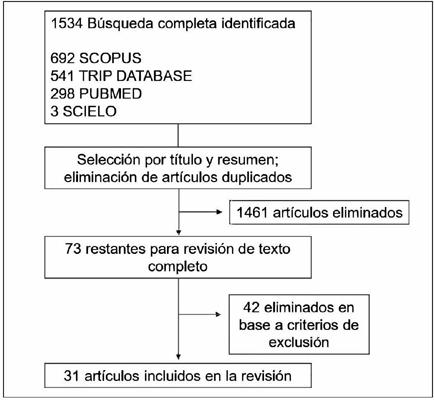
Analizamos los títulos y resúmenes de todos los artículos encontrados, eliminando los duplicados, en un idioma distinto al inglés o español y aquellos que no evaluaron intervenciones para el vasoespasmo en microcirugía. Posteriormente realizamos un análisis bibliográfico del texto completo de los artículos remanentes, excluyendo artículos de revisión, cartas al editor, casos clínicos y trabajos sin un diseño experimental. La Fig. 1 muestra la selección sistemática de artículos.
Del total de 31 artículos incluidos, 5 analizan intervenciones no farmacológicas: adventicectomía, efecto del tabaco y adecuado manejo en la ligadura de ramas. Un total de 26 artículos analizan intervenciones farmacológicas: drogas vasopresoras en anestesia y efecto de vasodilatadores.
A continuación, analizamos en detalle cada una de estas intervenciones.
A) Medidas no farmacológicas
Encontramos un total de 5 artículos sobre medidas no farmacológicas. Detallamos las características de los mismos en la Tabla I.
Tabla I. Evidencia sobre medidas no farmacológicas para el manejo de vasoespasmo.
| Estudio y año | Diseño y población | Intervenciones | Medición/ resultados medidos | Principales resultados/ conclusiones |
|---|---|---|---|---|
| Rao y col. 1983(8) | Ensayo experimental, no aleatorizado 6 perros y 40 conejos | Perros: inyección de nicotina intraarterial de colgajo libre Conejos: grupo control: anastomosis femoral sin inyección de nicotina Grupo intervención 1: anastomosis + inyección nicotina peritoneal pre y postoperatorio Grupo intervención 2: anastomosis + nicotina peritoneal postoperatorio Grupo intervención 3: nicotina intraperitoneal preoperatorio + anastomosis femoral | Efecto vasoconstrictor de la nicotina. Permeabilidad de anastomosis a inyección intraperitoneal de nicotina en periodos variables a conejos con anastomosis femoral | Marcada vasoconstricción y disminución del flujo arterial con curva dosis-respuesta. (Plateau a los 8 mg) Sin diferencias significativas entre grupos que recibieron nicotina en cualquier temporalidad frente a grupo control Evitar fumar en el periodo perioperatorio de transferencia microvascular |
| Hou y col. 1986(2) | Ensayo experimental, no aleatorizado 50 ratas | Evaluan 6 grupos de ratas con inducción de vasoespasmo aplicando sangre de rata donante. Adicionalmente se evaluó el efecto del pretratamiento a rata donante de sangre con heparina y con aspirina | Velocidad de flujo arterial mediante doppler | La instilación de sangre extravascular produjo marcada vasoconstricción. La reducción del flujo en las ratas que recibieron sangre de donantes pretratados con heparina fue estadísticamente menor que las ratas receptoras de sangre no heparinizada. No hubo diferencias estadísticamente significativas en los pretratados con aspirina |
| Van Adrichem y col. 1996(7) | Estudio experimental aleatorizado 60 ratas | Grupo intervención: ratas expuestas a tabaco en colgajo libre y pediculado Grupo control: ratas sin tabaco en colgajo libre y pediculado | Vitalidad, tamaño del colgajo y permeabilidad de anastomosis vasculares 14 días tras la cirugía. Monitorización con termometría y flujometría doppler láser | No diferencias en supervivencia de colgajos pediculados entre ratas expuestas a tabaco y no expuestas La supervivencia de colgajos microquirúrgicos en ratas no expuestas a tabaco fue significativamente superior a las ratas expuestas No diferencias significativas en las mediciones del flujo doppler en relación a exposición del tabaco ni con el tipo de colgajo Demuestra que fumar cigarrillos podría ser perjudicial en la supervivencia de colgajos libres vascularizados |
| Lecoq y col. 2008(5) | Ensayo experimental, no aleatorizado 30 ratas | Vasoespasmo producido por fenilefrina, alfa agonistas, epinefrina y prazocina vía intravenosa Grupo 1: colgajo de ingle derecho basado en vasos epigástricos con adventicectomía Grupo 2: colgajo de ingle izquierdo basado en vasos epigástricos sin adventicectomía | Medición de flujo de sangre con flujómetro doppler láser Presión arterial media | Tras aplicar fenilefrina y epinefrina, se observó mayor flujo sanguíneo en el grupo 1 en comparación al 2 (sin adventicectomía) La prazocina no produjo efectos estadísticamente significativos |
| Ugurlu y col. 2016(6) | Ensayo experimental aleatorizado. 16 ratas | Grupo intervención: adventicectomia + anastomosis microquirúrgica Grupo control: anastomosis microquirúrgica sin adventicectomía | Medición del diámetro de los vasos en respuesta a la instilación local de oximetazolina 1 hora después de la anastomosis | Grupo intervención no tuvo diferencias en el diámetro del vaso pre y post aplicación de oximetazolina. Grupo control presentó contracción significativa de su diámetro |
- Adventicectomía
Se basa en el principio de la denervación simpática del vaso que se está anastomosando.(5) La interrupción de la inervación simpática de los vasos sanguíneos produce una disminución de la liberación de noradrenalina en los terminales nerviosos de la musculatura de la pared vascular, eliminando el vasoespasmo y dilatando el músculo liso arterial.(6). Además impide la interposición de este tejido altamente trombogénico en la anastomosis.
- Suspensión del tabaco
El principal componente del tabaco es la nicotina, la cual es agonista de los receptores colinérgicos nicotínicos. Induce vasoconstricción periférica al estimular la liberación de catecolaminas de la médula suprarrenal, al aumentar la producción del potente vasoconstrictor tromboxano A2 y al disminuir la producción de prostaglandina I2, que tiene un papel en la vasodilatación y en la inhibición de la agregación plaquetaria.(7)
- Adecuado control de la hemostasia
Cuando existe una hemorragia, el vasoespasmo es un mecanismo adaptado para detenerla. Existen dos componentes asociados a esto: el primero es la contractura circunferencial de tipo mecánico que se produce al lesionar el vaso y el segundo es generado por diversos mediadores, como el tromboxano A2 secretado por plaquetas en el proceso de coagulación, que mantiene disminuido el lumen del vaso.(2)
B) Medidas farmacológicas
Dado que existen múltiples mecanismos que pueden regular tanto la vasoconstricción como la vasodilatación, se han utilizado clínicamente distintos agentes para disminuir el espasmo arterial y mejorar la perfusión del colgajo. Los mecanismos de acción de cada agente terapéutico están ampliamente descritos en la literatura.(1)
Muchos pacientes requieren apoyo de drogas vasoactivas tanto intraoperatorias como durante el postoperatorio. La mayoría de estos agentes son simpaticomiméticos, que si bien pueden aumentar la presión arterial sistémica, la vasoconstricción asociada que provocan puede reducir la perfusión del colgajo, dando como resultado la isquemia.(5)
Los agentes químicos más utilizados se clasifican en 5 categorías basadas en sus mecanismos de acción farmacológica: anestésicos locales (lidocaína, bupivacaína), inhibidores de fosfodiesterasas (papaverina, pentoxifilina y amrinona), bloqueadores de canales de calcio (nicardipino, verapamilo, nifedipino y sulfato de magnesio), vasodilatadores directos (nitroglicerina, hidralazina, prostaglandina E1, nitroprusiato y O-ethyl nitrite (ENO) y alfa-antagonistas (fentolamina y clorpromazina).(9)
A continuación, presentamos brevemente las familias de fármacos más utilizados y sus mecanismos de acción. Detallamos las características de los estudios encontrados en la Tabla II.
Tabla II. Evidencia sobre medidas farmacológicas para el manejo del vasoespasmo.
| Estudio y año | Diseño y población | Intervenciones | Medición/ resultados medidos | Principales resultados/ conclusiones |
|---|---|---|---|---|
| Pucket y col. 1985(18) | Estudio experimental, no aleatorizado 150 ratas | Inducción de vasoespasmo por frío, trauma y epinefrina. Aplicación de bupivacaína 0.75% y lidocaína (2% y 20%) | Diámetro del vaso sanguíneo | Todos los agentes presentaron acción vasodilatadora. Efecto dosis dependiente en lidocaína. Lidocaína 20% obtuvo mayor efecto vasodilatador que bupivacaína 0.75% y lidocaína 2% |
| Crabb y col. 1985(19) | Estudio experimental, no aleatorizado 24 conejos (Colgajo libre arteria epigástrica en conejos) | Inducción de vasoespasmo mediante trauma quirúrgico. Aplicación de lidocaína al 20% y prostaciclina 200 ng/ml en vasos con vasoespasmo inducido por epinefrina | Diámetro y flujo sanguíneo directo del vaso sanguíneo | Ambos fármacos fueron efectivos para aumentar el flujo sanguíneo y el diámetro del vaso. Sin diferencias significativas entre ambos |
| Geter y col. 1986(20) | Estudio experimental, no aleatorizado 330 ratas (colas de ratas) | Distribución en 8 grupos según la aplicación de diversos agentes: Grupo control, lidocaína en diferentes concentraciones (3%, 10% y 20%) nifedipino, carbaciclina, forskolina, regitina, alfa antagonistas: clorpromazina, prometazina y proclorperazina | Diámetro de los vasos a los 0-15-30-45-60 y 75 minutos | Lidocaína al 2% y 10% no resolvieron el vasoespasmo, mientras que la lidocaína al 20% logró resolución completa. Los alfa antagonistas también mostraron efecto positivo al resolver completamente el vasoespasmo, siendo el agente más efectivo la clorpromazina. Forskolina logró resolución parcial de vasoespasmo (80%). Nifedipino y carbaciclina no lo resolvieron |
| Hou y col. 1987(21) | Estudio experimental, no aleatorizado 100 ratas (Arterias femorales de rata) | Vasoespasmo inducido por aplicación de sangre heteróloga. Se aplicó localmente papaverina 0.3% y dosis crecientes de lidocaína (1%-2% y 20%) | Flujo sanguíneo en la arteria femoral medido con velocímetro doppler láser | Lidocaína al 1 y 2% no lograron aumentar el flujo sanguíneo, mientras que la lidocaína 20% y papaverina 0.3% lograron aumento significativo |
| Beekman y col. 1988(11) | Estudio experimental aleatorizado 70 ratas (Arteria de cola de rata) | Vasoconstricción inducida con ergotomina. Inyección local de lidocaína a dosis creciente (2%-4%-8%-12%-16%-20%) | Diámetro de la arteria a los 30 minutos | Concentraciones menores a 12% presentaron nulo o escaso efecto. Sin embargo, el efecto de lidocaína al 12% no presenta diferencias significativas ante la lidocaína al 20% |
| Chen y col. 1990(22) | Estudio experimental, aleatorizado 24 ratas Modelo de vasos en cremaster | Vasoespasmo inducido con epinefrina Aplicación tópica de: Grupo 1 (control): solución salina Grupo 2: prostaglandina E1 (PGE1) Grupo 3: lidocaína 1% | Diámetro arterial medido con video microscopía | PGE1 en una concentración de 10 pg/ml puede revertir significativamente la vasoconstricción inducida por epinefrina Lidocaína al 1% no pudo revertir la vasoconstricción inducida por la epinefrina y, por el contrario, su aplicación resultó en una vasoconstricción pronunciada |
| Ohta y col. 1991(23) | Estudio experimental, no aleatorizado 25 ratas Modelo de vasos femorales | Vasoespasmo inducido con sangre de rata donante Grupo control (vasos izquierdos): solución fisiológica Grupo intervención: lidocaína al 2%, 4%, 10%, 20%, 40% (aplicación tópica) Tras aplicar un componente se lavó y se indujo nuevamente el vasoespasmo con sangre heteróloga | Diámetro de vasos mediante observación y medición directa | Los diámetros arteriales tras la aplicación de lidocaína al 4%,10%, 20% y 40% fueron estadísticamente mayores que los controles. Lidocaína al 2% no mostró diferencias significativas con los controles. El mayor efecto vasodilatador fue obtenido con lidocaína 20%. |
| Huang y col. 1991(24) | Estudio experimental, no aleatorizado 47 ratas Modelo de vasos en cremaster | Vasoespasmo inducido por epinefrina Aplicación tópica de: Grupo 1: fentolamina Grupo 2: papaverina Grupo 3: reserpine Grupo 4: nicotinic acid amide (NAA) Grupo 5: sulfato de magnesio Grupo 6: danshen compound (salvia miltiorrhiza crude) Grupo 7: tolazolina Grupo 8: lidocaína 2% Grupo 9 (control): ringer lactato | Diámetro de vasos mediante observación y medición directa | Fentolamina tiene acción espasmolítica más fuerte para el espasmo arterial. NAA, papaverina y reserpina tienen un efecto menor en la reversión del vasoespasmo. El sulfato de magnesio y el compuesto danshen no mostraron efectos para resolver el vasoespasmo. La tolazolina tiene una acción bifásica con una vasodilatación inicial, seguida por vasoespasmo. Lidocaína 2% no presentón efecto vasodilatador, sino al contrario, un fuerte efecto espasmódico en las arteriolas |
| Okamoto y col. 1993(25) | Estudio experimental, no aleatorizado 32 conejos, modelo de colgajo basado en vasos epigástricos superficiales | Vasoespasmo: producido por trauma quirúrgico Grupo 1: solución salina Grupo 2: heparina sistémica Grupo 3: PGE1 sistémica Grupo 4: heparina + PGE1 sistémicas | Área de viabilidad del colgajo medida con test de luminiscencia con fluoresceína | La aplicación sistémica de PGE1 aumenta el área de viabilidad del colgajo, sin diferencias significativas entre el grupo en que se aplicó sólo PGE1 y el grupo en que se aplicó PGE1 + heparina. Heparina por sí sola no aumentó el área de viabilidad del colgajo |
| Gherardini y col. 1995(26) | Estudio experimental, aleatorizado 59 ratas | Vasoespasmo mediante trauma mecánico. Grupo 1: solución fisiológica. Grupo 2: Lidocaína 2% Grupo 3: Lidocaína 20%. Grupo 4: inyección de péptido relacionado al gen de la calcitonina (CGRP). | Análisis de flujo sanguíneo con doppler | CGRP logró revertir vasoespasmo inducido por trauma, mientras que lidocaína al 2% y 20% no mostraron efectos significativos |
| Kerscher y col. 1996(27) | Diseño experimental, no aleatorizado 20 ratas (disección de arteria femoral) | Vasoespasmo secundario a tracción mecánica. Grupo control aplicación de solución salina, grupo con lidocaína al 1% y grupo con aplicación de papaverina | Variación del diámetro de una arteria distal a la bifurcación de la arteria femoral | Tanto lidocaína al 1% como papaverina tienen resultados estadísticamente superiores a la solución salina |
| Evans y col. 1997(28) | Estudio experimental, no aleatorizado 35 conejos, anastomosis termino-terminal de arteria carótida | Vasoespasmo por trauma y norepinefrina. Efecto de nicardipino, papaverina y lidocaína 2%. | Análisis de flujo sanguíneo mediante flujo doppler. | Nicardipino sistémico y papaverina local presentan efecto vasodilatador efectivo. Nicardipino local y lidocaína al 2% no presentan efecto vasodilatador |
| Weinzweig y col. 1999(13) | Estudio experimental, aleatorizado 60 ratas (Colgajo libre de arteria epigástrica superficial anastomosado a arteria femoral de rata) | Vasoespasmo por trauma mecánico y hielo local por 1 minuto. 6 grupos aleatorios. Grupo control: inyección de solución salina 0,9%, Grupos de intervención: se aplicó nifedipino o verapamilo vía local o sistémica | Temperatura al centro del colgajo y en el segmento proximal y distal de la arteria femoral a los 10- 20 y 30 minutos de liberación de abrazaderas vasculares | Nifedipino y verapamilo aplicados por vía local o sistémica logran disminuir el descenso de la temperatura en el colgajo, pero sólo la aplicación local logra recuperación total de la temperatura inicial |
| Ichioka y col. 2000(29) | Estudio experimental, no aleatorizado 70 ratas Modelo de vasos femorales | Vasoespasmo inducido por epinefrina Aplicación tópica de: Grupo 1: amrinona Grupo 2: lidocaína 10% Grupo 3: solución salina Grupo 4: sin solución | Flujo arterial medido por sonda de ultrasonido doppler | Resolución del vasoespasmo tanto en grupo de amrinona como en el de lidocaína. El grupo de amrinona mostró un grado significativamente mayor de aumento máximo en el flujo sanguíneo que el grupo de lidocaína. El efecto de la lidocaína disminuyó con el tiempo, mientras que la amrinona tuvo un efecto más duradero |
| Demaria y col. 2003(12) | Estudio experimental, no aleatorizado 8 conejos Modelo de vasos femorales | Vasoespasmo inducido por tracción mecánica. Aplicación tópica de: Grupo 1: papaverina Grupo 2: lidocaína 1% | Diámetro arterial medido con ultrasonido doppler | Ambos fármacos produjeron un aumento en el diámetro arterial, sin diferencias significativas entre ellos |
| Baccarani y col. 2007(30) | Estudio experimental, no aleatorizado 26 ratas (Colgajo de arteria epigástrica inferior) | Vasoespasmo inducido por endotelina-1 Grupo 1: solución fisiológica Grupo 2: O-ethyl nitrite (ENO) Grupo 3: lidocaína 20%. Grupo 4: ENO + lidocaína 20% | Flujo sanguíneo medido con sistema doppler | El O-ethyl nitrite y la lidocaína al 20% aumentaron significativamente el flujo arterial tras la vasoconstricción, sin diferencias entre ambos |
| Gulmez y col. 2008(31) | Estudio experimental, aleatorizado 27 ratas (Colgajo dorsal basado en vasos circunflejos ilíacos profundos) | Vasoespasmo por trauma mecánico por disección Grupo control solución salina 0.9% y grupo aplicación de metamizol sistémica intraperitoneal | Flujo arterial por doppler inmediato y a los 7 días | El grupo tratado con metamizol presentó un mayor flujo doppler postoperatorio inmediato, pero el efecto no se mantuvo a los 7 días |
| Hyza y col. 2009(15) | Estudio experimental, no aleatorizado 40 ratas (Colgajo de arteria epigástrica inferior superficial) | Vasoespasmo por tracción mecánica Grupo control: sin adición de ningún componente Grupo intervención: aplicación tópica de sulfato de magnesio 10% | Medición de flujo de sangre con flujómetro doppler láser | Duración del vasoespasmo significativamente más corta en el grupo de tratamiento con sulfato de magnesio 10% |
| Yokoyama y col. 2011(10) | Estudio experimental, no aleatorizado 35 ratas Modelo de vasos femorales | Vasoespasmo inducido por epinefrina1ª etapa: evaluación de cambios en el flujo de sangre. Grupo 1: aplicación única de solución salina Grupo 2: infusión continúa de solución salina Grupo 3: aplicación tópica dosis única lidocaína 2% Grupo 4: infusión tópica continua lidocaína 2%2ª etapa: evaluación del tratamiento y prevención del vasoespasmo. Grupo 5: nada Grupo 6: aplicación tópica dosis única lidocaína 2% Grupo 7: infusión tópica continua lidocaína 2% | Flujo arterial medido por sonda ultrasonido doppler | La aplicación única de lidocaína 2% tiene efecto rápido y es eficaz para tratar el vasoespasmo, aunque tiene corta duración. La infusión continua de lidocaína 2% tuvo efecto más duradero |
| Eley y col. 2012(32) | Estudio pseudo-experimental tipo antes- después 24 sujetos sometidos a colgajos libres | Control: medición basal de individuo sin aplicación de drogas Intervenciones: cada individuo fue expuesto de forma aleatoria a dosis crecientes de epinefrina, norepinefrina, dobutamina y dopamina | Flujo arterial por doppler | Dobutamina y norepinefrina tuvieron efectos beneficiosos en el flujo sanguíneo de la piel del colgajo, con mayor incremento del flujo al administrar norepinefrina |
| Hyza y col. 2014(1) | Estudio experimental, no aleatorizado 300 ratas (Colgajo pediculado de colgajo inguinal) | Vasoespasmo por tracción mecánica. Población distribuida en 15 grupos: un grupo control y 14 fármacos distintos para manejo de vasoespasmo: Sistémicos (pentoxifilina, PGE1, sulfato de magnesio 10%) Locales (pentoxifyllin, nitroglicerina, lidocaína 2%, sulfato de magnesio 10%, sulfato de magnesio 20%, bupivacaína 0,5%, trimecaína 1%, nitroprusiato, papaverina, verapamilo, alprostadil) | Flujo arterial por doppler | Efecto positivo en la reducción del vasoespasmo con: sulfato de magnesio 10% (local), verapamilo (local) y pentoxifilina (parenteral). Prolongación significativa del vasoespasmo tras la administrar lidocaína 2 %. |
| Hyza y col. 2015(14) | Estudio experimental, no aleatorizado 8 cerdos (comparación de colgajos de epigástrica superficial entre hemicuerpos) | Vasoespasmo por tracción mecánica Grupo control: aplicación local de solución fisiológica Grupo intervención: aplicación tópica de sulfato de magnesio 10% | Medición de flujo de sangre con flujómetro doppler láser | Duración del vasoespasmo en grupo de tratamiento con sulfato de magnesio 10% significativamente más corta que en grupo control. Velocidad de perfusión del colgajo no fue significativamente menor (p= 0,1) |
| Kaya y col. 2016(33) | Estudio experimental, aleatorizado 35 ratas (modelo de anastomosis femoral) | Vasoespasmo por trauma mecánico por disección Ratas aleatorizadas a 4 grupos: control (1), metamizol (tópico) (2), papaverina (3), lidocaína 10% (4) | Diámetro de los vasos 5-10-20-30 minutos tras la aplicación de los diferentes fármacos | Metamizol y papaverina lograron aumento del diámetro de las arterias, sin diferencias significativas entre ambos |
| Sakarya y col. 2019(34) | Estudio experimental, aleatorizado. 25 ratas (modelo de anastomosis en arteria femoral) | Vasoespasmo por trauma por disección. Ratas aleatorizadas a 5 grupos: control (1), cafeína sistémica preoperatoria (2), cafeína sistémica postoperatoria (3), cafeína perioperatoria (4) y cafeína local (5) | Diámetro del vaso y análisis histológico de la muestra | La aplicación local de cafeína produjo efecto vasodilatador importante, y disminución de la hiperplasia de la íntima en el análisis histológico. La aplicación sistémica de cafeína no logró disminución estadísticamente significativa del diámetro del vaso |
| Jin y col. 2019(16) | Estudio pseudo-experimental tipo antes- después 37 pacientes sometidos a colgajos libres (ALT o SCIP) | Grupo control: pacientes antes de la administración de PGE1 sistémica Grupo intervención: PGE 0,4 ug/hr vía sistémica | Velocidad de flujo sanguíneo utilizando ecografía doppler | La administración de PGE1 vía sistémica incrementó significativamente la velocidad de flujo sanguíneo, sin cambios hemodinamicos significativos |
| Ma Q y col. 2021(4) | Estudio experimental, no aleatorizado 80 ratas, modelo de arteria femoral | Vasoespasmo por tracción mecánica Aplicación local de: Grupo 1: Prostaglandina E1 Grupo 2: Sodium nitroprusside 10% Grupo 3: Sulfato de magnesio 10% Grupo 4: Papaverine Grupo 5: Phentolamine Grupo 6: Verapamil, 2% Grupo 7: Lidocaína 2% Grupo 8: Amrinone, Grupo 9: Lidocaína 12% Grupo 10 (control): Solución fisiológica | Diámetro arterial medido con láser | Todos los agentes mostraron disminución del tiempo consumido por la arteria para revertir el espasmo en comparación con solución salina normal (P < 0,001). Sulfato de magnesio al 10% mostró la mejor potencia antiespasmódica, lo que permitió que los vasos requirieran menos tiempo para revertir el espasmo (arteria y vena). Lidocaína al 12% ocupó el segundo lugar en eficacia, pero no logró efecto en la vena femoral |
- Anestésicos locales
Estabilizan la membrana celular para prevenir la despolarización y la activación de los canales de calcio. Además, inducen un efecto espasmolítico directo en las células musculares lisas.(10) El principio activo más utilizado en la literatura es la lidocaína en diferentes concentraciones (1-2%-4%-8%-10%-12%-16%-20%).(11)
- Inhibidores de la fosfodiesterasa
Antagonizan la fosfodiesterasa, por lo que su inhibición produce un aumento de la concentración de este segundo mensajero dentro de las células. Además, los inhibidores de la fosfodiesterasa provocan una disminución en la entrada de calcio e inhiben la liberación de calcio de las reservas intracelulares. Todo esto produce una relajación y vasodilatación de la musculatura de los vasos(12) El principio activo más utilizado en la literatura es la papaverina. Este fármaco, además del efecto espasmolítico, también inhibe la agregación plaquetaria inducida por colágeno y la liberación de serotonina.(9)
- Bloqueadores de los canales de calcio
La elevación de concentraciones de calcio intracelular causa vasoconstricción a través de la cinasa de la cadena ligera de la miosina, permitiendo la interacción miosina-actina y la contracción del músculo liso. El antagonismo de los canales de calcio transmembrana regulados por voltaje disminuye las concentraciones de calcio intracelular en las células del músculo liso vascular, produciendo vasodilatación.(13) Los inhibidores de los canales de calcio son los más utilizados en el tratamiento de la hipertensión, aunque algunos se usan para tratar la angina cardíaca y el vasoespasmo cerebral. Los medicamentos derivados de la dihidropiridina (nicardipino y nifedipino) comprenden la mayor parte de los bloqueadores de los canales de calcio disponibles comercialmente. El verapamilo pertenece al grupo fenilalquilamina que generalmente produce menos vasodilatación y menos taquicardia refleja. El nifedipino y verapamilo fueron los principios activos más utilizados en los trabajos revisados.(9)
- Sulfato de magnesio
La teoría exacta sobre el mecanismo de acción del sulfato de magnesio en el vasoespasmo aún no es del todo conocida.(1) Es un antagonista del calcio único, ya que puede actuar sobre la mayoría de los tipos de canales de calcio en el músculo liso vascular. Se cree que su mecanismo de acción está relacionado con la inhibición competitiva entre los iones de magnesio y calcio para los sitios de unión de la calmodulina, que es la proteína reguladora de la quinasa de cadena ligera de miosina. El calcio no puede activar la quinasa de cadena ligera de miosina cuando el ión Mg+ está unido a la calmodulina. Esto da como resultado la relajación inducida por Mg+ de las fibrillas del músculo liso debido a cambios conformacionales en la actomiosina ATPasa, lo que la hace menos activa de manera dependiente de la dosis.(14) Esto provocaría una relajación arterial que posteriormente podría disminuir la resistencia vascular periférica y cerebral, aliviar el vasoespasmo y disminuir la presión arterial.(15)
- Vasodilatadores directos
El propósito de estos agentes es producir relajación de la musculatura lisa vascular arterial y venosa. Actúan a través de mecanismos de segundo mensajero, que varían en función del fármaco empleado, produciendo radicales libres que estimulan los nucleótidos de adenosina monofosfato cíclica (AMPc) y guanosin monofosfato cíclica (GMPc) y participan en la transducción de las diferentes vías de señalización intracelular.(9)
Uno de los agentes más utilizados es la prostaglandina E1 (PGE1), la cual al inhibir la expresión de moléculas de adhesión como E-selectina, ICAM-1 y VCAM-1, de citoquinas inflamatorias como TNFalfa y MCP-1, componentes de la matriz y factores de crecimiento como CYR61 y CTGF, se le atribuyen múltiples funciones como la activación del sistema fibrinolítico, la disminución de la asimilación de colesterol por el lecho vascular, la disminución de la adhesión endotelial de plaquetas y leucocitos, y un efecto antiproliferativo y miorrelajante de las células de músculo liso. La dosis intravenosa de 80ug/24 horas ha demostrado su seguridad en microcirugía utilizándose en asociación con drogas antitrombóticas, aspirina y heparina de bajo peso molecular sin incrementar la tasa de complicaciones hemorrágicas.(16).
Un estudio realizado con modelo de anastomosis arterial y venosa femoral de rata, evidenció una concentración incrementada de lipoprostaglandina E1 en las células de músculo liso alrededor de la zona anastomótica de forma selectiva.(17)
La lipoprostaglandina E1 produce un incremento significativo de la velocidad de flujo arterial máxima a nivel del pedículo del colgajo libre sin complicaciones hemodinámicas asociadas cuando se administra a una tasa de 0.4ug/h 10 minutos después de completar la anastomosis vascular (medido en un conjunto de 37 pacientes a los que se les realizó colgajos SCIP y ALT).(16)
- Alfa-antagonistas
Actúan por inhibición de los receptores alfa-1, alfa-2 o ambos. La estimulación de los receptores alfa de las células de musculatura lisa produce vasoconstricción por medio de la liberación de calcio intracelular desde el retículo sarcoplásmico; la inhibición de los receptores alfa provoca vasodilatación.(9)
Discusión
La compleja e impredecible aparición del vasoespasmo asociado a la realización de anastomosis microquirúrgicas y sus complicaciones relacionadas, han llevado a la necesidad de utilizar diversas técnicas para la reversión de este problema.
Las 3 medidas no farmacológicas analizadas fueron la adventicectomía, la suspensión del tabaco y el control de las ramas arteriales durante la disección. Los estudios en ratas realizados por Godden y Lecoq y col.(5,6) muestran resultados favorables para la adventicectomía al demostrar experimentalmente que esta intervención logra disminuir la vasoconstricción al inhibir la respuesta simpática. Si bien no encontramos estudios que analizaran el efecto de esta intervención en seres humanos, está ampliamente avalada por la opinión y recomendaciones de los expertos.(35)
Los estudios sobre los efectos del tabaco en el vasoespasmo realizados por Rao y col.(8) y Van Adrichem y col.(7) muestran resultados temporales y no logran presentar una diferencia clínicamente significativa en los colgajos. Sin embargo, dada la gran cantidad de evidencia que respalda los efectos negativos del tabaco sobre la cicatrización y el aumento de complicaciones durante al menos 6 semanas antes de la cirugía, excepto en los casos en que la postergación de la microcirugía empeore el pronóstico de su condición basal (ejemplo: cáncer, trauma, etc.).
En relación al espasmo inducido por la sangre, el trabajo de Hou y col.(2) resalta la importancia del adecuado control de las ramas arteriales, ya que su rotura y posterior sangrado pueden inducir un vasoespasmo. Pese a que no encontramos estudios adicionales que analicen el efecto de esta intervención, una ejecución inadecuada tiene efectos negativos evidentes (sangrado-vasoconstricción), por lo que consideramos que se debe realizar de rutina con la máxima prolijidad utilizando adecuados clips hemostáticos. Por otro lado, la ligadura de ramas adyacentes a la arteria aumenta el flujo y mejora la perfusión del colgajo.
Entre las intervenciones farmacológicas, la papaverina es la más utilizada según una encuesta realizada a miembros de la American Society for Reconstructive Microsurgery (ASRM) y la World Society for Reconstructive Microsurgery (WSRM).(35) Su efectividad para el manejo del vasoespasmo ha sido probada en diversos estudios(12,21,27,28,33) e incluso algunos de ellos plantean su superioridad a la lidocaína en concentraciones entre el 1-10%(27,28,33) y con un efecto comparable a la lidocaína al 20%.(21) Estos hallazgos muestran que la papaverina es un agente tópico espasmolítico y antiespasmódico eficaz con un inicio de acción rápido y una duración razonable del efecto, por lo que debe ser considerada como un elemento terapéutico de primer orden para el manejo de vasoespasmo.
Existen pocos trabajos experimentales que evalúen la aplicación sistémica de la lipoprostaglandina E1 (PGE1) para el vasoespasmo en colgajos libres, sin embargo, la PGE1 ha sido evaluada por diversos estudios observacionales que demuestran la mejoría de una amplia gama de sintomatología clínica asociada a pacientes con enfermedad vascular periférica, úlceras por pie diabético y neuropatía diabética.(37,38)
Encontramos 5 estudios que evaluaron la efectividad de la prostaglandina E1(alprostadil) para el manejo del vasoespasmo.(1,4,16,22,25) La aplicación tópica de este fármaco tiene evidencia heterogénea. Mientras el estudio publicado por Chen y col. mostró efectividad y superioridad en el efecto de la PGE1 por encima de la lidocaína al 1%,(4) el estudio de Ma mostró el peor desempeño para la resolución del vasoespasmo en comparación al resto de los compuestos.(4)
En el caso de la aplicación sistémica, la evidencia ha mostrado resultados más consistentes. Los estudios en animales realizados por Hyza y Okamoto y col., así como los resultados en colgajos libres en seres humanos realizados por Jin y col., muestran un claro efecto vasodilatador de la PGE1, con un adecuado perfil de seguridad.(1,16,25) Si bien aún no existen estudios aleatorizados en humanos, consideramos que la evidencia existente permite utilizar este fármaco de forma segura.
Los trabajos que evalúan la lidocaína para el manejo del vasoespasmo muestran que este fármaco tiene una efectividad dosis-dependiente,(11,18,20,21,23) con una mayor eficacia observada con concentraciones entre el 12%-20%.(11,18,20,21) Sorprendentemente, algunos estudios plantean que probablemente las concentraciones bajas, en el orden de 1% o 2%, no sean efectivas(1,11,20,21,26,28) o incluso puedan tener efectos deletéreos, con una prolongación en la vasoconstricción.(1,22) Esto es particularmente relevante considerando que la lidocaína es el segundo fármaco más utilizado para el manejo del vasoespasmo según la encuesta de Turin y col.(35). En nuestro medio, gran parte de los cirujanos que realizan microcirugía utilizan la presentación al 2% ya que se encuentra fácilmente en todos los establecimientos de salud. Las presentaciones de mayor concentración son poco utilizadas ya que son difíciles de conseguir.
Pese a la elevada frecuencia de uso de los bloqueadores de calcio en la clínica, sólo encontramos estudios experimentales en animales que evalúen su uso. Muestran que tanto la vía sistémica (nicardipino), como local (verapamilo y nifedipino), tienen un efecto vasodilatador en los modelos experimentales utilizados.(13,28) Si bien estos fármacos pueden ser una buena alternativa terapéutica dada su amplia disponibilidad y bajo costo, consideramos prudente esperar estudios que analicen el perfil de seguridad de los efectos adversos que pueden ocurrir en colgajos realizados en humanos.
Otro fármaco prometedor, dado su bajo costo y amplia disponibilidad, es el sulfato de magnesio al 10%. Pese a que ha sido usado de forma sistémica por neurólogos, neurocirujanos y ginecólogos en el tratamiento de vasoespasmo cerebral, preeclampsia y otras patologías,(39) no se han realizado estudios tanto in vitro como in vivo de su uso sistémico y efectos de vasodilatación en colgajos libres. Hyza y col. realizan diversos estudios en los que analizan su efectividad.(1,14,15); en estos estudios experimentales en ratas y cerdos, demuestran la eficacia de la aplicación tópica del sulfato de magnesio al 10% para el manejo del vasoespasmo. Pese a que no existen estudios que analicen esta intervención para el manejo del vasoespasmo en microcirugía en humanos, las experiencias para el manejo del vasoespasmo cerebral han mostrado resultados promisorios. En ellas, se han tratado pacientes con sulfato de magnesio al 10% en los que han objetivado una menor duración del vasoespasmo y una reducción de la isquemia cerebral retardada en pacientes con hemorragia subaracnoidea aneurismática.(40)
Sólo un estudio evalúa el efecto de los alfa-antagonistas en ratas, describiendo un efecto positivo al resolver completamente el vasoespasmo. Destaca la clorpromazina como el fármaco con mejores resultados en términos de aumentar el diámetro de los vasos sanguíneos tras el espasmo inducido por trauma de disección.(20)
Los estudios experimentales en animales muestran efectos positivos del metamizol para el manejo del vasoespasmo tanto en su forma sistémica, como al en su aplicación local.(31,33) Pese a que no existe evidencia en estudios en humanos que evalúen esta intervención, al ser un fármaco de uso cotidiano para el manejo del dolor, consideramos que los pacientes que no tengan alergias específicas a este fármaco se pueden beneficiar de su utilización como analgésico durante el intra y postoperatorio.
En relación al uso de drogas vasoactivas durante esta cirugía, la escasa evidencia disponible parece mostrar un perfil de seguridad adecuado de la epinefrina, convirtiéndola en el fármaco de elección.(32)
Recomendaciones: algoritmo de manejo para el tratamiento del vasoespasmo
Pese a que la revisión de la literatura que hemos llevado a cabo en el presente estudio no ofrece un protocolo claro o algoritmo de manejo estructurado respecto a las técnicas empleadas, los estudios individuales nos presentan resultados que, sumados a la experiencia clínica acumulada, nos permite proponer un protocolo de manejo estructurado para el vasoespasmo en microcirugía.
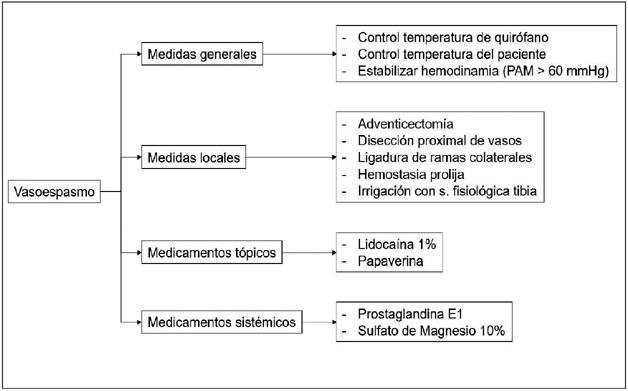
Durante el procedimiento quirúrgico, realizamos medidas para la prevención y tratamiento del vasoespasmo. La Fig. 2 resume nuestras recomendaciones, que se sustentan también por la experiencia de nuestro propio grupo de trabajo.
- Medidas preventivas
Comienzan con un adecuado control de la temperatura de la sala operatoria (22-25 °C) y del paciente mediante dispositivos de calentamiento por convección de aire. Realizamos una prolija disección de los tejidos y ligadura cuidadosa de las ramas de arterias y venas con el fin de generar la mínima infiltración posible de sangre en los tejidos adyacentes. Durante todo el procedimiento el equipo quirúrgico irriga de forma intermitente solución fisiológica tibia en el lugar de disección; una vez que comenzada la disección del pedículo, se irriga de forma intermitente lidocaína al 2% o papaverina tópicas. Además, tanto el colgajo como los pedículos vasculares son resguardados con compresas y/o gasas embebidas en solución fisiológica tibia durante todo tiempo que no requieran manipulación. Adicionalmente, el protocolo quirúrgico de colgajos libres en nuestra institución considera el uso de noradrenalina solo en los casos que requieran vasoactivos en el periodo perioperatorio. Todos los pacientes a los que se les realizan colgajos microquirúrgicos reciben ácido acetilsalicílico a dosis de 100 mg/día durante 14-30 días y heparina de bajo peso molecular a dosis de 40 mg/día subcutánea hasta la deambulación.
- Medidas terapéuticas
En los casos en donde se objetive clínicamente un vasoespasmo, intensificamos las medidas preventivas (control/ajuste de temperatura del paciente, aplicación tópica de lidocaína al 2% o papaverina y gasas/compresas tibias aplicadas localmente). Posteriormente, iniciamos una bomba de infusión continua de prostaglandina E1 (Alprostadil®) a dosis de 20 mcg/día vía intravenosa. En casos donde el vasoespasmo no cede con estas medidas, solicitamos al equipo de anestesia la aplicación sistémica de 1 ampolla de sulfato de magnesio al 10%.
En los casos en que asociado al vasoespasmo se identifica un trombo, realizamos una trombectomía mecánica con cateter Fogarty e indicamos un bolo de 5000 UI de heparina intravenosa. En el postoperatorio inmediato iniciamos anticoagulación terapéutica con heparina de bajo peso molecular a dosis de 40 mg/12 horas vía subcutánea.
Conclusiones
La evidencia actual respecto a la efectividad de las medidas orientadas al manejo del vasoespasmo en microcirugía está basada principalmente en estudios en animales. El algoritmo de manejo del vasoespasmo que presentamos en este trabajo se sustenta en la experiencia clínica acumulada y en la mejor evidencia actualmente disponible, fruto de la revisión de la literatura que hemos llevando a cabo.
Creemos que, el disponer de esta estrategia terapéutica, permite estandarizar el manejo de esta situación en la práctica clínica, para facilitar una rápida toma de decisiones.