Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Oncología (Barcelona)
versión impresa ISSN 0378-4835
Oncología (Barc.) vol.27 no.1 ene. 2004
ORIGINALES
Actividad genotóxica de la terapia con I131 en pacientes tratados por carcinomas de tiroides#
J. Navarro FernándezI; M. Alcaraz BañosI; A. Gómez MoragaI; V. Vicente OrtegaII; M. Canteras JornadaIII
IDepartamento de Radiología y Medicina Física
IIDepartamento de Anatomía Patológica
IIIDepartamento de Bioestadística. Facultad de Medicina. Universidad de Murcia
Dirección para correspondencia
RESUMEN
INTRODUCCIÓN: El test de micronúcleos (MN) sobre linfocitos humanos irradiados con bloqueo citocinético (CB) se utiliza para valorar el daño cromosómico y genotóxico de diferentes agentes físicos y químicos.
OBJETIVO: Determinar un posible efecto genotóxico inducido por la terapia con I131 en pacientes con cáncer de tiroides y determinar la dosis equivalente corporal total (DECT) de radiación ionizante que supone dicho tratamiento.
MATERIAL Y MÉTODOS: Se ha determinado la frecuencia de aparición de MN en cultivos de linfocitos CB en tres grupos de individuos diferentes: 1) en 35 voluntarios sanos para establecer la frecuencia espontánea de MN; 2) en 9 voluntarios supuestamente sanos para realizar las curvas dosis-respuesta "in vitro" con radiación gamma; y 3) en 25 pacientes que han recibido una dosis ablativa de I131 en el tratamiento de un carcinoma de tiroides. Se ha determinado el número de MN/500 células CB previo al tratamiento y tres días después de la administración de I131. La DECT de la terapia se ha calculado por el número de MN en linfocitos obtenido a los tres días de la administración de I131 comparada con la frecuencia de MN expuestas "in vitro" a radiación gamma que produciría una idéntica frecuencia de MN.
RESULTADOS: Se ha obtenido una relación lineal entre la frecuencia de MN y la dosis de radiación ionizante administradas "in vitro" con radiación gamma. La frecuencia de MN tras el tratamiento con I131(8´89 MN/500CB) es significativamente mayor (p<0.01), duplicando la frecuencia espontánea (4´08/500MN) basal.
CONCLUSIÓN: La terapia con I131 induce un incremento significativo del daño cromosómico en los pacientes irradiados por carcinoma de tiroides, equivalente a una dosis corporal total de 13 cGy durante los tres primeros días desde la administración terapéutica de I131.
Palabras clave: Efectos de la radiación. Micronúcleos. Linfocitos. Cáncer de tiroides.
SUMMARY
INTRODUCTION: The micronuclei (MN) test of irradiated human lymphocytes with cytogenetic arrest (LCA) is employed to evaluate the chromosomal damage and the genotoxic effect of different physical and chemical agents.
OBJECTIVE: To determine the possible genotoxic effect induced by I131 therapy of thyroid cancer patients, and to calculate the equivalent total body irradiation (TBI) of the treatment.
MATERIAL AND METHODS: The frequency of appearance of MN was determined in LCA cultures from three different groups: 1) 35 healthy volunteers, in order to establish the spontaneous frequency of MN; 2) 9 supposedly healthy volunteers to carry out in vitro dose-response curves of gamma rays irradiated lymphocytes, and 3) 25 patients with thyroid carcinoma that had received ablative doses of I131 to treat the disease. The number of MN per 500 LCB before the treatment and three days after the administration of I131 was determined. The equivalent TBI of the therapy was assessed by comparing the frequency of MN in lymphocytes obtained three days after the I131 administration with the dose of gamma radiation necessary to produce the same frequency of MN in in vitro irradiated lymphocytes from healthy people.
RESULTS: A lineal relationship was found between the frequency of MN and the dose of gamma radiation in vitro. The MN frequency of the lymphocytes after the I131 treatment was 8.89 MN per 500 LCA, a significantly higher figure doubling the spontaneous basal frequency of 4.08 MN per 500 LCA (p<0.01).
CONCLUSION: The I131 therapy induces a significant increase of chromosomal damage of the lymphocytes from thyroid cancer patients receiving I131 radiation, that has an equivalent TBI of 13 cGy during the first three days of treatment.
Key words: Radiation effects. Lymphocytes. Micronuclei. Thyroid cancer.
Introducción
Uno de los objetivos de la radiobiología es el desarrollo y aplicación de ensayos que sean capaces de determinar las lesiones ocasionadas por la utilización de la radiación ionizante en los diversos campos de las actividades humanas. Junto con el perfeccionamiento de técnicas dosimétricas físicas en exposiciones ocupacionales, se han desarrollado también diversos métodos biológicos para la evaluación individual de las dosis de radiación absorbidas. Estos indicadores o dosímetros biológicos se basan en la existencia de distintos niveles de alteraciones inducidas por la radiación en la organización biológica, tanto a nivel molecular como a nivel subcelular, celular, tisular e incluso a nivel orgánico1.
El test mayoritariamente aceptado desde hace algunos años es el análisis de las aberraciones cromosómicas (en anillo y dicéntricas) en linfocitos de sangre periférica, estimulados in vítro para entrar en actividad mitótica2, 3. Sin embargo, la dosimetría cromosómica tiene sus limitaciones, sobre todo en la evaluación de la dosis en exposiciones crónicas; la estimación de la dosis se complica por la vida limitada de los linfocitos y, por tanto, por la eliminación continua del daño cromosómico radioinducido. Por otra parte, el tiempo necesario para estudiar un número estadísticamente suficiente de células en metafase, así como la necesidad de personal entrenado y experimentado en su lectura, lo hace irrealizable en numerosas ocasiones y justifica la búsqueda de métodos alternativos, más rápidos, baratos y sensibles, que tengan una resolución comparable a la del análisis directo de las aberraciones cromosómicas4-9 . Entre estos métodos se encuentran las técnicas de hibridación con fluorescencia in situ10, medida de la condensación prematura de los cromosomas11, la técnica del intercambio de cromátidas hermanas12 o la inducción de micronúcleos en linfocitos con bloqueo citocinético5.
Hace más de tres décadas que Fliedner (1964) describió la primera inducción de micronúcleos (MN) tras una exposición a neutrones y radiación gamma "in vivo". Desde entonces distintos autores han descrito la aparición de MN en diferentes situaciones normales y patológicas13, 14, 15. Durante los últimos años se ha descrito que el test de determinación de micronúcleos en los linfocitos de sangre periférica con bloqueo citocinético es un indicador biológico en casos de exposiciones a radiaciones ionizantes14,16-19 sobre todo, tras las últimas modificaciones técnicas que recomiendan el estudio de los MN tras la primera división mitótica4, 5, 7, 20, 21.
El método de bloqueo citocinético (BC) en el cultivo de linfocitos humanos irradiados, obtenidos de sangre periférica descrito por Fenech y Morley (1985), con sus modificaciones posteriores24, 25 se considera el mejor test de micronúcleos con fines de determinación de las dosis de radiación absorbida4, 7, 9, 15, 21, 26-28 en las exposiciones parciales o corporales totales, en sobreexposiciones accidentales, e incluso en exposiciones de diagnóstico médico17, 21, 29, 30.
El presente estudio pretende determinar la existencia de un posible daño cromosómico genotóxico en los pacientes sometido a terapia con I131 por cáncer de tiroides y evaluado mediante el test de micronúcleos de linfocitos humanos irradiados con bloqueo citocinético.
Material y métodos
Se ha determinado la frecuencia de aparición de micronúcleos (MN) en cultivos de linfocitos humanos con bloqueo citogenético (CB) en tres grupos de individuos diferentes:
1) Grupo I: 35 voluntarios supuestamente sanos que permitan determinar la frecuencia espontánea de aparición de MN.
2) Grupo II: dos donantes supuestamente sanos con diferentes dosis de radiación gamma (0-16362 mGy), para determinar la frecuencia de aparición de micronúcleos en el citoplasma de linfocitos binucleados con citoplasma conservado y bloqueo citocinético con citochalasina B (CB) utilizando un irradiación IBL de Cs137, con objeto de establecer una curva dosis respuesta entre la dosis de radiación gamma administrada y la frecuencia de aparición de MN.
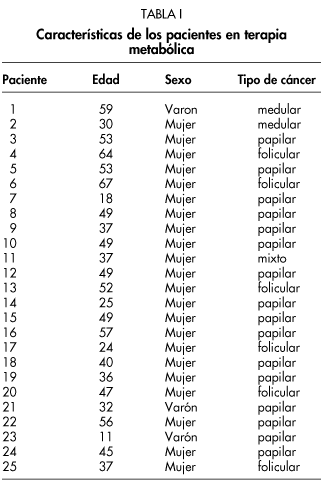
3) Grupo III: 25 pacientes de ambos sexos (3 hombres, 22 mujeres), con edad comprendida entre los 11 y 67 años (edad media de 43 años), a los que se les ha realizado tratamiento ablativo de los restos quirúrgicos de diferentes tipos de cáncer de tiroides en el Servicio de Medicina Nuclear del Hospital Universitario "Virgen de la Arrixaca" de Murcia. Los tipos de cáncer tratados son los siguientes: carcinoma papilar (16 pacientes), carcinoma folicular (6 pacientes), carcinoma medular (2 pacientes), carcinoma mixto (1 paciente) (ver Tabla I). Todos los pacientes recibieron una dosis ablativa de 100 mCi de I131 para la ablación de restos tiroideos siendo excluidos aquellos pacientes que por indicación de su enfermedad (afectación ganglionar, metástasis) requerían dosis mas elevadas. Previa a la administración de la dosis terapéutica fue confirmada la presencia de restos tiroideos tras la realización de una gammagrafia con dosis bajas (3 mCi) de I131.
Técnica de cultivo
A cada paciente se le han extraído 2 muestras de sangre diferentes, para la determinación independiente de la frecuencia de micronúcleos que presentan:
a) muestra I: extraída antes de administrar la dosis ablativa de I131 y que permite establecer la frecuencia de MN del paciente previa a la administración de I131.
b) muestra II: extraída al paciente en el momento de su alta hospitalaria, coincidiendo con el tercer día post-administración de I131 y que corresponde al tiempo de permanencia del paciente en el hospital, tras la administración del I131.
Las muestras sanguíneas obtenidas de las venas de la flexura del codo se trasvasaron a tubos estériles que contenían cada uno de ellos 0,2 ml de heparina sódica al 5% (Roger, Barcelona).
Las muestras de sangre, de cada paciente, se han cultivado por duplicado en las condiciones descritas por FENECH y MORLEY (1983) y FENECH (1993). Se cultivó 1 ml de sangre, a 37ºC y 5% C02, durante 72 h en 9 ml de medio F-10 (Gibco, Madrid) suplementado con un 15% de suero bovino fetal (Sigma, Madrid), 1,6% de fitohemaglutinina (Sigma, Madrid) y el 1% de penicilina/estreptomicina (Sigma, Madrid). A las 44 h del inicio del cultivo se añadía citochalasina B (Sigma, Madrid) a una concentración de 3 mg/ml. A las 72 h los linfocitos se trataron con solución hipotónica (KCI, 0,075 M) durante 3 minutos y se fijaron usando metanol:ácido acético (3:1). Las preparaciones se dejaron secar en corriente de aire suave y se tiñeron con May-Grünwald y Giemsa.
Las muestras "in vitro" para la obtención de la curva dosis-respuesta se han irradiado en un irradiador de muestras sanguíneas Irradiador IBL de Cs-137 , con una actividad de 1700 Ci y que produce una exposición constante de 302 mGy/sg. Las diferentes dosis de exposición empleadas se obtuvieron mediante la modificación del tiempo de exposición, único factor que permite variar dicho aparato.
En todos los casos se ha contado con la autorización expresa de los pacientes para la donación de 10 ml de sangre y su empleo específico en la presente investigación.
Recuento de micronúcleos
El análisis microscópico se ha llevado a cabo individual e independientemente por dos lectores diferentes y ha consistido en la determinación de la frecuencia de aparición de MN en el citoplasma de 500 células binucleadas bloqueadas citocinéticamente (MN/500 CB). Se ha utilizado un microscopio óptico LABORLUX 12 (Leitz, Alemania), utilizando sistemáticamente una magnificación de 1000x.
Análisis estadístico
El análisis estadístico ha consistido en comparaciones entre grupos realizando contrastes de igualdad de medias mediante análisis de varianza. Se han determinado ecuaciones mediante análisis de regresión y correlación polinómicas. También se han aplicado análisis de regresión y correlación lineales. Se han considerado estadísticamente significativos cuando se ha obtenido una (p<0.05).
La DECT tras la terapia con I131 se ha calculado a partir del número de micronúcleos presentes en 500 CB de los pacientes irradiados a los 3 días de la administración de la dosis de I131 y comparada con la dosis de radiación gamma expuestas "in vitro" que produciría una idéntica frecuencia de micronúcleos en 500 células binucleadas (WATANABE, 2000).
Resultados
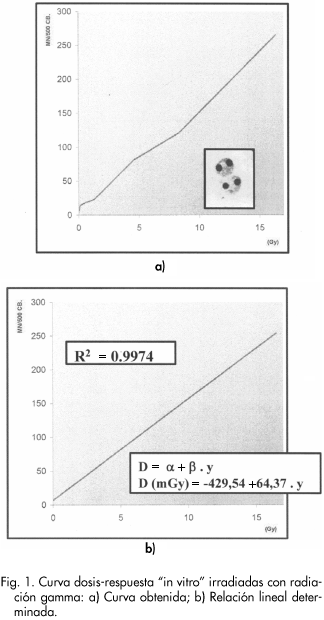
Se ha obtenido una relación dosis-respuesta lineal (D=a+b.y) entre la dosis de radiación administrada y la frecuencia de MN en donde D es la dosis de radiación gamma en mGy; y el numero de MN en células con bloqueo citocinético y a y b dos coeficientes de ajuste cuyos valores en nuestro estudio son de a= -429,54 y b = 64,37 (ver Tabla II; Fig.1).
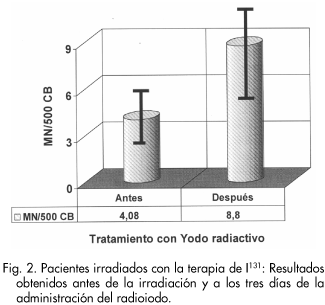
El análisis estadístico de los resultados obtenidos en los pacientes irradiados por actividades terapéuticas en medicina nuclear muestra que en 21 de los 25 pacientes estudiados se ha puesto de manifiesto un aumento de MN tras la administración de 131I (85%:21/25), y en los que se aprecia aumento estadísticamente significativo (p<0.01) respecto de las muestras controles obtenidas antes de la irradiación. La frecuencia de MN tras el tratamiento con 131I ( 4.08 MN/500 CB; 0.008 MN/CB) ha duplicado la frecuencia espontánea basal (8.8 MN/500CB; 0.0176 MN/CB). La edad y el sexo de los pacientes no presentan diferencias significativas (ver Tabla II). La DECT determinada en este grupo de pacientes es 136.916 mGy cuando se realiza la comparación con las frecuencias determinadas "in vitro" para las mismas dosis de radiación gamma.
Discusión
Durante los últimos 50 años el tratamiento con yodo radiactivo se ha considerado como un tratamiento válido y efectivo de diferentes enfermedades tiroideas tales como el hipertiroidismo y el tratamiento oncológico del cáncer bien desarrollado31, 32. Junto con estos efectos beneficiosos, pueden producirse algunos efectos colaterales indeseables, al exponerse a la radiación ionizante otros tejidos normales y sanos31, 33. En el hipertiroidismo se han descrito como complicaciones más frecuentes la tiroiditis radioinducida y el hipotiroidismo permanente31. En el cáncer de tiroides, el tratamiento con yodo radiactivo se administra tras la tiroidectomía total o parcial, y dado que las dosis de yodo radiactivo son mayores, las complicaciones descritas suelen ser más diversas y frecuentes. Los efectos adversos agudos más comunes tras la terapia con yodo radiactivo son: tiroiditis radioinducida, sialoadenitis, aparición de diferentes síntomas gastrointestinales, alteraciones gustativas, disminución transitoria de la actividad de la médula ósea, e incluso la aparición de leucemia34, 35, 33. Ocasionalmente también se han descrito disfunciones gonadales reversibles en estos pacientes36, 37. Desde un punto de vista radiológico diferentes autores han determinado que la terapia con yodo radiactivo puede producir una pérdida del tiempo de vida esperado algo menor del 1% en los pacientes tratados38.
También se ha descrito la posibilidad de inducción de un segundo tumor y del daño genético inducido por el tratamiento de radioyodo32, 33, 39. El interés de este posible efecto carcinogenético inducido por el yodo radiactivo ha aumentado tras apreciarse un gran incremento de cáncer de tiroides en las poblaciones infantiles de Ucrania tras el accidente nuclear de Chernobyl, y que se ha atribuido a la dispersión atmosférica y contaminación del medio ambiente con yodo radioactivo40, 41.
Además, diferentes estudios epidemiológicos ponen de manifiesto que diferentes tipos de tumores sólidos se relacionan con la administración del yodo radiactivo administrado en el tratamiento del hipertiroidismo y del cáncer de tiroides. Se ha descrito un aumento en el riesgo de incidencias de leucemias42 y cáncer de vejiga42, y de cáncer de colon43. En contraposición, dos estudios realizados sobre una población considerable no muestran ningún incremento significativo en las incidencias de leucemias en estos pacientes43, 44, ni tampoco un aumento de la frecuencia de aparición de un segundo tumor en los mismos pacientes45. Recientemente un estudio sobre la mortalidad de cáncer tras tratamiento con yodo radiactivo en adultos hipertiroideos pone de manifiesto que no se observa tampoco ningún incremento en la mortalidad de los pacientes tratados con I131 46.
En este ambiente, existen numerosos estudios epidemiológicos que realizan una estimación del riesgo de cáncer y que monitorizan las poblaciones expuestas a carcinógenos y agentes genotóxicos con diferentes objetivos, pretendiendo esclarecer los diferentes mecanismos de carcionogénesis47, 48. Entre éstos últimos, los ensayos citocinéticos sobre los linfocitos de sangre periférica son los más utilizados (tales como aberraciones cromosómicas, análisis de cromátides hermanas o micronúcleos) para detectar el daño cromosómico y genotóxico inducido por los diferentes agentes49, 50, 33. Los más recientes estudios sugieren que el incremento del número de estas alteraciones cromosómicas frecuentemente podrían predecir un incremento del riesgo de aparición de un cáncer en los individuos portadores51, 52. Si bien, dichos ensayos no nos permite saber con exactitud los efectos biológicos que podrían derivarse directamente del incremento de las alteraciones cromosómicas observadas51, 52.
Los resultados obtenidos en nuestro estudio ponen de manifiesto una relación dosis-respuesta lineal del incremento de aparición de micronúcleos en los pacientes tratados por cáncer de tiroides; y vuelve, por tanto, a reforzar el criterio de validez del test de micronúcleos como un buen indicador del daño cromosómico inducido por la exposición humana a radiación ionizante. Del mismo modo que nosotros, otros estudios citogenéticos realizados en pacientes que han recibido yodo radiactivo han descrito aumentos significativos de aberraciones cromosómicas53, 54, 55 y de micronúcleos33, 38, 56-59.
Se ha descrito que él número de micronúcleos determinados en la sangre de pacientes tratados con yodo radiactivo seria mas alta en la primera semana de la administración del mismo, y que podrían permanecer elevados durante aproximadamente el primer año, perdurando incluso hasta 3 años coincidiendo con la vida media estimada del linfocito en sangre periférica. Posteriormente, al desaparecer el linfocito, también desaparecería la posibilidad de la expresión del daño que permanece latente en el linfocito expuesto a radiación ionizante60, 61, 38. OTTOSEN y cols.,62 han descrito que los linfocitos podrían dividirse en dos grupos diferentes atendiendo a la duración de su vida: a) una pequeña parte tendría una supervivencia de solo de 3 o 4 días; b) la mayor parte sobreviviría de 100 a 200 días. Para NORMAN y cols.63 la vida media de los linfocitos en una mujer hematológicamente normal es de 530 días. Así pues, la vida media de los linfocitos parece ser muy variable, aunque puede existir un intervalo de 6 a 20 meses (media de 11.8), y que por tanto correspondería al periodo en donde la lesión podría ser detectada mediante este test. Ello implicaría que el test de micronúcleos no debería ser empleado como dosímetro biológico mas allá de un año desde la exposición al radio yodo.
La cinética de desaparición del numero de micronúcleos "en exceso" tras la exposición genotóxica no esta clara64. Se ha intentado explicar mediante diferentes mecanismos como la muerte celular de los linfocitos lesionados, el rápido desplazamiento por linfocitos no lesionados, e incluso también, mediante mecanismos de reparación celular del daño inducido59. Incluso, recientemente, se ha intentado poner de manifiesto una respuesta adaptativa del organismo frente a la inducción de micronúcleos con radiaciones ionizantes38.
Actualmente se cree en la posibilidad de que un incremento en el nivel o número de alteraciones cromosómicas puede indicar un incremento en el riesgo de padecer cáncer51 . Por ello, algunos autores resaltan que estos estudios deberían se cuidadosamente considerados en la evaluación de un posible daño genético tras la terapia con radioiodo. Sin embargo, los resultados de otros estudios epidemiológicos que se han publicado44,46 indican que estas alteraciones cromosómicas no tienen necesariamente que ir asociadas con un incremento demostrado de riesgo de cáncer. Por ello, aun cuando el test detecta un incremento de la frecuencia de MN, y por tanto, incremento en el daño cromosómico de los pacientes, queda por determinar cuales podrían ser las consecuencias biológicas reales en cuanto al riesgo de padecer una lesión tardía, y que estarían sin establecer todavía. Con todo, lo que se pone de manifiesto es que, al menos, una de las posibles vías de producción, como es el incremento de las lesiones del material genético, esta claramente relacionado con el tratamiento de radioiodo realizado.
Conclusión
La terapia con I131 induce un incremento significativo del daño cromosómico en los pacientes irradiados por carcinoma de tiroides, equivalente a una dosis corporal total de 13 cGy al menos durante los tres primeros días de la administración terapéutica del radioiodo. Así se demuestra una vía de inducción de cáncer radioinducido, aunque queda por establecer la importancia de las consecuencias biológicas de este proceso.
Bibliografía
1. Köteles GJ, Biando A. The need for and importance of biological indicators of radiation effects with special reference to injuries in radiation accidents. IAEA-TECDOC-273, International Atomic Energy Agency, Viena, 1982; 7-22. [ Links ]
2. Bianchi L, Tateó F, Pizzole R, Stivale LA, Grazia Veni M, Melli R, Santamaría L. Carotenoid reduce the chromosomal damage induced by bleomycin in human cultured Iymphocytes. Anticancer Research, 1993; 13:10071010. [ Links ]
3. Pohl-Ruling J, Fischer P, Buckton KE, Mukheriee RN, Binder W, Nonotry R, Bianchi NO, Fabry L. Comparison of dose dependence of chromosorne aberrations in peripheral lymphocytes at low levels of acute in vitro irradiation With 250 Kv X-rays and 14 MeV neutrons. En: Biologícal effects of low-level radiation. Internacional Atomic Energy Agency, Viena, 1983; 171-184. [ Links ]
4. Kormos C, Köteles GJ. Micronuclei in X-irradiated human lymphocytes. Mutation Research, 1988; 199:31 35. [ Links ]
5. Fenech M, Morley AA. Measurement of micronuciei in lymphocytes. Mutation Research, 1985a; 147:29-36. [ Links ]
6. Fenech M, Morely AA. The effect of donor age on spontaneous and induced micronuclei. Mutation Research,1985b; 148:99-105. [ Links ]
7. Kim SH, Cho CK, Kim TH, Yoo SY, Koh KH, Yun HG. Frecuency of micronuclei in lymphocytes following gamma an fast neutron irradiations. Anticancer Research, 1993; 13:1587-1591. [ Links ]
8. Almassy Z, Krepinsky AB, Bianco A, Köteles GJ. The present state and perspectives of micronucleus, assay technique in radiation protection. Applied Radiation and Isotopes, 1987; 38:241-249. [ Links ]
9. Prosser JS, Moquet JE, Lloyd DC, Edwards AA. Radiation induction of micronuclei in human lymphocytes. Mutation Research, 1988; 199:37-45. [ Links ]
10. Lucas JN, Tenjin T, Straumet T, Pinkel D, Moore D, Utt M, Gray JW. Rapid human chromosome aberration analysis using fluorescence in situ hybridization. Int. J. Radiat. Biol., 1990; 56:35-44. [ Links ]
11. Blakely WF, Prasanna PGS, Kolanko C.I, Pyle D, Masbrook DM, Loats AS, Rippeon TL, Loats H. Application of the premature chromosome condensation assay in simulated partial-body radiation exposures: evaluation of the use of an automated metaphase-finder. Stem. Cells, 1995; 13, Suppl. 1:223-230. [ Links ]
12. Gundy S, Bank J, Boitor I, Köteles GJ. The ocurrence of sister chromatid exchanges in lymphocytes of radon-exposed underground ore miners. Centr. Europ. J. Occup. Environ. Med. 1995; 1:78-86. [ Links ]
13. Imreh S, Radulescu D. Chromosorne aberrations and micronuclei in radiology practice. International Congress of Radiology, Brussels, 1981; 14. [ Links ]
14. Norman A, Cochran S, Bass D, Roe D. Effects of age, sex and diagnostic X-rays on chromosome damage. International Journal of Radiafion Biology, 1984; 46:317-321. [ Links ]
15. Ban S, Donovan MP, Cologne JB, Fujita S, Awa AA. Radiosensitivity of atomic bomb survivors as determined with a micronucleus assay. Radiology Research, 1993; 134:170-118. [ Links ]
16. Countryman PI, Heddle JA. The production of micronuclei from chromosome aberrations in irradiated cultures of human lymphocytes. Mutation Research, 1976; 41: 321-331 [ Links ]
17. Huber R, Streng S, Bauchinger M. The suitability of the human lymphocyte micronucleus assay system for biological dosimetry. Mutation Research, 1983; 111: 185193. [ Links ]
18. Krepinsky AB, Heddle JA. Micronuclei as rapid and inexpensive measure of radiation induced chromosomal aberrations. En: Radiation Incluced Chromosomal Damage in Man (Eds. Ishihara T. y Sasaki MS, Alan R. Liss Ins., New York, 1983; 93-109. [ Links ]
19. Hogstedt B, Micronuclei in lymphocytes whith preserve cytoplasm. A method for assessment of cytogenetic damage in man. Mutation Research, 1984; 130:63-72. [ Links ]
20. Pincu M, Bass D, Norman A. An improved micronucleus assay in lymphocytes. Mutation Research, 1984; 139: 61-65. [ Links ]
21. Balasem AN, Ali AS. Establishment of dose-response relationship between dosis of Cs-137 gamma rays and frequencies of micronuclei in human peripheral blood lymphocytes. Mutation Research, 1991; 259:133-138. [ Links ]
22. Almassy Z, Kanyar B, K8teles GJ. Frecuency of micronuclei in X-irradiated human lymphocytes. International Journal Radiation Biology, 1986; 49:719-725. [ Links ]
23. Alcaraz M, Gómez-Moraga A, Rosa B, Vicente V, Canteras M. Micronucleus assay in human lymphocytes irradiated during medical radiodiagnostic exploration. Annual Meeting Radiation Research 2000 and Grantholders Meeting of Committee on Cancer Research, 10-12 April 2000. Churchill Hall of University of Bristol. [ Links ]
24. Fenech M. The citokinesis-block micronucleus technique: a detailed description of the method and its application to genotoxicity studies in human populations. Mutation Research, 1993; 285:35-44. [ Links ]
25. Kirsch-Volders M, Fenech M. Inclusion of micronuciei in non-divided mononuclear lymphocytes and necrosis/ apoptosis may provide a more comprehensive cytokinesis block micronúcleos assay for biomonitoring purposes. Mutagenesis 2001, Jan; 16 (1):51-58. [ Links ]
26. Ramalho A, Sunievaric I, Natarajan AT. Use of the frecuencies oí micronuclei as quantitative indicators of X-rays induced chromosomal aberrations in human peripheral blood lymphocytes: comparison of two methods. Mutation Research, 1988; 207:141-146. [ Links ]
27. Gantenberg HW, Wuttke K, Streffer C, Muller WU. Micronuclei in human lymphocytes irradiated in vitro or in vivo. Radiation Research, 1991; 128:276-281. [ Links ]
28. Wuttke K, Streffer C, Muller WU. Radiation induced micronuclei in subpopulations of human lymphocytes. Mutation Research, 1993; 286:181-188. [ Links ]
29. Koksal G, Lloyd DC, Edwards AA, Prosser JS. The dependence of the micronucleus yield in human lymphocytes on culture and cytokinesis blockinq times. Radiation Protection Dosimetry, 1989; 29:209-212. [ Links ]
30. Yager JW, Eastmond DA, Robertson MI, Paridisin WM, Smith MT. Characterization of micronuclei induced in human lymphocytes by benzene metabolites. Cancer Research, 1990; 50:393-399. [ Links ]
31. Haynie TP, Vassilopoulou-Sellin R. How safe for the patient is iodine-131 therapy for differentiated thyroid carcinoma? (Editorial). J Nucl Med .1995;36: 7-28. [ Links ]
32. Zanzonico PB. Radiation dose to patients and relatives incindent to I131 therapy. Thyroid1997; 7: 199-204. [ Links ]
33. Gutierrez S., Carbonell E., Galofre P. Cytogenetic damage after 131-iodine treatment for hyperthyroidism and thyroid cancer. European Journal Nuclear Medicine.1999; 26:1589-1596. [ Links ]
34. Busbnell DL, Boles MA. Kautman GE, Wadas MA, Barnes WE. Complications, sequela and dosimetry of iodine-131 therapy for thyroid carcinoma. J Nucl Med. 1992;33: 2214-2221. [ Links ]
35. Sweeney DC, Johnston GS. Radioiodine therapy for thyroid cancer. Endocrinol Metab Clin North Am .1995;24: 803-839. [ Links ]
36. Raymond JP, Izembart NI. Marliac V. Temporary ovarian failure in thyroid cancer patients after thyroid remnant ablation with radioactive iodine. J Clin Endocrinol Metab.1989;69:186-190. [ Links ]
37. Pacini F, Gasperi M, Fueazzola L. Testicular function in patients with differentiated thvroid carcinoma treated with radioiodine. J Nucl Med. 1994;35: 1418-1422. [ Links ]
38. Monsieurs MA, Thierens HM, Vral AM, Van de Wiele C, De Ridder LI, Dierckx RA. Adaptive response in patients treated with I131. J Nucl Med. 2000;41:17-22 [ Links ]
39. DottorinI ME. Genetic risk assessment after iodine-131 exposure: an opportunity and obligation for nuclear medicine (Editorial). J Nucl Med . 1996;37: 612-615. [ Links ]
40. Kazakov VS, Demidchik ER Astakhova LN. Thyroid cancer after Chernobyl. Nature 1992;359: 21-22. [ Links ]
41. Likhtarev IA, Sobolev BG, Kairo IA. Thyroid cancer in the Ukraine. Nature 1995;375: 365 [ Links ]
42. Edmonds CJ, Smith T. The long-term hazards of the treatment of thyroid cancer with radioiodine. Br J Radiol. 1986;59:45-51. [ Links ]
43. De Vathaire F, Schlumberger M, Delisle MJ, Leukemias and cancers following iodine131 administration for thyroid cancer. Br J Cancer.1997;75: 734-739. [ Links ]
44. Hall P, Boice JD, Berg G. Leukaernia incidence after iodine-131 exposure. Lancet. 1992;340: 1-4. [ Links ]
45. Dottorini ME, Lomuscio G, Mazzucchelli L, Vignati A, Colombo L. Assessment of female fertility and carcinogenesis after iodine-131 therapy for differentiated thyroid carcinoma. J Nucl Med. 1995;36: 21-27 [ Links ]
46. Ron E, Morin Doody M. Becker DV. Cancer mortality followina treatment for adult hyperthyroidism. JAMA 1998;280:347-355. [ Links ]
47. Samet JM. Epidemiologic studies of ionízing radiation and cancer: past successes and future challenges. Environ Health Perspect .1997;105: 883-889. [ Links ]
48. Natarajan AT, Boei Jjwa, Darroudi F. Current cytogenetic methods for detecting exposure and effects of mutagens and carcinogens. Environ Health Perspect.1996;104: 445-448. [ Links ]
49. Evans HL. Mutation cytogenetics: past, present and future. Mutat Res. 1988;204: 355-363. [ Links ]
50. Tucker JD, Preston RJ. Chromosome aberrations, micronuclei, aneuploidy, sister chromatid exchanges, and cancer risk assessment. Mutat Res.1996;365: 147-159. [ Links ]
51. Hagmar L. Broer A, Hansteen I-L. Cancer risk in humans predicted by increased levels of chromosomal aberrations in lymphocytes: Nordic study group on the health risk of chromosome damaae. Cancer Res.1994;54: 2919-2922. [ Links ]
52. Bonassi S, ABBondandolo A, Camurri L. Are chromosome aberrations in circulatina lymphocytes predictive of future cancer onset in humans? Preliminary results of an Italian cohort study. Cancer Genet Cytogenet. 1995;79: 133-135. [ Links ]
53. Baugnet-Mahieu L, Lemaire M, Uonard ED, Léonard A. Gerber GB. Chromosome aberrations after treatment with radioactive iodine for thyroid cancer. Radiat Res. 1994;140: 429-431. [ Links ]
54. Gundy S, Katz N, Füzy M, Ésik O. Cytogenetic study of radiation burden in thyroid disease patients treated with externa irradiation or radioiodine. Mutat Res.1996;360: 107-113. [ Links ]
55. M'Kacher R, Légal J-D. Schiuniberger M. Sequential biological dosimetry after a single treatment with iodine131 for differentiated thvroid carcinorna. J NucI Med. 1997;38:377-380. [ Links ]
56. Livinston GK, Foster AE, Elson HR. Effect of in vivo exposure to iodine-131 on the frequency and persistence of micronuclei in human lymphocytes. J Toxicol Environ Health.1993;40:367-375. [ Links ]
57. Catena C, Villani P. Nastasi R. Micronuclei and 3AB-index in patients receiving iodine- 131 therapy. J Nucl Biol Med.1994;38:540-547. [ Links ]
58. Wuttke K, Streffer C, Vlüller WU, Reiners C, Biko J. Demidchik E.Micronuclei in lymphocytes for children from the vicinity of Chernobyl before and after 1311 therapy for thyroid cancer. Int J Radiat Biol.1996;69: 259-268. [ Links ]
59. Watanabe N, Yokoyama K, Kinuya S. Radiotoxicity after iodine-131 therapy for thyroid cancer using the micronucleus assay. J Nucl Med. 1998;39, 436-444. [ Links ]
60. Buckton KE, Court Brown WNI, Smith PG. Lymphocyte survival in man treated with X-rays for ankylosing spondylitis, Nature 1967;214: 470-473. [ Links ]
61. Evans HJ. What has been achieved with cytogenetic monitoring? In: Sorsa M, Norppa H, eds. Monitoring of occupational genotoxicants. New York, Alan R. Liss, 1986;3-23. [ Links ]
62. Ottesen J. On age of human white cells in peripheral blood. Acta Physiol Scand. 1954;32:75-93 [ Links ]
63. Noman A. Sasaki MS. Ottoman RE, Fingerhut AG. Lymphocyte lifetime in women. Science.1965;147:745. [ Links ]
64. Müller W-U, Nüsse M, Miller BM, Slavotinek A. Viagoi S, Streffer C. Micronuclei: a biological indicator of radiation damage. Mutat Res.1996; 366: 163-169. [ Links ]
 Dirección para correspondencia
Dirección para correspondencia
Dr. M. Alcaraz Baños
Área de Radiología y Medicina Física
Facultad de Medicina
E-30100 Campus de Espinardo
E-mail: mab@um.es
Recibido: 10.06.03
Aceptado: 03.11.03
# Este trabajo se ha realizado con una Ayuda del Programa I+D del Ministerio de Ciencia y Tecnología. (Proyecto nº PETR1995-0582-0P)














