Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.96 no.8 Madrid ago. 2004
|
TRABAJOS ORIGINALES |
Respuesta al tratamiento esteroideo del primer brote de enfermedad inflamatoria
intestinal que requiere ingreso hospitalario
M. Abu-Suboh Abadía, F. Casellas, J. Vilaseca y J-R. Malagelada
Servicio de Aparato Digestivo. Hospital Universitari Vall d'Hebron. Barcelona
RESUMEN
Introducción: la administración de corticoides constituye el tratamiento habitual de los brotes de enfermedad de Crohn (EC) y colitis ulcerosa (CU). Sin embargo, existe poca información sobre las tasas de respuesta y los factores que puedan predecirla.
Objetivo: determinar la respuesta al tratamiento esteroideo en un grupo homogéneo de pacientes de EC y CU que ingresan por primera vez en el hospital.
Métodos: análisis retrospectivo de 86 pacientes que en su primer ingreso hospitalario recibieron tratamiento esteroideo sistémico por brote grave de EC o CU entre 1995 y 2000. Fueron tratados de forma protocolizada con sueroterapia, dieta absoluta, 6-metil-prednisolona 1 mg/kg/día IV y enoxaparina a dosis profilácticas. Se ha considerado la respuesta clínica a los 30 días como buena en caso de remisión completa o mala si la remisión es parcial o ausente. Se realizó estudio univariado y multivariado según estadística no paramétrica de diferentes variables sociodemográficas y biológicas.
Resultados: se han incluido 45 pacientes con EC y 41 con CU. La tasa de buena respuesta fue del 64,4% en la EC y del 60,9% en la CU. El análisis univariado demostró que los pacientes con buena respuesta tienen un tiempo de evolución más corto y un menor número de brotes previos (p < 0,05) para la EC. Sin embargo, el análisis multivariado no demostró que alguna variable de las analizadas tuviera valor predictivo.
Conclusión: la respuesta de los brotes graves de enfermedad inflamatoria intestinal a los corticoides es alrededor del 60% en la EC y CU. Los datos del presente estudio no permiten predecir qué pacientes son los que responderán al tratamiento.
Palabras clave: Enfermedad inflamatoria intestinal. Colitis ulcerosa. Enfermedad de Crohn. Brote grave. Factores pronósticos. Tratamiento. Corticoides.
INTRODUCCIÓN
La enfermedad inflamatoria intestinal comprende un grupo de enfermedades que cursan con inflamación crónica del tubo digestivo de etiología desconocida. Engloba principalmente a dos enfermedades: la colitis ulcerosa (CU) en la que la inflamación afecta a la mucosa y la submucosa del colon, y la enfermedad de Crohn (EC), en la cual la inflamación es transmural y puede abarcar cualquiera o todos los segmentos del tubo digestivo. Ambas enfermedades se caracterizan por presentar repetidos brotes de actividad clínica, que alternan con periodos variables de inactividad. El tratamiento de la enfermedad inflamatoria intestinal difiere según se trate de controlar los brotes de actividad inflamatoria o de mantener la remisión. Con el fin de mantener la enfermedad en remisión se utilizan diferentes fármacos, incluyendo los 5-aminosalicilatos (5-ASA) e inmunosupresores, como la azatioprina y la 6 mercaptopurina (1). El tratamiento habitual de los brotes moderados o graves de la enfermedad inflamatoria intestinal, tanto de EC como de CU, consiste en la administración oral o parenteral de corticoides (2-5). Aunque la eficacia de los corticoides es variable, la experiencia acumulada y la ausencia de complicaciones graves en su utilización aguda los ha mantenido como terapia de elección. Alternativas terapéuticas al fracaso del tratamiento esteroideo incluyen la ciclosporina intravenosa en la colitis ulcerosa grave refractaria (6-8), el metotrexato (9,10) o el infliximab en la EC (11).
A pesar de la amplia aceptación del tratamiento esteroideo en la enfermedad inflamatoria intestinal activa, existe poca información sobre las tasas de respuesta, los factores que puedan predecirla y si modifica la evolución de la enfermedad a largo plazo. Dado que cada vez se dispone de nuevos tratamientos más potentes pero también más caros y con efectos adversos potencialmente más graves, sería muy importante poder reconocer aquellos factores, si existen, que permitieran predecir la respuesta al tratamiento corticoideo de los brotes moderados-graves de la enfermedad para identificar lo antes posible qué pacientes serán potenciales candidatos a otros tratamientos.
El objetivo de este estudio es determinar la respuesta al tratamiento corticoideo sistémico en un grupo homogéneo de pacientes en brote grave de debut hospitalario de EC y CU, tanto a corto como a largo plazo. Otro objetivo secundario del estudio es identificar posibles factores predictivos de buena respuesta al tratamiento corticoideo.
MÉTODOS
Pacientes
Se han incluido aquellos pacientes que han requerido un primer ingreso hospitalario por brote grave de enfermedad inflamatoria intestinal, tanto EC como CU, tratado con corticoides en el periodo comprendido entre 1995 y 2001. Los pacientes fueron diagnosticados de acuerdo a criterios clínicos, endoscópicos, radiológicos e histológicos estandarizados (12). El grado de actividad fue valorado mediante índices clínicos. La actividad clínica de los pacientes con EC fue valorada mediante los criterios de Harvey-Bradshaw (13), que hacen referencia al estado general, dolor abdominal, número diario de deposiciones, complicaciones y masa abdominal. La actividad de los pacientes con CU fue evaluada de acuerdo con los criterios de Rachmilewitz (14), que hacen referencia al número semanal de deposiciones, sangre en heces, estado general según el investigador, dolor abdominal, fiebre, hemoglobina y velocidad de sedimentación globular.
Procedimiento
Todos los pacientes incluidos en el estudio estuvieron ingresados y recibieron tratamiento protocolizado con dieta absoluta, nutrición parenteral total, metilprednisolona a dosis de 1 mg/kg/día, enoxaparina a dosis profilácticas y seguimiento clínico-analítico convencional. La respuesta al tratamiento corticoideo se analizó a los 30 días del inicio del tratamiento según los siguientes criterios:
-Remisión completa: regresión total de los síntomas clínicos; menos de 2 deposiciones al día sin sangre, pus ni moco en las heces, sin dolor abdominal, ausencia de fiebre, sin pérdida de peso ni síntomas extraintestinales.
-Remisión parcial: mejoría de la sintomatología con menos de 4 deposiciones al día pero con sangre, pus o moco en las heces, con dolor abdominal no diario, sin fiebre ni pérdida de peso ni sintomatología extraintestinal.
-No remisión: No modificación de la sintomatología clínica o empeoramiento durante el seguimiento (15,16).
Se consideró la repuesta como buena en caso de remisión completa y mala en caso de remisión parcial o no remisión.
Para determinar los factores de buena respuesta se recogieron en el momento de la inclusión diferentes variables sociodemográficas (edad, género, tabaquismo, tiempo de evolución y número de brotes), clínicas (número de deposiciones, sangre en heces, fiebre, localización e índice de actividad), y analíticas (leucocitos, velocidad de sedimentación globular, hemoglobina, hematocrito, albúmina, plaquetas y fibrinógeno).
Los pacientes que presentaron remisión completa recibieron tratamiento de mantenimiento y corticoides en pauta descendente estandarizada (reducción semanal de 10 mg hasta alcanzar una dosis de 30 mg a partir de la cual se realizó reducción semanal de 5 mg hasta suspender) fueron seguidos en consultas externas con control clínico y analítico cada 6 meses. Se valoró la evolución durante el año siguiente, considerando un nuevo brote la aparición de signos clínicos de actividad que justificaran un cambio terapéutico.
Estadística
Para el análisis estadístico, los pacientes fueron divididos en dos grupos: colitis ulcerosa y enfermedad de Crohn, que se analizaron independientemente. Los resultados se expresan como mediana y percentiles 25-75. La existencia de diferencias estadísticas se calculó primero mediante el análisis univariado para variables no-paramétricas de Mann-Whitney o el test exacto de Fisher, según fuera necesario, y posteriormente mediante análisis multivariado.
RESULTADOS
Pacientes
De los 86 pacientes incluidos, 45 correspondieron a EC y 41 a CU. De los 45 pacientes con EC, 36 eran pacientes en los que el primer brote obligó al ingreso hospitalario, los 9 restantes ya habían sido diagnosticados de EC con brotes previos que se habían manejado exclusivamente de forma ambulatoria. En el grupo de CU, 35 correspondieron al debut de la enfermedad y en 6 pacientes a un brote evolutivo.
Respuesta a corto plazo al tratamiento esteroideo
A los 30 días de tratamiento, 29 de los 45 pacientes con EC presentaron una buena respuesta, mientras que 16 presentaron mala respuesta (14 respuesta parcial y 2 nula respuesta). La tasa de buena respuesta al tratamiento esteroideo del grupo EC es del 64,4%.
De los 41 pacientes con CU, 25 presentaron una buena respuesta a los 30 días de tratamiento y 16 presentaron mala respuesta (10 por respuesta parcial y 6 por respuesta nula), con lo que la tasa de buena respuesta en la CU fue del 60,9%, que no es estadísticamente diferente de la observada en la EC.
Factores predictivos de respuesta
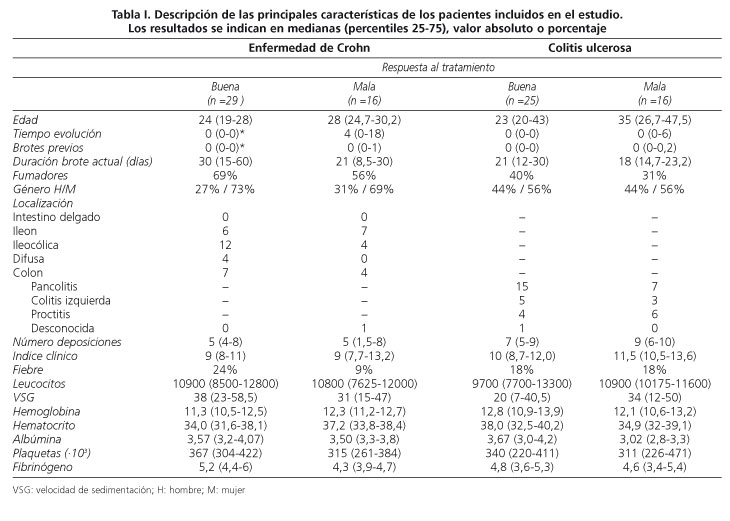
Los datos clínicos-analíticos y socio-demográficos obtenidos en los pacientes con EC y CU en el momento de la inclusión agrupados en función de la respuesta al tratamiento esteroideo se especifica en la tabla I.
El análisis univariado demostró para los pacientes con EC que un menor tiempo de evolución y un menor número de brotes previos predice una mejor respuesta a los corticoides (p < 0,05). En cambio para la CU el análisis univariado no mostró ninguna variable predictiva. El análisis multivariado de las variables incluidas en el análisis univariado no demostró que ninguna variable de las analizadas (tabla I) alcanzara significación estadística en la EC ni en la CU.
Evolución a largo plazo de la enfermedad
Los 29 pacientes con EC que habían presentado remisión completa al día 30 fueron seguidos durante un año. Recibieron tratamiento de mantenimiento con 5-ASA (22 pacientes), azatioprina (4 pacientes) y 3 de ellos no siguieron tratamiento de mantenimiento. Al cabo del año 16 pacientes (55%) seguían en remisión clínica completa, 7 presentaban criterios de corticodependencia y 6 presentaron rebrote. De los 6 que habían presentado rebrote, 2 precisaron cirugía.
Por otra parte, de los 25 pacientes con CU que habían presentado buena respuesta el día 30 del estudio, 23 recibieron tratamiento de mantenimiento con 5-ASA, uno ciclosporina y el restante no siguió tratamiento de mantenimiento. Al finalizar año de seguimiento, 20 (80%) permanecían en remisión clínica mientras que 5 (20%) habían presentado un nuevo brote de actividad (Fig. 1). De los 5 pacientes que habían presentado rebrote de la enfermedad 1 precisó cirugía (Fig. 2). La tasa de rebrote en el seguimiento a largo plazo fue similar para la EC y CU (55 vs 80% respectivamente, p = n.s.).
DISCUSIÓN
En el presente estudio se ha evaluado la respuesta a los corticoides del primer brote grave de enfermedad inflamatoria intestinal que requiere ingreso hospitalario. A los 30 días de tratamiento estandarizado con 1 mg/kg/día de 6-metilprednisolona parenteral, se obtuvo una buena respuesta en el 64,4% de los pacientes con EC y en el 60,9% de los afectos de CU (p = n.s.). Las tasas de buena respuesta obtenidas en el presente estudio son similares a las publicadas en otros estudios. Así, Faubion WA y cols. (16) determinaron, de forma similar a la utilizada en nuestro estudio, la respuesta clínica a los 30 días de tratamiento esteroideo de 74 pacientes con EC activa y 63 con CU activa, publicando una tasa de respuesta completa del 58% para EC y de 54% para CU. En 1995 Kornbluth y cols. (17), publican un meta-análisis en que se evidencian unas tasa de remisión media del 62% (43-80%) para CU y de 65% (55-94%) para EC.
Por otro lado se ha analizado qué variables sociodemográficas y biológicas pueden predecir una buena respuesta al tratamiento. Nuestros resultados sugieren que en la EC un menor tiempo de evolución y un menor número de brotes previos predicen una mejor respuesta a los corticoides (p<0,05). Sin embargo, el mismo análisis en la CU no demostró que ninguna de las variables tuviera un valor pronóstico estadísticamente significativo, aunque un mayor número de deposiciones y una peor puntuación del índice de actividad clínica al ingreso muestran una tendencia, no significativa, hacia una peor respuesta al tratamiento. Este resultado hace pensar que posiblemente con un mayor número de pacientes se podrían encontrar variables con valor pronóstico significativo. La ausencia de valor pronóstico de determinadas variables analizadas en el presente estudio confirma experiencias previas con factores como el tabaquismo (18).
La existencia de los factores predictivos de respuesta favorable a corticoides en los brotes de enfermedad inflamatoria intestinal ha sido estudiada con anterioridad (19). En 1990 Malchow y cols. demostraron que los pacientes con EC que presentaban una peor respuesta al tratamiento eran los que tenían una menor puntuación en el CDAI, una VSG baja y una duración de la enfermedad mayor que los que respondieron. (20). Estos hallazgos no pudieron ser confirmados por Munkholm y cols. (15), cuatro años después, al no encontrar relación entre síntomas clínicos (género, dolor abdominal, diarrea, fiebre y localización de la enfermedad) o determinaciones de laboratorio (hemoglobina, recuento de leucocitos, VSG, albúmina sérica y orosomucoide) y la respuesta al tratamiento de la EC. Por otro lado Linsgren y cols. identificaron en la CU como factores predictivos de una peor respuesta al tratamiento la fiebre, la persistencia de diarrea y la elevación de la proteína C reactiva al tercer día de tratamiento (21). Travis y cols. publicaron la existencia de una buena correlación entre una peor respuesta a corticoides (definida como necesidad de colectomía en pacientes con CU), la presencia de un número mayor de 8 deposiciones/día o una proteína C reactiva mayor de 45 mg/l con un número de deposiciones entre 3 y 8 al día (22). Por todo ello puede decirse que existe un cierto acuerdo en que en los pacientes con brote grave de CU, un mayor número de deposiciones, niveles más elevados de proteína C reactiva y descenso de la albuminemia son factores predictivos de fracaso terapéutico (19). Sin embargo, en la EC no existe un consenso acerca de qué factores pueden predecir el fracaso terapéutico. Los resultados de nuestro estudio no aportan evidencia que apoye el papel pronóstico de variables clínicas en la respuesta al tratamiento esteroideo de los brotes de enfermedad inflamatoria intestinal.
La respuesta a largo plazo en los pacientes que se encontraban en remisión completa el día 30 fue evaluada al cabo de un año, observando una respuesta clínica prolongada en el 55% de los pacientes con EC y el 80% de los pacientes con CU. La diferencia no es estadísticamente significativa (p = n.s.). Los resultados obtenidos en nuestro estudio parecen más favorables que los publicados por Faubion y cols. (16), que describen una tasa de respuesta mantenida al año de seguimiento del 49% en la CU, aunque sólo del 32% en la EC aunque no es posible comparar estadísticamente ambos estudios. En nuestra investigación, debido al número de pacientes incluidos en la fase de seguimiento a largo plazo y a las características metodológicas utilizadas, no hemos podido analizar la existencia de factores predictivos de recidiva. En la CU en remisión, se ha sugerido que variables como una edad menor y la existencia de brotes repetidos previos son factores predictivos independientes de rebrote de la enfermedad (23). En la EC en remisión, en cambio, no se conocen factores clínicos que tengan valor predictivo a largo plazo (24).
Los pacientes con buena respuesta el día 30 fueron seguidos durante un año. Presentaron un curso corticodependiente, definido como la incapacidad de suspender el tratamiento corticoideo sin una recaída sintomática, 7 pacientes afectos de EC (24%) y ninguno de CU (0%). Estos resultados coinciden con los de Munkholm, que demostró una tasa de corticodependencia en la EC del 36% (15). Posteriormente Frachimont y cols. identificaron como factores de riesgo para corticodepencia un diagnóstico a edad temprana, tabaquismo, uso de anticonceptivos orales, y enfermedad del colon y perianal (25).
En conclusión, la tasa de respuesta a los corticoides del primer brote grave hospitalario de enfermedad inflamatoria intestinal es del 64,4% para EC y de 60,9% para CU, que se mantiene al cabo de un año en más de la mitad de los pacientes. Los datos del presente estudio no permiten detectar variables que permitan predecir con fiabilidad la respuesta al tratamiento corticoideo.
BIBLIOGRAFÍA
1. Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease: a 30 year review. Gut 2002; 50: 485-9. [ Links ]
2. Shepherd HA, Barr GD, Jewell DP. Use of an intravenous steroid regimen in the treatment of acute Crohn' disease. J Clin Gastroenterol 1986; 8: 154-9. [ Links ]
3. Oshitani N, Kitano A, Matsumoto T, Kobayashi K. Corticosteroids for the management of ulcerative colitis. J Gastroenterol 1995; 30 (Supl.) 8: 118-20. [ Links ]
4. Summers RW, Switz DM, Sessions JT, Becktel JM, Best WR, Kern F, et al. National cooperative Crohn' disease study; results of drug treatment. Gastroenterology 1979; 77: 847-69. [ Links ]
5. Malchow H, Ewe K, Brandes JW, Goebell H, Ehms H, Summer H, et al. European cooperative Crohn' disease study (ECCDS): results of drug treatment. Gastroenterology 1984; 86: 249-66. [ Links ]
6. Cohen RD, Stein R, Hanauer SB. Intravenous cyclosporin in ulcerative colitis: a five year experience. Am J Gastroenterol 2000; 95: 830. [ Links ]
7. Hyde GM, Thillainayagam AV, Jewell DP. Intravenous cyclosporin as rescue therapy in severe ulcerative colitis: time for a reappraisal?. Eur J Gastroenterol Hepatol 1998; 10: 411-3. [ Links ]
8. Santos JV, Baudet JA, Casellas F, Guarner L, Vilaseca J, Malagelada JR. Efficacy of intravenous cyclosporine for steroid refractory attacks of ulcerative colitis. J Clin Gastroenterol 1995; 20: 285-9. [ Links ]
9. Paoluzi OA, Pica R, Marcheggiano A, Crispino P, Iacopini F, Iannon C, et al. Azathioprine or methotrexate in the treatment of patients with steroid-dependent or steroid-resistant ulcerative colitis: results of an open -label study on efficacy and tolerability in inducing and maintaining remission. Aliment Pharmacol Ther 2002; 16: 1571-80. [ Links ]
10. Alfandhli AA, McDonald JW, Feagan BG. Methotrexate for induction of remission in refractory Crohn disease. Cochrane Database Syst Rev 2003; (1): CD003459. [ Links ]
11. Present DH, Rutgeerts P, Targan S, Hanauer SB, Mayer L, van Hogerzand RA, et al. Infliximab for the treatment of fistulas in patients with Crohn' disease. N Engl J Med 1999; 340: 1398-405. [ Links ]
12. Hodgson HJF, Bhatti M. Assessment of disease activity in ulcerative colitis and Crohn' disease activity. Inflamm Bowel Dis 1995; 1: 117-43. [ Links ]
13. Harvey RF, Bradshaw JM. A simple index of Crohn' disease activity. Lancet 1980; 1: 514. [ Links ]
14. Rachmilewitz D. Coated mesalazine (5-aminosalicylic acid) versus sulphasalazine in the treatment of active ulcerative colitis: A randomized trial. BMJ 1989; 298: 82-6. [ Links ]
15. Munkholm P, Langholz E, Davidsen E, Binder V. Frequency of glucocorticoid resistance and dependency in Crohn' disease. Gut 1994; 35: 360-2. [ Links ]
16. Faubion WA, Edward V, Loftus JF, Harmsen WS, Zinsmeister AR, Sandborn J. The natural history of costicosteroid therapy for inflamatory bowel disease: a population-based study. Gastroenterology 2001: 121: 255-60. [ Links ]
17. Kornbluth A, Marion J-F, Salomon P, Janowitz HD. How effective is current medical therapy for severe ulcerative and Crohn' colitis? J Clin Gastroentol 1995; 20: 280-4. [ Links ]
18. Medina C, Vergara M, Casellas F, Lara F, Naval J, Malagelada JR. Influencia del hábito tabáquico en la cirugía de la enfermedad inflamatoria intestinal. Rev Esp Enferm Dig 1998; 90: 771-4. [ Links ]
19. Gelbmann CM. Position of treatment refractoriness in ulcerative colitis and Crohn' disease-Do we have reliable markers? Inflam Bowel Diseases 2000; 6: 123-31. [ Links ]
20. Malchow H, Steinhardt HJ, Lorenz-Meyer H. Feasability and effectiveness of a defined-formula diet regimen in treating active Crohn' disease. European Cooperative Crohn' Disease Study III. Scand J Gastroenterol 1990; 25: 235-44. [ Links ]
21. Lindgren SC, Flood LM, Kilander AF, Löfberg R, Persson TB, Sjödahl RI. Early predictors of glucocorticoids treatment failure in severe and moderately severe attacks of ulcerative colitis. Eur J Gastroenterol Hepatol 1998; 10: 831-5. [ Links ]
22. Travis SPL, Farrant JM, Rickets C, Nolan DJ, Mortensen NM, Kettlewell MGW, et al. Predicting outcome in severe ulcerative colitis. Gut 1996; 38: 905-10. [ Links ]
23. Bitton A, Peppercorn MA, Antonioli DA, Niles JL, Shah S, Bousvaros A, et al. Clinical, biological and histologic parameters as predictors of relapse in ulcerative colitis. Gastroenterology 2001; 120: 13-20. [ Links ]
24. Loftus EV, Schoenfeld P, Sandborn WJ. The epidemiology an natural history of Crohn' disease in population-based patient cohorts from North America: a systematic review. Aliment Pharmacol Ther 2002; 16: 51-60. [ Links ]
25. Franchimont DP, Louis E, Croes F, Belaiche J. Clinical pattern of corticosteroid dependent Crohn' disease. Eur J Gastroenterol Hepatol 1998; 10: 821-5. [ Links ]











 texto en
texto en