Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.97 no.2 Madrid feb. 2005
| TRABAJOS ORIGINALES |
Efecto de la ingesta de etanol en un modelo experimental de cáncer de colon
S. Pérez-Holanda, L. Rodrigo1, J. Viñas-Salas2 y C. Piñol-Felis2
Servicio de Cirugía. Hospital Grande Covián. Arriondas. Asturias. 1Departamento de Medicina. Facultad de Medicina.
Universidad de Oviedo. Asturias. 2Departamento de Medicina y Departamento de Cirugía. Facultad de Medicina.
Hospital Universitario "Arnau de Vilanova". Universidad de Lleida
RESUMEN
Objetivos: el presente trabajo experimental fue diseñado para examinar el efecto de la adición de un suplemento de etanol oral en ratas, en la aparición y desarrollo de la carcinogénesis colónica.
Material y métodos: se utilizaron un total de ciento diez ratas de la raza "Sprague-Dawley" de 10 semanas de vida, que se dividieron en 5 grupos: grupo A (20 ratas), sin tratamiento. Grupo B (20 ratas), con adición de etanol a la dosis de 1,23 g/kg peso al día, añadido al agua de bebida, durante 24 semanas. Grupo C (30 ratas), tratadas con 18 dosis semanales de dimetilhidracina (DMH) a la dosis de 21 mg/kg peso, cada una, desde la semana 10 de vida. Grupo D (20 ratas), tratadas únicamente con solución de ácido etilen-diamino-tetracético (EDTA), durante 18 semanas. Grupo E (20 ratas), tratadas con etanol a la misma dosis que las ratas del grupo B y las mismas inyecciones de DMH que las ratas del grupo C, administradas ambas de forma concomitante, desde la semana 10 de vida. Todas las ratas fueron sacrificadas entre las 25-27 semanas, del comienzo del estudio. Se estudió la incidencia de tumores colorrectales y su localización, así como los hallazgos anátomo-patológicos comparados entre grupos.
Resultados: no se observaron diferencias significativas, ni en el número de ratas que desarrollaron tumores de colon, ni en el número de animales libres de tumor, ni en el número de tumores por rata, ni en los hallazgos macro-microscópicos de los tumores entre los animales del grupo C, con respecto a los del grupo E.
Conclusiones: la adición de un suplemento de etanol a la dieta, en la dosis y tiempo establecidos, no modificó la producción de carcinogénesis colónica en ratas, usando un modelo dinámico de administración concomitante de inducción tumoral con
DMH.
Palabras clave: Alcohol. Cáncer. Carcinogénesis. Colon. Dimetilhidracina. Etanol. Neoplasia. Tumores.
INTRODUCCIÓN
El cáncer colorrectal (CCR) es un tumor frecuente, con una elevada mortalidad en los países occidentales (1), en los que la ingesta de alcohol es un hábito común. En un metanálisis realizado sobre su posible etiopatogenia se ha demostrado de forma convincente que los factores ambientales juegan un papel destacado en su inducción (2). De hecho, la tasa de incidencia podría verse reducida en un 30-35% aproximadamente, mediante la modificación de los hábitos alimentarios (3).
En un relevante trabajo basado en la evidencia epidemiológica y publicado en 1992 (4) se encontró una asociación entre el consumo de alcohol y el CCR. Más recientemente, mientras que algunos estudios clínicos defienden que la ingesta de etanol incrementa el riesgo de CCR (5-8), otros autores no observan dicha relación (9,10) e incluso otros investigadores defienden la teoría de que únicamente habría una relación con el desarrollo de adenomas, pero no con el CCR (11). Para estudiar la influencia de los diferentes factores etiológicos ambientales sobre el cáncer de colon en el hombre, los estudios prospectivos a largo plazo son difíciles de llevar a cabo (12). No obstante, muestran unos resultados contradictorios, defendiendo la asociación con cáncer en un caso (13) o mostrando una relación con la producción de adenomas únicamente en otro (14). Por otro lado, estudios experimentales han mostrado un mayor riesgo de CCR por efecto del alcohol tanto in vitro (15) como en modelos con roedores (16,17).
La inducción de cáncer colorrectal con 1,2 dimetilhidracina (DMH) en ratas es un modelo experimental válido actualmente y superponible al humano debido a que los tumores inducidos con DMH lo semejan tanto en sus características macro-microscópicas como en su comportamiento clínico (18-20).
El objetivo del presente estudio es investigar el efecto del consumo de etanol en ratas sometidas a la inducción tumoral colónica del DMH, dentro de un modelo dinámico (de administración concomitante) de ambas sustancias.
MATERIAL Y MÉTODOS
Se estableció un número de 20 ratas por grupo en base a una inducción tumoral a la dosis y tiempo establecidos por la DMH del 76-90% de las ratas (21,22); para una tasa de tumores en las ratas inducidas por DMH de 1,87; y una mortalidad variable y elevada según estudios previos en esta misma línea de investigación (23,24). Dicho número de ratas asignadas a cada grupo coincidió con otros autores consultados (25).
Ciento diez ratas "Sprague-Dawley" de 10 semanas de vida (Lab. Letica®, Barcelona, España), 55 machos y 55 hembras de la misma línea genética, fueron distribuidas en cinco grupos con igual número de machos que de hembras en cada uno. Ninguna de las 20 ratas del grupo A (grupo control) recibió tratamiento alguno. Las 20 ratas del grupo B (grupo control de etanol) recibieron etanol a 1,23 g/kg peso al día, añadido al agua corriente desde el principio del estudio hasta el sacrificio de las ratas. Se tomaron 30 ratas en el grupo C debido a la alta mortalidad obtenida en el grupo DMH en estudios previos (22-24). Dichas 30 ratas del grupo C (grupo control de DMH) recibieron 18 inyecciones subcutáneas (s.c.) semanales de 21 mg/kg peso de 1,2 dimetilhidracina (DMH; Fluka Chemica A.G., Sigma Co.®, St. Louis, Missouri, U.S.A.) desde la semana 10 de vida y de forma continuada. La solución inyectable de la DMH se preparó semanalmente, como en dichos estudios previos diluyendo 400 mg de DMH en agua destilada que contenía 37 mg de ácido etilenodiaminotetraacético (EDTA; Farmitalia Carlo Erba S.P.A.®, Milano, Italy) como agente estabilizador y ajustándose a un pH de 6,5 mediante hidróxido sódico 0,1 M (22). Las inyecciones se aplicaron en la región lumbar de la rata. Las 20 ratas del grupo D (grupo control de EDTA) recibieron el mismo volumen de la solución de EDTA que el grupo C, mezclada con agua destilada únicamente y sin DMH. Las 20 ratas del grupo E (grupo DMH + etanol) fueron tratadas con 18 inyecciones sc subcutáneas de 21 mg/kg peso de DMH, y 1,23 g/kg peso al día de etanol añadido al agua corriente, comenzando a la vez que la primera inyección de DMH en la semana 10 de vida y hasta el final del estudio. La cantidad ingerida de etanol se cuantificó en función de la cantidad de agua corriente consumida por las ratas.
La alimentación de todas las ratas del estudio fue estándar (Dieta ITM-R20, Lab. Letica®, Barcelona, España) la cual contiene un 3% de grasa y un 5% de fibra. La cantidad de alimento consumido por las ratas de los grupos tratados se controló a lo largo del estudio. El 50% de los animales de cada grupo eran pesados semanalmente hasta el momento del sacrificio. Además, se controló estrictamente la cantidad de etanol consumido por las ratas para evitar la deshidratación secundaria a la administración de etanol junto con el agua corriente observada por algunos autores (26). La habitación del estabulario se mantuvo a una temperatura y una humedad constantes, donde las ratas fueron sometidas a un ciclo circadiano de luz-oscuridad de 12 horas, como recomiendan diversos autores (27,28), y se separaron en jaulas con un máximo de tres animales por jaula, para evitar la autofagia y controlar el consumo oral de alcohol, como en estudios previos (22-24).
Se siguieron las recomendaciones para el trato de animales de experimentación del Comité Europeo de Ética (Directiva de la C. E. E. número 1986/609) a lo largo de todo el estudio.
Las ratas que sobrevivieron fueron sacrificadas entre las semanas 25 y 27 del estudio mediante instilación intraperitoneal de una dosis letal de hidrato de cloral al 4,5%, el cual induce primeramente un sueño profundo y posteriomente provoca la muerte del animal. Para evitar variaciones de los resultados, un número fijo e igual de ratas de cada grupo se sacrificaron en cada una de las semanas que duró el sacrificio (22).
En el momento de la autopsia, se examinaron las cavidades torácica y abdominal. Se extrajeron el colon y el recto, se abrieron a lo largo del borde antimesentérico y se lavó cuidadosamente la mucosa con agua corriente. Posteriomente se palpaba el tracto intestinal por completo para hallar tumores, adherencias u otras alteraciones. Se hizo un registro con el número de tumores, su localización y su tamaño. Posteriormente se tomaron muestras para el estudio histológico de los tumores así como de segmentos de la mucosa normal, tanto a nivel del ciego y colon ascendente (colon derecho) como del colon transverso, descendente y recto (colon izquierdo). Estas muestras se fijaron en formol al 10%, se incluyeron en parafina, se cortaron con el microtomo y se tiñeron mediante la tinción hematoxilina-eosina. Las lesiones de la mucosa colónica se clasificaron según los criterios de Grau de Castro-Piqué Badía (29) y Lev (30). Los tumores obtenidos se clasificaron en función de su grado de invasión parietal, de su diferenciación, de su estirpe histológica (definiendo al carcinoma mucinoso cuando su componente de mucina es superior al 50%), de su asociación a una placa linfoide, de su tamaño y de su aspecto macroscópico. Por otro lado se registraron los tumores de intestino delgado aparecidos así como otros hallazgos extraintestinales.
Se utilizó el test de Chi cuadrado para comparar entre los grupos de DMH (C) y DMH + etanol (E) la incidencia de tumores, los hallazgos anátomopatológicos, el número total de tumores colorrectales, el número de tumores desarrollados en el colon derecho y en el colon izquierdo, el tamaño medio de los tumores y la asociación tumoral con una placa linfoide. En los sucesos en que las condiciones para la aplicación del test de Chi cuadrado no se cumplieron, se utilizó el test de la corrección exacta de Fisher. Las diferencias entre ambos grupos fueron significativas cuando el valor de p resultó igual o menor que 0,05. Los resultados se presentan como media ± desviación estándar (SD).
RESULTADOS
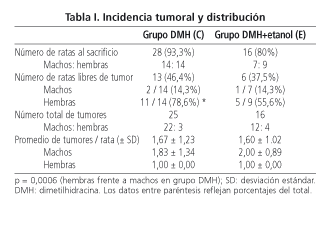
Seis ratas (5,5%) murieron antes de completar el estudio, 2 del grupo DMH (C; 6,7%) y 4 del grupo DMH+etanol (E; 20,0%). En el grupo C, falleció precozmente 1 rata macho a la que se realizó la autopsia muy tardíamente y no se pudo identificar la causa de muerte; y una rata hembra en la que no se identificó ningún tumor en la autopsia. En el grupo E, la mortalidad observada se debió en dos ratas machos a sendos tumores oclusivos, y la tercera rata macho falleció por hemorragia digestiva baja secundaria a un tumor colónico que la autopsia reveló también metástasis hepáticas; así como una rata hembra que no presentó tumor alguno. Estos animales se excluyeron del análisis. En el resto de las ratas que completaron el estudio no se apreciaron signos de deshidratación.
No se observaron diferencias significativas en la media de consumo de alcohol entre las ratas de los dos grupos que lo consumieron (1,23 ± 0,0074 g/kg peso al día en el grupo B y 1,23 ± 0,0094 en el grupo E; p = 0,82), midiendo el consumo de alcohol diariamente durante todo el estudio.
En los grupos sin DMH (grupo A, B y D) no se encontraron tumores. Únicamente aparecieron tumores colónicos en las ratas tratadas con DMH, 25 en el grupo DMH (28 ratas) y 16 en el grupo DMH + etanol (16 ratas). Hubo un menor número de animales machos libres de tumor (14,3% en ambos grupos) que de hembras libres de tumor (78,6% en el grupo DMH, p = 0,0006; 55,6% en el grupo DMH+etanol, p = 0,14 con la corrección del test de Fisher) (Tabla I). Excluyendo los animales libres de tumor, no se observaron diferencias significativas en el promedio de tumores por rata hallados entre los dos grupos inducidos con DMH (1,67 en el grupo DMH y 1,60 en el grupo DMH + etanol). No se registró ninguna metástasis hepática en estos grupos.
En cuanto al tamaño tumoral, no se apreciaron diferencias significativas (55,4
mm2 en el grupo C y de 45,8 mm2 en el grupo E). Tampoco en la morfología macroscópica de los tumores (con un 80% de los mismos de características polipoideas en el grupo C y 81,3% en el grupo E), ni en su localización (con un 68% de los mismos en el colon izquierdo en el grupo C y un 56,2% en el grupo E)
(Tabla II).
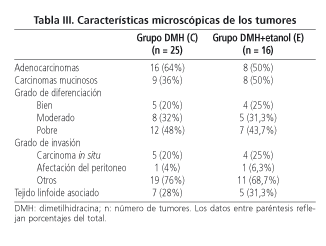
En cuanto a las características microscópicas de los tumores (Tabla
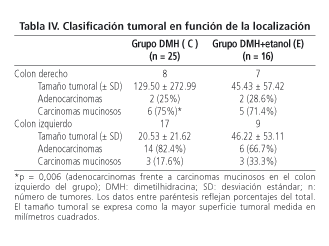
III), no se observaron diferencias significativas entre las ratas de los grupos C y E, respecto al número de adenocarcinomas y carcinomas mucinosos (considerando un componente mucinoso > 50% del adenocarcinoma), en el grado de diferenciación tumoral, en el grado de invasión parietal o en la asociación con tejido linfoide. Sin embargo, las ratas del grupo C (grupo control de DMH) presentaron un mayor número de carcinomas mucinosos en el colon
derecho (75%) que en el izquierdo (17,6%) (p = 0,006). Esta tendencia también se observó en la localización de los tumores de las ratas del grupo E (71,4%) en el colon derecho y (33,3%) en el colon izquierdo (p = 0,31, aplicando el test de corrección de Fisher)
(Tabla IV).
Se encontraron dos tumores de intestino delgado, uno en una rata del grupo C y otro en una rata del grupo E. Se registró un tumor ótico en una rata del grupo C.
DISCUSIÓN
El consumo de etanol es considerado como un posible factor de riesgo para el desarrollo del cáncer colorrectal, tanto en estudios clínicos (5-8) como experimentales en ratas (16,17).
Para estudiar el cáncer de colon controlando las diversas variables que intervienen en su inducción, la carcinogénesis colónica inducida con 1,2 dimetilhidracina (DMH) en ratas es un modelo válido empleado desde hace más de 3 décadas (18-20).
En estudios retrospectivos, se observa un riesgo elevado de cáncer de colon en mujeres a partir de un consumo de 63 g al día (5), mientras que otros trabajos (9) no aprecian dicho incremento, con un consumo diario de 30 g de etanol. Teniendo en cuenta estos resultados, nuestras ratas recibieron 1,23 g/kg de etanol diario durante las 24 semanas que duró el estudio, lo cual es una dosis de consumo y de riesgo en la población humana. Se trata de un trabajo original, donde se comprueba que el consumo de etanol a la dosis y tiempo establecidos no tiene influencia sobre la carcinogénesis colorrectal.
Con las cantidades de alcohol que se administraron, las ratas no mostraron su rechazo natural al alcohol, así que no era esperable que las diferencias de consumo de etanol entre el grupo E y el grupo control de etanol fueran significativas, como así sucedió.
Los resultados obtenidos en el modelo de carcinogénesis inducida por DMH son variables en función del diseño del estudio. En presencia de alcohol esta es inhibida, mientras que en su ausencia, se estimula debido a una inducción asociada al citocromo P450 (31). Más aún, al usar un carcinógeno primario, el alcohol puede comportarse de forma inversa, estimulando la carcinogénesis (32). Basado en estos resultados la administración de alcohol en nuestras ratas podría haber disminuido la carcinogénesis inducida por DMH; sin embargo, no observamos diferencias significativas en la carcinogénesis colorectal entre los grupos DMH y DMH + etanol.
La dosis de etanol administrada no modificó significativamente el número de ratas inducidas por DMH libres de tumor y tampoco modificó el número de tumores por rata. Algunos autores (32) afirman que no existe relación entre el tamaño tumoral o la estirpe histológica con la presencia de etanol, como observamos en nuestro estudio, pero estos autores relacionan la ingesta de etanol con el mayor número de tumores aparecidos en el recto, efecto que no hemos comprobado en nuestros animales. En nuestro trabajo hemos encontrado que tal consumo de etanol no modificó ni el número de tumores, ni su tamaño, ni la localización de los tumores inducidos por DMH, como han descrito otros autores sobre el mismo modelo (33).
Estudios clínicos llevados a cabo en pacientes con carcinoma colorrectal que bebían alcohol, parecían tener mayores tasas de mortalidad por cáncer, debido a un mayor desarrollo de metástasis hepáticas (34). La ausencia de metástasis hepáticas en nuestras ratas, no nos permiten aportar datos a este respecto.
En estudios in vitro (15) se describe que el consumo de etanol podría provocar una mayor agresividad de los tumores colorrectales; dicha agresividad es descrita en términos de una tasa de proliferación aumentada, con una menor diferenciación celular y una menor adhesión intercelular. Aunque algunos estudios en roedores (35) describen que la ingesta de etanol promueve algunos cambios en el tejido linfoide del epitelio, lo que explicaría un mecanismo promotor cocarcinogénico (28), no se apreció esta relación en nuestras ratas. Nuestros resultados mostraron que no existieron diferencias significativas en cuanto a las características anátomo-patológicas de los tumores inducidos por DMH por efecto del etanol, con lo que dicha agresividad no fue detectada en los tumores de nuestros animales.
En estudios epidemiológicos, el mecanismo por el que el alcohol podría modificar la carcinogénesis colorrectal parece ser dosis-dependiente (4,5,36), aunque otros autores no lo entienden así (37). Tomando todos ellos conjuntamente sugieren que cuanto más prolongada sea la ingesta de etanol, la cantidad diaria necesaria para observar un riesgo incrementado de cáncer colorrectal, es menor. Basándose en esta hipótesis, la explicación de nuestros resultados vendría dada porque el tiempo de duración del estudio habría resultado demasiado breve, aunque un modelo dinámico de administración concomitante de alcohol y procarcinógeno como el utilizado por nosotros podría resultar un diseño controvertido, para el estudio del efecto del etanol sobre la carcinogénesis colónica experimental inducida por la DMH.
Se relata una incidencia de carcinogénesis colónica experimental espontánea de menos de 2-3 ratas / 100.000 ratas observadas (38). En ausencia de carcinógeno (DMH), las ratas no presentaron tumores como se esperaba.
Los tumores colónicos proximales y distales y de recto deben ser considerados como entidades etiopatológicas diferentes, basándonos en estudios epidemiológicos (9) y experimentales en ratas (39); por lo que la respuesta del epitelio en las diferentes localizaciones colónicas puede ser diferente dentro de la misma rata DMH-inducida (16). En este punto, merece la pena destacar la clasificación histológica utilizada, donde la estirpe mucinosa del adenocarcinoma se toma, al agual que en patología humana, como una estirpe poco diferenciada, y con entidad suficiente, y diferente del adenocarcinoma "no mucinoso" (29). Tanto estudios experimentales (40) como revisiones de la literatura (41), asocian la localización derecha de los tumores con la peor diferenciación. En nuestro estudio demostramos que hubo significativamente un mayor número de carcinomas mucinosos en el colon derecho, respecto al colon izquierdo, de las ratas del grupo DMH, mientras que únicamente una tendencia hacia este comportamiento fue observada en los tumores de las ratas del grupo DMH+etanol sin llegar a la significación estadística (probablemente porque el número de tumores no fue suficiente). Nuestros datos divergen con los obtenidos por otros autores (31,42) que reflejan que el número de tumores del colon derecho están en relación inversamente proporcional al consumo de alcohol (más frecuentes en colon distal), en un modelo dinámico de carcinogénesis. La dosis de alcohol utilizada en este estudio, resultó, por tanto, insuficiente para mostrar el efecto inhibitorio sobre la carcinogénesis del colon derecho; con lo que los tumores del colon derecho mostraron su habitual peor comportamiento, comparándolos con los del colon izquierdo, como sugieren diversos autores (40,41). Estos resultados no son comparables al de otros autores (25,43), al haber utilizado en este trabajo la clasificación morfológica de Grau de Castro-Piqué Badía (29), y que ha sido comentada y publicada previamente (44).
Concluimos señalando que el suplemento oral con etanol a una dosis de 1.23 g/kg peso al día durante 24 semanas: a) no modificó la inducción tumoral en un modelo experimental dinámico de carcinogénesis colónica inducida por DMH a la dosis y tiempo establecidos en ratas Sprague-Dawley; y b) no observamos un comportamiento histológico diferente entre los tumores localizados en el colon derecho y los del colon izquierdo.
AGRADECIMIENTOS
Los autores quieren expresar su agradecimiento a D. Manuel Santiago por su ayuda técnica en el manejo y cuidado de los animales. Este trabajo de investigación ha sido subvencionado por la Universidad de Lleida y con una Beca de "Ayuda a la Investigación FISS Exp. nº 89/0612".
BIBLIOGRAFÍA
1. Greenwald P. Colon cancer overview. Cancer 1992; 70: 1206-15. [ Links ]
2. Trock B, Lanza E, Greenwald P. Dietary fiber, vegetables and colon cancer: Critical review and meta-analyses of the epidemiologic evidence. J Natl Cancer Inst 1990; 82: 650-61. [ Links ]
3. Vargas PA, Alberts DS. Primary prevention of colorectal cancer through dietary modifications. Cancer 1992; 70: 1229-35. [ Links ]
4. Kuhne GA, Vitetta, L. Alcohol consumption and the etiology of colorectal cancer: a review of the scientific evidence from 1957 to 1991. Nutr Cancer 1992; 18: 97-111. [ Links ]
5. Barra S, Negri E, Franceschi S, Guarneri S, La Vecchia C. Alcohol and colorectal cancer: A case-control study from northern Italy. Cancer Causes Control 1992; 3: 153-9. [ Links ]
6. Glynn SA, Albanes D, Pietinen P, Brown CC. Rautalahti M, Tangrea JA, et al. Alcohol consumption and risk of colorectal cancer in a cohort of Finnish men. Cancer Causes Control 1996; 7: 214-23. [ Links ]
7. Murata M, Takayama K, Choi BC, Pak AW. A nested case-control study on alcohol drinking, tobacco smoking, and cancer. Cancer Detect Prev 1996; 20: 557-65. [ Links ]
8. Yamada K, Araki S, Tamura M, Sakai I, Takahashi Y, Kashihara, et al. Case-control study of colorectal carcinoma in situ and cancer in relation to cigarette smoking and alcohol use (Japan). Cancer Causes Control 1997; l 8: 780-5. [ Links ]
9. Gerhardsson de Verdier M, Romelsjo A, Lundberg M. Alcohol and cancer of the colon and rectum. Eur J Cancer Prev 1993; 2: 401-8. [ Links ]
10. Tavani A, Ferraroni M, Mezzetti M, Franceschi S, Lo Re A, La Vecchia C. Alcohol intake and risk of cancers of the colon and rectum. Nutr Cancer 1998; 30: 213-9. [ Links ]
11. Kono S, Ikeda N, Yanai F, Shinchi K, Imanishi K. Alcoholic beverages and adenomatous polyps of the sigmoid colon: A study of male self-defence officials in Japan. Int J Epidemiol 1990; 19: 848-52. [ Links ]
12. Weisburger JH. Causes, relevant mechanisms and prevention of large bowel cancer. Semin Oncol 1991; 18: 316-36. [ Links ]
13. Goldbohm RA, Van den Brandt PA, Van´t Veer P, Dorant E, Stumans F, Hermus RJ. Prospective study on alcohol consumption and the risk of cancer of the colon and rectum in the Netherlands. Cancer Causes Control 1994; 5: 95-104. [ Links ]
14. Nagata C, Shimizu H, Kametani M, Takayama N, Ohnuma T, Matsushita S. Cigarette's smoking, alcohol use, and colorectal adenoma in Japanese men and women. Dis Colon Rectum 1999; 42: 337-42. [ Links ]
15. KoivistoT, Salaspuro M. Acetaldehyde alters proliferation, differentiation, and adhesion properties of human colon adenocarcinoma cell line Caco-2. Carcinogenesis 1998; 19: 2031-6. [ Links ]
16. Seitz HK, Czygan P, Simanowski UA, Waldherr R, Veith S, Raedsch R, et al. Stimulation of chemically induced rectal carcinogenesis by chronic ethanol ingestion. Alcohol 1985; 20: 427-33. [ Links ]
17. Simanowski UA, Stickel F, Maier H, Gartner U, Seitz HK. Effects of alcohol on gastrointestinal cell regeneration as a possible mechanism in alcohol-associated carcinogenesis. Alcohol 1995; 12: 111-5. [ Links ]
18. Banerjee A, Quirke P. Experimental models of colorectal cancer. Dis Colon Rectum 1998; 41: 490-505. [ Links ]
19. Barkla DH, Tutton PJ. Ultrastructure of 1,2-dimethylhydrazine-induced adenocarcinomas in rat colon. J Natl Cancer Inst 1997; 61: 1291-9. [ Links ]
20. Druckrey H, Preussman R, Matzkies F. Selektive Erzeugung von Darmkaebs bei Ratten durch 1,2-Dimethylhydrazin. Naturwissenschaften 58:285-286; 1967. In: Barkla DH, Tutton PJ. Ultrastructure of 1,2-dimethylhydrazine-induced adenocarcinomas in rat colon. J Natl Cancer Inst 1988; 61: 1291-9. [ Links ]
21. Hupp T, Buhr HJ, Ivancovic S, Beck N. Tierexperimentelle Untersuchungen zur karzinogeninduzierten Tumorbildung an Kolotomien in Abhängigkeit von Nahtmaterialien (Influence of suture material on experimental colonic carcinogenesis in rats). Langenbecks Arch Chir 1992; 377: 9-13. [ Links ]
22. Viñas Salas J, Biendicho Palau P, Piñol Felis C, Miguelsanz García S, Pérez Holanda S. Calcium inhibits colon carcinogenesis in an experimental model in the rat. Eur J Cancer 1998; 34: 1941-5. [ Links ]
23. Buenestado García J, Reñé Espinet JM, Piñol Felis C, Viñas Salas J. Modelo experimental de cáncer colorrectal. Rev Esp Enferm Dig 2002; 94: 367. [ Links ]
24. Buenestado García J, Piñol Felis C, Reñé Espinet JM, Pérez-Holanda S, Viñas Salas J. Silk suture promotes colon cancer in an experimental carcinogenic model. Dig Liver Dis 2002; 34: 609-10. [ Links ]
25. Noguera Aguilar JF, Tortajada Collado C, Moron Canis JM, Plaza Martínez A, Amengual Antich I, Pujol Tugores JJ. Modelo experimental para el estudio de la recidiva locorregional del cáncer colorrectal. Rev Esp Enferm Dig 2002; 94: 131-8. [ Links ]
26. Seitz HK, Simanowski UA. Alcohol and carcinogenesis. Am Rev Nutr 1988; 8: 99-119. [ Links ]
27. Glauert HP, Bennink MR. Influence of diet or intrarectal bile acid injections on colon epithelial cell proliferation in rats previously injected with 1,2-dimethylhydrazine. J Nutr 1983; 113: 475-82. [ Links ]
28. Hardman WE, Cameron IL. Colonic crypts located over lymphoid nodules of 1,2-dimethylhydrazine-treated rats are hyperplastic and at high risk of forming adenocarcinomas. Carcinogenesis 1994; 15: 2353-61. [ Links ]
29. Grau de Castro JJ, Piqué Badía JM. Cáncer colorrectal. En: Monografías clínicas en oncología. Barcelona: Ed. Doyma SA, 1990; 8: 63-75. [ Links ]
30. Lev R. Adenomatous polyps of the colon: Pathological and clinical features. New York: Springer-Verlach Inc., 1990. p. 1-2, 1-18. [ Links ]
31. Seitz HK, Czygan P, Waldherr R, Veith S, Raedsch R, Kässmodel H, et al. Enhacement of 1,2-Dimethylhydrazine-induced rectal carcinogenesis following chronic ethanol consumption in the rat. Gastroenterology 1984; 86: 886-91. [ Links ]
32. Seitz HK, Simanowski UA, Garzon FT, Rideout JM, Peters TJ, Koch A, et al. Possible role of acetaldehyde in ethanol-related rectal cocarcinogenesis in the rat. Gastroenterology 1990; 98: 406-13. [ Links ]
33. McGarrity TJ, Peiffer LP, Colony PC, Pegg AE. The effect of chronic ethanol administration on polyamine content during dimethylhydrazine induced colorectal carcinogenesis in the rat. Carcinogenesis 1988; 9: 2093-8. [ Links ]
34. Maeda M, Nagawa H, Maeda T, Koike H, Kasai H. Alcohol consumption enhances liver metastasis in colorectal carcinoma patients. Cancer 1998; 83: 1483-8. [ Links ]
35. López MC, Watzl B, Hebert AR, Murphy L, Huang DS, Watson RR. Ethanol-induced changes in the intestinal mucosa-associated immune system of young and mature mice. Alcohol 1993; 10: 555-7. [ Links ]
36. Newcomb PA, Storer BE, Marcus PM. Cancer of the large bowel in women in relation to alcohol consumption: A case-control study in Wisconsin (United States). Cancer Causes Control 1993; 4: 405-11. [ Links ]
37. Riboli E, Cornee J, Macquart-Moulin G, Kaaks R, Casagrande C, Guyader M. Cancer and polyps of the colo-rectum and lifetime consumption of beer and other alcoholic beverages. Am J Epidemiol 1991; 134: 157-66. [ Links ]
38. Winkler R, Pfeiffer M, Ayisi K, Dörner A. Spontaneous colostomy cancer in rat: a handly model of colonic carcinogenesis. En: Malt RA, Williamson RCN. Colonic carcinogenesis. Boston: MTP Press Limited, Harvard Medical School, 1982. p. 245-52. [ Links ]
39. McGarrity TJ, Peiffer LP, Colony PC. Cellular proliferation in proximal and distal rat colon during 1,2.dimethylhydrazine-induced carcinogenesis. Gastroenterology 1988; 95: 343-8. [ Links ]
40. Park HS, Goodlad RA, Wright NA. The incidence of aberrant crypt foci and colonic carcinoma in dimethylhydrazine-treated rats varies in a site-specific manner and depends on tumor histology. Cancer Res 1997; 57: 4507-10. [ Links ]
41. Klurfeld DM. Dietary fiber-mediated mechanisms in carcinogenesis. Cancer Res 1992; 52 (Supl. 7): 2055s-2059s. [ Links ]
42. Hamilton SR, Sohn OS, Fiala ES. Effects of timing and quality of chronic dietary ethanol consumption on azoxymethane-induced colonic carcinogenesis and azoxymethane metabolism in Fisher 344 rats. Cancer Res 1987; 47: 4305-11. [ Links ]
43. Noguera Aguilar JF, Zurita Romero M, Tortajada Collado C, Amengual Antich I, Soro Gosálvez JA, Rial Planas R. Perianastomotic colonic tumors after inclusion of titanium or Lactomer in the anastomotic suture line. An experimental study in rats. Rev Esp Enferm Dig 2000; 92: 36-43. [ Links ]
44. Pérez-Holanda S. Réplica "Relación entre el grado de diferenciación celular del cáncer colorrectal y su distribución topográfica". Rev Esp Enferm Dig 2002, 94: 568. [ Links ]











 texto en
texto en