Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.97 no.11 Madrid nov. 2005
|
TRABAJOS ORIGINALES |
Papel del sobrecrecimiento bacteriano intestinal y de la motilidad intestinal
en la traslocación bacteriana en un modelo experimental de cirrosis
E. Sánchez, F. Casafont, A. Guerra, I. de Benito1 y F. Pons-Romero
Servicios de Aparato Digestivo y 1Microbiología. Hospital Universitario Marqués de Valdecilla. Universidad de Cantabria. Santander
RESUMEN
Introducción: el sobrecrecimiento bacteriano intestinal (SBI) está relacionado con la motilidad del intestino delgado y diferentes trabajos con modelos experimentales han sugerido su relación con el desarrollo de traslocación bacteriana (TB). Tanto el sobrecrecimiento bacteriano intestinal como la traslocación bacteriana son eventos frecuentes en la cirrosis hepática.
Objetivos: los objetivos de este estudio han sido analizar la población cecal de bacterias aerobias y el tránsito intestinal en un modelo de ratas cirróticas y su relación con la TB.
Material y métodos: el estudio se ha realizado en un modelo experimental de cirrosis inducida por tetracloruro de carbono por vía oral en ratas Sprague-Dawley. Se llevaron a cabo cultivos microbiológicos convencionales a partir de ganglios linfáticos mesentéricos (GLM), sangre portal y periférica, hígado, bazo, y muestras cecales de todos los animales. Además se determinó el tiempo de tránsito intestinal en 10 ratas cirróticas y en 10 controles.
Resultados: la prevalencia de la traslocación bacteriana en los animales cirróticos fue de un 56%. La población de gérmenes aerobios en el ciego en las ratas cirróticas fue significativamente mayor (p < 0,01) que en las ratas controles. Las ratas cirróticas con TB presentaron un población bacteriana intestinal más elevada que las ratas sin TB (p < 0,05). La prevalencia de SBI en los animales cirróticos fue de un 67% frente a un 0% en los animales control (p < 0,01); también el SBI fue más frecuente en las ratas cirróticas con TB que en las cirróticas sin TB (93
vs. 33%) (p < 0,01). De las bacterias que traslocaron un 95,6% presentaban sobrecrecimiento en ciego. El tránsito intestinal fue más lento en las ratas cirróticas (60,5 ± 12,7
vs. 81,2 ± 5,7 cm) que en los animales controles (p < 0,01).
Conclusiones: estos resultados sugieren que el sobrecrecimiento bacteriano es frecuente en ratas cirróticas y predispone al desarrollo de traslocación bacteriana intestinal. Además, este sobrecrecimiento probablemente está favorecido por la existencia de una dismotilidad intestinal, frecuente en este modelo de cirrosis experimental.
Palabras clave: Sobrecrecimiento bacteriano intestinal. Traslocación bacteriana. Cirrosis experimental. Motilidad intestinal.
INTRODUCCIÓN
El paso de bacterias viables desde el intestino a los nódulos linfáticos mesentéricos (GLM) es conocido como traslocación bacteriana (TB) (1) y es un fenómeno que ocurre en numerosas situaciones clínicas que se caracterizan por el frecuente desarrollo de sepsis causadas por gérmenes gram-negativos (2).
Las infecciones son una complicación frecuente de los enfermos cirróticos y la mayoría de ellas están causadas por organismos de origen entérico (3). Diferentes estudios han documentado la importancia de la TB en la cirrosis (4,5), la cual parece jugar un papel importante en la patogénesis de estas infecciones y especialmente en la peritonitis bacteriana espontánea (PBE) (6,7). Los factores que favorecen la traslocación de la flora intestinal en la cirrosis no están completamente definidos y entre otros han sido involucrados la endotoxemia y la malnutrición (8-10). La ruptura del equilibrio ecológico en la flora intestinal parece ser un factor importante que se ha relacionado también con el desarrollo de TB y la predisposición a la aparición de infecciones (11,12). Por ejemplo, el sobrecrecimiento bacteriano intestinal (SBI) que se ha observado en algunos pacientes cirróticos, ha sido relacionado con una mayor predisposición al desarrollo de PBE (13-16). Otro dato que demuestra la importancia de la flora intestinal como factor patogénico de las infecciones en la cirrosis es el hecho de que la descontaminación intestinal selectiva mediante la administración de antibióticos, ha demostrado que previene la TB en ratas cirróticas, y es la profilaxis habitual de la PBE en pacientes cirróticos (17-20). Además, diversos estudios han demostrado que una motilidad intestinal deficiente es uno de los factores que contribuye al desarrollo de sobrecrecimiento bacteriano intestinal (SBI) y algunos autores han observado la existencia de un tránsito intestinal enlentecido en la cirrosis hepática, en relación con la gravedad de la enfermedad (21-24).
Los objetivos de este estudio han sido, en primer lugar, analizar la flora bacteriana del ciego en ratas cirróticas y su relación con la traslocación bacteriana; en segundo lugar establecer el papel que desempeña el SBI en la traslocación bacteriana; y finalmente, estudiar la motilidad intestinal en relación con estos fenómenos.
MATERIAL Y MÉTODOS
Hemos estudiado 27 ratas macho Sprague-Dawley con cirrosis inducida por tetracloruro de carbono (CCl4) y diez ratas sanas como controles. La cirrosis se ha inducido siguiendo el modelo experimental descrito por Runyon y cols. (25): los animales son mantenidos a temperatura y humedad constantes, con un ciclo de luz-oscuridad de 16/8 horas, y alimentados con pienso estándar; de acuerdo con las indicaciones para la investigación con animales plasmadas en la "Guía para el Cuidado y Uso de los Animales de Laboratorio". Los animales estuvieron bajo observación diaria. La inducción de la cirrosis comenzó cuando pesaban entre 100 y 150 g, mediante la adición de fenobarbital al agua de bebida a una concentración de 1,5 mmol/L. Cuando las ratas alcanzaron los 200 g de peso se les administró CCl4 por vía intragástrica, usando una dilución al 50% con aceite de oliva, y mediante canulación esofágica con una aguja especial, sin anestesia. El CCl4 fue administrado semanalmente partiendo de una dosis de 40 µL que fue aumentándose según el incremento de peso corporal del animal.
Estudio de la traslocación bacteriana y del SBI
Cuando los animales alcanzaron un estado de cirrosis estable (entre 9 y 11 semanas) recogimos las muestras para su procesamiento posterior. Para ello los anestesiamos con éter etílico (Iqanalítica, Probus S.A. Barcelona). Antes de la laparotomía tomamos una muestra de sangre periférica.
La laparotomía se llevó a cabo bajo condiciones de asepsia tras remover la piel y aplicar localmente una solución antiséptica. A continuación abrimos el peritoneo y exploramos posibles fuentes de infección. Las muestras fueron recogidas en el siguiente orden: sangre portal, nódulos linfáticos mesentéricos de la cavidad íleo-cecal, hígado, y bazo; siempre antes de la muerte del animal. Finalmente, se recogieron muestras de ciego. También se obtuvieron muestras de hígado para análisis histológico.
Inoculamos inmediatamente las muestras de sangre portal y periférica en frascos de hemocultivo (Batec Plus/ aerobio) y luego las procesamos en el sistema Bactec 9240 (Beckton-Dickinson, Maryland, EE.UU.). Homogeneizamos las muestras de hígado, bazo, y nódulos linfáticos que fueron colocadas en placas de CNA y agar MacConkey por espacio de 24 horas. Las muestras de ciego fueron homogeneizadas y luego diluidas 10:2, 10:4 y 10:6 previo a su cultivo en placas similares. Identificamos los microorganismos mediante los métodos bacteriológicos convencionales: API 20E (Bio Mérieux S.A. Mercy l'Etoile, France) y MicroScran (Baxter Healthcare, West Sacramento, CA, EE.UU.).
Definimos la existencia de traslocación bacteriana como el hallazgo de cultivo positivo en los GLM y la existencia de SBI cuando el contaje de bacterias en ciego superó la media más dos desviaciones estándar de la población en ratas normales.
Determinación del tránsito intestinal
Una hora antes del estudio de TB administramos a los animales un marcador líquido no absorbible, azul de Evans (50 mg en 1 mL de solución de NaCl al 0,9%), a través de un tubo orogástrico. Tras finalizar el estudio de traslocación evaluamos el intestino delgado en su totalidad. Siguiendo un método descrito previamente (26) determinamos la velocidad de tránsito intestinal midiendo la distancia entre el píloro y el sitio más alejado del intestino delgado teñido con azul de Evans.
Análisis estadístico
Expresamos los resultados como medias o proporciones, según lo requerido. El número de colonias se expresan como logaritmo en base 10 de las Unidades Formadoras de Colonias (UFC) por mL de homogeneizado. Expresamos el tránsito intestinal como la distancia medida en centímetros entre el píloro y la zona más distal del intestino teñida con el colorante. Para las comparaciones múltiples hemos usado el test ANOVA y el test no paramétrico de Kruskal-Wallis. Para las comparaciones entre grupos hemos usado el test de la U de Mann-Whitney y los test de Fisher o Chi cuadrado. Consideramos significativos los valores de p menores de 0,05.
RESULTADOS
Todas las ratas tuvieron cirrosis en el momento del estudio. En cuanto a TB, el 56% de las ratas presentaron cultivos positivos en GLM; ninguna de las ratas controles presentó traslocación (p < 0,02). La mayoría de las bacterias aisladas fueron gram-negativas entéricas y el organismo cultivado más frecuentemente fue E. coli, que creció en un 66,7% de los cultivos. Encontramos 7 casos de TB polimicrobiana. La población bacteriana total en los GLM de las ratas con traslocación fue de 3,37 ± 1,24 log10 CFU. La tabla I muestra las bacterias aisladas de las muestras de ciego y de nódulos linfáticos mesentéricos.
La población bacteriana total en ciego fue significativamente mayor en las ratas cirróticas (15,61 ± 5,36 log10 CFU) que en las ratas controles (7,89 ± 2,07 log10 CFU), p < 0,01. Este incremento se debió fundamentalmente a un aumento en la población de E. coli (p < 0,01) y de Proteus sp. (p < 0,01) (Tabla II). En 7 ratas cirróticas encontramos Enterococus y en 17 ratas cirróticas Enterobacter sp.; no encontramos estos organismos en ratas controles.
Clasificamos las ratas cirróticas de acuerdo a la presencia o ausencia de TB; no detectamos traslocación en 12 animales cirróticos. La
figura 1 ilustra el número total de bacterias aerobias en ciego de ambos grupos y el grupo control. Las ratas cirróticas con traslocación presentaron una población bacteriana intestinal más elevada (17,36 ± 4,71 log10 CFU) que las que no presentaron traslocación (13,39 ± 5,52
log10 CFU) (p < 0,05). Estas últimas a su vez presentaron mayor población que los animales controles (7,89 ± 2,07
log10 CFU). Estas diferencias entre los grupos fueron estadísticamente significativas (KW = 17,32; p < 0,01).
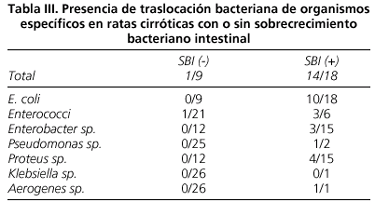
La prevalencia de SBI en las ratas cirróticas fue de un 67%. En relación a la traslocación, el SBI total fue más frecuente en las ratas cirróticas con TB que sin ella (93 vs. 33%) (p < 0,01) (Fig. 2). Analizamos la relación entre la traslocación de un organismo específico y la presencia de SBI de ese mismo microorganismo (Tabla III). La traslocación de una bacteria específica estuvo casi siempre asociada al SBI de la misma. Esto ocurrió en todos los casos de TB menos en uno (1 caso de traslocación de Enterococus sin sobrecrecimiento de este en ciego, aunque sí presente en cultivo). Por el contrario, el sobrecrecimiento de un organismo específico en ciego no siempre estuvo asociado a la traslocación de este. Cada organismo presentó un rango diferente de traslocación: E. coli 56%, Enterococus 50%, Pseudomonas sp. 50%, Proteus sp. 27%, Enterobacter sp. 20%; un animal presentó sobrecrecimiento intestinal y traslocación a GLM de Aerogenes sp. (Tabla III).
Con respeto al estudio del tránsito intestinal, los animales cirróticos presentaron un tránsito intestinal más lento (60,5 ± 12,7 cm) que el observado en los animales control (81,2 ± 5,7 cm) (p < 0,05)
(Fig. 3). No fue posible establecer una relación significativa entre la existencia de un tránsito intestinal prolongado y el desarrollo de traslocación bacteriana.
DISCUSIÓN
La traslocación bacteriana intestinal se ha postulado como el principal mecanismo patogénico en los casos de infecciones debidas a bacterias gram-negativas entéricas (1,27). Dado que este tipo de infecciones son muy frecuentes en la cirrosis hepática, se piensa ue la TB también juega un papel muy importante en esta situación, concretamente favoreciendo la aparición de bacteriemias y de peritonitis bacteriana espontánea (28-32).
Nuestro estudio confirma la alta prevalencia de TB, al menos en la cirrosis experimental, incluso en las primeras fases de la enfermedad, en las que no ha aparecido todavía ascitis. En estudios previos el desarrollo de la TB se ha relacionado fundamentalmente con la aprición de ascitis e incluso en el trabajo de García-Tsao sólo los animales cirróticos con ascitis presentaron TB (4-6). Nuestros datos sugieren que la acitis no es imprescindible para la aparición de TB y que deben existir otros factores que promueven su aparición diferentes de la misma. Entre los factores que han sido implicados en la existencia de una mayor predisposición a la aparición de TB se encuentran las disfunciones o anormalidades en la barrera mucosa intestinal, la malnutrición, la presencia de alteraciones inmunológicas y el sobrecrecimiento bacteriano intestinal, todas ellas descritas en casos de cirrosis hepática (4,33-39).
En nuestro modelo las ratas cirróticas tuvieron una población bacteriana cecal significativamente mayor que los animales controles, fundamentalmente a expensas de un incremento en la flora gram-negativa (E. coli y Proteus). Este aumento en la población bacteriana condujo a la aparición de sobrecrecimeinto en el 67% de los animales cirróticos, hallazgos que confirman los descritos por otros autores (39,40). Hay que señalar que son precisamente estas bacterias gram-negativas las que se han asociado con mayor frecuencia con el fenómeno de traslocación (7,10,30,39). De hecho, en nuestro estudio hemos observado que la población bacteriana intestinal de los animales cirróticos era mayor en los que presentaban TB que en los que no. Igualmente, las ratas cirróticas con criterios de SBI tuvieron una mayor prevalencia de TB que las ratas sin sobrecrecimiento. Esta relación entre el SBI y la existencia de TB y la aparición de complicaciones infecciosas, ha sido valorada previamente tanto a nivel experimental como en estudios en humanos. En animales cirróticos y también en los no cirróticos se ha observado que la existencia de SBI se correlaciona con la aparición de TB y en casos de cirrosis con el desarrollo de PBE (6,7,41). Nuestros resultados confirman el probable papel del sobrecrecimiento bacteriano como factor promotor de la traslocación, en la cirrosis hepática y posiblemente favoreciendo la aparición de PBE. De hecho, nuestro mismo grupo ha observado que en pacientes cirróticos la existencia de SBI se relaciona con una mayor prevalencia de PBE durante la hospitalización, con respecto a los pacientes cirróticos sin sobrecrecimiento (13). Por tanto, todos estos datos sugieren que en la cirrosis hepática el SBI es un factor promotor de la TB y posteriormente del desarrollo de complicaciones infecciosas como la PBE.
Un dato interesante de nuestro estudio es que si bien la traslocación de un germen específico se asocia a su sobrecrecimiento a nivel cecal, no todos los animales con sobrecrecimiento presentaron traslocación. Este dato sugiere que el sobrecrecimiento intestinal de cada bacteria es un factor necesario pero no suficiente, para su traslocación y que por tanto existen otros factores involucrados en la misma. Uno de estos factores probablemente está en relación con la propia virulencia del germen. Se sabe que existen bacterias que tienen una mayor facilidad y predisposición para traslocar, debido a diferencias en su capacidad de penetrar el epitelio intestinal (42-44). En nuestro trabajo hemos observado que los organismos que traslocaron con más frecuencia fueron E. coli y Enterococci, resultados que están en consonancia con lo descrito en la literatura.
Es conocido que la flora intestinal esta controlada por diferentes mecanismos fisiológicos como la motilidad gastrointestinal, el ácido gástrico y las interacciones bacterianas (36,42,45-47) que tratan de impedir su sobrecrecimiento. En la cirrosis hepática se ha descrito que varios de estos mecanismos pueden estar alterados y así se ha observado por ejemplo la existencia de hipoclorhidria (15) y enlentecimiento del tránsito intestinal (47-51). Esta hipomotilidad a su vez se ha puesto en relación con el desarrollo de SBI en pacientes con hepatopatías (23,51) y se ha asociado a una mayor incidencia de PBE (24). La probable implicación de este trastorno de la motilidad intestinal en la patogenia del SBI y la traslocación bacteriana está avalada por los hallazgos de diferentes estudios en los que se ha observado que la administración de fármacos procinéticos provoca una disminución en ambos fenómenos (52-54). En nuestro estudio hemos observado también un tránsito intestinal más lento en los animales cirróticos que en los controles, aunque no hemos podido establecer una correlación significativa con la traslocación bacteriana. Probablemente una de las causas de esta falta de correlación se deba al método indirecto utilizado para medir el tiempo de tránsito intestinal, que no permite una valoración detallada del mismo, comparado con métodos mucho más exactos y sensibles utilizados en otros estudios (55,56).
Todos estos datos sugieren que en la cirrosis hepática el sobrecrecimiento bacteriano intestinal aparece de forma frecuente y precoz, incluso antes del desarrollo de ascitis y que es un factor promotor de la traslocación bacteriana. Además, para que un determinado germen trasloque, su sobrecrecimiento es una condición necesaria aunque no suficiente. Por último, la cirrosis se asocia con frecuencia a un tránsito intestinal enlentecido, lo que probablemente es un factor favorecedor de la aparición del sobrecrecimiento bacteriano intestinal y por tanto de traslocación.
BIBLIOGRAFÍA
1. Alexander JW, Boyce ST, Babcock GF, Gianotti L, Peck MD, Dunn DL, et al. The process of microbial translocation. Ann Surg 1990; 212: 496-512. [ Links ]
2. Mainous MR, Tso P, Berg RD, Deitch MD. Studies of the route, magnitude, and time course of bacterial translocation in a model of systemic inflammation. Arch Surg 1991; 126: 33-7. [ Links ]
3. Rimola A, Soto R, Bory F, Arroyo V, Piera C, Rodes J. Reticuloendothelial system phagocytic activity in cirrhosis and its relation to bacterial infections and prognosis. Hepatology 1984; 4: 53-8. [ Links ]
4. Garc'a-Tsao G, Lee FY, Barden GE, Cartun R, West AB. Bacterial translocation to mesenteric lymph nodes is increased in cirrhotic rats with ascites. Gastroenterology 1995; 108: 1835-41. [ Links ]
5. Llovet JM, Bartol' R, Planas R, Cabre E, Jiménez M, Urban A, et al. Bacterial translocation in cirrhotic rats. Its role in the development of spontaneous bacterial peritonitis. Gut 1994; 35: 1648-52. [ Links ]
6. Runyon BA, Squier S, Borzio M. Translocation of gut bacteria in rats with cirrhosis to mesenteric lymph nodes partially explains the pathogenesis of spontaneous bacterial peritonitis. J Hepatol 1994; 21: 792-6. [ Links ]
7. Martín L, Sánchez E, Casafont F, Agüero J, Pons Romero F. Desarrollo de peritonitis bacteriana espontánea en un modelo experimental de rata cirrótica. Relación con la traslocación bacteriana intestinal. Rev Esp Enferm Dig 1995; 87: 632-6. [ Links ]
8. García-Tsao G, Albillos A, Barden GE, West AB. Bacterial translocation in acute and chronic portal hypertension. Hepatology 1993; 17: 1081-5. [ Links ]
9. Deitch EA, Xu DZ, Oi L, Specian RD, Berg RD. Protein malnutrition alone and in combination with endotoxin impairs systemic and gut-associated immunity. JPEN 1992; 16: 25-31. [ Links ]
10. Casafont F, Sánchez E, Martín L, Agüero J, Pons Romero F. Influence of malnutrition on the prevalence of bacterial translocation and spontaneous bacterial peritonitis in experimental cirrhosis. Hepatology 1997; 25: 1334-7. [ Links ]
11. Wells CL. Colonization and translocation of intestinal bacterial flora. Transplant-Proc 1996; 28 (5): 2653-6. [ Links ]
12. O'Boyle CJ, MacFie J, Mitchell CJ, Johnstone D, Sagar PM, Sedman PC. Microbiology of bacterial translocation in humans. Gut 1998; 42 (1): 29-35. [ Links ]
13. Morencos FC, De las Heras G, Martín Ramos L, Lopez MJ, Pons Romero F. Small bowel bacterial overgrowth in patients with alcoholic cirrhosis. Dig Dis Sci 1995; 40: 1252-6. [ Links ]
14. Yang CY, Chang CS, Chen GH. Small-intestine bacterial overgrowth in patients with liver cirrhosis, diagnosed with H2 and CH4 breath tests. Scand J Gastroenterol 1998; 33: 867-71. [ Links ]
15. Chesta J, Silva M, Thompson L, del Canto E, Defilippi C. Sobrecrecimiento bacteriano del intestino delgado en pacientes con cirrosis hepática. Rev Med Chile 1991; 119: 626-32. [ Links ]
16. Bode Ch, Kolepke R, Schäfer K, Bode J Ch. Breath hydrogen excretion in patients with alcoholic liver disease - evidence of small intestinal bacterial overgrowth. Z. Gastroenterol 1993; 31: 3-7. [ Links ]
17. Gines P, Rimola A, Planas R, Vargas V, Marco F, Almela M, et al. Norfloxacin prevents spontaneuos bacterial peritonitis recurrence in cirrhosis: results of a double-blind, placebo-controlled trial. Hepatology 1990; 12: 716-24. [ Links ]
18. Runyon BA, Borzio M, Young S, Squier SU, Guarner C, Runyon MA. Effect of selective bowel decontamination with norfloxacin on spontaneous bacterial peritonitis, translocation, and survival in an animal model of cirrhosis. Hepatology 1995; 21: 1719-24. [ Links ]
19. Llovet JM, Rodríguez-Iglesias P, Moitinho E, Planas R, Bataller R, Navasa M, et al. Spontaneous bacterial peritonitis in patients with cirrhosis undergoing selective intestinal decontamination. A retrospective study of 229 spontaneous bacterial peritonitis episodes. J Hepatol 1997; 26 (1): 88-95. [ Links ]
20. Soriano G, Guarner C, Teixido M, Such J, Barrios J, Enríquez J, et al. Selective inestinal decontamination prevents spontaneous bacterial peritonitis. Gastroenterology 1991; 100: 477-81. [ Links ]
21. Wang XD, Soltesz V, Andersson R. Cisapride prevents enteric bacterial overgrowth and translocation by improvement of intestinal motility in rats with acute liver failure. Eur Surg Res 1996; 28: 402-12. [ Links ]
22. Runkel NS, Moody FG, Smith GS, Rodríguez LF, Chen Y, Larocco MT, et al. Alterations in rat intestinal transit by morphine promote bacterial translocation. Dig Dis Sci 1993; 38: 1530-6. [ Links ]
23. Chesta J, Defilippi C, Defilippi C. Abnormalities in proximal small bowel motility in patients with cirrhosis. Hepatology 1993; 17: 828-32. [ Links ]
24. Chang CS, Chen GH, Lien HC, Yeh HZ. Small intestine dysmotility and bacterial overgrowth in cirrhotic patients with spontaneous bacterial peritonitis. Hepatology 1998; 28: 1187-90. [ Links ]
25. Runyon BA, Sugano S, Danel G, Mellencamp M. A rodent model of cirrhosis and spontaneous bacterial peritonitis. Gastroenterology 1991; 100: 489-93. [ Links ]
26. Wirthlin DJ, Cullen JJ, Spates ST, Conklin JL, Murray J, Caropreso DK, et al. Gastrointestinal transit during endotoxemia: the role of nitric oxide. J Surg Res 1996; 60: 307-11. [ Links ]
27. Baron P, Traber LD, Traber DL, Nguyen T, Hollyoak M, Heggers JP, et al. Gut failure and translocation following burn and sepsis. J Surg Res 1994; 57 (1): 197-204. [ Links ]
28. Navasa M, Rimola A, Rodes J, Bacterial infections in liver disease. Seminars Liver Dis 1997; 17: 323-33. [ Links ]
29. Caly WR, Strauss E. A prospective study of bacterial infections in patients with cirrhosis. J Hepatol 1993; 18: 353-8. [ Links ]
30. Llovet JM, Bartol' R, Planas R, Cabré E, Jiménez M, Urban A, et al. Bacterial translocation in cirrhotic rats. Its role in the development of spontaneous bacterial peritonitis. Gut 1994; 35: 1648-52. [ Links ]
31. Guarner C, Soriano G. Spontaneous bacterial peritonitis. Seminars Liver Dis 1997; 17: 203-17. [ Links ]
32. Runyon BA. Bacterial infections in patients with cirrhosis. J Hepatol 1993; 18: 271-2. [ Links ]
33. Garcia-Tsao G. Spontaneuos bacterial peritonitis. Gastroenterol Clin North Am 1991; 21: 257-75. [ Links ]
34. Sorell WT, Quigley EMM, Jin G, Johnson TJ, Rikkers LF. Bacterial translocation in the portal-hypertensive rat: studies in basal conditions and on exposure to hemorrhagic shock. Gastroenterology 1993; 104: 1722-6. [ Links ]
35. Pelletier G, Briantais MJ, Buffet C, Pillot J, EtiennePelletier G, Briantais MJ, et al. Serum and intestinal secretory Ig A in alcohlic cirrhosis of the liver. Gut 1982; 23: 475-80. [ Links ]
36. Kirsch M. Bacterial overgrowth. Am J Gastroenterol 1990; 85: 231-7. [ Links ]
37. Steffen E, Berg R. Relationship between caecal population levels of indigenous bacteria and translocation to mesenteric lymph nodes. Infect Inmmun 1983; 39: 1252-9. [ Links ]
38. O'Boyle CJ, MacFie J, Mitchell CJ, Johnstone D, Sagar PM, Sedman PC. Microbiology of bacterial translocation in humans. Gut 1998; 42 (1): 29-35. [ Links ]
39. Guarner C, Runyon BA, Young S, Heck M, Sheikh MY. Intestinal bacterial overgrowth and bacterial translocation in cirrhotic rats with ascites. J Hepatol 1997; 26: 1372-8. [ Links ]
40. Llovet JM, Bartoli R, March F, Planas R, Vinado B, Cabré E, et al. Translocated intestinal bacteria cause spontaneous bacterial peritonitis in cirrhotic rats: molecular epidemiologic evidence. J Hepatol 1998; 28: 307-13. [ Links ]
41. Berg RD. Bacterial translocation from the gastrointestinal tract. J Med 1992; 23 (3-4): 217-44. [ Links ]
42. Wells CL, Jechorek RP, Gillingham KJ. Relative contributions of host and microbial factors in bacterial translocation. Arch Surg 1991; 126: 247-52. [ Links ]
43. Katouli M, Bark T, Ljungqvist O, Svenberg T, Mollby R. Composition and diversity of intestinal coliform flora influence bacterial translocation in rats after hemorrhagic stress. Infect Immun 1994; 62 (11): 4768-74. [ Links ]
44. Steffen E, Berg R, Deitch E. Comparison of translocation rates of various indigenous bacteria from the gastrointestinal tract to the mesenteric lymph nodes. J Infect Dis 1988; 157: 1032-8. [ Links ]
45. Drude RB, Hines C. The pathophysiology of intestinal bacterial overgrowth syndromes. Arch Intern Med 1980; 140: 1349-52. [ Links ]
46. Wells CL, Maddaus MA, Reynolds CM, Jechorek RP, Simmons RL. Role of anaerobic flora in the translocation of aerobic and facultatively anaerobic intestinal bacteria. Infect Immun 1987; 55: 2689-94. [ Links ]
47. Dinsmore JE, Jackson RJ, Smith SD. The protective role of gastric acidity in neonatal bacterial translocation. J Pediatr Surg 1997; 32 (7): 1014-6. [ Links ]
48. Madrid AM, Brahm J, Buckel E, Silva G, Defilippi C. Orthotopic liver transplantation improves small bowel motility disorders in cirrhotic patients. Am J Gastroenterol 1997; 92: 1044-5. [ Links ]
49. Husebye E. Gastrointestinal motility disorders and bacterial overgrowth. J Intern Med 1995: 237: 419-27. [ Links ]
50. Chesta J, DeFilippi C, DeFilippi C. Abnormalities in proximal small bowel motility in patients with cirrhosis. Hepatology 1993; 17: 828-32. [ Links ]
51. Van Thiel DH, Fagiuoli S, Wright HI, Chien MC, Gavaler JS. Gastrointestinal transit in cirrhotic patients: effect of hepatic encephalopathy and its treatment. Hepatology 1994; 19: 67-71. [ Links ]
52. Pardo A, Bartoli R, Lorenzo-Zuniga V, Planas R, Vinado B, Riba J, et al. Effect of cisapride on intestinal bacterial overgrowth and bacterial translocation in cirrhosis. Hepatology 2003; 31: 858-63. [ Links ]
53. Pérez-Paramo M, Muñoz J, Albillos A, Freile I, Portero F, Santos M, et al. Effect of propranolol on the factors promoting bacterial translocation in cirrhotic rats with ascites. Hepatology 2003; 31: 43-8. [ Links ]
54. Zhang SC, Wang W, Ren WY, He BM, Zhou K, Zhu WN. Effect of cisapride on intestinal bacterial and endotoxin translocation in cirrhosis. World J Gastroenterol 2003; 9: 534-8. [ Links ]
55. Reilly JA, Quigley EMM, Forst CF, Rikkers LF. Small intestinal transit in the portal hypertensive rat. Gastroenterology 1991; 100: 670-4. [ Links ]
56. Chesta J, Debnam ES, Srai SKS, Epstein O. Delayed stomach to caecum transit time in the diabetic rat. Possible role of hyperglucagonemia. Gut 1990; 30: 660-2. [ Links ]











 texto en
texto en