Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 no.5 Madrid may. 2010
Neoplasia papilar mucinosa intraductal del páncreas: resultados clínico-patológicos
Intraductal papillary mucinous neoplasms (IPMN) of the pancreas: clinico-pathologic results
J. A.-Cienfuegos1, F. Rotellar1, P. Martí Cruchaga1, V. Valentí1, G. Zozaya1, A. Bueno1, N. Pedano1, M. D. Lozano2, J. J. Sola2 y F. Pardo1 1Departamento de Cirugía General y Digestiva. Dirección para correspondencia RESUMEN Introducción: la neoplasia papilar mucinosa intraductal (NPMI) del páncreas comprende una serie de lesiones que evolucionan desde lesiones benignas (adenoma) hasta carcinoma ductal invasivo. Palabras clave: Neoplasia papilar mucinosa intraductal. Factores pronósticos. Carcinoma invasivo. Supervivencia. ABSTRACT Background: intraductal papillary mucinous neoplasm (IPMN) shows a series of lesions which evolve from benign lesions -adenoma- to invasive carcinoma. Key words: Intraductal papillary mucinous neoplasm. Prognosis factors. Invasive carcinoma. Survival. Introducción La neoplasia papilar mucinosa intraductal del páncreas (NPMI) comprende un espectro de lesiones con características biológicas y clínicas que han suscitado gran interés en la última década (1-6). La primera serie de casos clínicos de NPMI fue descrita por Ohhashi en 1982 y recibió su nombre por Sessa en 1994 (7,8). El hecho de que el 20-30% de la NPMI sea multifocal y que el 5-10% pueda afectar a toda la glándula, ha generado múltiples controversias en el tratamiento quirúrgico y seguimiento de estos pacientes (1-5). Los hechos más significativos de la NPMI son sus formas de presentación -variante ductal, de conductos pancreáticos accesorios y mixta- y la progresión secuencial desde lesiones incipientes, como el adenoma hasta el carcinoma
in situ y carcinoma invasivo; por lo que se le debe considerar como una lesión precursora del cáncer de páncreas, especialmente en las lesiones del conducto pancreático principal (9-13). Con el fin de clarificar las controversias mencionadas, se han celebrado varias reuniones de consenso en cuanto al diagnóstico y tratamiento. El objetivo de este trabajo es analizar los resultados del tratamiento quirúrgico de la NPMI y su concordancia con las recomendaciones de las conferencias de consenso (14-16). Material y métodos Entre marzo de 1993 y septiembre de 2009 se intervinieron 38 pacientes por tumores quísticos de páncreas, de los cuales 15 estaban diagnosticados de neoplasia papilar mucinosa intraductal (NPMI), objeto de este estudio. Se realizó un análisis retrospectivo de las historias clínicas, objetivándose los síntomas principales, los relacionados con la cirugía, la histopatología, la supervivencia y el patrón de recurrencia. La indicación quirúrgica se estableció en sesión interdisciplinar, basados en diferentes pruebas de imagen: tomografía computerizada multicorte (TC), ultrasonografía endoscópica (USE) con punción con aguja fina (PAAF), colangiopancreatografía por resonancia magnética (CPRM) y citología según las pautas de las reuniones de consenso mencionadas. En las lesiones localizadas en la cabeza del páncreas, proceso uncinado y cuerpo de páncreas, se realizó duodenopancreatectomía cefálica (intervención de Krauss-Whipple). En las lesiones centrales se realizó pancreatectomía
central y en las lesiones de cuerpo y cola de páncreas se realizó pancreatectomía caudal o distal. En los pacientes con afectación de todo el conducto de Wirsung, se practicó pancreatectomía total. En todos los casos se realizó estudio intraoperatorio de los bordes de resección pancreática. El diagnóstico de NPMI se realizó de acuerdo con la nomenclatura establecida por la World Health Organization (WHO) (17) y la conferencia de consenso celebrada en Osaka en el año 2004 (15). Se excluyeron los tumores que presentaban un patrón similar al estroma ovárico y que fueron diagnosticados como tumores quísticos mucinosos (17). La NPMI se clasificó en tres categorías: las que afectaban al conducto pancreático principal, las originadas en las ramas accesorias y las neoplasias mixtas cuando afectaban a ambos componentes. Los tumores se clasificaron en NPMI no invasivas y en NPMI invasivas; de acuerdo con los criterios de WHO y los publicados posteriormente por Singh y Maitra (9,17). Los bordes de resección se estudiaron de acuerdo con las normas de la AJCC (Cancer Staging Manual) (18). El margen de resección pancreático se consideró positivo siempre que se identificara microscópicamente cualquier grado de NPMI. La mortalidad operatoria se definió como el fallecimiento en el mismo ingreso hospitalario o en los primeros 30 días del postoperatorio. Se definió fístula pancreática cuando las concentraciones de amilasa eran tres veces superiores al valor en plasma en el drenaje percutáneo (19). La recurrencia se definió como "local" en el lecho pancreático, "regional" en la cavidad peritoneal y "a distancia" si se producía en hígado, pulmón, huesos, etc. Los intervalos de confianza se han calculado con el programa Epi Info 6.0, 4C. Se calculó la supervivencia actuarial según el método de Kaplan-Meier, con el programa SPSS, versión 15.0. Resultados En la
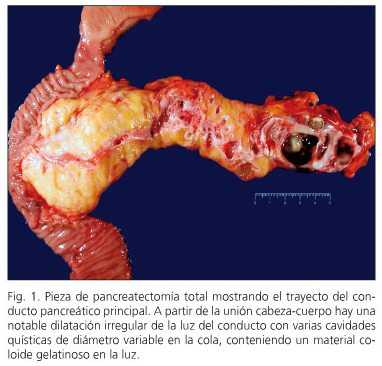
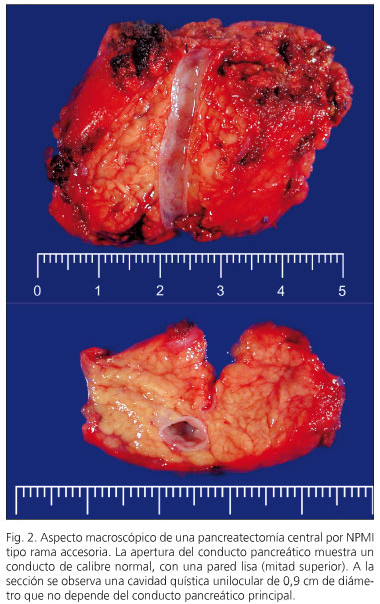
tabla I se resumen las características clínicas más relevantes de la serie. La incidencia fue similar en ambos sexos y con un rango de edad entre 33 y 79 años (mediana 61 años; media 63,2 años); límite de confianza (LC): 95%; 55,95-70,44. Los síntomas de presentación fueron generalmente anodinos, si bien cinco pacientes cursaron con síntomas específicos, como ictericia, fiebre, episodios previos de pancreatitis y síndrome constitucional. La prueba diagnóstica más utilizada fue el CT-abdominal con la ultrasonografía endoscópica (USE), y punción con aguja fija. La citología fue positiva para tumor mucinoso en 8 de los 9 casos en que se realizó (sensibilidad 88,8%). En dos pacientes se obtuvo material insuficiente. Ocho de las neoplasias se localizaron en la cabeza del páncreas, en tres enfermos afectaba de forma difusa al conducto pancreático principal y en los restantes la NPMI afectaba a cuerpo-cola, proceso uncinado y en dos casos al cuerpo del páncreas. Se realizaron seis duodenopancreatectomías cefálicas, cuatro pancreatectomías totales, dos pancreatectomías centrales, dos pancreatectomías parciales y una pancreatectomía distal. Se registraron complicaciones en 6 pacientes (40%). Cuatro presentaron "colecciones en el lecho quirúrgico" de los que 3 requirieron drenaje transgástrico mediante USE. Un enfermo, al que se le practicó una enucleación, desarrolló una fístula pancreática a los cuatro días del alta y fue tratada con drenaje percutáneo. Otro paciente desarrolló vaciamiento gástrico retardado. La estancia hospitalaria media fue de 10 días (rango 4-22 días). No existió mortalidad operatoria. En cinco casos la NPMI fue de tipo mixto y en cuatro la NPMI afectaba al conducto pancreático principal (Fig. 1). En los seis restantes la NPMI afectaba a ramas pancreáticas accesorias (Fig. 2). En tres casos se describió displasia leve en el margen de resección pancreático y no se amplió la resección.
2Servicio de Anatomía Patológica. Clínica Universidad de Navarra. Pamplona, Navarra
Objetivo: analizar los resultados clínicos y patológicos de 15 pacientes diagnosticados de NPMI e intervenidos según las recomendaciones de conferencia de consenso.
Material y métodos: análisis retrospectivo de 15 pacientes con NPMI, intervenidos entre marzo de 1993 y septiembre de 2009; según pautas de conferencias de consenso internacionales. Se recogieron datos demográficos, pruebas diagnósticas, tipo de intervención, histopatología y supervivencia actuarial con un seguimiento entre mes y medio y nueve años.
Resultados: se realizaron 6 duodenopancreatectomías cefálicas, 4 pancreatectomías totales, 2 pancreatectomías centrales, 2 pancreatectomías parciales y una pancreatectomía distal. Se registró una morbilidad del 40%, sin mortalidad operatoria, con una estancia media de 10 días. En 5 casos la NPMI fue de tipo mixto, en 4 afectaba al conducto pancreático y en los 6 restantes a ramas accesorias. Dos pacientes presentaron carcinoma in situ y 3 carcinoma invasivo con ganglios negativos. Un paciente, sin carcinoma invasivo, falleció a los 66 meses por adenocarcinoma de páncreas. La supervivencia actuarial hasta recidiva o muerte fue de 105,133 meses; con un rango de seguimiento entre mes y medio y 9 años.
Conclusiones: la NPMI tipo ductal y mixto exige la resección completa debido a la elevada incidencia de carcinoma invasivo o de lesiones precursoras de malignidad. Por su carácter multifocal los enfermos deben ser revisados a largo plazo. Existen controversias en las NPMI tipo accesorio asintomáticas y menores de 3 cm.
Aim: to analyze the clinical and pathological results of 15 patients diagnosed of IPMN, and surgically treated according to the guidelines of International Consensus Conference.
Material and method: a retrospective analysis of 15 patients surgically treated between March 1993 and September 2009, according to the International Consensus recommendation. Demographic, diagnostic tools, surgical report, pathologic database and actuarial survival were analyzed with a follow-up from one and a half month through nine years.
Results: 6 patients underwent pancreaticoduodenectomies, 4 total pancreatectomies, 2 body or central pancreatectomies, 2 partial pancreatectomies (enucleation) and 1 distal pancreatectomy. A morbidity of 46 and 0% hospital mortality were assessed, with a median length hospital stay of 10 days. In five cases, the IPMN was combined type (both main and branch pancreatic ducts involved) in four main duct-type and branch duct-type in the another six as well. Several atypia (IPMN carcinoma in situ) was observed in 2 patients and invasive carcinoma with negative lymph nodes was identified in 3 patients. A patient without invasive carcinoma died at 66 months of follow-up for pancreas adenocarcinoma. The actuarial survival up to recurrence or death was 105,133 months with a range of follow-up from 1 month and a half until 9 years.
Conclusions: IPMN main duct or mixed type warrants complete resection due to its incidence of invasive carcinoma or precursor lesions of malignancy as well. Due to its multifocal pattern, patients should be followed in long-term surveillance. The management of asymptomatic IPMN type branch less than 3 cm is controversial.
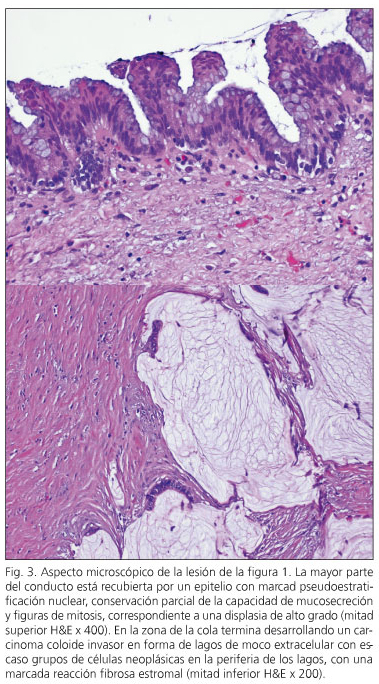
En tres pacientes se detectó neoplasia intraepitelial pancreática ("PanIN"). En dos casos se trataba del tipo PanIN-1A, lesiones planas con atipia mínima, y una lesión PanIN-2 con atipia moderada. Dos pacientes presentaban NPMI con displasia de alto grado -carcinoma in situ- (casos 6 y 10) y otros tres pacientes (casos 1, 2 y 3) presentaban un carcinoma invasivo con ganglios negativos (Fig. 3). Dos de ellos se encuentran libres de enfermedad a los ocho y nueve años de seguimiento, mientras que uno se encuentra libre de enfermedad a los tres años de la pancreatectomía y tras ser reintervenido de una recidiva regional a los 15 meses de la pancreatectomía.
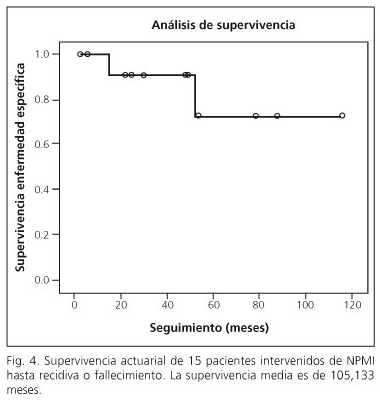
Un paciente (caso 4) falleció a los cinco años y medio de una recidiva ganglionar locorregional de un adenocarcinoma de páncreas. El resto de los pacientes permanecen vivos y libres de enfermedad. Todos los pacientes fueron revisados con un rango de seguimiento entre un mes y medio y nueve años; obteniéndose una supervivencia actuarial de 105,133 meses con índice de confianza de 95% (86,264-124,003) y una supervivencia hasta la recidiva o muerte de 98,355 meses (intervalo de confianza: 76,761-119,949). En la figura 4 se recoge la supervivencia actuarial hasta la presencia de recidiva o fallecimiento.
Discusión
La primera serie de la NPMI fue descrita por Ohhasi en 1982 (7,20). Posteriormente Sessa y cols. caracterizaron la lesión con el término actualmente empleado (8).
Por último, la World Health Organization (WHO) en 1996, con motivo de una clasificación de los exocrinos del páncreas, definió la NPMI como la proliferación papilar de un epitelio columnar secretor de mucina en el conducto principal o en los conductos pancreáticos accesorios (17). Dicha clasificación ha esclarecido una serie de términos confusos que han dificultado conocer su evolución natural y realizar valoraciones comparativas entre diferentes autores (5,6).
En la última década ha habido una gran proliferación de publicaciones referidas a la NPMI y se estima que entre el 8 y 20% de las resecciones pancreáticas en centros de referencia se debe a esta entidad (22-24). Uno de los aspectos más singulares son sus formas de presentación -ductal, rama pancreática accesoria y mixta-, y el que se la considere como una lesión premaligna, en la que la secuencia displasia leve-carcinoma in situ, carcinoma invasivo está bien establecida. En las piezas de resección pancreática se han descrito focos de neoplasia intraepitelial pancreática (PanIN), dividida a su vez en diversos grados de atipia celular (PanIN-1, PanIN-2, PanIN-3). Las lesiones PanIN-1, a su vez, se subdividen en tipo plano (PanIN-1A) y tipo papilar (PanIN-1B).
Debido a las controversias suscitadas se han celebrado varias reuniones de consenso y emitido guías de actuación al respecto (14-16). Si bien nuestra serie es limitada, representa la segunda en la literatura española y expresa todas las lesiones de la NPMI, desde su forma más benigna hasta el carcinoma invasivo. El perfil demográfico es similar a otras series, presentándose en edades relativamente avanzadas (70-80 años); lo que ha podido suscitar una actitud "nihilista" respecto al tratamiento quirúrgico de estos pacientes.
La localización más frecuente en cabeza y cuerpo de páncreas (9 de los 15 casos), y los síntomas de presentación, coinciden con los descritos en otros trabajos (3,21-25). En nuestra serie, los cuatro casos con signos de malignidad -carcinoma in situ o carcinoma invasivo- fueron aquellos que tenían afectación del conducto principal o mixto, hecho que concuerda con la mayoría de los autores (24,26-29).
Un enfermo falleció a los 66 meses, de una recidiva ganglionar de un adenocarcinoma de páncreas (caso 3) y que presentó el tipo de afectación mixta, patrón morfológico con mayor incidencia de lesiones invasivas en las grandes series (24,26-30). La posible recidiva o tumor "de novo" pancreático apareció a los cinco años y medio, que es el tiempo estimado (5-7 años) en completarse la evolución de adenoma a carcinoma (9,11,12,24,27). En una serie muy similar a la nuestra, Adsay y cols. describen dos pacientes con una NPMI no invasiva que fallecieron a los 65 meses de la cirugía por diseminación locorregional de un adenocarcinoma de páncreas (21). En uno de los pacientes y carcinoma invasivo (caso 13), se produjo una recidiva en peritoneo a los 15 meses de la pancreatectomía total. Dicha enferma permanece viva y libre de enfermedad a los 3 años tras ser reintervenida.
Se ha descrito la afectación multifocal en el páncreas hasta en un 30% de los pacientes -con variante "conducto accesorio"- y se ha publicado un 10% de recurrencias en pacientes con NPMI no invasivas, sometidos a pancreatectomías parciales y con márgenes negativos (31,32). Se ha descrito adenocarcinoma de páncreas sincrónico o metracrónico en el 9,2% de 76 pacientes en NPMI (33). Tres de los pacientes presentaban afectación del margen de resección pancreática con displasia leve. Existe acuerdo en que no es necesaria una resección más amplia del páncreas (11,16,15,32,34).
El resto de los pacientes permanecen libres de enfermedad con un rango de seguimiento entre 6 meses y 8 años. No existió mortalidad operatoria y la morbilidad del 40% se encuentra en el rango referido por centros acreditados con experiencia en resecciones pancreáticas (35,36). La hospitalización media fue de 10 días, con un rango de 5 y 22 días. De la experiencia publicada se concluye que las NPMI de afectación ductal y mixta deben ser resecadas quirúrgicamente con la confirmación intraoperatoria de ausencia de invasión de los bordes de resección pancreática, estimándose una supervivencia del 80% a los cinco años en el caso de la NPMI no invasiva y del 30% en los casos con carcinoma invasivo. En la tabla II presentamos la experiencia reciente de grandes series (26,31,37-41).
Anteriormente hemos comentado que la incidencia de carcinoma invasivo es más frecuente en las lesiones del conducto principal del páncreas (75%), que en las lesiones originadas en conductos accesorios (25%) (15,24,30,42,43). Dichos antecedentes justifican el estudio de Salvia y cols. en el que realizaron el seguimiento de 89 pacientes con NPMI tipo rama-accesorio, asintomáticas, de un tamaño menor de 3,5 cm y valores de CA-19.9 normales. En dicho estudio sólo cinco pacientes (6%) desarrollaron un aumento de tamaño y fueron resecados sin signos de malignidad (44,45). Resultados similares han sido publicados por Tanno y cols., en el seguimiento de 81 pacientes durante 61 meses (46).
A raíz de este estudio -grado de evidencia 3- las guías prácticas recomiendan el seguimiento de aquellas lesiones que afecten exclusivamente a los conductos pancreáticos accesorios asintomáticos, menores de 3 cm de diámetro y que no presenten nódulos en su interior (15,44,47,48). El intervalo de seguimiento -mediante CT y EUS- no debe superar los seis meses; debido a la mayor incidencia de adenocarcinoma de páncreas metacrónico en el resto de la glándula pancreática (49,50).
Basados en experiencias previas, podemos concluir que la NPMI con afectación del conducto principal y tipo mixto se debe resecar con confirmación histológica de ausencia de invasión de los bordes de resección. En los casos de NPMI no invasiva, se estima una supervivencia a los 5 años del 80% y del 30% en aquellos casos que presentan un carcinoma invasivo. La tabla II resume la experiencia de las series más importantes.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier A. Cienfuegos.
Departamento de Cirugía General.
Clínica Universidad de Navarra.
Avda. Pío XII, 36. 31008 Pamplona, Navarra.
e-mail: fjacien@unav.es
Recibido: 24-11-09.
Aceptado: 09-02-10.
Bibliografía
1. Garcea G, Ong SL, Rajesh A, Neal CP, Pollard CA, Berry DP, et al. Cystic lesions of the pancreas. A diagnostic and management dilemma. Pancreatology 2008; 8: 236-51. [ Links ]
2. Goldsmith JD. Cystic neoplasms of the pancreas. Am J Clin Pathol 2003; 119(1): S3-S16. [ Links ]
3. Basturk O, Coban I, Adsay NV. Pancreatic cysts: pathologic classification, differential diagnosis, and clinical implications. Arch Pathol Lab Med 2009; 133: 423-38. [ Links ]
4. Adsay NV. Cystic lesions of the pancreas. Modern Pathology 2007; 20: 571-93. [ Links ]
5. Seijo Ríos S, Lariño Noia J, Iglesias García J, Lozano León A, Domínguez Muñoz JE. Tumor papilar mucinoso e intraductal: abordaje diagnóstico y terapéutico. Gastroenterol Hepatol 2008; 31: 92-7. [ Links ]
6. Fernández-Esparrach G, Pellisé M, Ginès A. Tumor mucinoso papilar intraductal del páncreas: una entidad más desconocida que infrecuente. Gastroenterol Hepatol 2003; 26: 562-70. [ Links ]
7. Ohhashi K, Murakami Y, Takekoshi T. Four cases of mucous secreting pancreatic cancer (abstr). Prog Diagn Endosc 1982; 20: 348-51. [ Links ]
8. Sessa F, Solcia E, Capella C, Bonato M, Scarpa A, Zamboni G, et al. Intraductal papillary-mucinous tumours represent a distinct group of pancreatic neoplasms: an investigation of tumour cell differentiation and K-ras, p53 and c-erbB-2 abnormalities in 26 patients. Virchows Arch 1994; 425: 357-67. [ Links ]
9. Singh M, Maitra A. Precursor lesions of pancreatic cancer: molecular pathology and clinical implications. Pancreatology 2007; 7(1): 9-19. [ Links ]
10. Hruban RH, Maitra A, Kern SE, Goggins M. Precursors to pancreatic cancer. Gastroenterol Clin North Am 2007; 36: 831-49. [ Links ]
11. Maitra A, Fukushima N, Takaori K, Hruban RH. Precursors to invasive pancreatic cancer. Adv Anat Pathol 2005; 12: 81-91. [ Links ]
12. Maitra A, Hruban RH. Pancreatic cancer. Annu Rev Pathol Mech Dis 2008; 3: 157-88. [ Links ]
13. Serikawa M, Sasaki T, Fujimoto Y, Kuwahara K, Chayama K. Management of intraductal papillary-mucinous neoplasm of the pancreas: treatment strategy based on morphologic classification. J Clin Gastroenterol 2006; 40: 856-62. [ Links ]
14. Furukawa T, Klöppel G, Volkan Adsay N, Albores-Saavedra J, Fukushima N, Horii A, et al. Classification of types of intraductal papillary-mucinous neoplasm of the pancreas: a consensus study. Virchows Arch 2005; 447: 794-9. [ Links ]
15. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, et al.; International Association of Pancreatology. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006; 6: 17-32. [ Links ]
16. Hruban RH, Takaori K, Klimstra DS, Adsay NV, Albores-Saavedra J, Biankin AV, et al. An illustrated consensus on the classification of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. Am J Surg Pathol 2004; 28: 977-87. [ Links ]
17. Kloppel G, Solcia E, Longnecker DS, Capella C, Sobin LH. Histological typing of tumours of the exocrine pancreas. In: World Health Organization International Classification of Tumours. 2nd ed. Berlin: Springer; 1996. p. 11-20. [ Links ]
18. Edge SB, Byrd DR, Compton EC, Fritz AG, Greene FL, Trotti A, editors. Exocrine and endocrine pancreas. En: AJCC. Cancer staging manual. 7th ed. New York: Springer-Verlag; 2010. p. 241-9. [ Links ]
19. Bassi C, Dervenis C, Buturrini G, Fingerhut A, Yeo C, Izbicki J, et al.; International Study Group on Pancreatic Fistula Definition. Postoperative pancreatic fistula: as international study group (ISGPF) definition. Surgery 2005: 138: 8-13. [ Links ]
20. Ohhashi K, Takagi K. ERCP and imaging diagnosis of pancreatic cancer (Abstr). Endoscopy 1980; 77: 1493-5. [ Links ]
21. Adsay NV, Conlon KC, Zee SY, Brennan MF, Klimstra DS. Intraductal papillary-mucinous neoplasms of the pancreas: an analysis of in situ and invasive carcinomas in 28 patients. Cancer 2002; 94: 62-77. [ Links ]
22. Raut CP, Cleary KR, Staerkel GA, Abbruzzesse JL, Wolff RA, Lee JH, et al. Intraductal papillary mucinous neoplasms of the pancreas: effect of invasion and pancreatic margin status on recurrence and survival. Ann Surg Oncol 2006; 13: 582-94. [ Links ]
23. Ubiña Aznar E, Rivera Irigoin R, Méndez Sánchez I, Fernández Moreno N, García Fernández G, Sánchez Cantos A. Endoscopic signs of mucinous tumor of the pancreas. Rev Esp Enferm Dig 2007; 7: 413-4. [ Links ]
24. Sohn TA, Yeo CJ, Cameron JL, Hruban RH, Fukushima N, Campbell KA, et al. Intraductal papillary mucinous neoplasms of the pancreas: an updated experience. Ann Surg 2004; 239: 788-97. [ Links ]
25. Marín Serrano E, Macías Rodríguez MA, Rendón Unceta P, Pérez Requena J, Guillén Mariscal P, Martín Herrera L. Pancreatic intraductal papillary mucinous tumor. Rev Esp Enferm Dig 2005; 11: 836-7. [ Links ]
26. Schnelldorfer T, Sarr MG, Nagorney DM, Zhang L, Smyrk TC, Qin R, et al. Experience with 208 resections for intraductal papillary mucinous neoplasm of the pancreas. Arch Surg 2008; 143: 639-46. [ Links ]
27. Salvia R, Fernández-del Castillo C, Bassi C, Thayer SP, Falconi M, Mantovani W, et al. Main-duct intraductal papillary mucinous neoplasms of the pancreas: clinical predictors of malignancy and long-term survival following resection. Ann Surg 2004; 239: 678-85. [ Links ]
28. Yang AD, Melstrom LG, Bentrem DJ. Outcomes after pancreatectomy for intraductal papillary mucinous neoplasms of the pancreas: an institutional experience. Surgery 2007; 142: 529-34. [ Links ]
29. D'Angelica M, Brennan MF, Suriawinata AA, Klimstra D, Conlon KC. Intraductal papillary mucinous neoplasms of the pancreas: an analysis of clinicopathologic features and outcome. Ann Surg 2004; 239: 400-8. [ Links ]
30. Rodríguez JR, Salvia R, Crippa S, Warshaw AL, Bassi C, Falconi M, et al. Branch-duct intraductal papillary mucinous neoplasms: observations in 145 patients who underwent resection. Gastroenterology 2007; 133: 72-9. [ Links ]
31. White R, D'Angelica M, Katabi N, Tang L, Klimstra D, Fong Y, et al. Fate of the remnant pancreas after resection of noninvasive intraductal papillary mucinous neoplasm. J Am Coll Surg 2007; 204: 987-93. [ Links ]
32. Chari ST, Yadav D, Smyrk TC, DiMagno EP, Miller LJ, Raimondo M, et al. Study of recurrence after surgical resection of intraductal papillary mucinous neoplasm of the pancreas. Gastroenterology. 2002; 23: 1500-7. [ Links ]
33. Yamaguchi K, Ohuchida J, Ohtsuka T, Nakano K, Tanaka M. Intraductal papillary-mucinous tumor of the pancreas concomitant with ductal carcinoma of the pancreas. Pancreatology 2002; 2: 484-90. [ Links ]
34. Andea A, Sarkar F, Adsay VN. Clinicopathological correlates of pancreatic intraepithelial neoplasia: a comparative analysis of 82 cases with and 152 cases without pancreatic ductal adenocarcinoma. Mod Pathol 2003; 16: 996-1006. [ Links ]
35. Joseph B, Morton JM, Hernandez-Boussard T, Rubinfeld I, Faraj C, Velanovich V. Relationship between hospital volume, system clinical resources, and mortality in pancreatic resection. J Am Coll Surg 2009; 208: 520-7. [ Links ]
36. van Heek NT, Kuhlmann KF, Scholten RJ, de Castro SM, Busch OR, van Gulik TM, et al. Hospital volume and mortality after pancreatic resection: a systematic review and an evaluation of intervention in the Netherlands. Ann Surg 2005; 242: 781-8. [ Links ]
37. Wada K, Kozarek RA, Traverso W. Outcomes following resection of invasive and noninvasive intraductal papillary mucinous neoplasms of the pancreas. Am J Surg 2005; 189: 632-7. [ Links ]
38. Raut CP, Cleary KR, Staerkel GA, Abbruzzesse JL, Wolff RA, Lee JH, et al. Intraductal papillary mucinous neoplasms of the pancreas: effect of invasion and pancreatic margin status on recurrence and survival. Ann Surg Oncol 2006; 13: 582-94. [ Links ]
39. Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Surgical outcome of intraductal papillary mucinous neoplasms of the pancreas. Ann Surg Oncol 2007; 14: 3174-80. [ Links ]
40. Nara S, Shimada K, Kosuge T, Kanai Y, Hiraoka N. Minimally invasive intraductal papillary-mucinous carcinoma of the pancreas: clinicopathologic study of 104 intraductal papillary-mucinous neoplasms. Am J Surg Pathol 2008; 32: 243-55. [ Links ]
41. Nagai K, Doi R, Kida A, Kami K, Kawaguchi Y, Ito T, et al. Intraductal papillary mucinous neoplasms of the pancreas: clinicopathologic characteristics and long-term follow-up after resection. World J Surg 2008; 32: 271-8. [ Links ]
42. Terris B, Ponsot P, Paye F, Hammel P, Sauvanet A, Molas G, et al. Intraductal papillary mucinous tumors of the pancreas confined to secondary ducts show less aggressive pathologic features as compared with those involving the main pancreatic duct. Am J Surg Pathol 2000; 24: 1372-7. [ Links ]
43. Kobari M, Egawa S, Shibuya K, Shimamura H, Sunamura M, Takeda K, et al. Intraductal papillary mucinous tumors of the pancreas comprise 2 clinical subtypes: differences in clinical characteristics and surgical management. Arch Surg 1999; 134: 1131-6. [ Links ]
44. Salvia R, Crippa S, Falconi M, Bassi C, Guarise A, Scarpa A, et al. Branch-duct intraductal papillary mucinous neoplasms of the pancreas: to operate or not to operate? Gut 2007; 56: 1086-90. [ Links ]
45. Ghaneh P, Neoptolemos J. A new approach to managing intraductal papillary mucinous pancreatic neoplasms. Gut 2007; 56: 1041-4. [ Links ]
46. Tanno S, Nakano Y, Nishikawa T, Nakamura K, Sasajima J, Minoguchi M, et al. Natural history of branch duct intraductal papillary-mucinous neoplasms of the pancreas without mural nodules: long-term follow-up results. Gut 2008; 57: 339-43. [ Links ]
47. Bassi C, Sarr MG, Lillemoe KD, Reber HA. Natural history of intraductal papillary mucinous neoplasms (IPMN): current evidence and implications for management. J Gastrointest Surg 2008; 12: 645-50. [ Links ]
48. Woo SM, Ryu JK, Lee SH, Yoon WJ, Kim YT, Yoon YB. Branch duct intraductal papillary mucinous neoplasms in a retrospective series of 190 patients. Br J Surg 2009; 96: 405-11. [ Links ]
49. Tanno S, Nakano Y, Koizumi K, Sugiyama Y, Nakamura K, Sasajima J, et al. Pancreatic ductal adenocarcinomas in long-term follow-up patients with branch duct papillary mucinous neoplasms. Pancreas 2010; 39: 36-40. [ Links ]
50. Belyaev O, Seeling MH, Muller CA, Tannapfel A, Schmidt WE, Uhl W. Intraductal papillary mucinous neoplasms of the pancreas. J Clin Gastroenterol 2008; 42: 284-94. [ Links ]











 texto en
texto en