Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 no.7 Madrid jul. 2010
Utilidad de la ecoendoscopia en la estadificiación preoperatoria del cáncer gástrico: rentabilidad diagnóstica e impacto terapéutico
Usefulness of endoscopic ultrasonography in preoperative gastric cancer staging: diagnostic yield and therapeutic impact
A. Repiso1, R. Gómez-Rodríguez1, R. López-Pardo2, M. M. Lombera1, M. Romero1, A. Aranzana2, S. Abad2, R. Rodríguez-Merlo3, L. López4 y J. M. Carrobles1
Servicios de 1Aparato Digestivo, 2Cirugía General, 3Anatomía Patológica y 4Oncología Médica. Hospital "Virgen de la Salud". Toledo
Dirección para correspondencia
RESUMEN
Objetivos: valorar la rentabilidad diagnóstica de la ecoendoscopia en la estadificación locorregional del cáncer gástrico en nuestro medio y determinar el impacto de la técnica sobre el manejo terapéutico posterior.
Material y métodos: estudio retrospectivo realizado en pacientes diagnosticados histológicamente de adenocarcinoma gástrico que habían sido remitidos para la realización de ecoendoscopia. Se comparó el resultado de la técnica con el estudio final obtenido en la pieza operatoria y/o laparoscopia-laparotomía exploradora. Se comparó la decisión terapéutica inicial basada en los resultados de las técnicas diagnósticas convencionales, con el manejo terapéutico final basado en el resultado de la ecoendoscopia.
Resultados: se incluyeron en el estudio 46 pacientes con adenocarcinoma gástrico (en 36 de los cuales se disponía de exploración de referencia). La precisión diagnóstica fue del 70% para el estadio T, y para T1, T2, T3 y T4 del 100, 38, 82 y 100%, respectivamente. La sensibilidad y especificidad para diferenciar el estadio T1-2 del T3-4 fue del 94 y 85% respectivamente. No se identificaron factores relacionados con la obtención de un diagnóstico correcto en la estadificación T. La precisión diagnóstica fue del 72% para el estadio N (N0: 58%; Nx 88%). En 7 pacientes se identificó la presencia de líquido libre perigástrico, en 5 de los cuales se confirmó posteriormente la existencia de carcinomatosis peritoneal. En 13 pacientes (28%) del resultado de la ecoendoscopia se derivó una modificación en el manejo terapéutico posterior.
Conclusiones: la ecoendoscopia es una técnica útil en la estadificación locorregional del adenocarcinoma gástrico, lo que puede tener importantes implicaciones en el manejo terapéutico de estos pacientes.
Palabras clave: Cáncer gástrico. Ecoendoscopia. Tratamiento.
ABSTRACT
Objectives: to evaluate the diagnostic yield of endoscopic ultrasonography in loco-regional staging of gastric cancer in our medium and to determine the impact of this technique on later therapeutic management.
Material and methods: this is a retrospective study carried out on patients histologically diagnosed with gastric adenocarcinoma who had been referred for endoscopic ultrasonographic examination. The technique results were compared with those obtained from surgical samples and/or from exploratory laparoscopy- laparotomy. We compared the initial therapeutic decision based on conventional diagnostic techniques with the final therapeutic management based on the endoscopic ultrasonography results.
Results: forty-six patients with gastric adenocarcinoma were included in the study (a reference exploration was available in 36 cases). Diagnostic precision was 70% in stage T, while in stages T1, T2, T3 y T4 was 100, 38, 82, and 100%, respectively. The sensitivity and specificity to differentiate T1-2 from T3-4 was 94 and 85%, respectively. We could not identify factors associated with obtaining a correct diagnosis in staging T. Diagnostic precision was 72% for stage N (N0: 58%; Nx 88%). The presence of free perigastric fluid was identified in 7 cases; the presence of peritoneal carcinomatosis was later confirmed in 5 of these. The result of endoscopic ultrasonography led to a modification in the subsequent therapeutic management in 13 patients (28%).
Conclusions: endoscopic ultrasonography is a useful technique for loco-regional staging of gastric adenocarcinoma, which may have important implications in the therapeutic management of these patients.
Key words: Gastric cancer. Endoscopic ultrasonography. Treatment.
Introducción
A pesar de la disminución global de la incidencia del cáncer gástrico en la última década, continúa siendo uno de los tumores gastrointestinales más frecuentes y la segunda causa de muerte por cáncer en el mundo (1). En el momento actual sólo el tratamiento quirúrgico es potencialmente curativo en estos pacientes y la supervivencia tras la cirugía dependerá en gran medida del estadio del cáncer en el momento de la operación. Por lo tanto la precisión en la estadificación preoperatoria es el factor pronóstico más importante en la predicción de los resultados quirúrgicos y en la supervivencia, y será esencial cuando se plantea un tratamiento individualizado del cáncer gástrico según el estadio tumoral pudiendo evitar cirugías innecesarias en pacientes con enfermedad irresecable (2).
Con el desarrollo de las técnicas radiológicas, quirúrgicas y endoscópicas se dispone en el momento actual de una amplio arsenal diagnóstico sin quedar claramente establecido, en la práctica clínica, las posibilidades reales de cada técnica, ni el lugar que han de ocupar en la estadificación preoperatoria del cáncer gástrico.
Mediante ecoendoscopia es posible obtener imágenes de calidad de la pared gástrica y estructuras anatómicas perigástricas por lo que ha sido utilizada con alto rendimiento diagnóstico en la estadificación locorregional del cáncer gástrico (3-6). Sin embargo, la trascendencia que estos resultados tienen en la práctica clínica habitual ha sido motivo de debate. Mientras algunos autores no consideran imprescindible el estudio preoperatorio por ecoendoscopia pues el manejo de estos pacientes es quirúrgico independientemente del estadio locorregional (7), otros autores consideran que la información adicional que aporta la ecoendoscopia respecto a otras técnicas de imagen puede tener importantes implicaciones en el manejo terapéutico de estos pacientes (8,9).
El objetivo de nuestro estudio fue: a) valorar la rentabilidad diagnóstica de la ecoendoscopia en la estadificación locorregional del cáncer gástrico en nuestro medio; b) determinar los factores relacionados con el resultado de la técnica; y c) intentar establecer el impacto de la técnica sobre el manejo terapéutico posterior.
Material y métodos
Población de estudio
Estudio retrospectivo realizado entre los pacientes remitidos a la Unidad de Endoscopias del Servicio de Aparato Digestivo de nuestro hospital, desde enero de 2005 a enero de 2009. Incluimos en el estudio pacientes con aceptable riesgo quirúrgico en los que tras la realización de historia clínica, exploración física, estudios analíticos, endoscopia digestiva alta con toma de biopsias, radiografía simple de tórax, ecografía abdominal y TC toracoabdominal habían sido diagnosticados histológicamente de adenocarcionoma gástrico en ausencia de metástasis a distancia y fueron remitidos para la realización de ecoendoscopia. Se recogieron los datos epidemiológicos en estos pacientes y las características histológicas, localización y características endoscópicas y ecoendoscópicas de estos tumores. Fueron excluidos los pacientes en los que no se pudo recoger una historia clínica adecuada (un paciente) y aquellos en los que no se pudo realizar (dos pacientes con estenosis a nivel de cardias que impidió la progresión del ecoendoscopio) o rechazaron la realización de la ecoendoscopia (un paciente).
Estudio ecoendoscópico
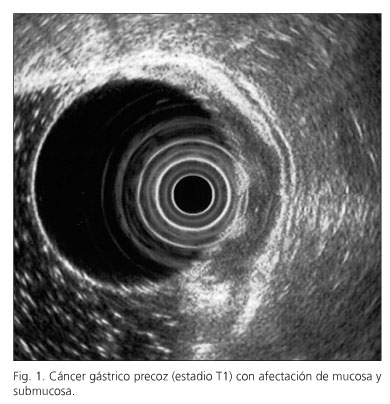
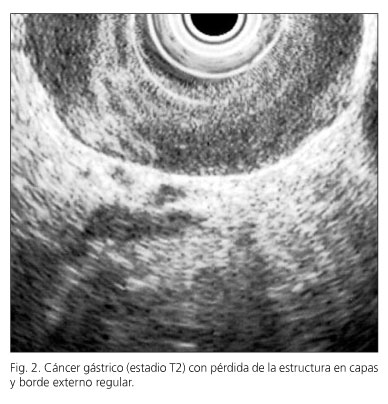
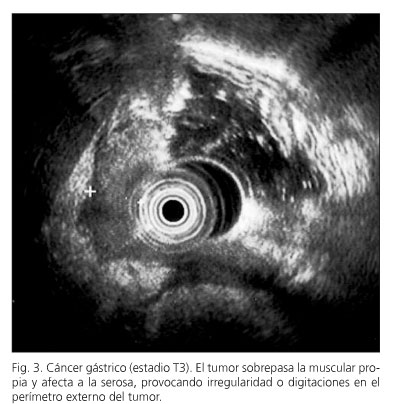
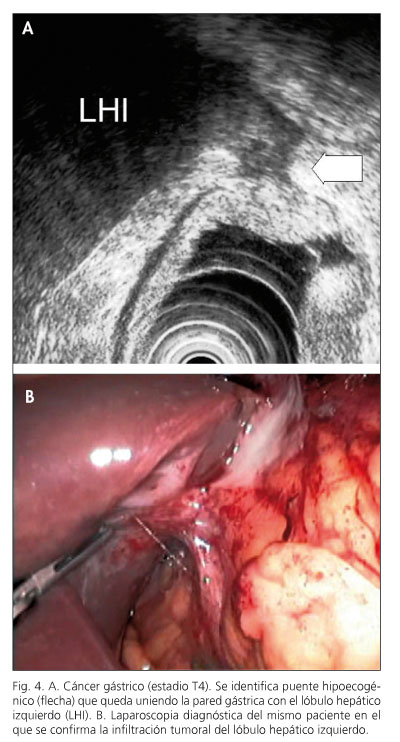
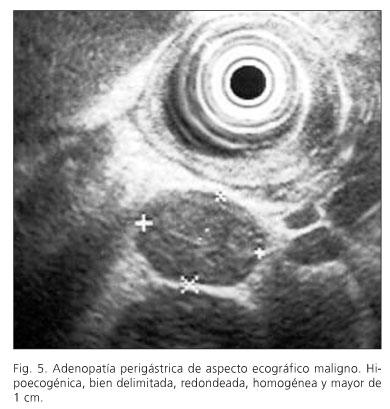
El equipo endoscópico empleado fue un ecoendoscopio Olympus modelo GF-UMQ130, utilizando frecuencias de 7,5 y 20 MHz. La exploración se realizó con el paciente en decúbito lateral izquierdo utilizando sedación consciente con midazolam o propofol. Las imágenes ecográficas de las neoplasias gástricas se obtuvieron colocando la punta del endoscopio en cuerpo y antro gástrico intentando obtener cortes ecográficos perpendiculares a la pared gástrica. Se consideraron tumores en estadio T1 aquellos con afectación exclusiva de mucosa-submucosa (Fig. 1), en estadio T2 cuando el engrosamiento contacta con la capa correspondiente a muscular propia (Fig. 2), en estadio T3 cuando el tumor sobrepasa la muscular propia y afecta a la adventicia, provocando irregularidad o digitaciones en el perímetro externo del tumor (Fig. 3) y en el estadio T4 si existe afectación de los órganos en vecindad (Fig. 4). Se consideró una adenopatía como de probable naturaleza maligna cuando se identificaron al menos dos signos ecográficos de malignidad, incluida la forma redondeada, borde bien delimitado, homogéneo y/o tamaño superior a 1 cm (Fig. 5). Cuando se identificaron adenopatías en territorios ganglionares a distancia se decidió completar la exploración con la realización de punción aspirativa (PAAF) guiada por ecoendoscopia en aquellos casos en los que se consideró que un resultado positivo para células malignas podría implicar un cambio en el manejo terapéutico de estos pacientes. En la realización de los estudios participaron 2 exploradores con al menos 3 años de experiencia realizando ecoendoscopia (AR y RGR), en la misma unidad de trabajo, con el mismo método y que conocían el resultado de las exploraciones realizadas antes de la ecoendoscopia. En todos los pacientes se obtuvo un consentimiento informado previo a la exploración endoscópica. Se comparó el resultado de la técnica con el estudio final obtenido en la pieza operatoria y/o laparoscopia-laparotomía exploradora.
Planteamiento de actuación diagnóstico-terapéutico
Todos los pacientes fueron evaluados por un grupo multidisciplinar constituido por gastroenterólogos, cirujanos generales, oncólogos y patólogos. De forma general se planteó inicialmente el tratamiento quirúrgico en pacientes con aceptable riesgo quirúrgico, tumores localizados y ausencia de afectación ganglionar extensa. En las formas localmente avanzadas en los que se sospechó la afectación de órganos en vecindad (estadio T4) y/o afectación ganglionar extensa, en ausencia de metástasis a distancia, se decidió iniciar tratamiento con quimioterapia neoadyuvante y plantear posteriormente el tratamiento quirúrgico cuando existió una respuesta significativa al tratamiento quimioterápico. Se comparó la decisión terapéutica inicial basada en los resultados de las técnicas diagnósticas "convencionales", con el manejo terapéutico basado en el resultado de la ecoendoscopia.
Estudio estadístico
Las variables cuantitativas se indican con la media ± desviación estándar. Para la comparación de porcentajes se utilizó la prueba de la Chi-cuadrado y cuando al menos más del 25% de los valores esperados era menor de 5, mediante el test de Fisher. Se consideraron estadísticamente significativos valores de p menores de 0,05. Todos los cálculos se hicieron utilizando el software estadístico SPSS (SPSS Inc., Chicago, IL).
Resultados
Se incluyeron en el estudio 46 pacientes diagnosticados de adenocarcinoma gástrico, con una edad media de 64,69 años (rango: 36-81), de los que 32 eran varones (70%) y 14 mujeres (30%). En 25 casos se trataban de lesiones ulceradas (54%). Existía afectación del cuerpo y/o fundus gástrico en 36 casos, del antro en 9 y de cuerpo y antro en un caso. Histológicamente en 15 casos eran tumores pobremente diferenciados y 31 moderadamente o bien diferenciados.
En la evaluación de la rentabilidad diagnóstica se incluyeron 36 pacientes en los que se disponía de exploración de referencia. Incluimos 34 en los que se disponía de pieza de resección quirúrgica que fue estudiada histológicamente y 2 pacientes con tumores irresecables en los que se confirmó la afectación de órganos en vecindad (estadio T4) en la laparoscopia exploradora (Fig. 4). En el análisis de la rentabilidad diagnóstica se excluyeron 2 pacientes que recibieron tratamiento con quimioterapia neoadyuvante y posteriormente fueron intervenidos quirúrgicamente. El resultado de la ecoendoscopia y el de la exploración de referencia fueron coincidentes en el 70% de los casos para el estadio T y para T1, T2, T3 y T4 en el 100, 38, 82 y 100%, respectivamente (Tabla I). La sensibilidad y especificidad para diferenciar el estadio T1-2 del T3-4 fue del 94 y 85%, respectivamente (Tabla II). No se identificaron factores relacionados con la obtención de un diagnóstico correcto en la estadificación T (Tabla III).
En 17 pacientes se identificaron adenopatías con al menos dos signos ecográficos de malignidad. La ecoendoscopia y la exploración de referencia fueron coincidentes en el 72% de los casos para el estadio N (N0: 58%; Nx 88%) (Tabla IV). El valor predictivo positivo para diagnosticar la afectación ganglionar fue del 88% (Tabla II). En 3 casos se completó la exploración realizando PAAF guiada por ecoendoscopia en adenopatías mediastínicas (2 casos) o interaortocava (un caso). El estudio citológico de las muestras obtenidas identificó la presencia de células malignas en 2 casos.
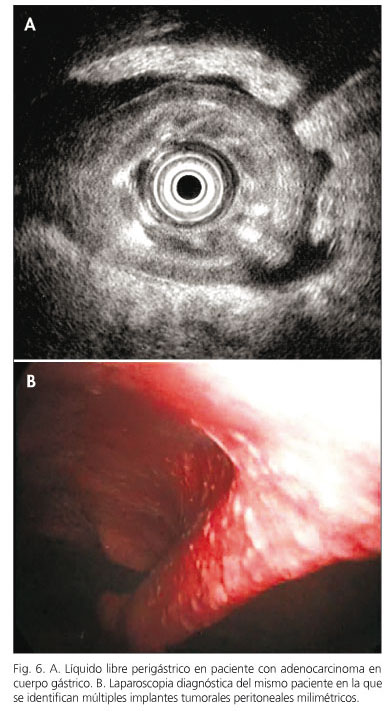
En 7 pacientes (15%) se identificó la presencia de líquido libre perigástrico, en 5 de los cuales (71%) se confirmó la existencia de carcinomatosis peritoneal mediante laparoscopia (3 casos) (Fig. 6), laparotomía exploradora (un caso) o PAAF guiada por ecoendoscopia (un caso). En este último caso se completó la exploración realizando paracentesis diagnóstica guiada por ecoendoscopia a nivel del fondo de saco de Douglas utilizando la vía transrectal (evitando de este modo la contaminación de la muestra por células tumorales si la punción se hubiese realizado transgástrica). Fue informada como positiva para células malignas. En 5 de los 39 pacientes (13%) en los que no se identificó la presencia de ascitis por ecoendoscopia se identificaron implantes peritoneales en la laparoscopia/laparotomía exploradora.
En 13 pacientes (28%) del resultado de la ecoendoscopia se derivó una modificación en el planteamiento terapéutico posterior. Incluidos 4 pacientes en los que se indicó un tratamiento paliativo en base a los hallazgos de la ecoendoscopia y la PAAF guiada por ecoendoscopia (dos casos en los que se confirmó la existencia de adenopatías metastásicas en territorios ganglionares a distancia, un paciente en el que se identificó la afectación tumoral del lóbulo hepático izquierdo, un paciente en el que se observó la presencia de ascitis y en el que posteriormente se identificaría la presencia de células tumorales en la PAAF transrectal. Dos de los cuatro pacientes en los que se inició tratamiento neoadyuvante se consiguieron rescatar para tratamiento quirúrgico con intención curativa (Tabla V).
Discusión
Clásicamente la utilidad de la ecoendoscopia en el diagnóstico de extensión locorregional de esta neoplasia ha sido demostrada en múltiples estudios (3). Así la precisión diagnóstica para el estadio T varía entre el 70 y el 90% según las series y en función de tipo de ecoendoscopio utilizado, frecuencias ecográficas y localización del tumor (cardias o resto del estómago) (8-12). Al igual que observamos en nuestros pacientes la mayor parte de los errores en la estadificación en profundidad se observan en los tumores diagnosticados por ecoendoscopia de estadio T2 (8-12), en la mayoría de las ocasiones, en nuestra serie, debidos a sobreestadificación (tumores en estadio T1 que fueron erróneamente interpretados como en estadio T2). Aunque probablemente por el reducido número de casos nosotros no identificamos factores técnicos o histológicos relacionados con estos errores diagnósticos, en otras series se describe en el caso de sobreestadificación: la inflamación, necrosis y fibrosis peritumoral que suele existir en lesiones tumorales ulceradas o la obtención de cortes ecográficos tangenciales a la pared gástrica, sobre todo en tumores localizados en antro, incisura y fundus gástrico. Los errores debidos a infraestadificación pueden deberse a la invasión microscópica en profundidad no detectable por la técnica, artefactos ecográficos en relación con contenido aéreo, moco o restos alimentarios en estómagos de retención o características anatómicas como la ausencia de serosa a nivel de curvatura menor y cara posterior de fundus por lo que tumores en esta localización pueden ser incorrectamente interpretados como T2 a pesar de la afectación transmural (8-12).
La precisión diagnóstica de la ecoendoscopia en la estadificación ganglionar del cáncer gástrico es menor que en la estadificación T y varía del 55 al 87% en las series publicadas (3). La proporción de adenopatías malignas detectadas es alta en los ganglios perigástricos localizados en curvatura menor pero menor en otras localizaciones. Los errores diagnósticos descritos en la estadificación ganglionar se han relacionado con la falta de precisión diagnóstica de las características ecográficas que deberían permitir la distinción entre adenopatías metastásicas y reactivas-inflamatorias, la frecuencia y profundidad de penetración de los transductores utilizados en ecoendoscopia, la existencia de micrometástasis a nivel ganglionar o la extensión de la linfadenectomía quirúrgica. Así cuantos más ganglios se resequen más adenopatías metástasicas de identifican y en consecuencia se darán más casos de infraestadificación con las técnicas de imagen (8-12).
Un hallazgo ecoendoscópco que resultó de gran utilidad en el manejo de los pacientes con cáncer gástrico de nuestra serie fue la presencia de líquido libre perigástrico. A este respecto recientemente se han publicado los resultados de una serie prospectiva en el que se incluyen 402 pacientes con cáncer gástrico en los que previamente no se había detectado la presencia de ascitis por TC abdominal y en los que describe la presencia de ascitis en la ecoendoscopia en 36 casos (9%), en 23 de los cuales (64%) se demostró la existencia de carcinomatosis peritoneal (13). Sin embargo, aunque la ecoendoscopia detecta pequeñas cantidades de líquido ascítico no visibles por TC abdominal, un resultado negativo no descarta la presencia de carcinomatosis peritoneal. En centros en los que la laparoscopia exploradora no se realiza en todos los pacientes con cáncer gástrico, la presencia de líquido libre perigástrico en la ecoendoscopia debería obligar a su realización (13,14).
Clásicamente en la neoplasia gástrica, a diferencia de otros tumores, la realización de una ecoendoscopia no se ha considerado imprescindible, pues después de décadas de estudios no existía ningún tratamiento neoadyuvante que hubiese demostrado ser eficaz, y el tratamiento de estos pacientes era quirúrgico, con intención curativa o paliativa, independientemente del estadio locorregional (2,7). En el momento actual, sin embargo, coincidiendo con el desarrollo de las técnicas de imagen que han permitido un diagnóstico de extensión preoperatorio más fiable y seleccionar de este modo los pacientes que se beneficiarán de los tratamientos neoadyuvantes (evitando el sobretratamiento que pudo ocurrir en estudios previos), una estrategia perioperatoria ha demostrado prolongar la supervivencia. Así, en un reciente estudio multicéntrico inglés (15) se incluyeron 503 pacientes con cáncer gástrico potencialmente resecable (estadio T2-T4 y/o N1-N3) que fueron aleatorizados para recibir tratamiento quirúrgico solo o quimioterapia perioperatoria, utilizando tres ciclos previos, a la cirugía seguido de tres ciclos adicionales tras la resección; tras un periodo de seguimiento en los pacientes del grupo de tratamiento con quimioterapia, se observó una mejora significativa en la supervivencia global (36 vs. 23%). Sin embargo, las implicaciones que estos resultados tienen sobre la estadificación por ecoendoscopia de los pacientes con cáncer gástrico es limitada, pues a excepción de los tumores en estadio T1 (cáncer gástrico precoz) en el que el planteamiento inicial sería quirúrgico o endoscópico (en casos seleccionados), la decisión de iniciar tratamiento neoadyuvante dependió de la presencia o ausencia de metástasis a distancia y no del estadio T o N. Por lo tanto, en la mayoría de los casos el resultado de la ecoendoscopia no modificó el manejo de los pacientes basado en los resultados del TC abdominal. En base a estos resultados en muchos centros el tratamiento neoadyuvante ha pasado a convertirse en la pauta de actuación habitual (16,17) y además han motivado el inicio de otros estudios en los que se están evaluando complejas pautas de actuación preopratorias en función del estadio tumoral, y al igual que lo establecido en el cáncer de recto o esofágico, sólo los pacientes con ciertos estadios se beneficiarían del tratamiento, por lo que una precisa estadificación será esencial en el manejo terapéutico (18). A este respecto la ecoendoscopia, a pesar de sus limitaciones, podría tener importantes implicaciones en el manejo terapéutico de estos pacientes pues como pudimos demostrar en nuestra serie permite distinguir con alto rendimiento diagnóstico los tumores en estadio T1-2 de aquellos con formas localmente avanzadas en estadio T3-4. A la espera de los resultados de estos nuevos trabajos, otra posible pauta de actuación, más próxima a la que venimos utilizando en nuestro medio, es reservar el tratamiento neoadyuvante para los pacientes en estadio T4 sin metástasis a distancia o con afectación ganglionar extensa, que implicaría realizar una linfadenectomía extendida y plantear posteriormente el tratamiento quirúrgico cuando existe una respuesta significativa al tratamiento quimioterápico (19). La ecoendoscopia juega un papel importante en esta decisión pues su precisión diagnóstica sigue siendo superior a la de otras técnicas de imagen en el estudio de la extensión en profundidad (11).
En conclusión, la ecoendoscopia es una técnica útil en la estadificación preoperatoria del cáncer gástrico de cuyo resultado se pueden derivar importantes decisiones en el manejo de estos pacientes. La decisión sobre la estadificación preoperatoria por ecoendoscopia en tumores potencialmente resecables deberá individualizarse en función de la experiencia, disponibilidad y la decisión de grupos de trabajo multidisciplinares que evalúen las posibles estrategias diagnóstico-terapéuticas.
 Dirección para correspondencia:
Dirección para correspondencia:
Alejandro Repiso Ortega.
Servicio de Aparato Digestivo.
Hospital "Virgen de la Salud".
Avda Barber, 30. 45004 Toledo.
e-mail: arepiso@sescam.jccm.es
Recibido: 30-12-09.
Aceptado: 26-01-10.
Bibliografía
1. Roder DM. The epidemiology of gastric cancer. Gastric Cancer 2002; 5: S5-11. [ Links ]
2. Allum WH, Griffin SM, Watson A, Colin-Jones D; Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland; British Society of Gastroenterology; British Association of Surgical Oncology. Guidelines for the management of oesophageal and gastric cancer. Gut 2002; 50: 1-23. [ Links ]
3. Puli SR, Reddy JBK, Bechtold ML, Antillon MR, Ibdah JA. How good is endoscopic ultrasound for TNM staging of gastric cancers? A meta-analysis and systemic review. World J Gastroenterol 2008; 14: 4011-9. [ Links ]
4. Habermann CR, Weiss F, Riecken R, Honarpisheh H, Bohnacker S, Staedtler C, et al. Preoperative staging of gastric adenocarcinoma: comparison of helical CT and endoscopic US. Radiology 2004; 230: 465-71. [ Links ]
5. Hizawa K, Iwai K, Esaki M, Matsumoto T, Suekane H, Iida M. Is endoscopic ultrasonography indispensable in assessing the appropriateness of endoscopic resection for gastric cancer? Endoscopy 2002; 34: 973-8. [ Links ]
6. Bhandari S, Shim CS, Kim JH, Jung IS, Cho JY, Lee JS, et al. Usefulness of three-dimensional, multidetector row CT (virtual gastroscopy and multiplanar reconstruction) in the evaluation of gastric cancer: a comparison with conventional endoscopy, EUS, and histopathology. Gastrointest Endosc 2004; 59: 619-26. [ Links ]
7. Soria MT, Fuenmayor R, Llach J. Ecoendoscopia en el diagnóstico de extension de las neoplasias digestivas. Gastroenterol Hepatol 2002; 25: 7-12. [ Links ]
8. Xi WD, Zhao C, Ren GS. Endoscopic ultrasonography in preoperative staging of gastric cancer: determination of tumor invasion depth, nodal involvement and surgical respectability. World J Gastroenterol 2003; 9: 254-7. [ Links ]
9. Ganpathi IS, So JB, Ho KY. Endoscopic ultrasonography for gastric cancer. Does it influence treatment? Surg Endosc 2006; 20: 559-62. [ Links ]
10. Tsendsuren T, Jun SM, Mian XH. Usefulness of endoscopic ultrasonography in preoperative TNM staging of gastric cancer. World J Gastroenterol 2006; 12: 43-7. [ Links ]
11. Polkowski M, Palucki J, Wronska E, Szawlowski A, Nasierowska-Guttmejer A, Butruk E. Endosonography versus helical computed tomography for locoregional staging of gastric cancer. Endoscopy 2004; 36: 617-23. [ Links ]
12. Willis S, Truong S, Gribnitz S, Fass J, Schumpelick V. Endoscopic ultrasonography in the preoperative staging of gastric cancer. Surg Endosc 2000; 14: 951-4. [ Links ]
13. Chu KM, Kwok KF, Law S, Wong KH. A prospective evaluation of catheter probe EUS for the detection of ascites in patients with gastric carcinoma. Gastrointest Endosc 2004; 59: 471-4. [ Links ]
14. Sultan J, Robinson S, Hayes N, Griffin SM, Richardson DL, Preston SR. Endoscopic ultrasonography-detected low-volume ascites as a predictor of inoperability for oesophagogastric cancer. Br J Surg 2008; 95: 1127-30. [ Links ]
15. Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355: 11-20. [ Links ]
16. Van Cutsem E, Dicato M, Arber N, Benson A, Cunningham D, Díaz-Rubio E, et al. The neo-adjuvant, surgical and adjuvant treatment of gastric adenocarcinoma. Current expert opinion derived from the Seventh World Congress on Gastrointestinal Cancer, Barcelona, 2005. Ann Oncol 2006; 17: 13-8. [ Links ]
17. Cunningham D, Oliveira J. Gastric cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2008; 19: 23-4. [ Links ]
18. De Vita F, Giuliani F, Galizia G, Belli C, Aurilio G, Santabarbara G, et al. Neo-adjuvant and adjuvant chemotherapy of gastric cancer. Ann Oncol 2007; 18: 20-3. [ Links ]
19. Kida M. EUS in gastric cancer. In: Hawes RH, Fockens P, editors. Endosonography. Philadelphia: Elsevier Inc.; 2006. p. 111-26. [ Links ]











 texto en
texto en