Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.103 no.7 Madrid jul. 2011
https://dx.doi.org/10.4321/S1130-01082011000700015
CARTAS AL EDITOR
Adenocarcinoma y linfoma gástricos sincrónicos
Synchronic gastric adenocarcinoma and lymphoma
Palabras clave: Neoplasia sincrónica gástrica. Cáncer gástrico. Linfoma gástrico.
Key words: Synchronic gastric neoplasia. Gastric adenocarcinoma. Gastric lymphoma.
Sr. Editor:
La presencia de múltiples carcinomas en estómago está descrita ampliamente en la literatura médica pero más rara es la detección sincrónica de un adenocarcinoma gástrico junto a un linfoma gástrico primario. Recientemente se ha relacionado la asociación de estos tumores sincrónicos con la infección por Helicobacter pylori (1).
Presentamos un nuevo caso en el que es un cáncer gástrico avanzado el que se halla sincrónicamente a un linfoma gástrico.
Caso clínico
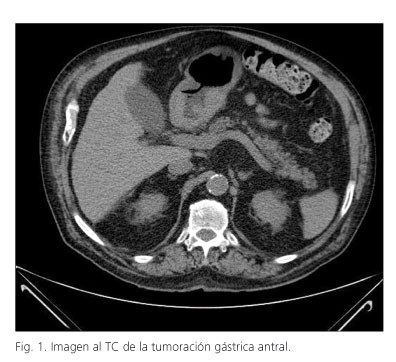
Varón de 81 años con antecedentes de hipertensión arterial, diabetes mellitus, insuficiencia renal crónica y arteriopatía periférica. Presenta síndrome tóxico y dispepsia gástrica. Estudio endoscópico que informa de neoformación a nivel antral yuxtapilórica que dificulta el paso del endoscopio y resto de la exploración dentro de la normalidad. La biopsia informa de adenocarcinoma. En la analítica destaca una anemia hipocrómica, y unos marcadores tumorales dentro de la normalidad (CEA: 3,17 µg/l, CA 19.9: 17,31 KU/l). Se realiza TAC abdominal que evidencia una tumoración gástrica que se extiende por toda la curvatura menor hasta bulbo y primera porción duodenal con adenopatías adyacentes al margen inferior. Colelitiasis. No presenta adenopatías retroperitoneales ni metástasis a distancia (Fig. 1). Se practica intervención quirúrgica que evidencia neoplasia antral extendida a cuerpo gástrico y se practica colecistectomía, gastrectomía total y esófago-yeyunostomía en Y de Roux. El estudio anatomopatológico informa de dos masas de aspecto neoplásico, con centro úlcero-necrótico y márgenes mamelonados, separadas por pared gástrica de apariencia normal en una longitud de 3 cm. La tumoración más proximal mide 65 x 55 mm constituida por una proliferación neoplásica, de patrón difuso, que infiltra la pared gástrica alcanzando el tejido adiposo circundante, y se trata de un linfoma no Hodgkin de alto grado, compatible con linfoma difuso de célula grande de inmunofenotipo B. La tumoración más distal mide 55 x 55 mm, constituida por una proliferación neoplásicas, de patrón difuso y glandular, constituida por células poligonales, con núcleo irregular, redondo, con nucléolo prominente y citoplasma amplio, eosinófilo. Dicha proliferación neoplásica infiltra la pared gástrica hasta la capa muscular propia, sin alcanzar la serosa ni el tejido adiposo. Se trata de un adenocarcinoma de patrón intestinal y difuso. Márgenes quirúrgicos de resección no afectados. Se halla infiltración neoplásica por adenocarcinoma en uno de 32 ganglios resecados, sin extensión extracapsular. El paciente sigue curso postoperatorio sin complicaciones. Valorado por el comité oncológico se desestima tratamiento adyuvante por las comorbilidades del paciente. Controlado en consultas externas a los 6 meses sigue buena evolución.
Discusión
La presencia de adenocarcinoma sincrónicamente con linfoma gástrico fue descrita por primera vez por Rabinovitch en 1952 (2) y desde entonces se han publicado un total de 56 casos en la literatura médica (1,3).
Los cambios en la mucosa circundante al linfoma gástrico primario junto a hallazgos similares en el adenocarcinoma han sugerido que estos dos tumores pueden compartir una disfunción inmunológica o una patogénesis común (4). Se cree que el H. pylori contribuye al desarrollo tanto del carcinoma como del linfoma. El desarrollo de adenocarcinoma se describe por la secuencia infección por H. pylori, gastritis crónica que predispone a metaplasia intestinal y esta a displasia y más tarde a carcinoma. El H. pylori ocasiona la aparición de agregados linfoides en la submucosa y posteriormente la proliferación monoclonal de células B en este tejido linfoide adquirido puede promover la aparición de un linfoma MALT gástrico (5-7). Por otro lado, también se ha relacionado la tendencia a presentarse neoplasias secundarias en pacientes inmunodeprimidos como explicación a que la presencia de linfoma gástrico parece aumentar el riesgo de carcinoma gástrico pero no a la inversa que en nuestro podría explicar el menor tamaño del adenocarcinoma.
En el estudio endoscópico estas dos entidades presentan características macroscópicas semejantes y pueden inducir a confusión como lesiones multifocales del linfoma. Por eso se recomienda la biopsia de todas las áreas sospechosas. Aunque no existen guías clínicas para el tratamiento de tumores gástricos sincrónicos, se considera que este se debe realizar siguiendo las pautas terapéuticas del adenocarcinoma con gastrectomía total y disección D1 o D2 (1). El tratamiento de elección de los linfomas gástricos agresivos es la quimioterapia que en nuestro caso no se ha podido realizar por las comorbilidades presentadas por el paciente.
Carles Olona Casas, Vicente Vicente Guillén, Aleidis Caro Tarragó, Jose M.a Coronas Riba y Enric Duque Guilera
Servicio de Cirugía General y del Aparato Digestivo. Hospital Universitario Joan XXIII. Tarragona
Bibliografía
1. Hamaloglu E, Topalogu S, Ozdemir A, Ozenc A. Synchoronous and metachronous occurrence of gastric adenocarcinoma and gastric lymphoma: A review of the literature. World J Gastroenterol 2006;12 (22):3564-74. [ Links ]
2. Rabinovitch J, Pines B, Grayzel D. Coexisting lymphosarcoma and ulcer-carcinoma of the stomach. Arch Surg 1952;64:185-91. [ Links ]
3. Lee JH, Bae JS, Ryu KW, Lee JS, Park SR, Kim ChG, et al. Gastric cancer patients at high-risk of having synchronous cancer. World J Gastroenterol 2006;12(16):2588-92. [ Links ]
4. Zamboni G, Franzin G, Scarpa A, Bonetti F, Pea M, Mairuzzi GM, et al. Carcinoma-like signet-ring cells in gastric mucosa-associated lymphoid tissue (MALT) lymphoma. Am J Surg Pathol 1996;20:588-98. [ Links ]
5. Ishihama T, Kondo H, Saito D, Yamaguchi H, Kuniaki S, Yokota T, et al. Clinicopatholigical studies on coexisting gastric malignant lymphoma and gastric adenocarcinoma: report of four cases and review of the Japanese literature. Jpn J Clin Oncol 1997;27(2):101-6. [ Links ]
6. Kaffes A, Hughes L, Hollinshead J, Katelaris P. Synchronous primary adenocarcinoma, mucosa-associated lymphoid tissue lymphoma and a stromal tumor in a Helicobacter pylori-infected stomach. Journal of Gastroenterology and Hepatology 2002;17:1033-6. [ Links ]
7. Chan A, Chu K, Yuen S, Leung S, Lam S, Wong J. Synchronous gastric adenocarcinoma and mucosa-associated lymphoid tissue lymphoma in association with helicobacter pylori infection: comparing reported cases between the East and West. Am J Gastroenterol 2001; 96:1922-4. [ Links ]











 texto en
texto en