Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.105 no.5 Madrid may./jun. 2013
https://dx.doi.org/10.4321/S1130-01082013000500006
Células dendríticas del intestino humano como controladoras de la inmunidad mucosa
Human intestinal dendritic cells as controllers of mucosal immunity
David Bernardo
Antigen Presentation Research Group. Imperial College London, Northwick Park & St Mark's Campus. Harrow, Reino Unido
El autor se encuentra actualmente financiado por el BBSRC del Reino Unido (WMNI P33458).
Dirección para correspondencia
RESUMEN
Las células dendríticas son las células profesionales presentadoras de antígenos más potentes que existen y, tras realizar la presentación antigénica, controlan el tipo de respuesta inmune que se establecerá (proinflamatoria/reguladora), así como su localización. Debido a su gran plasticidad y capacidad de maduración en respuesta a señales de peligro locales derivadas de la inmunidad innata, las células dendríticas son un elemento clave en la conexión entre la inmunidad innata y las respuestas de la inmunidad adaptativa. En el intestino, las células dendríticas controlan los mecanismos de la tolerancia inmunológica frente a los antígenos de la dieta y/o la flora comensal, a la vez que son capaces de iniciar una respuesta inmunológica activa en presencia de un patógeno invasor. Las células dendríticas son pues muy eficientes en controlar el delicado balance entre tolerancia/inmunidad en un ambiente tan cargado de antígenos como es el intestino, y cualquier factor que las afecte puede tener repercusiones en su funcionalidad, pudiendo en última instancia desarrollarse patologías intestinales como la enfermedad celiaca o las enfermedades inflamatorias intestinales. En esta revisión sintetizaremos nuestro conocimiento de las células dendríticas del intestino humano, su capacidad para expresar e inducir marcadores de migración, los diversos factores ambientales que modulan sus propiedades, los diferentes subtipos de células dendríticas que nos encontramos en el intestino y los problemas derivados de su estudio incluyendo sus diferentes estrategias de identificación, las diferencias entre humanos y modelos murinos y sus variaciones fenotípicas a lo largo del tracto gastrointestinal.
Palabras clave: Células dendríticas. Intestino humano. Enfermedad celiaca, Enfermedad inflamatoria intestinal. Inmunología mucosas. Marcadores de migración.
ABSTRACT
Dendritic cells are the most potent, professional antigen-presenting cells in the body; following antigen presentation they control the type (proinflammatory/regulatory) of immune response that will take place, as well as its location. Given their high plasticity and maturation ability in response to local danger signals derived from innate immunity, dendritic cells are key actors in the connection between innate immunity and adaptive immunity responses. In the gut dendritic cells control immune tolerance mechanisms against food and/or commensal flora antigens, and are also capable of initiating an active immune response in the presence of invading pathogens. Dendritic cells are thus highly efficient in controlling the delicate balance between tolerance and immunity in an environment so rich in antigens as the gut, and any factor involving these cells may impact their function, ultimately leading to the development of bowel conditions such as celiac disease or inflammatory bowel disease. In this review we shall summarize our understanding of human intestinal dendritic cells, their ability to express and induce migration markers, the various environmental factors modulating their properties, their subsets in the gut, and the problems entailed by their study, including identification strategies, differences between humans and murine models, and phenotypical variations along the gastrointestinal tract.
Key words: Dendritic cells. Human intestine. Celiac disease. Inflammatory bowel disease. Mucosal immunology. Migration markers.
Células dendríticas
Células dendríticas como presentadoras de antígenos
Las células dendríticas (CD) son las células presentadoras de antígeno (CPA) más potentes que existen. Al contrario que otras CPA, como linfocitos B o macrófagos, las CD son las únicas que pueden iniciar una respuesta inmune primaria al estimular linfocitos T näive o vírgenes y controlar el desarrollo de una respuesta inmune tolerogénica o proinflamatoria (1-6).
Los precursores de las CD migran desde la médula ósea a prácticamente todos los tejidos que existen, incluyendo la mucosa intestinal. Una vez en su destino, las CD inmaduras y sésiles son muy eficientes para capturar antígenos y procesarlos, lo que les permite muestrear su entorno (7,8). Además de ser centinelas, las CD también son sensores del sistema inmune gracias a su alta expresión de receptores de reconocimiento de patrones (RRP) como los Toll-like receptors (TLR) (9-11), así como su capacidad de activarse en presencia de un estrés inmunológico innato mediado por citocinas y/o especies reactivas de oxígeno (12,13). Las CD son pues el nexo de unión entre las respuestas inmunes innatas (no antígeno específicas) y las altamente especializadas respuestas inmunes adaptativas. Cuando las CD han captado "antígeno de peligro" a través de su RRP o bien han detectado una señal de estrés inmunológico, pierden su sensibilidad y su alta capacidad para procesar antígenos e inician una migración hacia los órganos linfoides secundarios de forma CCR7-dependiente (2,14). Durante su migración, las CD irán madurando, lo que se manifiesta en tres cambios principales o señales (15): la primera señal es una expresión aumentada en su superficie de los antígenos que han procesado gracias al aumento de las moléculas HLA. La segunda de las señales se refiere a una expresión aumentada de moléculas co-estimuladoras como CD80(B7.1)/CD86 (B7.2) (ligandos de CD28/CTLA4 en los linfocitos T) o CD40 (ligando de CD40L en los linfocitos T). La tercera señal implica un cambio en la producción de citocinas, alterándose el balance en citocinas proinflamatorias y reguladoras (1-6,15). Una vez en los tejidos linfoides secundarios, las CD habrán perdido su capacidad para capturar antígenos, pero por el contrario serán extremadamente eficientes en la presentación antigénica y estimulación de linfocitos T, verdaderos efectores de la respuesta inmunológica. La combinación en intensidad y calidad de las tres señales de la presentación antigénica determinará el tipo de respuesta inmunológica (proinflamatoria/reguladora) que adquirirán los linfocitos.
CD y marcadores de migración
Además de controlar el tipo de respuesta inmune (proinflamatoria/reguladora) que se establece frente a cada antígeno, las CD también controlan su localización (16). Previamente a ser estimulados, los linfocitos T näive expresan marcadores de migración que los dirigen a los tejidos linfoides (17). Una vez allí, y durante la presentación antigénica, las CD entregan una cuarta señal e inducen la expresión de homing markers o marcadores de migración. En concreto, las CD inducen en los linfocitos efectores los marcadores de migración apropiados para dirigirlos a los tejidos diana donde encontrarán al antígeno frente al que han sido entrenados (18-21), por lo que las respuestas inmunes son realizadas de forma tísulo-específica en lugar de sistémica.
Los mecanismos mediante los que las CD inducen marcadores de migración en los linfocitos efectores empiezan a ser dilucidados y parecen implicar, entre otros, a vitaminas liposolubles como la vitamina A y la vitamina D. La molécula 25-OHD, que se puede generar en la piel desde la vitamina D tras una activación dependiente de luz ultravioleta, induce la expresión de marcadores de migración cutáneos en los linfocitos T (22). Por su parte, las CD del intestino poseen la maquinaria enzimática necesaria para sintetizar ácido retinoico (AR), que es un metabolito derivado de la vitamina A de la dieta, que a su vez induce la expresión de marcadores de migración intestinales en los linfocitos T (23). Sin embargo, y como discutiremos más adelante, el AR no controla únicamente la capacidad de migración intestinal de los linfocitos efectores, sino que está implicado en otros muchos mecanismos de la inmunidad intestinal (24).
Células dendríticas tolerogénicas en el intestino
Mientras que el sistema inmune sistémico favorece el desarrollo de una respuesta inmune activa frente a un antígeno extraño, el sistema inmune de las mucosas funciona al revés: en un ambiente tan rico en antígenos como el intestino, el sistema inmune del intestino prima, por defecto, el establecimiento de los mecanismos de la tolerancia inmunológica (25) frente a la flora comensal y antígenos de la dieta (26). Cuando el balance inmunidad/tolerancia se encuentra alterado, el sistema inmune se puede equivocar y establecer una respuesta inmune anormal frente a la flora comensal y/o los antígenos de la dieta como sucede, respectivamente, en las enfermedades inflamatorias intestinales (EII) (27) o en la enfermedad celiaca (ECe) (28).
Las CD del intestino son claves controlando los mecanismos de la tolerancia inmunológica en un ambiente tan rico en antígenos como el intestino (29,30). En condiciones normales de ausencia de inflamación, las CD tienen un perfil regulador evitando el desarrollo de respuestas inmunes frente a los antígenos de la dieta y/o la flora comensal (29,31). La menor capacidad inmunogénica de las CD intestinales es consecuencia de varios factores. Uno de ellos es que poseen una expresión disminuida de RRP como los TLR (30), lo que les otorga una menor capacidad para detectar a las bacterias comensales en un ambiente tan cargado con antígenos bacterianos. Además, las CD del intestino tienen disminuida la segunda señal de la presentación antigénica, ya que comparadas con CD de otros órganos, en el intestino presentan una menor expresión de moléculas co-estimuladoras en su superficie junto a una capacidad fagocítica aumentada (32,33). Finalmente, la tercera señal de la presentación antigénica también se encuentra inclinada hacia una mayor producción de citocinas reguladoras, como IL-10, frente a citocinas proinflamatorias como IL-6 o IL-12 (30). En estas condiciones, las CD del intestino humano tienen pues una menor capacidad estimuladora comparada con las de otros tejidos (21), lo cual es esencial para mantener los mecanismos de la tolerancia y prevenir procesos inflamatorios en ausencia de patógenos invasores (30,34,35). Además de una capacidad estimuladora disminuida, las CD intestinales también ayudan de forma activa la tolerancia mucosa al favorecer la diferenciación de células T y células B antígeno específicas de función reguladora (36-39) y secretoras de IgA respectivamente (40-42). Por último, las CD inducen la expresión de marcadores de migración hacia el intestino (α4β7 y/o CCR9) tanto en las células B secretoras de IgA como en las células T reguladoras (40,44-46), siendo esto esencial para que los mecanismos de la tolerancia inmunológica se mantengan restringidos al intestino. La importancia de las CD controlando la tolerancia inmunológica se entiende en las EII donde existe una acumulación de CD en el colon (47). Además, estas CD tienen niveles elevados de moléculas co-estimuladoras y una mayor capacidad para secretar citocinas proinflamatorias, por lo que en lugar de linfocitos reguladores favorecen el desarrollo de linfocitos T proinflamatorios (48) que conducirán el proceso inflamatorio y la pérdida de la tolerancia inmunológica frente a la flora comensal.
Marcadores de migración e inmunidad intestinal
Marcadores de migración en el intestino
Las células T migradoras al intestino expresan el heterodímero α4β7 en su superficie (49) ya que su ligando, la molécula MAdCAM-1, se expresa en las células endoteliales de las vénulas poscapilares de la lámina propia del intestino delgado y grueso (50-52). Otra molécula que controla la migración a los tejidos intestinales es el receptor de quimiocinas CCR9. Su ligando, la molécula CCL25/ TECK, se expresa en las células epiteliales del intestino delgado (53-55) siguiendo un gradiente con su mayor expresión en el extremo proximal que disminuye progresivamente en el íleon para no ser detectable en el colon (56). Sin embargo, las moléculas que controlan este "código postal inmunológico" no parecen controlar únicamente el tejido diana de migración, sino también el tipo de célula migradora, ya que se ha descrito que los monocitos, linfocitos T y linfocitos B usan marcadores de migración diferenciados incluso cuando migran al mismo tejido (57,58). Estos mecanismos diferenciados en distintas poblaciones leucocitarias podrían permitir una especialización funcional de las respuestas inmunes en diferentes segmentos del tracto gastrointestinal.
Marcadores de migración, enfermedades inflamatorias intestinales y manifestaciones extraintestinales
La expresión de marcadores de migración en los linfocitos T y de sus ligandos tisulares mantiene localizadas las respuestas inmunes. En las EII [como colitis ulcerosa (CU) y enfermedad de Crohn (ECr)] y en la ECe existe una expresión aumentada de la molécula MAdCAM-1 en la lámina propia del intestino (59-62). Esto se refleja en una redistribución de los linfocitos T circulantes β7+ de sangre periférica hacia los compartimentos intestinales, encontrándose así una densidad elevada de linfocitos T con una capacidad aumentada para secretar citocinas proinflamatorias en la lámina propia de dichos pacientes. Por otro lado, las CD de los ganglios linfáticos mesentéricos de los pacientes con ECr tienen la capacidad de primar a los linfocitos respondedores con la molécula CCR9 (65). En estos mismos pacientes se ha descrito una expresión aumentada de su ligando CCL25/TECK en el intestino delgado (pero no en el colon), lo que permite el reclutamiento de linfocitos T CCR9+ proinflamatorios en su lámina propia.
Si bien la expresión de los marcadores de migración y sus ligandos ayuda a comprender las bases de las respuestas inmunes (tolerogénicas/proinflamatorias) en el intestino, existen evidencias para creer que también son responsables del desarrollo de las manifestaciones extraintestinales en las EII. Un ejemplo se encuentra en la población de linfocitos T-γδ, particularmente importantes en los mecanismos de la inmunidad intestinal (68-70). En condiciones normales de ausencia de inflamación, los linfocitos circulantes T-γδ presentan un patrón de migración restringido al intestino caracterizado por la expresión de la integrina β7 en su superficie y ausencia de la molécula CLA que controla la migración a los tejidos cutáneos (71). Sin embargo, en pacientes con EII que asocian manifestaciones extraintestinales como eritema nodoso existe una población aberrante T-γδ con un perfil β7-CLA+ que desaparece cuando los pacientes son tratados con esteroides y alcanzan una mejoría clínica (71). Por su parte, en los pacientes con CU que desarrollan colangitis esclerosante primaria tras una inflamación de los conductos biliares se ha descrito cómo las moléculas MAdCAM-1 y CCL25 no encuentran restringida su expresión al intestino y, por el contrario, se detectan en el hígado de dichos pacientes (72). Finalmente, algunos pacientes con ECr desarrollan una inflamación paradójica extraintestinal siguiendo un tratamiento inmunosupresor con anticuerpos anti-TNF (73). Un reciente estudio ha demostrado que el cultivo in vitro de células mononucleares de sangre periférica en presencia de infliximab (anticuerpo monoclonal anti-TNFα) induce cambios en la expresión de los marcadores de migración de los linfocitos T (74) que podrían estar implicados en el desarrollo de dicha inflamación paradójica.
Marcadores de migración en las CD
Si bien el estudio de los marcadores de migración ha estado generalmente restringido a las poblaciones linfocitarias, las CPA como las CD también expresan marcadores de migración que varían en función del tejido analizado (21) y, al igual que en el caso de los linfocitos, diferentes patologías parecen inducir cambios en sus marcadores de migración.
En los pacientes con EII activa, la mayor expresión de la molécula CCL25/TECK en el intestino (66,67) parece estar también implicada con un mayor reclutamiento de monocitos circulantes, que a su vez presentan una expresión aumentada de su ligando CCR9 (75). Por otro lado, en los pacientes con ECr restringida a diferentes tejidos (intestino delgado/intestino grueso) existen cambios en la expresión de los marcadores de migración β7, CLA y CCR9 de las CD de sangre periférica que correlaciona con el tejido afecto, sugiriéndose de nuevo una mayor infiltración de las CD en los tejidos diana (76). Dichos cambios en los marcadores de migración de las poblaciones circulantes podrían, por tanto, tener utilidad como nuevas herramientas diagnósticas mediante abordajes menos invasivos, o bien como nuevas dianas terapéuticas (16), como discutiremos a continuación.
Marcadores de migración como dianas terapéuticas
Dada la importancia de los marcadores de migración, estos se han revelado dianas terapéuticas muy interesantes en las patologías intestinales (77,78). El anticuerpo monoclonal humanizado contra la integrina a4 natalizumab se ha mostrado capaz de inducir remisión clínica y mantenerla en pacientes con ECr al bloquear el heterodímero α4β7 encargado de controlar la migración al intestino (79,80). Sin embargo, este tratamiento podría tener efectos secundarios consecuencia de que los marcadores de migración son redundantes y diferentes combinaciones de receptores de quimiocinas y diversas integrinas controlan la migración a distintos tejidos dentro del organismo humano (16,21). Pese a que no se conoce su rol detallado en estados de no inflamación, el heterodímero de integrinas α4β1 (VLA-4) regula la entrada de los linfocitos (tras su interacción con la molécula de adhesión VCAM expresada en las células endoteliales de los tejidos inflamados) en el sistema nervioso central (81). De esta manera, el natalizumab (anti α4) también se ha mostrado eficaz para tratar a los pacientes con esclerosis múltiple (82). Consecuencia de que el código sea redundante y diferentes tejidos (intestino-cerebro) compartan parte de los marcadores de migración (integrina α4), algunos pacientes con ECr o esclerosis múltiple que han sido tratados con natalizumab han desarrollado una leucoencefalopatía multifocal progresiva causada por la reactivación de infecciones latentes de polyomavirus JC. Podría ser, por tanto, que la inhibición del tráfico linfocitario constitutivo a los tejidos diana (en este caso el cerebro) afecte a la inmunovigilancia sistémica, lo que en este caso par-ticular permite el desarrollo de una infección latente (83,84). Como consecuencia de la redundancia del código, ha visto la luz (85) una nueva generación de anticuerpos monoclonales dirigidos contra el heterodímero α4β7 y algunos se han mostrado eficientes para tratar a pacientes con EII sin mostrar, aparentemente, ninguna prueba de inmunosupresión sistémica. Sin embargo, y como hemos visto en el caso de la reactivación del polyomavirus JC, estos abordajes inmunosupresores no están exentos de un cierto riesgo que desafortunadamente no se puede predecir de antemano.
Factores ambientales como moduladores en el intestino
Las CD del intestino presentan una serie de particularidades inmunológicas únicas que les permiten controlar los procesos de la tolerancia inmunológica frente a los antígenos de la dieta y/o de la flora comensal (46,87-90). Por tanto, uno podría preguntarse si estas constituyen un linaje independiente aislado de las CD de otros tejidos del organismo.
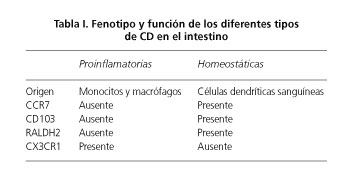
Subpoblaciones de CD en el intestino: CD103/Cx3CR1
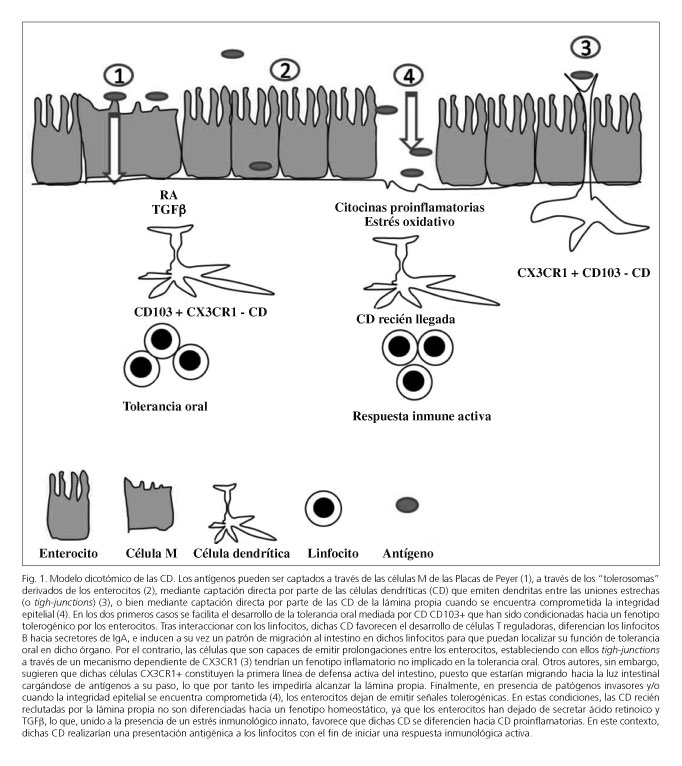
Nuevos estudios han sugerido que en la lámina propia del intestino existen, al menos, dos subpoblaciones de CD con diferentes características y marcadores de migración. Las CD del intestino podrían pues ser divididas en tolerogénicas (CD103+, CCR7+ y CX3CR1-) y proinflamatorias (CD103-, CCR7- y CX3CR1+), encargadas respectivamente de controlar los mecanismos de la tolerancia frente a los antígenos de la dieta y la flora comensal, o por el contrario disparar las respuestas inmunes frente a patógenos invasores (91-93) (Fig. 1). Además, las CD tolerogénicas poseen a su vez la maquinaria enzimática necesaria (la enzima RALDH2) para metabolizar la vitamina A y generar AR (Tabla I). En condiciones basales de ausencia de inflamación, las CD recién llegadas al intestino serían educadas por el microambiente tisular para adquirir un fenotipo regulador frente a los antígenos no patógenos. Por el contrario, en presencia de un proceso proinflamatorio y/o señales de peligro, estos facilitarían la diferenciación in situ de los monocitos hacia CD proinflamatorias (91-94). Esta dicotomía permitiría explicar la capacidad de las CD del intestino para distinguir patógenos invasores mediada por CD recién reclutadas en el intestino en este contexto de "peligro", además de mantener la tolerancia frente a la flora comensal y los nutrientes mediada por las CD que habrían sido extravasadas durante procesos no-inflamatorios y que habrían adquirido un fenotipo regulador (95).
Si bien esta hipótesis se basa principalmente en información obtenida desde modelos murinos, las células CD103+ de los ganglios mesentéricos humanos comparten varias características con las CD murinas que han dado base al modelo de las dos poblaciones de CD (65,96). De hecho, las CD CD103+ del intestino delgado humano se encuentran disminuidas en la ECe (97), mientras que en pacientes con diabetes mellitus tipo 1 no son eficaces para generar células T con fenotipo regulador por oposición a los controles sanos (98).
Sin embargo, son más las evidencias en contra de este modelo dicotómico. Aunque la mayoría de las CD de la lámina propia del intestino humano poseen un perfil regulador (21,30,33) este no se encuentra restringido a la población CD103+ (Tabla 1) que es, a su vez, minoría en el intestino humano (99). De manera similar, las CD de la lámina propia del colon humano no expresan la molécula CCR7 (100) sugiriéndose, en base a dicho modelo dicotómico (Tabla 1), que se trata de CD proinflamatorias. Sin embargo, la molécula CX3CR1 (tradicionalmente asociada con las CD "proinflamatorias" del intestino) se encuentra virtualmente ausente en las CD del colon humano (99). Por tanto, parece que el modelo de células reguladoras CD103+ y pro-inflamatorias CX3CR1+ es una sobresimplificación. Nuevas evidencias sugieren que la población CX3CR1 no sería de CD propiamente dichas sino de macrófagos (99) que, opuestamente a los tradicionalmente considerados, sí que tendrían la capacidad de migrar a los nódulos linfáticos para realizar presentación antigénica (101,102). Por otro lado, otros autores han sugerido que el rol de estas células presentadoras de antígeno CX3CR1, ya sean CD o macrófagos, estaría relacionado con un modelo de tolerancia pasivo frente a patógenos invasores. Dichas células tendrían la capacidad de migrar al lumen en presencia de una infección, a la vez que se cargan de antígenos bacterianos, limitando pues su capacidad de acceso a la lámina propia y por tanto manteniendo la tolerancia (103,104). En resumen, parece, pues, que el modelo dicotómico de CD en el intestino humano es una sobresimplificación derivada de las limitaciones existentes para el estudio de las CD, como discutiremos más adelante.
Plasticidad fenotípica de las CD intestinales
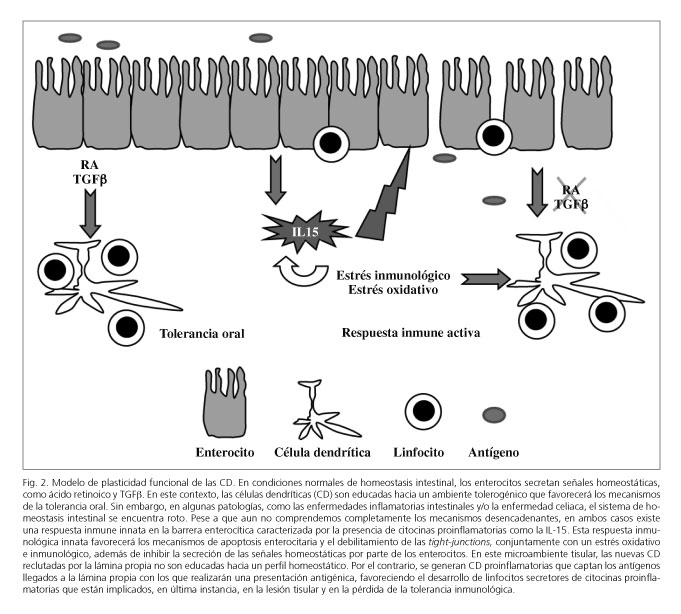
Nuevas evidencias señalan que es el propio microambiente tisular el que condiciona el fenotipo de las CD induciendo un perfil regulador una vez que abandonan el torrente sanguíneo y alcanzan el intestino. Las CD de diferentes tejidos expresan diversos marcadores de migración (21) que son dinámicos y modulados por el microambiente en el que se encuentran estas CD (21,105), como prueba de la plasticidad de las CD. Esta flexibilidad por parte de las CD parece extenderse a otras de sus propiedades, como la capacidad para polarizar diferentes tipos de respuestas inmunológicas Th1, Th2 o T reguladoras dependiendo de su exposición previa a diferentes citocinas y/o señales derivadas de la microbiota (106). De esta manera, tras ser condicionadas por el microambiente local, las CD adquieren por una parte los marcadores de migración del tejido en el que se encuentran, pero también la capacidad de imprimirlos en los linfocitos respondedores modulando así las respuestas inmunes al enviar a los linfocitos efectores de vuelta al tejido diana donde se encuentra el antígeno (18,21,107). En condiciones de ausencia de inflamación, las CD del intestino adquieren un perfil regulador tras ser expuestas a diferentes señales "sedantes" secretadas por los enterocitos (93,96,108-110) (Fig. 2) como la linfopoyetina del estroma tímico o thymic stromal lymphopoietin (TSLP), diversas citocinas reguladoras como TGF-β o IL-10 (40,44,93,96,111,112) y, especialmente, el AR.
El AR es la forma activa de la vitamina A y es central para el desarrollo de la tolerancia inmunológica. En presencia de AR, las CD adquieren la capacidad de generar células T reguladoras y células B secretoras de IgA, así como de inducir un perfil de migración restringido al intestino (40,44-46,88,113). El AR es, por tanto, esencial en los mecanismos de la tolerancia inmunológica en el intestino, y precisamente las propias CD del intestino (pero no de otros tejidos) poseen la maquinaria enzimática necesaria para la conversión de la vitamina A en AR (65,114,115). El sistema inmune del intestino, sin embargo, es dinámico: en presencia de una señal de peligro su perfil "regulador" desaparece, ya que los enterocitos dejan de secretar las señales "sedantes". Esto es en parte debido a que los propios enterocitos poseen a su vez capacidad de reconocer la presencia de bacterias invasoras. Los enterocitos están programados para secretar TGF-β y AR cuando reconocen a las bacterias en su membrana apical a través de sus PRR, pero en presencia de bacterias invasoras que han atravesado las uniones estrechas o tight-junctions estas serán reconocidas por los PRR de la membrana basolateral de los enterocitos (116-119). En este contexto, los enterocitos bloquean la secreción de las señales inhibidoras y por tanto la "sedación" de las CD. La presencia además de una respuesta inmune innata frente a las bacterias invasoras implicará la secreción de diferentes citocinas proinflamatorias y/o de especies reactivas del oxígeno con capacidad de inducir una maduración en las CD (12,13). En estas condiciones, las CD reconocen ahora a los antígenos que captan como patógenos invasores y bloquean los mecanismos de la tolerancia inmunológica para favorecer los mecanismos de una respuesta inmune activa (Fig. 2). Esta capacidad de las CD para responder de forma rápida y eficiente al microambiente en el que se encuentran les confiere la capacidad de controlar el sistema inmune y el balance entre los mecanismos de inmunidad y tolerancia.
Problemas en el estudio de las células dendríticas
Pese a su enorme relevancia controlando el tipo y localización de las respuestas inmunes, tanto en condiciones basales como durante procesos inflamatorios como ECe o las EII (21,30,33,63,64,120,121), el estudio de las CD se enfrenta a numerosos problemas. Esto es debido no solo a su escaso número, sino también a otros factores que complican su caracterización como son: a) las diferentes especies usadas para su estudio; b) la estrategia de identificación seguida; y c) el compartimento estudiado dentro del intestino.
Diferencias entre ratones y humanos
La mayoría de nuestro conocimiento actual sobre las CD se ha obtenido desde modelos murinos. Pese a que los mecanismos de inmunidad/tolerancia puedan ser los mismos en humanos y en modelos murinos, las rutas de señalización y las poblaciones celulares implicadas pueden variar enormemente (122). Un ejemplo se encuentra en la población de linfocitos Tgd del compartimento intraepitelial, que raramente supera el 20 % en humanos pero que sin embargo constituye hasta el 50 % de los linfocitos en modelos murinos (122,123). De manera similar, la molécula TLR4 es expresada por los linfocitos B murinos pero no por los humanos (122), mientras que, si bien FoxP3 parece ser un marcador válido para identificar células T reguladoras en ratones, su validez en humanos parece dudosa (124). Además, los efectos beneficiosos de la microbiota en el sistema inmune intestinal son especie-específicos (125), y los humanos y los diferentes modelos murinos también diferimos en la composición de nuestra microbiota (122).
Estrategias de identificación
Las CD del intestino y los macrófagos comparten una serie de características fenotípicas y funcionales que dificultan su correcta caracterización en el intestino (126). Además, numerosos tipos de células disponen de marcadores únicos asociados que facilitan su identificación (CD3+ para linfocitos T, CD14+ para monocitos, CD19+ para linfocitos B, etc.), pero hasta la fecha no se ha identificado un marcador que permita caracterizar a las CD.
La caracterización de las CD en tejido suele realizarse atendiendo a la expresión de HLA-DR (u otras moléculas HLA-II) y exclusión de diferentes tipos de poblaciones celulares. Sin embargo, aquí surge otro problema, ya que diferentes laboratorios usan marcadores distintos para excluir a las CD. En nuestro laboratorio identificamos las CD como HLA-DR+ CD3- CD14- CD16- CD19- CD34-, pero otros laboratorios excluyen el marcador CD14 de su cocktail y/o añaden el marcador CD56. Sin embargo, recientemente se ha caracterizado una población de CD que se encuentra aumentada en la lámina propia de los pacientes con CU (127) y que expresa el marcador CD56+. Esta población no ha sido descrita (hasta mi conocimiento) en modelos murinos, aunque cada vez se encuentran más evidencias en la literatura médica centrada en su caracterización en humanos (128-130), pese a que su papel en los mecanismos de inflamación/tolerancia (si es que tienen alguno) en el tracto gastrointestinal aun debe ser dilucidado.
El uso de diferentes estrategias de identificación de las CD por parte de diferentes grupos de investigación dificulta no solo su caracterización, sino también la comparación de resultados. Tratando de obviar el problema sobre la identificación de las CD, algunos autores se olvidan de la problemática distinción entre macrófagos y CD y, por el contrario, se centran en el estudio de CPA en los tejidos, identificadas como leucocitos con alta expresión de las moléculas HLA-II (97,120,131). Estas diferencias de caracterización permiten a su vez identificar lo que aparentemente son discrepancias en la bibliografía. Recientemente Di Sabatino y cols. (121) identificaron un subtipo de CD plasmacitoides en la lámina propia del duodeno celiaco que constituían una fuente importante de IFNα y que sería la fuente mayoritaria de CD en la lesión celiaca. Sin embargo, otros grupos no han identificado CD plasmacitoides en el duodeno celiaco (97,120,131). Estas discrepancias pueden entenderse al considerar las diferentes estrategias de identificación de las CD. Si bien Di Sabatino y cols. (121) identificaron las CD como HLA-II+ y linaje negativas, otros autores se centran en la identificación de CPA (97,120,131). Un problema radica en que las CD plasmacitoides tienen una expresión disminuida de molécula HLA-II, por lo que, aunque pueden ser identificadas siguiendo estrategias clásicas de identificación de las CD, no se encontrarían incluidas dentro del compartimento de CPA debido a su menor expresión de HLA-II (datos propios no publicados). Un artículo reciente parece señalar que esta diferente estrategia de identificación no es el origen del aparente conflicto entre laboratorios (132), lo que añade un nuevo factor de complicación al estudio de las CD procedente del procesamiento de las muestras y/o el protocolo utilizado.
Sobre cuál es la mejor estrategia de identificación de las CPA en el intestino, las diferencias entre CD y macrófagos, y a su vez los distintos subtipos de CD, este autor no puede ofrecer, lamentablemente, una respuesta única y recomienda seguir una estrategia de identificación acorde a la pregunta que se quiere contestar, pero siendo consciente de que cada abordaje de identificación ofrece limitaciones y que, seguramente, no exista un abordaje mejor que otro, sino diferentes formas complementarias de abordar un mismo problema.
Variaciones tisulares
La mayoría de nuestro conocimiento actual sobre las CD intestinales proviene del intestino grueso. Este constituye un órgano diferenciado del intestino delgado, por lo que no es de extrañar que las CD de ambos compartimentos tengan distintas propiedades inmunológicas como una expresión diferencial de CCR7 (100) o varios niveles de maduración (Mann, E.R. comunicación personal). Las variaciones en el fenotipo de las CD podrían encontrarse incluso dentro del mismo órgano. El colon ascendente y el colon descendente presentan diferencias como el riego sanguíneo, actividades enzimáticas (133,134) o diferente expresión génica en los enterocitos (135). De hecho, los tumores que afectan a ambos compartimentos han sido considerados tradicionalmente como diferentes (136) y nuevas evidencias han confirmado que se trata de entidades moleculares diferenciadas (137,138). Estas divergencias sugieren, por tanto, la presencia de diferencias biológicas en la mucosa de ambos compartimentos del colon. Confirmando este punto, si bien la molécula CCR9 se considera un marcador de migración específico al intestino delgado y ciertamente las CD del íleon terminal humano expresan dicho marcador, las CD del colon también expresan dicho marcador (99) y existe a su vez una expresión diferencial entre el colon ascendente y el colon descendente. Además, las CD de ambos subcompartimentos difieren en la expresión de moléculas implicadas en el reconocimiento de antígenos bacterianos, -marcadores de activación, marcadores de migración, producción de citocinas y capacidad estimuladora sobre los linfocitos (manuscrito en preparación). Suponer, por tanto, que las CD constituyen una única población a lo largo del intestino es otra sobresimplificación, y hemos de recordar el tejido desde el cual se han obtenido. De igual manera, hemos de ser conscientes del tejido afecto en cuestión cuando estudiamos diferentes patologías del intestino, ya que quizá las propiedades de las CD y del sistema inmune en general varíen en diferentes tejidos. De esta manera, y así como el cáncer colorrectal no es una entidad continua (137,138), quizás las EII también varíen en función del tejido afecto, por lo que podrían requerir diferentes tratamientos en función de su localización.
Conclusión
El estudio de las CD es imprescindible para comprender los mecanismos que controlan las respuestas inmunológicas en el tracto gastrointestinal, tanto en condiciones basales de ausencia de inflamación como cuando la tolerancia inmunológica se encuentra comprometida. Pese a que el estudio de las CD no es tarea sencilla y numerosos aspectos dificultan su caracterización, nuevas evidencias experimentales señalan que se está en el buen camino para desentrañar su complejidad y sus mecanismos de actuación. Cuando consigamos descifrar completamente los mecanismos mediante los cuales las CD controlan la tolerancia oral, estaremos en condiciones de entender por qué en determinadas patologías como las EII o la ECe el sistema no funciona correctamente y establece una respuesta inmunológica frente a antígenos inocuos. Pero, sobre todo, estaremos en condiciones de desarrollar nuevas terapias individualizadas y específicamente tísulo-, o incluso sub-tísulo-específicas, obviando los problemas de inmunomodulación sistémica que suelen tener asociados los pacientes con EII.
![]() Dirección para correspondencia:
Dirección para correspondencia:
David Bernardo
Antigen Presentation Research Group
Imperial College London Northwick Park and St. Mark's Campus
Level 7W St. Mark's Hospital, Watford Road
Harrow, HA1 3UJ, UK
e-mail: d.bernardo-ordiz@imperial.ac.uk
Recibido: 26-03-2013
Aceptado:02-04-2013
Bibliografía
1. Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature 1998;392:245-52. [ Links ]
2. Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000;18:767-811. [ Links ]
3. Shortman K, Liu YJ. Mouse and human dendritic cell subtypes. Nat Rev Immunol 2002;2:151-61. [ Links ]
4. Palucka K, Banchereau J. How dendritic cells and microbes interact to elicit or subvert protective immune responses. Curr Opin Immunol 2002;14:420-31. [ Links ]
5. Lipscomb MF, Masten BJ. Dendritic cells: Immune regulators in health and disease. Physiol Rev 2002;82:97-130. [ Links ]
6. ONeill HC, Wilson HL. Limitations with in vitro production of dendritic cells using cytokines. Leukoc Biol 2004;75:600-3. [ Links ]
7. Jiang W, Swiggard WJ, Heufler C, Peng M, Mirza A, Steinman RM, et al. The receptor DEC-205 expressed by dendritic cells and thymic epithelial cells is involved in antigen processing. Nature 1995;375:151-5. [ Links ]
8. Sallusto F, Cella M, Danieli C, Lanzavecchia A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: Downregulation by cytokines and bacterial products. J Exp Med 1995;182:389-400. [ Links ]
9. Benko S, Magyarics Z, Szabó A, Rajnavölgyi E. Dendritic cell subtypes as primary targets of vaccines: the emerging role and cross-talk of pattern recognition receptors. Biol Chem 2008;389:469-85. [ Links ]
10. Granucci F, Zanoni I, Ricciardi-Castagnoli P. Central role of dendritic cells in the regulation and deregulation of immune responses. Mol Life Sci 2008;65:1683-97. [ Links ]
11. Kabelitz D, Wesch D, Oberg HH. Regulation of regulatory T cells: Role of dendritic cells and toll-like receptors. Crit Rev Immunol 2006;26:291-306. [ Links ]
12. Perera PY, Lichy JH, Waldmann TA, Perera LP. The role of interleukin-15 in inflammation and immune responses to infection: implications for its therapeutic use. Microbes Infect 2012;14:247-61. [ Links ]
13. Reis e Sousa. Activation of dendritic cells: Translating innate into adaptive immunity. Curr Opin Immunol 2004;16:21-5. [ Links ]
14. Sallusto F, Schaerli P, Loetscher P, Schaniel C, Lenig D, Mackay CR, et al. Rapid and coordinated switch in chemokine receptor expression during dendritic cell maturation. Eur J Immunol 1998;28:2760-9. [ Links ]
15. Cella M, Sallusto F, Lanzavecchia A. Origin, maturation and antigen presenting function of dendritic cells. Curr Opin Immunol 1997;9:10-6. [ Links ]
16. Hart AL, Ng SC, Mann E, Al-Hassi HO, Bernardo D, Knight SC. Homing of immune cells: role in homeostasis and intestinal inflammation. Inflamm Bowel Dis 2010;16:1969-77. [ Links ]
17. von Andrian UH, Mackay CR. T-cell function and migration. Two sides of the same coin. N Engl J Med 2000;343:1020-34. [ Links ]
18. Stagg AJ, Kamm MA, Knight SC. Intestinal dendritic cells increase T cell expression of alpha4beta7 integrin. Eur J Immunol 2002;32:1445-54. [ Links ]
19. Mora JR, Bono MR, Manjunath N, Weninger W, Cavanagh LL, Rosemblatt M, et al. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature 2003;424:88-93. [ Links ]
20. Johansson-Lindbom B, Svensson M, Wurbel MA, Malissen B, Márquez G, Agace W. Selective generation of gut tropic T cells in gut-associated lymphoid tissue (GALT): Requirement for GALT dendritic cells and adjuvant. J Exp Med 2003;198:963-9. [ Links ]
21. Mann ER, Bernardo D, Al-Hassi HO, English NR, Clark SK, et al. Human gut-specific homeostatic dendritic cells are generated from blood precursors by the gut microenvironment. Inflamm Bowel Dis 2012;18:1275-86. [ Links ]
22. Sigmundsdottir H, Pan J, Debes GF, Alt C, Habtezion A, Soler D, et al. DCs metabolize sunlight-induced vitamin D3 to 'program' T cell attraction to the epidermal chemokine CCL27. Nat Immunol 2007; 8:285-93. [ Links ]
23. Iwata M, Hirakiyama A, Eshima Y, Kagechika H, Kato C, Song SY. Retinoic acid imprints gut-homing specificity on T cells. Immunity 2004;21:527-38. [ Links ]
24. von Boehmer H. Oral tolerance: is it all retinoic acid? J Exp Med 2007;204:1737-9. [ Links ]
25. Macdonald TT, Monteleone G. Immunity, inflammation, and allergy in the gut. Science 2005;307:1920-5. [ Links ]
26. Mowat AM. Anatomical basis of tolerance and immunity to intestinal antigens. Nat Rev Immunol 2003;3:331-41. [ Links ]
27. Strober W, Fuss I, Mannon P. The fundamental basis of inflammatory bowel disease. J Clin Invest 2007;117:514-21. [ Links ]
28. Sollid LM. Coeliac disease: Dissecting a complex inflammatory disorder. Nat Rev Immunol 2002;2:647-55. [ Links ]
29. Chirdo FG, Millington OR, Beacock-Sharp H, Mowat AM. Immunomodulatory dendritic cells in intestinal lamina propria. Eur J Immunol 2005;35:1831-40. [ Links ]
30. Hart AL, Al-Hassi HO, Rigby RJ, Bell SJ, Emmanuel AV, Knight SC, et al. Characteristics of intestinal dendritic cells in inflammatory bowel diseases. Gastroenterology 2005;129:50-65. [ Links ]
31. Coombes JL, Maloy KJ. Control of intestinal homeostasis by regulatory T cells and dendritic cells. Semin Immunol 2007;19:116-26. [ Links ]
32. Steinman RM, Hawiger D, Nussenzweig MC. Tolerogenic dendritic cells. Annu Rev Immunol 2003;21:685-711. [ Links ]
33. Bell SJ, Rigby R, English N, Mann SD, Knight SC, Kamm MA, et al. Migration and maturation of human colonic dendritic cells. J Immunol 2001;166:4958-67. [ Links ]
34. O'Garra A, Barrat FJ, Castro AG, Vicari A, Hawrylowicz C. Strategies for use of IL-10 or its antagonists in human disease. Immunol Rev 2008;223:114-31. [ Links ]
35. Saraiva M, O'Garra A. The regulation of IL-10 production by immune cells. Nat Rev Immunol 2010;10:170-81. [ Links ]
36. Xiao S, Jin H, Korn T, Liu SM, Oukka M, Lim B, et al. Retinoic acid increases Foxp3+ regulatory T cells and inhibits development of Th17 cells by enhancing TGF-beta-driven Smad3 signaling and inhibiting IL-6 and IL-23 receptor expression. J Immunol 2008;181:2277-84. [ Links ]
37. Benson MJ, Pino-Lagos K, Rosemblatt M, Noelle RJ. All-trans retinoic acid mediates enhanced T reg cell growth, differentiation, and gut homing in the face of high levels of co-stimulation. J Exp Med 2007; 204:1765-74. [ Links ]
38. Sun CM, Hall JA, Blank RB, Bouladoux N, Oukka M, Mora JR, et al. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J Exp Med 2007;204:1775-85. [ Links ]
39. Leithäuser F, Meinhardt-Krajina T, Fink K, Wotschke B, Möller P, Reimann J. Foxp3-expressing CD103+ regulatory T cells accumulate in dendritic cell aggregates of the colonic mucosa in murine transfer colitis. Am J Pathol 2006;168:1898-909. [ Links ]
40. Mora JR, Iwata M, Eksteen B, Song SY, Junt T, Senman B, et al. Generation of gut-homing IgA-secreting B cells by intestinal dendritic cells. Science 2006;314:1157-60. [ Links ]
41. Suzuki K, Maruya M, Kawamoto S, Sitnik K, Kitamura H, Agace WW, et al. The sensing of environmental stimuli by follicular dendritic cells promotes immunoglobulin A generation in the gut. Immunity 2010; 33:71-83. [ Links ]
42. Macpherson AJ, Uhr T. Induction of protective IgA by intestinal dendritic cells carrying commensal bacteria. Science 2004;303:1662-5. [ Links ]
43. Rodrigo Mora J, von Andrian UH. Role of retinoic acid in the imprinting of gut-homing IgA-secreting cells. Semin Immunol 2009;21: 28-35. [ Links ]
44. Strober W. Vitamin A rewrites the ABCs of oral tolerance. Mucosal Immunol 2008;1:92-5. [ Links ]
45. Mora JR, Iwata M, von Andrian UH. Vitamin effects on the immune system: Vitamins A and D take centre stage. Nat Rev Immunol 2008;8:685-98. [ Links ]
46. Denning TL, Wang YC, Patel SR, Williams IR, Pulendran B. Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses. Nat Immunol 2007; 8:1086-94. [ Links ]
47. Niess JH. Role of mucosal dendritic cells in inflammatory bowel disease. World J Gastroenterol 2008;14:5138-48. [ Links ]
48. te Velde AA, van Kooyk Y, Braat H, Hommes DW, Dellemijn TA, Slors JF, et al. Increased expression of DC-SIGN+IL-12+IL-18+ and CD83+IL-12-IL-18- dendritic cell populations in the colonic mucosa of patients with Crohn's disease. Eur J Immunol 2003;33:143-51. [ Links ]
49. Lefrançois L, Parker CM, Olson S, Muller W, Wagner N, Schön MP, et al. The role of beta7 integrins in CD8 T cell trafficking during an antiviral immune response. J Exp Med 1999;189:1631-8. [ Links ]
50. Berlin C, Berg EL, Briskin MJ, Andrew DP, Kilshaw PJ, Holzmann B, et al. Alpha 4 beta 7 integrin mediates lymphocyte binding to the mucosal vascular addressin MAdCAM-1. Cell 1993;74:185-95. [ Links ]
51. Berg EL, McEvoy LM, Berlin C, Bargatze RF, Butcher EC. L-selectin-mediated lymphocyte rolling on MAdCAM-1. Nature 1993;366:695-8. [ Links ]
52. Nakache M, Berg EL, Streeter PR, Butcher EC. The mucosal vascular addressin is a tissue-specific endothelial cell adhesion molecule for circulating lymphocytes. Nature 1989;337:179-81. [ Links ]
53. Zabel BA, Agace WW, Campbell JJ, Heath HM, Parent D, Roberts AI, et al. Human G protein-coupled receptor GPR-9-6/CC chemokine receptor 9 is selectively expressed on intestinal homing T lymphocytes, mucosal lymphocytes, and thymocytes and is required for thymus-expressed chemokine-mediated chemotaxis. J Exp Med 1999;190:1241-56. [ Links ]
54. Wurbel MA, Philippe JM, Nguyen C, Victorero G, Freeman T, Wooding P, et al. The chemokine TECK is expressed by thymic and intestinal epithelial cells and attracts double- and single-positive thymocytes expressing the TECK receptor CCR9. Eur J Immunol 2000;30:262-71. [ Links ]
55. Johansson-Lindbom B, Agace WW. Generation of gut-homing T cells and their localization to the small intestinal mucosa. Immunol Rev 2007;215:226-42. [ Links ]
56. Ericsson A, Kotarsky K, Svensson M, Sigvardsson M, Agace W. Functional characterization of the CCL25 promoter in small intestinal epithelial cells suggests a regulatory role for caudal-related homeobox (Cdx) transcription factors. J Immunol 2006;176(6):3642-51. [ Links ]
57. Mora JR. Homing imprinting and immunomodulation in the gut:role of dendritic cells and retinoids. Inflamm Bowel Dis 2008;14:275-89. [ Links ]
58. Luster AD, Alon R, von Andrian UH. Immune cell migration in inflammation:present and future therapeutic targets. Nat Immunol 2005; 6:1182-90. [ Links ]
59. Souza HS, Elia CC, Spencer J, MacDonald TT. Expression of lymphocyte-endothelial receptor-ligand pairs, alpha4beta7/MAdCAM-1 and OX40/OX40 ligand in the colon and jejunum of patients with inflammatory bowel disease. Gut 1999;45:856-63. [ Links ]
60. Arihiro S, Ohtani H, Suzuki M, Murata M, Ejima C, Oki M, et al. Differential expression of mucosal addressin cell adhesion molecule-1 (MAdCAM-1) in ulcerative colitis and Crohn's disease. Pathol Int 2002;52:367-74. [ Links ]
61. Briskin M, Winsor-Hines D, Shyjan A, Cochran N, Bloom S, Wilson J, et al. Human mucosal addressin cell adhesion molecule-1 is preferentially expressed in intestinal tract and associated lymphoid tissue. Am J Pathol 1997;151:97-110. [ Links ]
62. Di Sabatino A, Rovedatti L, Rosado MM, Carsetti R, Corazza GR, MacDonald TT. Increased expression of mucosal addressin cell adhesion molecule 1 in the duodenum of patients with active celiac disease is associated with depletion of integrin alpha4beta7-positive T cells in blood. Hum Pathol 2009;40:699-704. [ Links ]
63. Hart AL, Kamm MA, Knight SC, Stagg AJ. Quantitative and functional characteristics of intestinal-homing memory T cells: Analysis of Crohn's disease patients and healthy controls. Clin Exp Immunol 2004;135:137-45. [ Links ]
64. Hart AL, Kamm MA, Knight SC, Stagg AJ. Prospective evaluation of intestinal homing memory T cells in ulcerative colitis. Inflamm Bowel Dis 2004;10:496-503. [ Links ]
65. Jaensson E, Uronen-Hansson H, Pabst O, Eksteen B, Tian J, Coombes JL, et al. Small intestinal CD103+ dendritic cells display unique functional properties that are conserved between mice and humans. J Exp Med 2008;205:2139-49. [ Links ]
66. Papadakis KA, Prehn J, Moreno ST, Cheng L, Kouroumalis EA, Deem R, et al. CCR9-positive lymphocytes and thymus-expressed chemokine distinguish small bowel from colonic Crohn's disease. Gastroenterology 2001;121:246-54. [ Links ]
67. Saruta M, Yu QT, Avanesyan A, Fleshner PR, Targan SR, Papadakis KA. Phenotype and effector function of CC chemokine receptor 9-expressing lymphocytes in small intestinal Crohn's disease. J Immunol 2007;178:3293-300. [ Links ]
68. Bhagat G, Naiyer AJ, Shah JG, Harper J, Jabri B, Wang TC, et al. Small intestinal CD8+TCRgammadelta+NKG2A+ intraepithelial lymphocytes have attributes of regulatory cells in patients with celiac disease. J Clin Invest 2008;118:281-93. [ Links ]
69. Locke NR, Stankovic S, Funda DP, Harrison LC, TCR gamma delta intraepithelial lymphocytes are required for self-tolerance, Immunology 2006;176:6553-9. [ Links ]
70. M. Brandes, K. Willimann, B. Moser, Professional antigen-presentation function by human gammadelta T Cells. Science 2005;309:264-8. [ Links ]
71. Mann ER, McCarthy NE, Peake ST, Milestone AN, Al-Hassi HO, Bernardo D, et al. Skin- and gut-homing molecules on human circulating gamma delta T cells and their dysregulation in inflammatory bowel disease. Clin Exp Immunol 2012;170:122-30. [ Links ]
72. Eksteen B, Grant AJ, Miles A, Curbishley SM, Lalor PF, Hübscher SG, et al. Hepatic endothelial CCL25 mediates the recruitment of CCR9+ gut-homing lymphocytes to the liver in primary sclerosing cholangitis. J Exp Med 2004;200:1511-7. [ Links ]
73. Peake STC, Bernardo D, Mann ER, Al-Hassi HO, Knight SC, Hart AL. Mechanisms of action of anti-tumor necrosis factor alpha agents in Crohn's disease. Inflamm Bowel Dis 2013;19:1546-55. [ Links ]
74. Peake ST, Bernardo D, Mann ER, Al-Hassi HO, Knight SC, Hart AL. Infliximab induces a dysregulated tissue-homing profile on human T-lymphocytes in-vitro: A novel mechanism for paradoxical inflammation? J Crohns Colitis 2013;doi:pii:S1873-9946(13)00019-6. 10.1016/ j.crohns.2013.01.001 [ Links ]
75. Linton L, Karlsson M, Grundström J, Hjalmarsson E, Lindberg A, Lindh E, et al. HLA-DR(hi) and CCR9 Define a Pro-Inflammatory Monocyte Subset in IBD. Clin Transl Gastroenterol 2012;doi:10. 1038/ctg.2012.23. [ Links ]
76. Peake ST, Bernardo D, Knight SC, Hart AL. Homing marker expression on circulating dendritic cells correlates with different phenotypes of Crohn's disease. J Crohns Colitis 2012 Oct 23. pii:S1873-9946(12) 00424-2. doi:10.1016/j.crohns.2012.10.002. [ Links ]
77. Thomas S, Baumgart DC. Targeting leukocyte migration and adhesion in Crohn's disease and ulcerative colitis. Inflammopharmacology 2012;20:1-18. [ Links ]
78. Nishimura M, Kuboi Y, Muramoto K, Kawano T, Imai T. Chemokines as novel therapeutic targets for inflammatory bowel disease. Ann N Y Acad Sci 2009;1173:350-6. [ Links ]
79. Targan SR, Feagan BG, Fedorak RN, Lashner BA, Panaccione R, Present DH, et al. Natalizumab for the treatment of active Crohn's disease:results of the ENCORE Trial. Gastroenterology 2007;132:1672-83. [ Links ]
80. Ghosh S, Goldin E, Gordon FH, Malchow HA, Rask-Madsen J, Rutgeerts P, et al. Natalizumab for active Crohn's disease. N Engl J Med 2003;348:24-32. [ Links ]
81. Irani DN, Griffin DE. Regulation of lymphocyte homing into the brain during viral encephalitis at various stages of infection. J Immunol 1996;156:3850-7. [ Links ]
82. Miller DH, Khan OA, Sheremata WA, Blumhardt LD, Rice GP, Libonati MA, et al. A controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2003;348:15-23. [ Links ]
83. Langer-Gould A, Atlas SW, Green AJ, Bollen AW, Pelletier D. Progressive multifocal leukoencephalopathy in a patient treated with natalizumab. N Engl J Med 2005;353:375-81. [ Links ]
84. Khalili K, White MK, Lublin F, Ferrante P, Berger JR. Reactivation of JC virus and development of PML in patients with multiple sclerosis. Neurology 2007;68:985-90. [ Links ]
85. Pan WJ, Hsu H, Rees WA, Lear SP, Lee F, Foltz IN, et al. Pharmacology of AMG 181, a human anti-alpha(4) beta(7) antibody that specifically alters trafficking of gut-homing T cells. Br J Pharmacol 2013;169:51-68. [ Links ]
86. Feagan BG, Greenberg GR, Wild G, Fedorak RN, Paré P, McDonald JW, Treatment of ulcerative colitis with a humanized antibody to the alpha4beta7 integrin. N Engl J Med 2005;352:2499-507. [ Links ]
87. Worbs T, Bode U, Yan S, Hoffmann MW, Hintzen G, Bernhardt G, et al. Oral tolerance originates in the intestinal immune system and relies on antigen carriage by dendritic cells. J Exp Med 2006;203:519-27. [ Links ]
88. Kang SG, Lim HW, Andrisani OM, Broxmeyer HE, Kim CH. Vitamin A metabolites induce gut-homing FoxP3+ regulatory T cells. J Immunol 2007;179:3724-33. [ Links ]
89. Sánchez-Sánchez N, Riol-Blanco L, Rodríguez-Fernández JL. The multiple personalities of the chemokine receptor CCR7 in dendritic cells. J Immunol 2006;176:5153-9. [ Links ]
90. Coombes JL, Powrie F. Dendritic cells in intestinal immune regulation. Nat Rev Immunol 2008;8:435-46. [ Links ]
91. Varol C, Vallon-Eberhard A, Elinav E, Aychek T, Shapira Y, Luche H, et al. Intestinal lamina propria dendritic cell subsets have different origin and functions. Immunity 2009;31:502-12. [ Links ]
92. Bogunovic M, Ginhoux F, Helft J, Shang L, Hashimoto D, Greter M, et al. Origin of the lamina propria dendritic cell network. Immunity 2009;31:513-25. [ Links ]
93. Rescigno M. Before they were gut dendritic cells. Immunity 2009;31: 454-6. [ Links ]
94. Ráki M, Tollefsen S, Molberg Ø, Lundin KE, Sollid LM, Jahnsen FL. A unique dendritic cell subset accumulates in the celiac lesion and efficiently activates gluten-reactive T cells. Gastroenterology 2006; 131:428-38. [ Links ]
95. Laffont S, Powrie F. Immunology: Dendritic-cell genealogy. Nature 2009;462:732-3. [ Links ]
96. Iliev ID, Spadoni I, Mileti E, Matteoli G, Sonzogni A, Sampietro GM, et al. Human intestinal epithelial cells promote the differentiation of tolerogenic dendritic cells. Gut 2009;58:1481-9. [ Links ]
97. Beitnes AC, Ráki M, Lundin KE, Jahnsen J, Sollid LM, Jahnsen FL. Density of CD163+ CD11c+ dendritic cells increases and CD103+ dendritic cells decreases in the coeliac lesion. Scand J Immunol 2011;74:186-94. [ Links ]
98. Badami E, Sorini C, Coccia M, Usuelli V, Molteni L, Bolla AM, et al. Defective differentiation of regulatory FoxP3+ T cells by small-intestinal dendritic cells in patients with type 1 diabetes. Diabetes 2011; 60:2120-4. [ Links ]
99. Mann ER, Landy JD, Bernardo D, Peake ST, Hart AL, Al-Hassi HO, et al. Intestinal dendritic cells:Their role in intestinal inflammation, manipulation by the gut microbiota and differences between mice and men. Immunol Lett 2013;150:30-40. [ Links ]
100. Al-Hassi HO, Bernardo D, Murugananthan AU, Mann ER, English NR, Jones A, et al. A mechanistic role for leptin in human dendritic cell migration: Differences between ileum and colon in health and Crohn's disease. Mucosal Immunol 2012. doi:10.1038/mi.2012.113. [ Links ]
101. Cerovic V, Houston SA, Scott CL, Aumeunier A, Yrlid U, Mowat AM, et al. Intestinal CD103(-) dendritic cells migrate in lymph and prime effector T cells. Mucosal Immunol 2013;6:104-13. [ Links ]
102. Diehl GE, Longman RS, Zhang JX, Breart B, Galan C, Cuesta A, et al. Microbiota restricts trafficking of bacteria to mesenteric lymph nodes by CX(3)CR1(hi) cells. Nature 2013;494:116-20. [ Links ]
103. Arques JL, Hautefort I, Ivory K, Bertelli E, Regoli M, Clare S, et al. Salmonella induces flagellin- and MyD88-dependent migration of bacteria-capturing dendritic cells into the gut lumen. Gastroenterology 2009;137:579-87. [ Links ]
104. Nicoletti C, Arques JL, Bertelli E. CX?CR1 is critical for Salmonella-induced migration of dendritic cells into the intestinal lumen. Gut Microbes 2010;1:131-4. [ Links ]
105. Dudda JC, Lembo A, Bachtanian E, Huehn J, Siewert C, Hamann A, et al. Dendritic cells govern induction and reprogramming of polarized tissue-selective homing receptor patterns of T cells: Important roles for soluble factors and tissue microenvironments. Eur J Immunol 2005;35:1056-65. [ Links ]
106. Kapsenberg ML. Dendritic-cell control of pathogen-driven T-cell polarization. Nat Rev Immunol 2003;3:984-93. [ Links ]
107. Edele F, Molenaar R, Gütle D, Dudda JC, Jakob T, Homey B, et al. Cutting edge: Instructive role of peripheral tissue cells in the imprinting of T cell homing receptor patterns. J Immunol 2008;181:3745-9. [ Links ]
108. Rimoldi M, Chieppa M, Salucci V, Avogadri F, Sonzogni A, Sampietro GM, et al. Intestinal immune homeostasis is regulated by the crosstalk between epithelial cells and dendritic cells. Nat Immunol 2005;6:507-14. [ Links ]
109. Butler M, Ng CY, van Heel DA, Lombardi G, Lechler R, Playford RJ, et al. Modulation of dendritic cell phenotype and function in an in vitro model of the intestinal epithelium. Eur J Immunol 2006;36:864-74. [ Links ]
110. Iliev ID, Mileti E, Matteoli G, Chieppa M, Rescigno M. Intestinal epithelial cells promote colitis-protective regulatory T-cell differentiation through dendritic cell conditioning. Mucosal Immunol 2009;2:340-50. [ Links ]
111. Belardelli F, Ferrantini M. Cytokines as a link between innate and adaptive antitumor immunity. Trends Immunol 2002;23:201-8. [ Links ]
112. Ueno H, Klechevsky E, Morita R, Aspord C, Cao T, Matsui T, et al. Dendritic cell subsets in health and disease. Immunol Rev 2007;219: 118-42. [ Links ]
113. Sigmundsdottir H, Butcher EC. Environmental cues, dendritic cells and the programming of tissue-selective lymphocyte trafficking. Nat Immunol 2008;9:981-7. [ Links ]
114. Coombes JL, Siddiqui KR, Arancibia-Cárcamo CV, Hall J, Sun CM, Belkaid Y, et al. A functionally specialized population of mucosal CD103+ DCs induces Foxp3+ regulatory T cells via a TGF-beta and retinoic acid-dependent mechanism. J Exp Med 2007;204:1757-64. [ Links ]
115. Johansson-Lindbom B, Svensson M, Pabst O, Palmqvist C, Marquez G, Förster R, et al. Functional specialization of gut CD103+ dendritic cells in the regulation of tissue-selective T cell homing. J Exp Med 2005;202:1063-73. [ Links ]
116. Lee J, Mo JH, Katakura K, Alkalay I, Rucker AN, Liu YT, et al. Maintenance of colonic homeostasis by distinctive apical TLR9 signalling in intestinal epithelial cells. Nat Cell Biol 2006;8:1327-36. [ Links ]
117. Lee J, Mo JH, Shen C, Rucker AN, Raz E. Toll-like receptor signaling in intestinal epithelial cells contributes to colonic homoeostasis. Curr Opin Gastroenterol 2007;23:27-31. [ Links ]
118. Pott J, Hornef M. Innate immune signalling at the intestinal epithelium in homeostasis and disease. EMBO Rep 2012;13:684-98. [ Links ]
119. Wells JM, Rossi O, Meijerink M, van Baarlen P. Epithelial crosstalk at the microbiota-mucosal interface. Proc Natl Acad Sci U S A 2011;108(Supl. 1):4607-14. [ Links ]
120. Ráki M, Tollefsen S, Molberg Ø, Lundin KE, Sollid LM, Jahnsen FL. A unique dendritic cell subset accumulates in the celiac lesion and efficiently activates gluten-reactive T cells. Gastroenterology 2006; 131:428-38. [ Links ]
121. Di Sabatino A, Pickard KM, Gordon JN, Salvati V, Mazzarella G, Beattie RM, et al. Evidence for the role of interferon-alfa production by dendritic cells in the Th1 response in celiac disease. Gastroenterology 2007;133:1175-87. [ Links ]
122. Gibbons DL, Spencer J. Mouse and human intestinal immunity: Same ballpark, different players;different rules, same score. Mucosal Immunol 2011;4:148-57. [ Links ]
123. Leon F, Camarero C, Eiras P, Roy G. Specificity of IEL profiling in the diagnosis of celiac disease. Am J Gastroenterol 2004;99:958. [ Links ]
124. Bernardo D, Al-Hassi HO, Mann ER, Tee CT, Murugananthan AU, Peake ST, et al. T-cell proliferation and forkhead box P3 expression in human T cells are dependent on T-cell density: Physics of a confined space? Hum Immunol 2012;73:223-31. [ Links ]
125. Chung H, Pamp SJ, Hill JA, Surana NK, Edelman SM, Troy EB, et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell 2012;149:1578-93. [ Links ]
126. Pabst O, Bernhardt G. The puzzle of intestinal lamina propria dendritic cells and macrophages. Eur J Immunol 2010;40:2107-11. [ Links ]
127. Ng SC, Plamondon S, Al-Hassi HO, English N, Gellatly N, Kamm MA, et al. A novel population of human CD56+ human leucocyte antigen D-related (HLA-DR+) colonic lamina propria cells is associated with inflammation in ulcerative colitis. Clin Exp Immunol 2009; 158:205-18. [ Links ]
128. Anguille S, Lion E, Tel J, de Vries IJ, Couderé K, Fromm PD, et al. Interleukin-15-induced CD56(+) myeloid dendritic cells combine potent tumor antigen presentation with direct tumoricidal potential. PLoS One 2012;7(12):e51851. [ Links ]
129. Tel J, Smits EL, Anguille S, Joshi RN, Figdor CG, de Vries IJ. Human plasmacytoid dendritic cells are equipped with antigen-presenting and tumoricidal capacities. Blood 2012;120:3936-44. [ Links ]
130. Roothans D, Smits E, Lion E, Tel J, Anguille S. CD56 marks human dendritic cell subsets with cytotoxi potential. OncoImmunology 2013;2:1-3. [ Links ]
131. Beitnes AC, Ráki M, Brottveit M, Lundin KE, Jahnsen FL, Sollid LM. Rapid accumulation of CD14+CD11c+ dendritic cells in gut mucosa of celiac disease after in vivo gluten challenge. PLoS One 2012;7 (3):e33556. [ Links ]
132. Ráki M, Beitnes AC, Lundin KE, Jahnsen J, Jahnsen FL, Sollid LM. Plasmacytoid dendritic cells are scarcely represented in the human gut mucosa and are not recruited to the celiac lesion. Mucosal Immunol 2013;doi:10.1038/mi.2012.136. [ Links ]
133. Seitz HK, Egerer G, Oneta C, Krämer S, Sieg A, Klee F, et al. Alcohol dehydrogenase in the human colon and rectum. Digestion 1996;57:105-8. [ Links ]
134. Simrén M, Stotzer PO, Sjövall H, Abrahamsson H, Björnsson ES. Abnormal levels of neuropeptide Y and peptide YY in the colon in irritable bowel syndrome. Eur J Gastroenterol Hepatol 2003;15:55-62. [ Links ]
135. Glebov OK, Rodriguez LM, Nakahara K, Jenkins J, Cliatt J, Humbyrd CJ, et al. Distinguishing right from left colon by the pattern of gene expression. Cancer Epidemiol Biomarkers Prev 2003;12:755-62. [ Links ]
136. Benedix F, Schmidt U, Mroczkowski P, Gastinger I, Lippert H, Kube R et al. Colon carcinoma -classification into right and left sided cancer or according to colonic subsite? Analysis of 29,568 patients. Eur J Surg Oncol 2011;37:134-9. [ Links ]
137. Komuro K, Tada M, Tamoto E, Kawakami A, Matsunaga A, Teramoto K, et al. Right- and left-sided colorectal cancers display distinct expression profiles and the anatomical stratification allows a high accuracy prediction of lymph node metastasis. J Surg Res 2005;124:216-24. [ Links ]
138. Bauer KM, Hummon AB, Buechler S. Right-side and left-side colon cancer follow different pathways to relapse. Mol Carcinog 2012;51:411-21. [ Links ]











 texto en
texto en