Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.107 no.5 Madrid may. 2015
ARTÍCULO ESPECIAL
Manejo de los fármacos antitrombóticos asociados a los procedimientos endoscópicos*
Management of antithrombotic drugs in association with endoscopic procedures
Fernando Alberca de las Parras1, Francisco Marín2, Vanessa Roldán Schilling3 y Fernando Carballo Álvarez1
1Unidad de Gestión Clínica de Digestivo y 2Servicio de Cardiología. Hospital Clínico Universitario Virgen de la Arrixaca. IMIB. Murcia.
3Servicio de Hematología y Oncología Médica. Hospital Universitario Morales Meseguer. Murcia
* Este documento cuenta con el aval del Grupo de Trombosis de la Sociedad Española de Cardiología (SEC), la Sociedad Española de Endoscopia Digestiva (SEED), la Sociedad Española de Patología Digestiva (SEPD) y la Sociedad Española de Trombosis y Hemostasia (SETH).
Dirección para correspondencia
RESUMEN
Los fármacos antitrombóticos (anticoagulantes y antiagregantes) han experimentado un importante incremento de su uso derivado de los conocimientos sobre el riesgo cardiovascular. Por ello, es cada vez más frecuente encontrarnos con pacientes con estos tratamientos a los que hay que realizar procedimientos endoscópicos. En el acto de la toma de decisiones el endoscopista debe apoyarse en otros especialistas (básicamente cardiólogos y hematólogos) pues el riesgo no sólo se encuentra en las posibilidades aumentadas de sangrado, sino también en la posibilidad de trombosis ante la suspensión o variación de las dosis de dichos fármacos. Por ello es esencial conocer su farmacología, sus indicaciones y el riesgo de los procedimientos endoscópicos para poder tomar decisiones correctas. Se han aunado los esfuerzos de cuatro sociedades científicas para aportar respuestas clínicas con respecto al uso de antiagregantes y anticoagulantes, elaborando algoritmos de actuación, así como una propuesta práctica de un protocolo para las unidades de endoscopia.
Palabras clave: Fármacos antitrombóticos. Antiagregantes. Anticoagulantes. Procedimientos endoscópicos.
ABSTRACT
The use of antithrombotic drugs (anticoagulants and antiplatelets) has increased significantly with our understanding of cardiovascular risk. Encountering patients on these therapies who require an endoscopic procedure is therefore increasingly common. At decision making the endoscopist must rely on other specialists (basically cardiologists and hematologists) as risk not only lies among increased bleeding odds but also in the possibility of thrombosis following dose discontinuation or change. Understanding the pharmacology, indications, and risks of endoscopic procedures is therefore essential if sound decisions are to be made. The efforts of four scientific societies have been brought together to provide clinical answers on the use of antiplatelets and anticoagulants, as well as action algorithms and a practical protocol proposal for endoscopy units.
Key words: Antithrombotic drugs. Antiplatelets. Anticoagulants. Endoscopic procedures.
Introducción
Desde hace años la anticoagulación y la antiagregación simple o doble se han convertido en un arma terapéutica y preventiva, sobre todo en patologías cardiovasculares de alta prevalencia. Esto, unido al aumento del intervencionismo en las técnicas endoscópicas, supone un incremento del riesgo. Pero el riesgo no sólo procede de la potencial hemorragia, sino también de los riesgos trombóticos (1), no siendo aceptable que los endoscopistas obviemos los mismos.
Existen varias guías y recomendaciones de las sociedades científicas para el manejo de dichas situaciones (2-8) y se han demostrado incluso beneficios secundarios tanto en ahorro económico como en la incidencia de trombosis cuando se siguen dichas recomendaciones (9).
En 2010 se publicó una primera versión española de esta guía (6). Sin embargo, la aparición de nuevos fármacos y de datos importantes en la literatura obliga a revisarla y a plantear una versión actualizada que además ha buscado el consenso con el Grupo de Trombosis de la Sociedad Española de Cardiología y la Sociedad Española de Trombosis y Hemostasia.
De todas formas se ha analizado el bajo seguimiento que se ha hecho de las guías y su aplicabilidad (10,11), lo que obligaría a desarrollar guías menos académicas pero más prácticas pues quizá la aplicación de los criterios de reintroducción precoz de los fármacos se plantea por cardiólogos (12) y esto condiciona el seguimiento de los gastroenterólogos ante el miedo de hemorragias precoces.
En el presente documento se pretende resumir la evidencia disponible y analizar los nuevos fármacos introducidos en el mercado, adoptando un formato de preguntas clínicas que pueda ayudar al gastroenterólogo en la toma de decisiones.
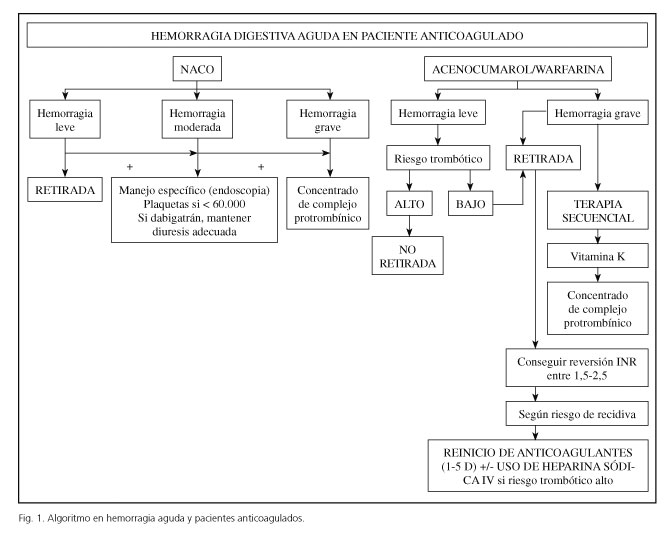
¿Qué actitud será la apropiada ante el sangrado digestivo agudo en pacientes que toman anticoagulantes o antiagregantes?
Como en cualquier situación en medicina la toma de decisiones depende del riesgo y la gravedad. En pacientes de alto riesgo trombótico (por ejemplo, en prótesis mitrales) y hemorragias leves no tiene sentido suspender la anticoagulación, sino que se pueden plantear medidas farmacológicas y endoscópicas, y dejar la reversión en un segundo plano.
De forma general los anticoagulantes deben ser cesados inmediatamente si la hemorragia es grave. En el caso de que no tenga criterios de gravedad la actitud dependera del riesgo trombotico del paciente, y se pueden iniciar los siguientes metodos terapeuticos de forma secuencial y en paralelo a la técnica endoscopica resolutiva (3,13) (Fig. 1).
1. Vitamina K1 i.v. (fitomenadiona), 10 mg (una ampolla) en 100 ml de suero fisiologico o suero glucosado 5%: 10 ml en 10 minutos (1 mg/10 min) y luego el resto en 30 minutos. Su efecto comienza en 6 horas y dura menos de 12 horas.
2. Plasma fresco, de 10 a 30 ml/kg; a las 6 horas se puede repetir la mitad de la dosis, ya que la vida media de los factores es de 5 a 8 horas. Actualmente las guias no recomiendan el uso de plasma fresco para revertir la anticoagulacion salvo que sea la unica arma terapeutica disponible, no siendo tampoco un arma aceptada en la expansion plasmatica.
3. Concentrado de complejo protrombinico asociado a factor IX (BERIPLEX 500 U.I.®, OPTAPLEX®, PROTHROMPLEX IMMUNO TIM 4 600 U.I.®): equivale a 500 ml de plasma. La dosis se calcula segun la siguiente formula: (Tiempo de protrombina deseado - obtenido) x kg peso x 0,6. Puede ser trombogenico.
4. Factor VII recombinante activado (Novoseven®): 90 μg/kg en bolus lento (amp. de 2 ml = 1,2 mg). Su efecto aparece a los 10 a 30 minutos de la administracion y dura 12 horas. Normaliza el tiempo de protrombina y corrige los defectos de funcion plaquetar. Es muy trombogenico y su uso esta indicado actualmente solo en pacientes hemofilicos con inhibidor, en hemofilia adquirida y en deficits congenitos graves de FVII. Estos dos ultimos farmacos no se administran juntos.
Se utilizarán estas medidas hasta que el INR se estabilice entre 1,5 y 2,5 y cese el sangrado.
El riesgo de sangrado en pacientes que toman anticoagulantes es de 6,5 veces mayor que los que no lo toman (14).
Desde el punto de vista práctico, y en una situación de emergencia, la actitud correcta es la aplicación inicial de concentrado de complejo protrombínico pues es el que revierte el problema de la forma más inmediata.
Con los nuevos anticoagulantes (NACO) el planteamiento cambia discretamente pues ni la vitamina K ni el plasma fresco han demostrado su eficacia (15). La actitud dependerá, como es lógico, de la gravedad de la hemorragia y se debe tener especial cuidado con la función renal sobre todo en pacientes con dabigatrán, pues prolonga su efecto anticoagulante. Algo semejante ocurre con el apixabán y el rivaroxabán en la insuficiencia hepatocelular.
La suspensión de los antiagregantes y los AINE no va a cambiar la historia natural pues su efecto sobre la hemostasia se va a mantener algunos días, aunque se debe tener en cuenta si estamos ante lesiones que previsiblemente no van a cicatrizar con rapidez. No se debe olvidar que la aspirina y los AINE pueden ser así mismo la causa de la hemorragia. En cualquier caso su efecto puede ser revertido parcialmente con la transfusión de plaquetas frescas si la gravedad del sangrado lo aconseja.
¿Qué alteraciones en la coagulación deben tenerse en cuenta ante la realización de técnicas endoscópicas y cómo se pueden corregir? (Tabla I)
Ante casos extremos (menos de 10.000 plaquetas, INR mayor de 6,...) y con una hemorragia activa, debemos corregir dichas alteraciones antes de realizar la técnica endoscópica pues al hacerlo puede cesar el sangrado y se podría evitar la misma y las complicaciones secundarias que pudieran derivarse.
En los pacientes que presentan trombocitopenia la actitud depende del tipo de procedimiento: en los procedimientos de riesgo alto es necesario que la cifra de plaquetas sea superior a 50.000/μl; las de bajo riesgo se pueden realizar en pacientes con plaquetas > 20.000/μl. La corrección de déficit de plaquetas se realiza de forma programada, infundiendo durante la técnica endoscópica y en el tramo previo inmediato. Es suficiente incrementar la cuenta de plaquetas entre 40.000 a 50.000/ mm3. Cada unidad de plaquetas aumenta el recuento en 5.000 a 10.000 por mm3 y la dosis es de 1 U/10 kg de peso. En caso de refractariedad a plaquetas con manifestaciones de sangrado grave se recomienda factor VIl activado recombinante (rVlla) (Novoseven®) con efecto hemostático en pacientes con trombocitopenia grave y trombocitopatías, a una dosis de 90 a 150 µg/kg cada dos horas por vía intravenosa, hasta controlar el sangrado.
La actividad de protrombina menor de 50% (vs. INR > 1,4) se encuentra de forma habitual en las hepatopatías crónicas, déficits de factores VII y X, así como el uso de anticoagulantes orales. En este caso se aplican las mismas pautas comentadas previamente en los pacientes anticoagulados. En términos generales, sólo suele ser necesario corregir aquellos déficits de FVII y FX severos (< 10%).
La alteración del tiempo de tromboplastina parcial activado (PTTA) se mide como una prolongación respecto al PTTAtr. Se puede ver en el uso de heparina sódica i.v. (cada vez más en desuso) y en algunos pacientes con HBPM. En el caso de la heparina sódica, el TTPA se normaliza al retirar la misma en el plazo de 4 a 6 horas. Sin embargo, si queremos por situación de urgencia una reversión más rápida, se utilizará el sulfato de protamina. En el caso de la HBPM, el efecto suele desaparecer entre las 12-24 h y la normalización del TTPA puede tardar algo más. Para las HBPM la utilidad de la protamina es limitada. También se puede ver alargamiento del TTPA en déficits factoriales (hemofilia A/B/C) y ante la presencia de un anticoagulante lúpico.
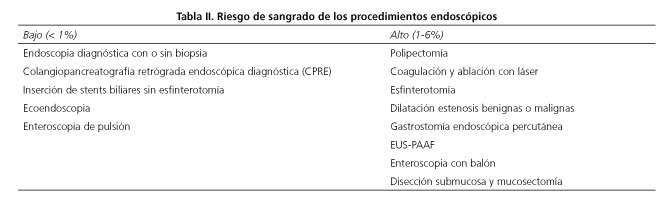
¿Qué técnicas endoscópicas se consideran de mayor riesgo de sangrado?
El riesgo de sangrado se ha estratificado por consenso de expertos, y así se indica en guías clínicas (2) y manuales, estableciendo dos niveles de riesgo (Tabla II). Estando de acuerdo básicamente en esta clasificación es importante plantear que podríamos aumentar la estratificación del riesgo pues no es lo mismo una esfinterotomía endoscópica en un paciente pluripatológico que la extirpación de un pólipo pediculado. Por ello es importante que siempre la opinión del endoscopista se tenga en cuenta sobre todo tras el procedimiento, planteando plazos de reintroducción de los antitrombóticos.
- Colonoscopia: por sí misma no es una técnica que aumente el riesgo de sangrado en pacientes con problemas de coagulación.
- Biopsias: el riesgo de hemorragia en biopsias es muy raro, de aproximadamente el 1‰ (16).
- Polipectomía: el riesgo de sangrado mayor de la polipectomía en varias series amplias oscila entre el 0,05 y el 1%, si bien puede ser de hasta el 4,3% en pólipos mayores de 1 cm y del 6,7% en mayores de 2 cm (17-19). Parece ser que dicho riesgo aumenta con el tamaño mayor de 2 cm de los pólipos y se ha detectado que sangran más los pediculados que los sésiles, por lo que en pacientes con problemas de coagulación es aconsejable asociar una técnica que disminuya el riesgo como el uso de adrenalina profiláctica, el endo-loop o lazo desechable y los endoclips (19).
Existen dos tipos de sangrado: inmediato, cuando no se coagulan bien los vasos nutricios; y tardío, entre 1 y 14 días, más grave; esto se debe tener en cuenta antes de reintroducir los antiagregantes.
En pacientes antiagregados se ha analizado muy pobremente su papel en el sangrado digestivo; en un estudio en animales de experimentación, al realizar lesiones de 7 mm en colon, se demostró un aumento del tiempo de sangrado en los tratados con aspirina frente a los no tratados (155 segundos vs. 169 segundos - p < 0,05) (20); así mismo se ha encontrado un aumento del sangrado en los puntos de biopsia en pacientes tratados con aspirina frente a aquellos controles o con AINE (21). Sin embargo estos estudios experimentales no han encontrado traducción clínica en la literatura cuando se trata de su aplicación en pacientes sometidos a técnicas endoscópicas.
La aspirina y los AINE no han demostrado que aumenten el riesgo de sangrado ante polipectomías, aunque se trata de estudios retrospectivos o limitados en su análisis y fueron la base para la guía clínica de la ASGE y la europea, la cual no recomienda la retirada de los antiagregantes previa a las técnicas endoscópicas (22). Sin embargo, uno de los estudios, prospectivo, aunque no presenta un aumento de las complicaciones sí muestra trazas de sangrado en heces hasta en un 6,3% de los pacientes frente a un 2,1% en los placebos (23). Se ha analizado específicamente la complicación más importante, que es el sangrado tardío en un estudio de casos control, confirmando que no existe un aumento del sangrado en el subgrupo que toma aspirina frente al placebo, pero no se analizó el uso de aspirina más allá de 3 días después de la técnica, habiéndose descrito episodios de sangrado hasta 19 días después (24). Por ello, algunos autores recomiendan la retirada de los antiagregantes de 4 a 7 días antes de las técnicas de riesgo y su reintroducción a los 7 días si se ha puesto por prevención secundaria o, si se trata de prevención primaria a los 14 tras polipectomía (25).
En pacientes anticoagulados el riesgo de hemorragia postpolipectomía es mayor, incluso aunque se hayan interrumpido previamente al procedimiento (2,6% vs. 0,2%, p = 0.005) (26). En un amplio registro de 120.886 procedimientos en 95.807 pacientes sólo se detectó un 2% de sangrado en pacientes con heparina suspendida (27). En otro trabajo sólo se describen 3 episodios de sangrado en 225 polipectomías en 123 pacientes anticoagulados a los que se había quitado la anticoagulación previamente (28). Recientemente se ha publicado un trabajo en el que extirpan pólipos menores de 10 mm en 70 pacientes en tratamiento con acenocumarol y aprecian tasas de sangrado mayores en el grupo tratado con asa caliente frente al tratado con asa fría, tanto en sangrado precoz (23 vs. 5,7%) como tardío (14 vs. 0%) (29).
CPRE y esfinterotomía. La incidencia de hemorragia se sitúa entre el 2,5 y el 5% (30). Los diferentes estudios definen la anticoagulación como claro factor de riesgo para el sangrado. Con respecto a la antiagregación sólo dos estudios retrospectivos (31,32) han analizado dicho efecto, con resultados no concluyentes como se plantea en la guía clínica de la sociedad americana, pero con un riesgo para el sangrado agudo en uno de ellos (32) del 9,7% vs. 3,9% (AAS vs. control, p < 0,001) y para el sangrado diferido del 6,5% vs. 2,7% (p = 0,04), lo cual sugiere que salvo en situaciones de urgencia es deseable la retirada al menos 7 días antes de la técnica. La esfinteroplastia con balón se ha propuesto como una técnica alternativa en pacientes con necesidad de apertura urgente de la vía biliar y con alteraciones de la coagulación (33), así como el uso de prótesis biliares sin esfinterotomía de forma transitoria.
Enteroscopia. La técnica simple no parece suponer un riesgo, pero si se plantea como técnica terapéutica e intervencionista se debe enfocar como una técnica de riesgo, ya que hasta en el 64% de los casos se realiza terapéutica (34).
Disección endoscópica submucosa (DES). En un trabajo retrospectivo recientemente publicado en pacientes sometidos a 1.166 DES se analiza el sangrado tardío y se demuestra que el uso de fármacos antitrombóticos es un factor independiente de riesgo para ello, siendo mayor ante el uso de dos fármacos (aunque sin significación estadística) (35).
Gastrostomía endoscópica percutánea (PEG). Existen varios trabajos que analizan de forma retrospectiva el papel de los fármacos antitrombóticos en este procedimiento, sin detectar un aumento de riesgo de sangrado ante el uso de aspirina y clopidogrel, e incluso ante el uso concomitante de ambos (36).
¿Cuáles son los principales antiagregantes comercializados en españa?
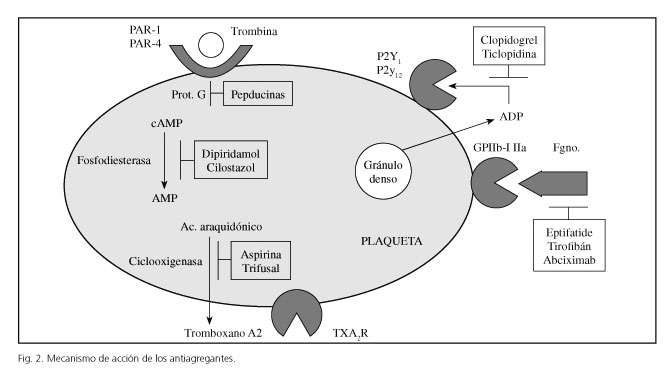
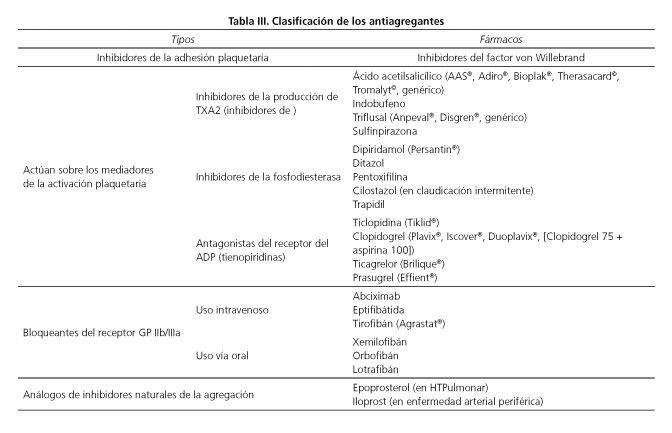
Los antiagregantes son fármacos que actúan inhibiendo la función de las plaquetas a diferentes niveles según vemos en la figura 2. Su clasificación depende de su mecanismo de acción (Tabla III).
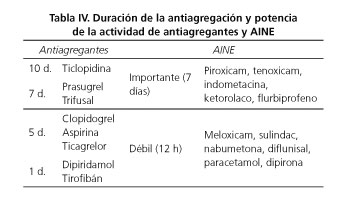
Existe un amplio espectro de acción y su efecto antiagregante y la duración del mismo parecen ser diferentes según cada uno (Tabla IV).
Un factor a tener en cuenta es la asociación a antiinflamatorios no esteroideos (AINE), que pueden potenciar el efecto antiagregante.
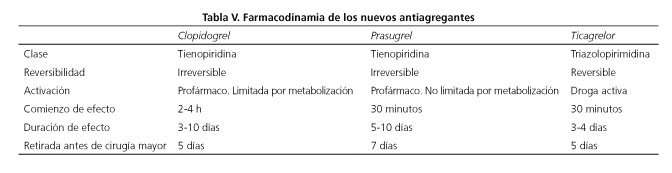
Los nuevos bloqueantes de receptores de ADP son la llave en la prevención del síndrome coronario agudo, principalmente tras la colocación de stents. Desde el punto de vista del digestólogo debemos saber que su efecto antiagregante es inmediato y mayor que el de la aspirina y que debemos suspenderlos entre 5 y 7 días antes de los procedimientos de alto riesgo (37) (Tabla V).
¿Cuáles son las principales indicaciones de los antiagregantes?
Los gastroenterólogos debemos conocer estas indicaciones así como la trascendencia que para los enfermos tiene la retirada de un fármaco que ha sido correctamente indicado (8).
Dichas indicaciones son (38):
- IAM con o sin elevación de ST: doble antiagregación (DA), aspirina más clopidogrel (o prasugrel o ticagrelor), durante 12 meses.
- Angina inestable o IAM sin elevación de ST que no necesitan coronariografía: DA entre 1 y 12 meses.
- Colocación de stent metálico: DA hasta 12 meses.
- Colocación de stent recubierto de fármacos antiproliferativos: DA durante 12 meses.
- Tras fibrinólisis (hasta 12 meses).
- Enfermedad coronaria estable: sólo aspirina (clopidrogrel en intolerantes a aspirina).
- Prevención primaria de cardiopatía en pacientes de riesgo: no precisan doble antiagregación, sólo aspirina o clopidogrel, y puede suspenderse sin riesgo.
- IAM que no han sido sometidos a tratamiento de reperfusión (por lo menos 1 mes e idealmente hasta 12 meses).
- Ictus isquémico asociado a arteriosclerosis de gran vaso y enfermedad de pequeños vasos (aspirina, cilostazol o clopidogrel) (39).
¿Cuál es el riesgo de suspender un tratamiento antiagregante bien indicado?
La suspensión de la doble antiagregación (aspirina + clopidogrel) precozmente tiene un riesgo de trombosis del stent del 29% (8-30%). La interrupción de la doble antiagregación después del implante de un stent incrementa el riesgo de trombosis subaguda del stent con efecto sobre la mortalidad entre un 15 y un 45% en un mes (40). En la profilaxis secundaria tras IAM el riesgo es mayor (x 3 veces) ante la retirada en los primeros 14 días. También aumenta el riesgo en los 3 días siguientes a la angioplastia con balón (41).
¿Son iguales todos los antiagregantes en su poder antiplaquetario y en elriesgo de sangrado secundario? ¿todas las dosis de los antiagregantes se comportan igual?
La aspirina no contraindica la realización de ningún procedimiento diagnóstico ni terapéutico (7).
No se han encontrado diferencias entre la dosis de aspirina de 100 y 300 mg en cuanto a su poder antiagregante plaquetario; tan sólo tiene cierto mayor poder antiagregante la dosis de 300 mg fraccionada en tres tomas diarias de 100 mg, por lo que no se justica manejar de forma diferente a los pacientes según la dosis que tomen (42).
No existen estudios prospectivos y aleatorizados en cirugía no cardiaca que evalúen el riesgo de hemorragia quirúrgica asociada al clopidogrel sólo o con aspirina en pacientes portadores de stent, y sólo se ha descrito un aumento de sangrado al asociar a dosis de aspirina mayores de 200 mg.
Parece ser que ticagrelor y prasugrel tienen un mayor poder antiplaquetario incluso que clopidogrel, por lo que el riesgo hemorrágico de los nuevos antiagregantes sería mayor.
En vista de estos datos, aunque con baja evidencia, y para pruebas de alto riesgo de sangrado, se ha definido que se deben retirar el clopidogrel y el ticagrelor 5 días antes y el prasugrel 7 días antes (43).
¿Es la antiagregación, simple o doble, una contraindicación para alguna técnica endoscópica?
No existen datos convincentes que conviertan la antiagregación simple en una contraindicación absoluta para ninguna técnica endoscópica (7), aunque probablemente habría que individualizar entre la AAS, para la que con ciertas garantías se puede aplicar este algoritmo, y por otro lado los nuevos antiagregantes, que quizá precisen una evaluación más cuidadosa.
En cuanto a la antiagregación doble no hay trabajos que analicen su efecto, aunque parece razonable con los datos existentes el intentar evitar realizar intervencionismo mientras sea necesario su uso. En cualquier caso la decisión se hará basándose en el riesgo endoscópico y trombótico: si el endoscópico es bajo, se hará con ambos fármacos; si es alto, dependerá del riesgo trombótico pues si ese es bajo, se suspenderá el clopidogrel y se hará el procedimiento con aspirina; si es alto se intentará retrasar el procedimiento endoscópico o se puede valorar utilizar terapia puente con inhibidores de la glicoproteína IIb-IIIa.
¿Cuál será la pauta práctica para la reversión de la antiagregación?
En todos los casos lo deseable es retrasar la terapéutica hasta que el riesgo trombótico sea el menor posible; en los casos de doble antiagregación es posible suspender el clopidogrel 7 días antes y mantener la aspirina según la pauta prevista.
Diferentes guías (6) han hecho propuestas para el manejo de los antiagregantes que se basan principalmente en definir si la indicación es urgente o no y en valorar la indicación del antiagregante: en las indicaciones primarias y secundarias, al considerar el riesgo trombótico muy bajo, se podrá suspender la aspirina; en cualquier otro caso se mantendrá.
En un documento de consenso del American College de Cardiología con el American College de Gastroenterología se establecen unos periodos de tiempo desde el momento en que se realiza la coronariografía para colocar un stent o hacer una angioplastia y decidir la actitud a seguir con los antiagregantes. Establecen en 14 días el punto de corte para no hacer procedimientos electivos o realizarlos sólo con aspirina a partir de este momento con respecto a la angioplastia, en 30 a 45 días para el stent metálico y en un año para el stent recubierto (15).
Está en discusión la indicación de la terapia puente con HBPM en pacientes antiagregados a los que hay que hacer una endoscopia con un procedimiento añadido. No existe evidencia acerca de su beneficio (40) y parece claro que no protege de forma efectiva ante la trombosis en pacientes con stents coronarios, aunque se ha propuesto su posible papel protector ante situaciones de riesgo trombótico y de sangrado con endoscopias relativamente no demorables debido a su papel antiagregante.
Al volver a reintroducir los antiplaquetarios debemos valorar de nuevo tanto el riesgo de sangrado como el riesgo de trombosis. Inicialmente se reiniciarán a las 24 horas del procedimiento endoscópico salvo en situaciones de alto riesgo de sangrado en que se deberá valorar con cardiólogo/neurólogo/hematólogo.
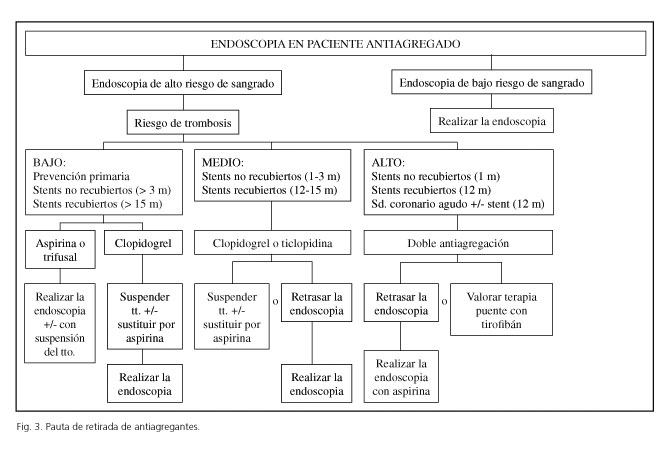
Basándonos en estos datos elaboramos un documento de trabajo que ayude en la toma de decisiones de los clínicos previa a la realización de endoscopias, delimitando el riesgo hemorrágico del procedimiento y, a partir de ahí, definiendo el riesgo trombótico (Fig. 3).
¿Cuál será el papel de un inhibidor de la glicoproteína IIb-IIIa en la reversión de la antiagregación?
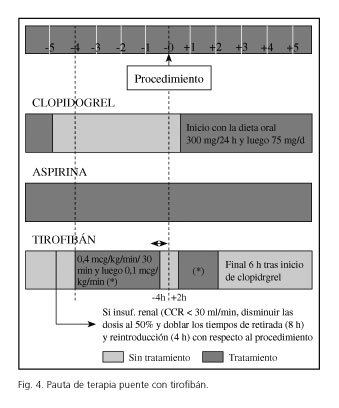
En un trabajo prospectivo no controlado, con 30 enfermos sometidos a cirugía mayor no demorable en los 6 meses posteriores a la colocación de un stent recubierto, se utiliza un inhibidor de la glicoproteína IIb-IIIa, el tirofibán i.v. (Fig. 4) como terapia puente, retirando el clopidogrel 5 días antes, sin apreciarse patología coronaria ni hemorrágica: esto supone una posibilidad interesante en este subgrupo de pacientes (44). Sin embargo no se han publicado más trabajos sobre este tema, por lo que debemos seguirlo con cautela y plantearlo como una alternativa únicamente en el seno de protocolos conjuntos con los servicios de cardiología y hematología.
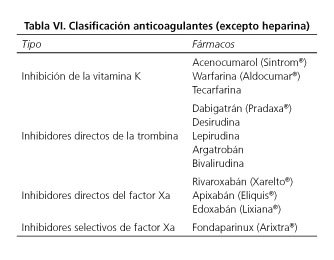
¿Cuáles son los principales anticoagulantes comercializados en españa (exceptuando heparinas)? (Tabla VI)
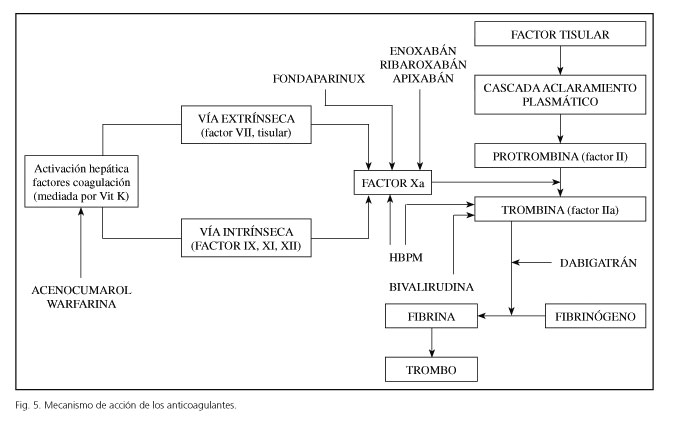
En la figura 5 se esquematiza el punto de acción de los principales anticoagulantes. Los habituales, la warfarina y el acenocumarol, son bien conocidos y tienen una vida media larga que puede obligar a plantear terapias puente con heparinas de bajo peso molecular ante situaciones de riesgo de sangrado.
Recientemente se han comercializado nuevos anticoagulantes (NACO), los inhibidores directos de la trombina (dabigatrán) y del factor Xa (rivaroxabán y apixabán). El edoxabán aún no tiene disponible su comercialización. Estos fármacos no disponen de un antídoto específico, por lo que se recomienda que los centros dispongan de protocolos de actuación para el manejo de las complicaciones hemorrágicas, preparaciones para cirugía y exploraciones invasivas en pacientes tratados con los NACO. Su efecto antiacoagulante es de aproximadamente 24 horas, aunque puede ser mayor en caso de insuficiencia renal (hasta 4 días) presentando cada uno un aclaramiento diferente. Por ello es esencial conocer este dato para poder plantear la pauta de retirada de los NACO antes de un procedimiento intervencionista. Aunque prolongan el tiempo de hemorragia los estudios de coagulación no sirven para monitorizar los niveles, si bien ante su retirada el dabigatrán se considerará sin efecto anticoagulante efectivo cuando el PTTA sea normal (45). Con dosis terapéuticas el PTTA puede llegar a prolongarse hasta dos o tres veces el control.
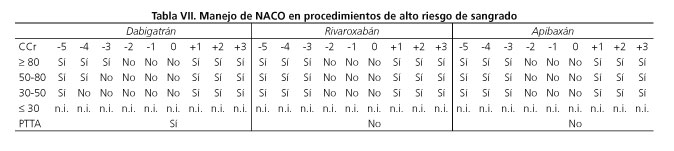
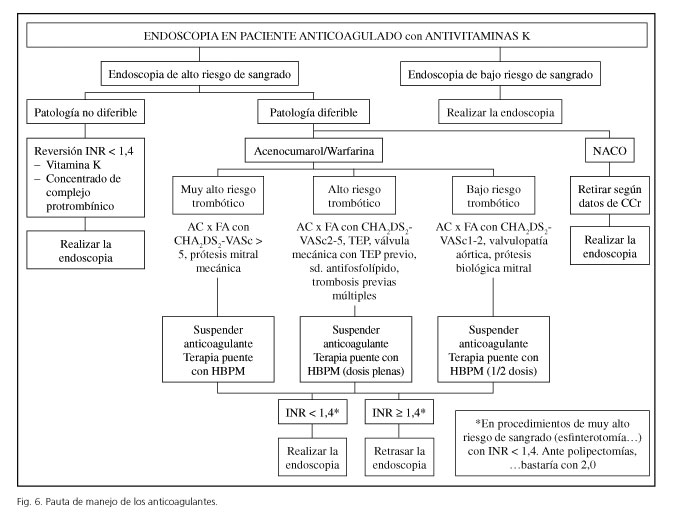
En pacientes que van a ser sometidos a procedimientos con bajo riesgo de sangrado podría limitarse la suspensión a una sola dosis (es decir, 10 h en el caso de dabigatrán y apixabán y 20 h en el rivaroxabán) o incluso no ajustar ante gastroscopias o colonoscopias, con o sin biopsias; si el riesgo es alto (Tabla VII) deberían suspenderse entre 2 y 3 veces la vida media (45). La reintroducción de estos fármacos se hace a las 24 horas pues su rapidez de acción hace que los pacientes estén anticoagulados de forma inmediata. Sin embargo, en procedimientos de alto riesgo de sangrado podría retrasarse a 2 días.
Dabigatrán y rivaroxabán aumentan el riesgo de sangrado gastrointestinal en 1,5 veces con respecto a la warfarina, mientras que el apixabán es semejante a esta (46).
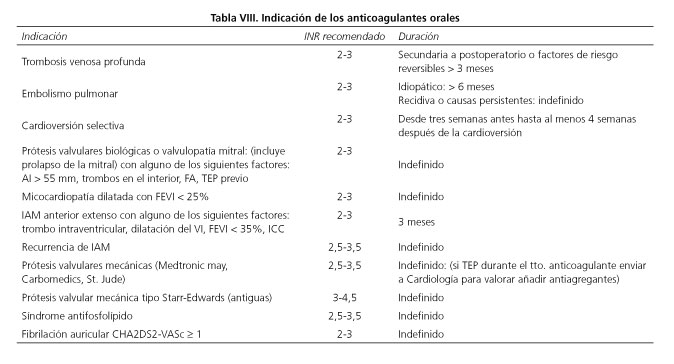
¿Cuáles son las indicaciones de los anticoagulantes? (Tabla VIII)
Un gastroenterólogo debe conocer el terreno en el que se mueve, y aún más pues cada día van incrementándose las indicaciones de estos fármacos que han reducido la mortalidad por eventos vasculares en pacientes de riesgo.
Con respecto a la fibrilación auricular se establece indicación en los pacientes con afectación valvular y en aquellos con un riesgo trombótico establecido según la clasificación CHA2DS2-VASc (47) (C-insuficiencia cardiaca congestiva o disfunción de ventrículo izquierdo), H- hipertensión, A- edad ≥ 75, D- diabetes, S- stroke o accidente trombótico previo (ACV, TIA, TEP), V- enfermedad vascular (infarto miocárdico previo, arteriopatía periférica o placas aórticas), A- edad entre 65 y 74 y S- sexo femenino. Se considera indicada la anticogulación cuando en una fibrilación auricular se cumple uno de los criterios (48) (Tabla IX). A mayor número de criterios, mayor es el riesgo de trombosis si se suspende la anticoagulación (49).
Por otro lado, en la toma de decisiones con los pacientes cardiópatas se utiliza también el HAS-BLED score que evalúa el riesgo de sangrado:
- H- Hipertensión: 1 punto si no controlada, con TAs ≥ 160.
- A- Alteración de función real (1 punto) o hepática (1 punto) o ambas (2 puntos).
- S- Antecedentes de accidente cerebrovascular (1 punto) sobre todo lacunar.
- B- Antecedentes de hemorragia, anemia o tener predisposición al sangrado (1 punto).
- L- INR lábil, inestable o alto, o con menos de 60% del tiempo en el rango terapéutico (1 punto).
- E- Edad ≥ 65 años (1 punto).
- D- Drogas y/o alcohol: antiplaquetarios (1 punto), consumo de 8 o más bebidas alcohólicas por semana (1 punto) o 2 puntos para ambos.
Una puntuación de 3 o más indica un mayor riesgo de sangrado en el año siguiente a la anticoagulación, por lo que podría estar indicado aumentar los controles o incluso disminuir las dosis de los anticoagulantes como el dabigatrán.
¿Es la anticoagulación una contraindicación para alguna técnica endoscópica?
- Sí, para las técnicas endoscópicas de alto riesgo de sangrado.
- No lo es para la realización de cualquier exploración diagnóstica, incluyendo la toma de biopsias (7).
- En casos urgentes se puede plantear realizar cualquier técnica tras revertir la anticoagulación.
Existen dudas acerca de cuál es el nivel de INR adecuado para realizar procedimientos endoscópicos con alto riesgo de sangrado de forma segura. En las guías endoscópicas se manejan niveles superiores a 1,4 el día del procedimiento (hay que realizar un control analítico), aunque algunas guías cardiológicas abogan por niveles de 2,0. No hay que olvidar que el riesgo de sangrado, como ya hemos comentado, persiste aumentado aun realizando un seguimiento correcto de las guías, por lo que como recomendación general podemos asumir el nivel de 1,4, aunque en situaciones de muy alto riesgo trombótico, como las prótesis metálicas, podríamos aceptar niveles más altos.
¿Qué patologías tienen un mayor riesgo trombótico ante la reversión de la anticoagulación?
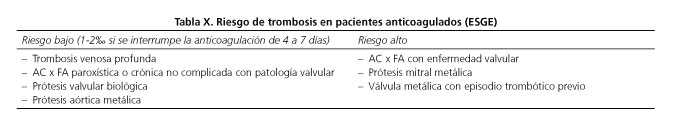
La ASGE (2) define el riesgo de trombosis en dos grados (Tabla X).
Dicha valoración ha sido asumida de forma generalizada por otros autores, en manuales (50), en revisiones (51) y en guías clínicas (7) aunque en los foros cardiológicos se prefiere la clasificación CHA2DS2-VASc cuando se habla en concreto de la fibrilación auricular. Podría ser práctico diferenciar en tres niveles el riesgo trombótico teniendo en cuenta las diferentes formas de actuar y aplicar terapias puente (52) (Tabla XI) y así lo aplicamos en el algoritmo que proponemos. Distinguimos entre riesgo alto y muy alto principalmente con fines prácticos dado que sólo se ha demostrado en las situaciones de muy alto riesgo beneficio profiláctico con la enoxaparina en dosis dividida y no con otras HBPM.
¿Cúal será la pauta práctica para la reversión de la anticoagulación?
En un análisis de decisión basado en la aplicación de las guías clínicas de la ASGE (2,4) se definieron como las estrategias más coste-efectivas las siguientes (53):
- En pacientes de riesgo trombótico bajo (por ejemplo, fibrilación auricular sin patología valvular) o si la posibilidad de polipectomía excede el 60%, cesar la warfarina 5 días antes.
- En colonoscopias de screening, en las que se espera encontrar pólipos en más de un 35% de los casos, mantener la warfarina con reducción de dosis.
- Si la posibilidad de polipectomía es menor o igual al 1%, continuar con warfarina.
Existe un acuerdo más o menos definido acerca de la pauta apropiada, basándose tanto en el tipo de terapia endoscópica como en la indicación de la anticoagulación (9).
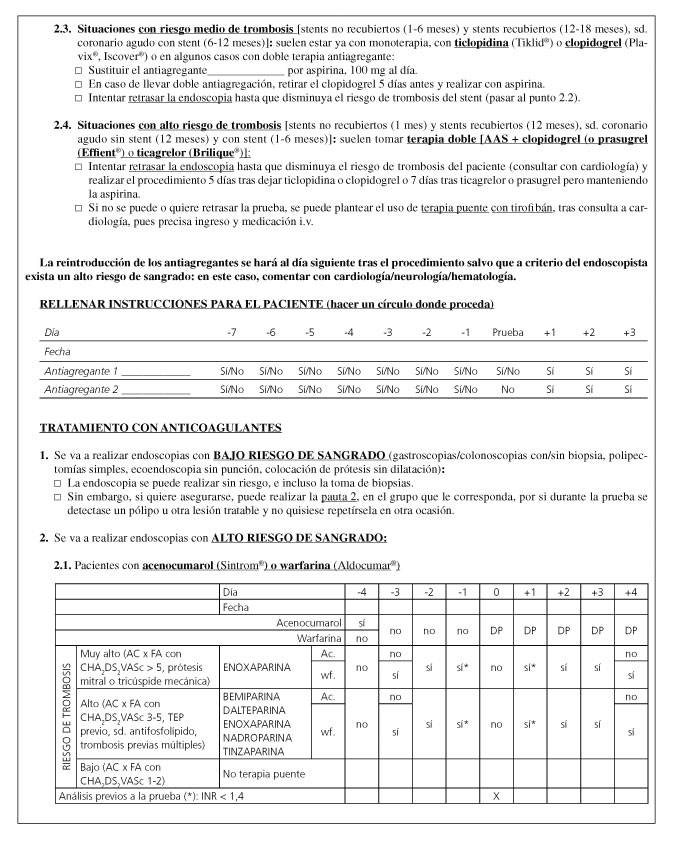
Se definirá la actitud de acuerdo con el riesgo de sangrado del procedimiento endoscópico y posteriormente actuar según el tipo de anticoagulante que lleve el enfermo: si toma acenocumarol o warfarina (esta última se tiene que suspender un día más que el acenocumarol) debemos realizar terapia puente con HBPM ajustada al riesgo trombótico. Si toma NACO, la toma de decisiones se hará dependiendo del aclaramiento de creatinina (CCr) pues la pauta de retirada varía dependiendo de la molécula (Fig. 6). Se ha discutido si se debe poner terapia puente con HBPM en pacientes en los que se retiran los NACO, pero si se ajusta la retirada al CCr evitaremos tener al paciente desprotegido o sobretratado.
La reintroducción del anticoagulante tras el procedimiento se hará de forma general a partir de 6 horas tras el mismo, salvo en situaciones de alto riesgo en que podríamos retrasarlo 24 horas si el riesgo trombótico lo permite. Se colocará la pauta previa. En los casos con terapia puente se pondrá una dosis a las 24 horas y, si se considera que existe un alto riesgo de sangrado, se puede prolongar la HBPM y retrasar el reinicio del anticoagulante siempre de acuerdo con cardiólogo, neurólogo o hematólogo.
¿Cuál será el papel de la heparina de bajo peso molecular en la reversión de la anticoagulación?
En sus recomendaciones, la ASGE (4) plantea una pauta de manejo con el uso de heparina de bajo peso molecular como puente, en pacientes de alto riesgo trombótico; el problema es que no se han definido ni las dosis ni cuál es el momento ideal para la reintroducción de la heparina, aunque se plantea que puede oscilar entre las 2 y las 6 horas tras el procedimiento, debiendo consensuarse con otros especialistas implicados. Otros autores proponen reducción de dosis de la HBPM previo a procedimientos intervencionistas, con reintroducción precoz en pacientes de alto riesgo, aunque está descrita en un ensayo para cateterismos diagnósticos y no para técnicas de alto riesgo de sangrado (Tabla XII).
Se ha utilizado la HBPM en dosis altas y dobles (54). Sin embargo no hay evidencia clara de su superioridad sobre dosis bajas y simples, aunque parece que sí aumenta el sangrado (7). Muchas consultas de coagulación establecen pautas de ajuste de dosis dependiendo del riesgo trombótico, y cada centro debe definir en consenso con Hematología y Cardiología la pauta puente apropiada.
Se ha demostrado la eficacia y seguridad de diferentes HBPM en el manejo como terapia puente en la retirada de los anticoagulantes, con estudios no aleatorizados con enoxaparina sódica (55), dalteparina (56) o bemiparina (57), aportando esta última el posible beneficio de la dosis única. En un trabajo español se valora su efecto protector en gastroscopias y colonoscopias con un protocolo de manejo sencillo y fácilmente aplicable en dosis única de bemiparina de 3.500 unidades (57). Sin embargo se trataba de gastroscopias y colonoscopias, de bajo riesgo de sangrado, y la dosis de 3.500 unidades podría ser insuficiente en situaciones de alto riesgo trombótico.
Sin embargo la terapia puente plantea dudas como la potenciación el efecto al asociar en el tiempo dos fármacos anticoagulantes, lo que podría aumentar los riesgos hemorrágicos. Por otro lado, la eliminación renal de la HBPM puede plantear problemas de sobredosificación en casos de insuficiencia real no controlada o no conocida.
¿Qué hay que hacer en pacientes con antiagregación y anticoagulación simultánea?
Dicha pauta sólo estaría indicada cuando existe una patología que exige anticoagulación oral (fibrilación auricular, trombosis venosa profunda, embolismo pulmonar o prótesis valvular) y una patología coronaria (síndrome coronario agudo y/o implante de stent) (58). De todas formas se aconseja mantenerla durante el menor tiempo posible. No existe ninguna recomendación en las guías clínicas publicadas ni acercamiento en los trabajos publicados ante los procedimientos endoscópicos. Sí existen recomendaciones en unas guías europeas de consenso en cardiología que ante situaciones de sangrado agudo grave y triple terapia puede llegar a ser necesario monitorizar niveles de INR por debajo de 2, manteniendo clopidogrel y usando la aspirina a dosis bajas. Es una situación cada vez más frecuente y debemos individualizar específicamente.
¿Qué se debe hacer si el paciente usa aspirina, antiagregantes o anticoagulantes fuera de las indicaciones aceptadas?
En estas situaciones quizá lo más razonable sería suspender la terapia antes del procedimiento endoscópico pues no tiene sentido aumentar el riesgo de sangrado, por pequeño que sea, sin que estemos disminuyendo el riesgo trombótico.
¿Podemos aconsejar una pauta práctica para los pacientes antiagregados y/o anticoagulados?
Es importante el manejo mixto con los cardiólogos, hematólogos y neurólogos individualizando las condiciones de cada paciente.
Aunque al final del protocolo se hace una propuesta práctica (Anexo 1) debemos aunar las sensaciones del endoscopista tras la prueba y su calibración del riesgo, junto con las del cardiólogo, hematólogo o neurólogo para de esa forma consensuar plazos de retirada (más o menos estables) y de reintroducción (bastante más elásticos).

Las guías son una pauta de ayuda en la toma de decisiones que rige el acto médico y no pautas cerradas que hay que seguir de forma absoluta pues, hoy por día, la evidencia que las soporta es muy débil.
¿Es la colonoscopia de cribado una técnica que obligue a actuar de modo diferente a la colonoscopia diagnóstica estándar?
En las diferentes series de colonoscopia de cribado en nuestro medio, la posibilidad de realizar una polipectomía significativa, de pólipos mayores de 10 mm, se encuentra entre el 50 y el 60%.
Como ya hemos visto se considera coste-efectiva la disminución de la dosis del anticoagulante (50), si bien esta es una pauta poco habitual en nuestro medio. En estos pacientes quizá sea más apropiado, desde el punto de vista práctico, hacer terapia puente con HBPM.
En cuanto a los antiagregantes no retiraremos la aspirina, independientemente de la dosis. Si toma clopidogrel informaremos al paciente del riesgo hemorrágico discretamente aumentado o cambiar a aspirina, así como de la posibilidad de retrasar la prueba hasta que pueda retirarse.
Si toma doble antiagregación valorar retirar clopidogrel si es posible (según las pautas establecidas) y mantener aspirina.
Como actitud de consenso de nuestro equipo hemos decidido manejar el cribado como una endoscopia de alto riesgo dada la alta frecuencia de polipectomías (> 50%) para de esta forma evitar segundas exploraciones, aunque en la toma de decisiones debe participar el enfermo.
¿Qué importancia tiene la opinión del paciente en la decisión de retirar un fármaco anticoagulante o antiagregante?
Se ha analizado este punto dada la trascendencia para la salud de los pacientes que tiene y los pacientes prefieren el riesgo de los efectos secundarios (por ejemplo, el sangrado) que el riesgo de posibles eventos cardiovasculares (59). Esta apreciación nos debería obligar a tomar decisiones de forma individualizada, previamente a la prueba y con el tiempo suficiente para que el paciente pueda decidir.
Cada vez es más frecuente el hallazgo de pólipos en el transcurso de colonoscopias en pacientes tratados con anticoagulantes y/o antiagregantes. La toma de decisiones en ese caso debería ser consensuada previamente a la realización de la exploración, sobre todo si el paciente está sedado. Habría que indicar en el consentimiento informado la posibilidad de polipectomía e informar sobre riesgos y beneficios, así como la necesidad de repetir la preparación y la prueba en el caso de que se decida no realizar la polipectomía.
Agradecimientos
A los miembros de las Juntas Directivas de la SEED, SEPD, GTCV-SEC y SETH por sus aportaciones y correcciones para mejorar y dar sentido a este documento.
Agradecimiento especial a la Dra. Inmaculada Roldán, del Servicio de Cardiología del Hospital La Paz de Madrid y al Dr. Enric Brullet del Servicio de Digestivo del Hospital Parc Taulí de Sabadell por sus aportaciones concretas.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Fernando Alberca de las Parras.
Unidad de Gestión Clínica de Digestivo.
Hospital Clínico Universitario Virgen de la Arrixaca.
Ctra. Madrid-Cartagena, s/n.
30120 El Palmar. Murcia
e-mail:
alberca.fernando@gmail.com
Recibido: 25-01-2015
Aceptado: 16-02-2015
Bibliografía
1. Ezekowitz MD. Anticoagulation interruptus: Not without risk. Circulation 2004;110:1518-9. [ Links ]
2. Eisen, GM, Baron, TH, Dominitz, JA, et al. Guideline on the management of anticoagulation and antiplatelet therapy for endoscopic procedures. Gastrointest Endosc 2002;55:775. [ Links ]
3. Baker RI, Coaughlin PB, Gallus AS, et al.; the Warfarin Reversal Consensos Group. Warfarin reversal: Consensus guidelines, on behalf of the Australasian Society of Trombosis and Haemostasis. Medical Journal of Australia 2004;181:492-7. [ Links ]
4. Zuckerman, MJ, Hirota, WK, Adler, DG, et al. ASGE guideline: The management of low-molecular-weight heparin and nonaspirin antiplatelet agents for endoscopic procedures. Gastrointest Endosc 2005; 61:189-94. [ Links ]
5. Boustière C, Veitch A, Vanbiervliet G, et al. ESGE Guideline: Endoscopy and antiplatelet agents. Endoscopy 2011;43:445-58. [ Links ]
6. Alberca de las Parras F. Guía de práctica clínica para el manejo de la coagulación en pacientes sometidos a técnicas endoscópicas. Rev Esp Enferm Dig 2010;102:124-38. [ Links ]
7. Veitch AM, Baglin TP, Gershlick AH, et al. Guidelines for the management of anticoagulant endoscopic procedures and antiplatelet therapy in patients undergoing endoscopic procedures. Gut 2008;57:1322-9. [ Links ]
8. Becker RC, Scheiman J, Dauerman HL, et al; American College of Cardiology and the American College of Gastroenterology. Management of platelet-directed pharmacotherapy in patients with atherosclerotic coronary artery disease undergoing elective endoscopic gastrointestinal procedures. Am J Gastroenterol 2009;104:2903-17. [ Links ]
9. Gerson LB, Gage BF, Owens DK, et al. Effect and outcomes of the ASGE guidelines on the periendoscopic management of patients who take anticoagulants. Am J Gastroenterol 2000;95:1717-24. [ Links ]
10. Fujishiro M, Oda I, Yamamoto Y, et al. Multi-center survey regarding the management of anticoagulation and antiplatelet therapy for endoscopic procedures in Japan. J Gastroenterol Hepatol 2009;24:214-8. [ Links ]
11. Radaelli F, Paggi S, Terruzzi V, et al. Management of warfarin-associated coagulopathy in patients with acute gastrointestinal bleeding: A cross-sectional physician survey of current practice. Dig Liver Dis 2011;43:444-7. [ Links ]
12. Ono S, Fujishiro M, Hirano K, et al. Retrospective analysis on the management of anticoagulants and antiplatelet agents for scheduled endoscopy. J Gastroenterol 2009;44:1185-9. [ Links ]
13. Lobo B, Saperas E. Tratamiento de la hemorragia digestiva por ruptura de varices esofágicas. http://www.prous.com/digest/protocolos/view_protocolo.asp?id_protocolo=18. 2004 Prous Ed. [ Links ]
14. Cukor B, Cryer BL. The risk of rebleeding after an index GI bleed in patients on anticoagulation (abstract DDW 2008). Gastrointest Endosc 2008;67:AB24. [ Links ]
15. Heidbuchel H, Verhamme P, Alings M, et al. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Eurospace 2013;15: 625-51. [ Links ]
16. Parra-Blanco A, Kaminaga N, Kojima Y, et al. Hemoclipping for postpolypectomy and postbiopsy colonia bleeding. Gastrointest Endosc 2000;51:37-41. [ Links ]
17. Smith LE. Fiberoptic colonoscopy: Complications of colonoscopy and polyupectomy. Dis Colon Rectum 1976;19:407-12. [ Links ]
18. Sieg A, Hachmoeller-Eisenbach U, Eisenbach T. Prospective evaluation of complications in outpatient GI endoscopy: A survey among German gastroenterologists. Gastrointest Endosc 2001;53:620-7. [ Links ]
19. Di Giorgio P, De Luca L, Calcagno G, et al. Detachable snare versus epinephrine injection in the prevention of postpolypectomy bleeding: A randomized and controlled study. Endoscopy 2004;36:860-3. [ Links ]
20. Bason MD, Manzini L, Palmer RH. Effect of nabumetone and aspirin on colonic mucosal bleeding time. Aliment Pharmacol Ther 2001;15:539-42. [ Links ]
21. Nakajima H, Takami H, Yamagata K, et al. Aspirin effects on colonia mucosal bleeding: implications for colonia biopsy and polypectomy. Dis Colon Rectum 1997;40:1484-8. [ Links ]
22. Hui AJ, Wong RM, China JK, et al. Risk of colonoscopic polipectomy bleeding with anticoagulants and antiplatelet agents: analisis of 1657 cases. Gastrointestinal Endoscopy 2004. [ Links ]
23. Shiffman ML, Farrel MT, Yee YS. Risk of bleeding alter endoscopic biopsy or polypectomy in patients taking aspirin or other NSAIDs. Gastrointestinal Endoscopy 1994;40:458-62. [ Links ]
24. Yousfi M, Gostout CJ, Baron TH, et al. Postpolypectomy lower gastrointestinal bleeding: Potencial role of aspirin. Am J Gastroenterol 2004;99:1785-9. [ Links ]
25. Kimchi NA, Broide E, Scapa E, et al. Antiplatelet therapy and the risk of bleeding induced by gastrointestinal endoscopio procedures. A systematic review of the literature and recommendations. Digestion 2007;75:36-45. [ Links ]
26. Witt DM, Delate T, McCool KH, et al.; WARPED Consortium. Incidence and predictors of bleeding or thrombosis after polypectomy in patients receivin g and not receiving anticoagulation therapy. J Thromb Haemost 2009;7:1982-9. [ Links ]
27. Gerson LB, Michaels L, Ullah N, et al. Adverse events associated with anticoagulation therapy in the periendoscopic period. Gastrointest Endosc 2010;71:1211-7. [ Links ]
28. Friedland S, Sedehi D, Soetikno R. Colonoscopic polypectomy in anticoagulated patients. World J Gastroenterol 2009;15:1973-6. [ Links ]
29. Hirouchi A, Nakayama Y, Kajjyama M, et al. Removal of small colorectal polyps in anticoagulated patients: a prospective randomized comparison of cold snare and conventional polypectomy. Gastrointest Endosc 2013;79:417-2. [ Links ]
30. Cotton PB, Lehman G, Vennes J, et al. Endoscopic sphincterotomy complications and their management: An attemp at consensus. Gastorintest Endosc 1991;37:383-93. [ Links ]
31. Hui CK, Lai KC, Yuen MF, et al. Does withholding aspirrin for one week reduce the risk of post-sphinsterotomy bleeding? Aliment Pharmacol Ther 2002;16:929-36. [ Links ]
32. Nelson DB, Freeman ML. Mayor haemorrhage from endoscopio sphincterotomy: risk factor analysis. J Clin Gastroenterol 1994;19: 283-7. [ Links ]
33. Weinberg BM, Shindy W, Lo S. Dilatación esfinteriana endoscópica con balón (esfinteroplastia) versus esfinterotomía para los cálculos del conducto biliar común (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2007 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2007 Issue 4. Chichester, UK: John Wiley & Sons, Ltd. [ Links ]).
34. Mönkemüller K, Fry LC, Neumann H, et al. Diagnostic and therapeutic utility of double balloon endoscopy: experience with 225 procedures. Acta Gastroenterol Latinoam 2007;37:216-23. [ Links ]
35. Koh R, Hirasawa K, Yahara S, et al. Antithrombotic drugs are risk factors for delayed postoperative bleeding after endoscopic submucosal dissection for gastric neoplasms. Gastrointestinal Endoscopy 2013;78:476-83. [ Links ]
36. Singh D, Laya AS, Vaidya OU, et al. Risk of bleeding after percutaneous endoscopic gastrostomy (PEG). Dig Dis Sci 2012;57:973-80. [ Links ]
37. Camm AJ, Bassand JP, Agewall S, et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal 2011;32:2999-3054. [ Links ]
38. Steg G, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC) European Heart Journal 2012;33:2569-619. [ Links ]
39. Fuentes B, Gállego J, Gil-Nunez A, et al.; por el Comité ad hoc del Grupo de Estudio de Enfermedades Cerebrovasculares de la SEN. Guía para el tratamiento preventivo del ictus isquémico y AIT (II). Recomendaciones según subtipo etiológico. Neurología 2014;29:168-83. [ Links ]
40. Grines CL, Bonow RO, Casey DE Jr., et al. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: A science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. Circulation 2007;115:813-8. [ Links ]
41. Fleisher LA, Beckman JA, Brown KA, et al. Guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2007;50;159-241. [ Links ]
42. Cohen Arazi H, Carnevalini M, Falconi E, et al. The association of antiplatelet aggregation effect of aspirin and platelet count. Possible dosage implications. Revista Argentina de Cardiología 2012;80. [ Links ]
43. Fox KA, Mehta SR, Peters R, et al.; Clopidogrel in Unstable angina to prevent Recurrent ischemic Events Trial. Benefits and risks of the combination of clopidogrel and aspirin in patients undergoing surgical revascularization for non-ST-elevation acute coronary syndrome: the clopidogrel in unestable angina to prevent recurrent ischemic events (CURE) trial. Circulation 2004;110:1202. [ Links ]
44. Savonitto S, Urbano MD, Caracciolo M, et al. Urgent surgery in patients with a recently implanted coronary drug-eluting stent: a phase II study of "bridging" antiplatelet therapy with tirofiban during temporary withdrawal of clopidogrel. British Journal of Anaesthesia 2010;104:285-91. [ Links ]
45. Desai J, Granger CB, Weitz JI, et al. Novel oral anticoagulants in gastroenterology practice. Gastrointestinal Endoscopy 2013;78:227-39. [ Links ]
46. Desai J, Kolb JM, Weitz JI, et al. Gastrointestinal bleeding with the oral anticoagulants- defining the issues and the management strategies. Thrombosis and Haemostasis 2013;110:205-12. [ Links ]
47. Lip GY, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: The Euro Heart Survey on Atrial Fibrillation. Chest 2010;137:263-72. [ Links ]
48. Camm AJ, Lip GYH, De Caterina R, et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation. An update of the 2010 ESC Guidelines for the management of atrial fibrillation. European Heart Journal 2012;33:2719-47. [ Links ]
49. Gage BF, Waterman AD, Shannon W, et al. Validation of clinical classification schemes for predicting stroke: Results from the National Registry of Atrial Fibrillation. JAMA 2001;285:2864-70. [ Links ]
50. Morillas JD, Simón MA. Endoscopia: preparación, prevención y tratamiento de las complicaciones. En: Tratamiento de las enfermedades gastroenterológicas. Asociación Española de Gastroenterología. Ed SCM; 2006. [ Links ]
51. Kamath PS. Gastroenterologic procedures in patients with disorders of hemostasis. Up To Date. http://www.uptodate.com/physicians/gasthepa_toclist.asp 2007. [ Links ]
52. You JJ, Singer DE, Howard PA, et al. Antithrombotic Therapy for Atrial Fibrillation: Antithrombotic Therapy and Prevention of Thrombosis. 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Supl.):e531S-e575S. doi:10.1378/chest.11-2304. [ Links ]
53. Gerson LB, Triadafilopoulos G, Gage BF. The management of anticoagulants in the periendoscopic period for patients with atrial fibrillation: a decision analysis. Am J Med 2004;116: 451-9. [ Links ]
54. Seshadri N, Goldhaber SZ, Elkayam U, et al. The clinical challenge of brinding anticoagulation with low-molecular-weigth heparin in patients with mecanical prosthetic heart valves: an evidence-based comparative review focusing on anticoagulation options in pregnant and nonpregnant patients. Am Heart J 2005;150:27-34. [ Links ]
55. Douketis JD, Johnson JA, Turpie AG. Low-molecular-weith heparin as bringing interruption of warfarin. Arch Intern Med 2004;164:1319-26. [ Links ]
56. Turpie AGG, Johnson J. Temporary discontinuation of oral anticoagulants: Role of low molecular weight heparin (dalteparin). Circuation 200;102:II-826. [ Links ]
57. Constans M, Santamaria A, Mateo J, et al. Low-molecular-weight heparin as bridging therapy during interruption of oral anticoagulation in patients undergoing colonoscopy or gastroscopy. Int Clin J Prac 2007;61:212-7. [ Links ]
58. Wijns W, Kolh P, Danchin N, et al. Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) European Heart Journal 2010;31:2501-55. [ Links ]
59. Devereaux PJ, Anderson DR, Gardner MJ, et al. Differences between perspectives of physicians and patients on anticoagulation in patients with atrial fibrillation: observational study. BMJ 2001;323:1218-22. [ Links ]











 texto en
texto en