Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.108 no.3 Madrid mar. 2016
REVISIÓN
Consideraciones prácticas en el manejo de los inhibidores de la bomba de protones
Practical considerations in the management of proton-pump inhibitors
Lara Aguilera Castro, Carlos Martín de Argila de Prados y Agustín Albillos Martínez
Servicio de Gastroenterología y Hepatologia. Hospital Universitario Ramón y Cajal, IRYCIS. Universidad de Alcalá, Madrid
Dirección para correspondencia
RESUMEN
Los inhibidores de la bomba de protones (IBP) son uno de los principios activos más prescritos en España. En las últimas décadas se ha observado un sobreuso de estos fármacos tanto a nivel extrahospitalario como hospitalario que ha producido un aumento importante en el gasto sanitario y un incremento en el riesgo de posibles efectos adversos. Es importante que los profesionales sanitarios se ajusten a las indicaciones admitidas y a las dosis correctas para el empleo de estos medicamentos. Existen en el mercado diferentes tipos de IBP: omeprazol, pantoprazol, lansoprazol, rabeprazol y esomeprazol. El omeprazol es el más antiguo y utilizado, siendo también el más barato. Si bien en la mayoría de las indicaciones terapéuticas en las que se emplean estos medicamentos no se describen diferencias entre los distintos IBP en la curación de las enfermedades, el esomeprazol, IBP de última generación, ha demostrado mayor eficacia en la erradicación del H. pylori y en la curación de la esofagitis grave respecto al resto de IBP. En los últimos años el uso de los fármacos genéricos se ha extendido; este tipo de medicamentos presentan la misma biodisponibilidad que los medicamentos originales. En el caso de los IBP, los pocos estudios comparativos disponibles en la literatura entre los fármacos originales y los genéricos no han demostrado diferencias significativas en la eficacia clínica.
Palabras clave: Inhibidores de la bomba de protones. IBP. Omeprazol. Pantoprazol. Lansoprazol. Rabeprazol. Esomeprazol.
ABSTRACT
Proton-pump inhibitors (PPIs) are one of the most active ingredients prescribed in Spain. In recent decades there has been an overuse of these drugs in both outpatient clinics and hospitals that has lead to a significant increase in healthcare spending and to an increase in the risk of possible side effects. It is important for health professionals to know the accepted indications and the correct doses for the use of these drugs. On the market there are different types of PPI: omeprazole, pantoprazole, lansoprazole, rabeprazole and esomeprazole. Omeprazole is the oldest and most used PPI, being also the cheapest. Although there are no important differences between PPIs in curing diseases, esomeprazole, a new-generation PPI, has proved to be more effective in eradicating H. pylori and in healing severe esophagitis compared to other PPIs. In recent years the use of generic drugs has spread; these drugs have the same bioavailability than the original drugs. In the case of PPIs, the few comparative studies available in the literature between original and generic drugs have shown no significant differences in clinical efficacy.
Key words: Proton-pump inhibitor. PPI. Omeprazole. Pantoprazole. Lansoprazole. Rabeprazole. Esomeprazole.
Introducción
Los inhibidores de la bomba de protones (IBP) representan una familia de medicamentos ampliamente utilizada en nuestro país. La aparición en los años noventa de los IBP supuso una gran revolución en el manejo de la enfermedad ulcerosa y el reflujo gastroesofágico. Dos de los principales problemas de los IBP en la actualidad son su sobreutilización y los errores en la indicación terapéutica. Este hecho conduce a un gasto económico sanitario no despreciable y al riesgo de efectos secundarios a largo plazo. En esta revisión se comentan los problemas principales de la prescripción de los IBP, sus indicaciones, las diferencias entre los distintos IBP y consejos en su prescripción.
Breve recuerdo histórico: de las dietas alcalinas a los IBP
El tratamiento de la enfermedad ulcerosa y la enfermedad por reflujo gastroesofágico (ERGE) a principios del siglo xx consistía en la prescripción de alimentos alcalinos como leche, huevos y puré (1). Más adelante, surgieron preparados como el bicarbonato de sodio que mejoraban la sintomatología pero no prevenían las complicaciones. Los tratamientos quirúrgicos consistían en diferentes modalidades de cirugías gástricas para la enfermedad ulcerosa péptica y en la funduplicatura de Nissen para la ERGE (2).
A mediados del siglo xx se introdujo el uso de los antagonistas muscarínicos, siendo la atropina su principio activo principal. Mediante el bloqueo del receptor muscarínico de la célula parietal, se inhibía parcialmente la secreción ácida. Sin embargo, estos medicamentos tenían poca eficacia farmacológica y numerosos efectos adversos como consecuencia de la cantidad de receptores muscarínicos distribuidos por todo el organismo. Más tarde se descubrieron las prostaglandinas de tipo E, con los inconvenientes de su corta vida media y los efectos secundarios. Un cambio importante en el tratamiento antisecretor gástrico fue la aparición de los antagonistas de los receptores H2 (anti-H2) (3), los más utilizados fueron la ranitidina y la famotidina. Estos fármacos constituyeron un cambio sustancial al actuar bloqueando los receptores de histamina de las células parietales gástricas y lograr un control efectivo en la producción del ácido clorhídrico (4). Sin embargo, a pesar de su mayor eficacia clínica, no lograban una completa cicatrización de las lesiones esofágicas y gástricas, al no lograr una potente inhibición de la secreción ácida gástrica (5).
La auténtica revolución se produjo en los años setenta, al utilizar la piridin-2-tioacetamida, un compuesto que se estaba estudiando por su posible efecto antiviral. Modificando dicha sustancia, se creó el timoprazol, el primer IBP que presentaba un efecto antisecretor gástrico. En 1979 se sintetizó el omeprazol con mayor afinidad sobre la bomba de protones de la célula parietal y con menores efectos adversos (6). En los años posteriores se demostró la mayor eficacia clínica de los IBP respecto a los anti-H2 y se abrieron rápidamente nuevos campos de investigación que llevaron a la síntesis de nuevos IBP (pantoprazol, lansoprazol, rabeprazol y esomeprazol) con características diferenciales al omeprazol.
Sobreuso y sus consecuencias
La prescripción de los IBP ha ido en aumento en los últimos años. En 2010, el omeprazol se convirtió en el principio activo de mayor consumo en envases de España, representando un 5,51% del total de los envases de medicamentos facturados en ese año (7). En el subgrupo de fármacos antiulcerosos, entre 2000 y 2008 se observó un aumento en el uso de IBP del 200,8% y, al mismo tiempo, un descenso en la prescripción de los fármacos anti-H2. Entre los diferentes IBP, el esomeprazol se convirtió en 2007 en el IBP con mayor tasa de crecimiento (8). Respecto al resto de países europeos, España es líder en el consumo de antiulcerosos, con una prescripción del 70% por encima de la media (9).
La sobreutilización de los IBP se ha evidenciado en varios estudios (10-12). Martín-Echevarría y cols. observaron, en un estudio realizado en el Hospital de Guadalajara, que entre los pacientes que tomaban IBP durante el ingreso, un 73% presentaba una indicación no adecuada y, además, un 38% de los pacientes fueron dados de alta con este medicamento también sin adecuada indicación (13). A nivel extrahospitalario, un estudio observacional transversal realizado en el área IV de Madrid evidenció que tan sólo el 36,4% de los consumidores de IBP se ajustaban a los criterios de adecuada indicación de IBP (14). En pacientes hospitalizados en EE.UU. tratados con antisecretores gástricos se ha observado una inadecuada indicación en un 60% de los casos, siendo el error más frecuente de prescripción la profilaxis de lesiones gastrointestinales en pacientes con bajo riesgo gastrolesivo (15,16).
Con el sobreuso de los IBP se incrementa el riesgo de efectos secundarios de los IBP. Los más frecuentes son la cefalea, el dolor abdominal, la diarrea, el meteorismo, las náuseas y el estreñimiento. Suelen ser leves y reversibles con la suspensión del fármaco. Por otro lado, su seguridad con su consumo a largo plazo ha estado en controversia en los últimos años.
El ácido gástrico es una de las barreras contra las infecciones del tracto gastrointestinal superior, por este motivo se ha relacionado la hipoclorhidria con el aumento de las infecciones entéricas y las respiratorias causadas por la microaspiración. Las infecciones entéricas por Campylobacter y Salmonella, bacterias ácido sensibles, han sido relacionadas con el uso de IBP (17,18). Además, se ha postulado que este fármaco también podría aumentar el riesgo de colitis por Clostridium difficile. A pesar de la elevada heterogenicidad de los estudios y de no incluir ningún ensayo clínico, un metaanálisis y una revisión sistemática han observado dicha asociación (19,20). Diversos estudios epidemiológicos han relacionado los IBP con el aumento del riesgo de neumonía adquirida en la comunidad, sobre todo durante los primeros días de prescripción (21,22); en 2011 un metaanálisis confirmó dicha asociación con una OR de 1,27 (IC 95% 1,11-1,26) (23). Sin embargo, en otros estudios más recientes no se ha observado esta asociación (24,25). Un reciente estudio de casos y controles describe que los IBP podrían aumentar el riesgo de aparición de abscesos hepáticos criptogénicos (26). Las fracturas óseas también se han relacionado en varios estudios observacionales (27). Un estudio cruzado que analizó la densidad mineral ósea de la cadera y las vértebras lumbares no demostró asociación entre consumo de IBP y osteoporosis (28).
La absorción de vitamina B12 y magnesio requiere ácido gástrico y los IBP podrían ser responsables de producir deficiencias de estos elementos. En el caso de la vitamina B12, la mayoría de estudios son casos y controles y en muchos se ha cuestionado el método empleado de medida de la vitamina B12 y el no haber tenido en cuenta la dieta del paciente (29,30). Por otro lado, diversos estudios de baja consistencia metodológica asocian el consumo de IBP durante más de un año con hipomagnesemia (31,32). La Food Drug Administration (FDA) ha emitido una alarma al respecto y recomienda solicitar niveles de magnesio séricos antes de iniciar tratamiento con IBP a largo plazo y monitorizar la magnesemia en pacientes con factores de riesgo (33).
Recientemente se han publicado los resultados de dos ensayos clínicos multicéntricos con 812 pacientes en los cuales se aleatorizó a pacientes con ERGE a tomar IBP (esomeprazol u omeprazol) a largo plazo o a someterse a una cirugía laparoscópica antirreflujo, con un seguimiento de 5 y 12 años (34). Se analizaron los efectos adversos y se realizaron estudios analíticos hematológicos con determinaciones de vitamina B12, homocisteína, fólico, hierro, ferritina, calcio y vitamina D. No se observaron diferencias analíticas y clínicas relevantes entre los dos grupos.
Mecanismo de acción de los IBP
La producción de ácido gástrico por el estómago es controlada por una serie de mediadores endógenos. La somatostatina y las prostaglandinas son los principales inhibidores de esta secreción, mientras que los estimuladores más importantes son la acetilcolina, la gastrina y la histamina. Estos últimos se unen a un receptor específico mediado por la proteína G en la membrana basolateral de la célula parietal y producen por diferentes vías la activación de la bomba de protones ATPasa dependiente. Esta bomba intercambia hidrógeno por potasio y se sitúa en la membrana apical de la célula parietal (35).
Los diferentes fármacos utilizados para lograr un incremento en el pH intragástrico se han basado en la inhibición de dicha bomba de protones uniéndose a diferentes receptores de la célula parietal. La característica diferencial y principal de los IBP es su capacidad de unirse de forma directa e irreversible a esta bomba de protones, último eslabón metabólico en la producción del ácido clorhídrico, e inhibirla de forma eficaz. A pesar de ser una unión irreversible, para tratar de alcanzar el 100% de inhibición son necesarias altas dosis en cortos intervalos de tiempo o una perfusión intravenosa continua de estos medicamentos. Esto es debido a varios factores: la corta vida media plasmática del fármaco, la continua síntesis de nuevas bombas de protones por la célula parietal y a que sólo son bloqueadas las bombas activas que se encuentren expuestas a la luz del canalículo (36).
Mediante este mecanismo, los IBP consiguen inhibir la secreción gástrica ácida basal y la inducida por estímulos como la ingesta, y disminuyen el pepsinógeno secretado y la actividad proteolítica de la pepsina. No se ha demostrado en modelos in vivo que los IBP sean capaces de erradicar Helicobacter pylori; sin embargo, en estudios in vitro, se ha observado que estos fármacos inhiben la enzima ureasa que protege del pH ácido a dicho microorganismo (37). Además, también se ha observado que los IBP son capaces de estimular la acción bactericida de algunos antibióticos como la claritromicina (15).
Para evitar la inactivación del IBP en el medio ácido del estómago, las formulaciones de estos medicamentos requieren de una cubierta gastrorresistente. Tras la absorción en el duodeno, alcanzan el pico de concentración plasmática a los 30 minutos-3 horas. La ingesta con alimento retrasa su absorción. Tras una dosis estándar de IBP, la secreción ácida se recupera completamente a las 72-96 horas y su biodisponibilidad aumenta con la repetición de dosis (36). La corta vida media plasmática de los IBP condiciona una baja incidencia de toxicidad plasmática, incluso en situaciones de aclaramiento reducido como es el caso de los ancianos o pacientes con insuficiencia hepática y/o renal. Sólo en casos de marcada disminución de la función hepática será necesario reducir la dosis de estos medicamentos (38).
Los IBP son principalmente metabolizados en el hígado por la acción del citocromo P450, esencialmente por las isoenzimas CYP2C19 y CYP3A4 (39). La mayoría de los IBP presentan mayor afinidad por la CYP2C19 que por la CYP3A4, reservándose esta última cuando la principal vía se encuentra saturada. En la CYP2C19 se han demostrado polimorfismos que producen alteraciones en el metabolismo y variaciones en la vida plasmática del fármaco (40).
En función de fenotipos de la CYP2C19, se describen personas metabolizadoras rápidas o lentas de los IBP. Los denominados "metabolizadores rápidos" corresponden a CYP2C19 homocigotos sin mutación y heterocigotos con una sola mutación; y los denominados "metabolizadores lentos", a CYP2C19 con dos copias del gen mutado (41). Se calcula que los metabolizadores rápidos corresponden al 1% de la población negra, el 2-6% de la población caucásica y el 15-23% de la población asiática (42). Este grupo de pacientes metaboliza a mayor velocidad el fármaco, observándose una disminución significativa en la concentración en sangre del IBP que influye en la respuesta terapéutica del fármaco (40). Se ha observado que los metabolizadores lentos presentan tasas de erradicación de H. pylori mayores en comparación con los rápidos. Por otro lado, en la ERGE no erosiva, la esofagitis por reflujo y la úlcera duodenal también se ha observado una variación en los resultados terapéuticos con estos medicamentos en función del fenotipo metabolizador. En nuestro país, la tasa de metabolizadores rápidos es muy reducida; sin embargo, en zonas del este asiático, donde esta puede alcanzar el 23% de la población, se podría considerar la prescripción de dosis adecuadas de IBP según el polimorfismo detectado, ofreciéndose una prescripción terapéutica más personalizada (43).
Inhibición ácida potente y diferencias farmacológicas entre IBP
Dependiendo de la indicación terapéutica, la potencia de la inhibición de la secreción ácida gástrica requerida será diferente. Así, a pesar de que los niveles de ácido clorhídrico en esófago distal se encuentren en rangos normales en algunos pacientes con ERGE, en la ERGE sintomática habitualmente se necesita una inhibición ácida mucho mayor que en la úlcera duodenal o gástrica para alcanzar el éxito terapéutico (44). En el tratamiento de la hemorragia digestiva alta también se requiere que el pH gástrico esté lo más elevado posible para evitar la degradación del coágulo formado y acelerar la curación y cicatrización ulcerosa (45).
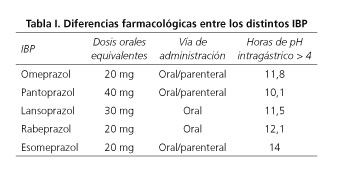
Existen diferentes parámetros que deben ser tenidos en consideración a la hora de comparar los distintos IBP disponibles. Entre ellos, la media del tiempo durante el cual el pH intragástrico es mayor de 4 es relativamente sensible a los cambios de pH en 24 horas y fácilmente entendible (45). En casos como la ERGE o la hemorragia digestiva alta es necesario obtener un pH intragástrico mantenido mayor de 4 durante al menos 16 horas al día (46).
Por otro lado, la inhibición de la secreción ácida gástrica de los IBP está influenciada por características individuales de cada paciente y factores externos. En relación a los factores individuales, cabe destacar la variación interpersonal del metabolismo de los IBP en relación a los polimorfismos del citocromo P2C19 y CYP3A4, ya comentados con anterioridad. Entre los factores externos se encuentra la infección por H. pylori. Se ha observado que en los pacientes infectados por H. pylori, el grado de inhibición de la secreción gástrica obtenido con los IBP es mayor (47). Se piensa que la gastritis producida por el H. pylori induce un aumento en la producción de gastrina que activaría las células parietales y las bombas de protones, aumentando la acción de los IBP. Por otro lado, el amonio producido por el H. pylori ayudaría a los IBP a neutralizar el ácido gástrico (48).
En relación a las diferencias farmacológicas con otros antisecretores gástricos, los anti-H2 presentan un inicio de efecto farmacológico más rápido que los IBP. Sin embargo, estos fármacos tienen una taquifilaxia temprana y su capacidad antisecretora disminuye tras las primeras 12-24 horas desde su administración (49). Actualmente, el empleo de los anti-H2 se restringe al manejo de la ERGE leve no erosiva, en algunos pacientes con dispepsia funcional, en pacientes con hipersensibilidad a los IBP y en pacientes que requieren una antisecreción gástrica mantenida y se les quiere realizar una prueba diagnóstica para la infección por H. pylori (36).
Los diferentes tipos de IBP actualmente disponibles presentan en general similares características farmacológicas. Sin embargo, se pueden diferenciar por la dosis equivalente, las vías de administración disponibles, el precio o las interacciones medicamentosas. Las dosis equivalentes, la vía de administración y la duración de la inhibición ácida de los distintos IBP se muestran en la tabla I. Respecto a la vía de administración, en España están comercializados para su empleo por vía parenteral el omeprazol, el pantoprazol y el esomeprazol. Si bien el precio del fármaco no debe ser la mayor prioridad a la hora de seleccionar el medicamento, sí debe ser un factor a tener en cuenta. Utilizando datos del año 2014, el omeprazol es el IBP más barato en el mercado farmacéutico español, seguido del lansoprazol, pantoprazol, rabeprazol y esomeprazol. Respecto a las diferencias en el tiempo de acción, se ha observado que el rabeprazol en comparación con omeprazol, presenta una mayor eficacia en la reducción de los síntomas de la ERGE grave y muy grave en los primeros tres días de tratamiento (49), diferencias que desaparecen a partir del cuarto día de administración. En relación a la duración de la acción en la inhibición de la secreción ácida gástrica, en un estudio aleatorizado y cruzado realizado por Miner y cols. se observó que la media de horas de pH intragástrico por encima de 4 fue de 14 horas con esomeprazol, 12,1 horas con rabeprazol, 11,8 horas con omeprazol, 11,5 horas con lansoprazol y 10,1 horas con pantoprazol, presentando el esomeprazol una mayor duración de la inhibición ácida gástrica con significación estadística respecto a los otros fármacos (50).
Las interacciones farmacológicas con los IBP son pocas y no relevantes clínicamente. La afinidad por los dos isoenzimas del citocromo P450 (CYP2C19 y CYP3A4) difiere entre los tipos de IBP y esto teóricamente podría producir ligeras diferencias en las interacciones. El pantoprazol y el rabeprazol presentan una vía de metabolización no enzimática (39) y por esta razón se ha sugerido que estos dos medicamentos podrían interaccionar menos que el omeprazol o lansoprazol. Sin embargo, en la práctica clínica los riesgos de interacción medicamentosa son extremadamente bajos (51).
Indicaciones de los IBP
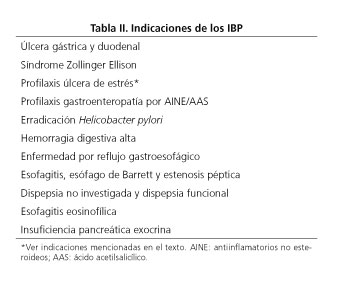
En la tabla II se muestran las indicaciones de los IBP en España (52).
La profilaxis de la gastroenteropatía por antiinflamatorios no esteroideos (AINE) es probablemente la indicación de IBP que más confusión produce entre los prescriptores de este medicamento. Las indicaciones de IBP en este tipo de pacientes se muestran en la tabla III (53). Recientemente, en un metaanálisis con 8.780 participantes de 10 ensayos clínicos se corroboró que el uso de IBP disminuye el riesgo de úlceras gastrointestinales y sangrado asociado al uso de ácido acetilsalicílico a bajas dosis (54). Este hecho también se demostró con la doble antiagregación con clopidogrel sin producir un aumento de los eventos cardiovasculares.
El empleo de IBP en la profilaxis de la úlcera de estrés se ciñe a pacientes que se encuentran en unidades de cuidados intensivos y presentan factores de riesgo para úlcera péptica (antecedente de úlcera, fallo renal agudo, cirrosis hepática, coagulopatía, shock, sepsis grave, fallo multiorgánico, necesidad de ventilación mecánica, traumatismo craneoencefálico, neurocirugía o quemados leves) (52).
En la hemorragia digestiva alta por úlcera péptica con alto riesgo de resangrado, tras tratamiento endoscópico efectivo, los IBP en perfusión continua han demostrado reducir el sangrado recurrente frente a placebo (55). En las principales guías clínicas se ha recomendado el empleo de una o dos dosis intravenosas en bolus de IBP seguidas de una perfusión continua a 8 mg/h. Esta pauta se ha puesto en entredicho a raíz de un reciente metaanálisis que compara la administración intermitente de IBP frente a la perfusión continua, en el que se observa que la dosis intermitente es comparable a la perfusión continua en relación al riesgo de resangrado, mortalidad y necesidad de transfusión (56). Sin embargo, este trabajo tiene como limitaciones metodológicas la heterogeneidad en la frecuencia y en la dosis de administración del fármaco en los estudios comparados (57). Por otro lado, se ha descrito también que la administración de IBP oral e intravenoso logra similares tasas de resangrado, mortalidad, estancia hospitalaria y necesidad de cirugía tras sangrado por úlcera péptica de alto riesgo (58).
En la ERGE los síntomas muchas veces son más difíciles de controlar en aquellos pacientes que no presentan lesiones esofágicas (59). En muchos pacientes con ERGE erosiva los IBP no logran alcanzar la curación completa de las lesiones esofágicas, habiéndose descrito que más del 20% de los pacientes con ERGE presentan una respuesta insuficiente a omeprazol 20 mg administrado dos veces al día (60). Con altas dosis de omeprazol (80 mg/día) se consiguen mejorías en pacientes refractarios (60). Una de las probables causas de fallo en la eficacia de las dosis estándar es el fenómeno de escape de ácido nocturno, donde no se produce una adecuada inhibición ácida durante largos periodos de la noche (61). Sin embargo, aún hoy no está clara la importancia clínica de este fenómeno y si se correlaciona claramente con la falta de respuesta terapéutica de estos medicamentos. Otras causas de refractariedad al tratamiento son el mal cumplimiento terapéutico, hipotensión del esfínter esofágico inferior y la peristalsis esofágica ineficaz (62).
Uno de los tratamientos ensayados para el tratamiento de la dispepsia (no investigada y funcional) es el empleo de los IBP (63). Diversas revisiones sistemáticas han observado que los IBP son superiores al placebo en la desaparición o mejoría de los síntomas de dispepsia (64). La mayor eficacia se observa en los pacientes con síntomas ulcerosos o de reflujo gastroesofágico, sin encontrarse diferencias en el grupo con dispepsia tipo dismotilidad (65). A pesar de no presentar unos resultados clínicamente relevantes, se recomienda el empleo de IBP en estos pacientes por varias razones: son fármacos con pocos efectos secundarios y, además, se pueden beneficiar de este tratamiento pacientes mal clasificados como dispepsia funcional que presenten realmente una enfermedad ulcerosa péptica o una ERGE (36,66).
En la esofagitis eosinofílica, los IBP son útiles para el diagnóstico diferencial con la ERGE y la esofagitis eosinofílica respondedora a IBP (67,68). En la insuficiencia pancreática exocrina, se ha extendido el uso de estos medicamentos ante la refractariedad de la terapia enzimática sustitutiva. La asociación de un IBP al tratamiento enzimático, aumenta el pH y secundariamente disminuye la degradación de la lipasa (69).
Diferencias clínicas entre los distintos IBP
Si bien existen, como se ha mencionado anteriormente, ciertas disparidades farmacológicas entre los distintos IBP, las repercusiones de estas diferencias en su eficacia en la práctica clínica habitual para la curación de las distintas enfermedades en las que se emplean estos medicamentos son difíciles de establecer por la escasez de estudios comparativos de calidad. Sin embargo, sí hay datos que permiten orientar en determinadas enfermedades la elección de uno u otro IBP.
En la infección por H. pylori se ha demostrado que los IBP aumentan las tasas de erradicación de este microorganismo (70). La inhibición potente de la secreción ácida gástrica induce la estabilidad de los antibióticos en el ácido medio gástrico y aumenta la sensibilidad de algunos antibióticos frente a la bacteria (45). Los IBP de última generación, rabeprazol y esomeprazol, han demostrado tener una mayor capacidad inhibitoria sobre H. pylori que los de primera generación (71-73). Un reciente metaanálisis observa que el empleo de los IBP de última generación (rabeprazol y esomeprazol) en la triple terapia estándar obtiene tasas de erradicación más elevadas que cuando se utilizan con esta terapia los IBP de primera generación (74). Además, esta superioridad se mostró aún más manifiesta cuando se compararon esomeprazol administrado a dosis dobles con un IBP de primera generación. Sin embargo, no se observaron diferencias estadísticamente significativas entre el rabeprazol y el esomeprazol. Además, en ese mismo estudio, las tasas de erradicación de la nueva generación de IBP no se vieron afectadas por el fenotipo de CYP2C19, mientras que en los de primera generación había una tendencia a tasas de menor erradicación en los pacientes metabolizadores rápidos de IBP. Esto sugiere que a dosis estándar cualquier IBP produce máxima inhibición en metabolizadores lentos, mientras que en metabolizadores rápidos se requieren altas dosis de IBP para alcanzar el mismo grado de inhibición (74). Por esta razón, los IBP de nueva generación pueden ser una opción interesante en países con alta tasa de metabolizadores rápidos.
En el tratamiento de la ERGE en pacientes con síntomas típicos de la enfermedad y sin datos de alarma clínica, se recomienda el tratamiento empírico con un IBP a dosis estándar durante 2-4 semanas (63). Sin embargo, es conocido que aproximadamente un 75% de los pacientes con síntomas típicos de ERGE no presentan enfermedad por reflujo erosiva y que los síntomas graves no son predictores de esofagitis erosiva (75). En pacientes con ERGE se ha observado una mejoría clínica más rápida en los primeros cinco días con esomeprazol 40 mg frente a omeprazol 20 mg, lansoprazol 30 mg y pantoprazol 40 mg; sin embargo, estas diferencias no se mantienen a partir del quinto día de tratamiento (76). Eggleston y cols., comparando rabeprazol 20 mg con esomeprazol 20 mg y 40 mg en el tratamiento de la ERGE, no identificaron diferencias significativas entre rabeprazol 20 mg, esomeprazol 20 mg y esomeprazol 40 mg en la resolución de los síntomas (75). Respecto a la ERGE refractaria, un estudio reciente con pacientes con estas características que evalúa el efecto del cambio de IBP observa que un 28,4% de los pacientes no presentaron mejoría tras la administración de omeprazol 20 mg diarios durante 8 semanas y cuando en este grupo de pacientes se sustituyó el omeprazol por rabeprazol 20 mg diarios se observó una mejoría clínica en tan sólo el 23,5% (77).
En relación a la ERGE erosiva, en una reciente revisión sistemática en la que se compararon diferentes tipos de IBP en pacientes con esofagitis erosiva grave, grados C y D de la Clasificación de Los Ángeles, el esomeprazol 40 mg demostró una ventaja sustancial frente a los otros cuatro IBP (omeprazol 20 mg, omeprazol 40 mg, pantoprazol 40 mg y lansoprazol 30 mg) respecto a las tasas de curación a las 4 y 8 semanas (78). Las dosis bajas de IBP en comparación con la dosis estándar no son igual de efectivas en la curación de la esofagitis erosiva o la ERGE sintomática (79), esto difiere del tratamiento de mantenimiento de la ERGE, donde sí presentan una eficacia similar.
En el tratamiento de mantenimiento de la úlcera péptica se ha observado que las dosis bajas de IBP presentan efectos similares a las dosis estándar (79). No se han visto diferencias estadísticamente significativas en las tasas de cicatrización de las úlceras entre omeprazol, pantoprazol, lansoprazol y rabeprazol (80). No hay estudios que comparen esomeprazol con otros IBP.
Medicamento original, genérico, copia y similar
En el mercado farmacéutico se encuentra una gran cantidad de denominaciones comerciales de IBP: IBP originales, IBP genéricos e IBP similares. Las diferencias clínicas subjetivas observadas por algunos clínicos en la práctica clínica diaria con estos distintos tipos de IBP han puesto en tela de juicio el uso de los fármacos genéricos. Es importante dejar claramente establecidas las diferencias conceptuales entre los distintos tipos de preparaciones farmacológicas de los IBP:
- Los medicamentos originales son nuevas moléculas que han pasado por todas las fases de investigación en el desarrollo que se exige a un nuevo principio activo.
- Los medicamentos genéricos tienen el mismo principio activo, la misma dosis y forma farmacéutica que el fármaco original y han demostrado equivalencia terapéutica, es decir, ser bioequivalentes al original. Los estudios para determinar bioequivalencia analizan el área bajo la curva (AUC). Para ser considerados bioequivalentes, el AUC del nuevo fármaco frente al producto de referencia debe estar entre el 80 y el 125%. En el mercado español, los medicamentos genéricos se distinguen por presentar las siglas EFG (Especialidad Farmacéutica Genérica) en el envase y el etiquetado general (81).
- Otra especialidad son las llamadas copias, medicamentos con el mismo principio activo que el original pero que no han demostrado equivalencia terapéutica y, por tanto, los excipientes o diferencias en el proceso de elaboración pueden determinar diferencias en el comportamiento del fármaco. El real decreto de 1993 que regula el registro de medicamentos exigió la demostración de que todo fármaco que se registre debe demostrar equivalencia terapéutica respecto al medicamento de referencia. La patente de omeprazol permaneció en vigor en Europa hasta el año 1999, por lo que todos los fármacos registrados han tenido que demostrar bioequivalencia y, en teoría, no debería haber copias, sino IBP llamados similares. Los fármacos similares sí han demostrado la bioequivalencia pero no presentan las siglas EFG.
Existen muy pocos estudios que hayan investigado las diferencias clínicas entre IBP originales y genéricos. El más destacable es un estudio retrospectivo realizado en Israel donde se compararon el omeprazol original (Losec®) y el genérico (Omepradex®) en la erradicación de la infección por H. pylori con la triple terapia estándar (82). Con una muestra de 450 pacientes, no se encontraron diferencias estadísticamente significativas entre los dos fármacos utilizados. No se han encontrado estudios clínicos comparativos entre originales y similares.
Consejos para optimizar el tratamiento con IBP
A pesar del uso generalizado de los IBP, el desconocimiento de la dosis a utilizar o el horario de administración pueden reducir su efectividad. Por tanto, es importante conocer y explicar al paciente cuándo y cómo debe tomar los IBP.
Se recomienda administrar los IBP en ayunas y unos 30 minutos antes de la ingesta, ya que la presencia de alimentos en el estómago disminuye su absorción. Además, la administración en ayunas consigue que el pico de concentración plasmática coincida con el máximo número de bombas de protones activadas. En la ERGE nocturna, se ha visto que la administración de omeprazol antes de la cena alcanza niveles inhibitorios de ácido mayores que si se administra antes del desayuno (83). Por otro lado, en pacientes con ERGE la administración de dos dosis diarias frente a una sola dosis doble es más efectiva, aunque dificulta el cumplimiento terapéutico.
En relación a la dosis, esta debe individualizarse en función de la indicación clínica y la respuesta terapéutica. En la ERGE, según la intensidad de la sintomatología, se pueden alcanzar dosis de hasta 80 mg diarios de omeprazol (60). Esomeprazol 40 mg dos veces al día podría alcanzar respuestas mayores que omeprazol 80 mg/día (36). Se ha sugerido que la monitorización de pH gástrico durante el tratamiento puede ayudar a identificar los pacientes no respondedores al IBP a las dosis prescritas, pudiéndose aumentar la dosis hasta conseguir un correcto control, definido como pH mayor de 4 durante un mínimo de 16 horas. Sin embargo, la incomodidad de la prueba y el coste de la misma hacen no recomendar esta práctica clínica de forma sistemática (36).
En la erradicación del H. pylori actualmente se recomienda, para optimizar la eficacia erradicadora, la utilización de dosis dobles de IBP (84). Un reciente metaanálisis ha observado que con dosis dobles de IBP la tasa de curación se incrementa un 8% comparado con el empleo de dosis estándar (85). Otro metaanálisis ha demostrado que cuando el IBP se administra cada 12 horas, frente a una vez al día, las tasas de curación son también superiores (86).
Como ya se ha comentado anteriormente, las interacciones de los IBP con otros fármacos son escasas; sin embargo, la prescripción de IBP con clopidogrel es una de las que más se han visto cuestionadas ante la sospecha de un aumento de los eventos cardiovasculares (87). Este hecho condicionó el envío de comunicados por parte de la FDA y la European Medicines Agency (EMEA) en los que advertían sobre este riesgo e incluso desaconsejaban el uso concomitante de IBP y clopidogrel en pacientes con riesgo cardiovascular. La Agencia Española del Medicamento desaconseja el uso de clopidogrel con omeprazol y esomeprazol, a pesar de la falta de estudios sólidos, y la FDA recomienda como alternativa el pantoprazol en este tipo de pacientes. En 2012 se publicó un metaanálisis donde se observó que el uso concomitante de IBP con clopidogrel en pacientes con enfermedad coronaria se asoció con un aumento de síndrome coronario agudo o eventos cardiovasculares mayores. Sin embargo, la conclusión del estudio fue que no existía suficiente evidencia para poder afirmar que fuese por interacción medicamentosa (87). Dada la ausencia de evidencias definitivas parece que lo prudente sea sopesar adecuadamente los riesgos gastrointestinales y los riesgos cardiovasculares de cada paciente. Allá donde el riesgo gastrointestinal sea evidente, debemos ejercer una acción terapéutica de prevención efectiva con IBP. Ello no obvia, desde luego, que se deban ejercer otras acciones que minimicen las posibles interacciones (por ejemplo, administrar el IBP en una franja horaria totalmente diferente al del clopidogrel; mañana vs. noche) (88).
Conclusiones
Los IBP son una familia de medicamentos muy eficaces para el tratamiento y la prevención de enfermedades frecuentes e importantes del aparato digestivo relacionadas con la secreción ácida gástrica. Poseen un buen perfil farmacológico y de seguridad para el paciente, tanto en administraciones cortas como cuando se administran de forma prolongada en el tiempo. Estas características han condicionado que en los últimos años se haya producido un sobreuso en el empleo de estos medicamentos en nuestro medio sanitario tanto a nivel ambulatorio como hospitalario, por ello se requiere que su empleo se ajuste a las indicaciones establecidas de acuerdo a las evidencias clínicas. Si bien las diferentes moléculas de los IBP muestran un perfil de eficacia clínica muy alto en las diferentes indicaciones terapéuticas, los IBP de última generación se han mostrado más eficaces en el tratamiento erradicador de la infección por H. pylori y en la esofagitis péptica grave. Existen muy pocos estudios que hayan analizado la eficacia de los IBP originales frente a las preparaciones genéricas de estos medicamentos, no habiéndose demostrado hasta el momento diferencias clínicas en su empleo. En los próximos años dispondremos de nuevas moléculas de fármacos antisecretores gástricos que mejorarán aún más el excelente perfil farmacológico y clínico de los IBP.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Lara Aguilera Castro.
Servicio de Gastroenterología y Hepatología.
Hospital Universitario Ramón y Cajal, IRYCIS.
Ctra. Colmenar Viejo, km. 9,100. 28034 Madrid
e-mail: laraaguilera88@hotmail.com
Recibido: 16-04-2015
Aceptado: 12-06-2015
Bibliografía
1. Díaz-Rubio M. Historical perspective of gastric acid inhibition. Drugs 2005;65(Suppl1):1-6. [ Links ]
2. Banic M, Malfertheiner P, Babic Z, et al. Historical impact to drive research in peptic ulcer disease. Dig Dis 2011;29:444-53. DOI: 10.1159/000331512. [ Links ]
3. Black JW, Duncan WA, Durant CJ, et al. Definition and antagonism of histamine H2-receptors. Nature 1972;236:385-90. DOI: 10.1038/236385a0. [ Links ]
4. Martín de Argila de Prados C. Crónica de una revolución: Manejo de las enfermedades relacionadas con la secreción ácida del estómago. Línea de comunicación 2015, Madrid (en imprenta). [ Links ]
5. Vela MF. Medical treatments of GERD: The old and new. Gastroenterol Clin North Am 2014;43:121-33. DOI: 10.1016/j.gtc.2013.12.001. [ Links ]
6. Sachs G. Pump blockers and ulcer disease. N Engl J Med 1984;310:785-6. DOI: 10.1056/NEJM198403223101211. [ Links ]
7. Subgrupos ATC y principios activos de mayor consumo en el Sistema Nacional de Salud en 2010. Información terapéutica del Sistema Nacional de Salud 2011;35:124-128. [ Links ]
8. García del Pozo J. Estudio de utilización de antiulcerosos en España (2000-2008). Información terapéutica de la Seguridad Social 2009; 33:49-54. [ Links ]
9. Simo Miñana J. Utilización de medicamentos en España y en Europa. Aten Primaria 2012;44:335-47. DOI: 10.1016/j.aprim.2011.06.009. [ Links ]
10. Sánchez-Cuen JA, Irineo-Cabrales AB, Bernal-Magana G, et al. Inadequate prescription of chronic consumption of proton pump inhibitors in a hospital in Mexico. Cross-sectional study. Rev Esp Enferm Dig 2013;105:131-6. DOI: 10.4321/S1130-01082013000300003. [ Links ]
11. Ponce J, Esplugues JV. Rationalizing the use of PPIs: An unresolved matter. Rev Esp Enferm Dig 2013;105:121-4. DOI: 10.4321/S1130-01082013000300001. [ Links ]
12. Ksiadzyna D, Szelag A, Paradowski L. Overuse of proton pump inhibitors. Pol Arch Med Wewn 2015 (en imprenta). [ Links ]
13. Martín-Echevarría E, Pereira Juliá A, Torralba M, et al. Evaluación del uso de los inhibidores de la bomba de protones en un servicio de medicina interna. Rev Esp Enferm Dig 2008;100:76-81. DOI: 10.4321/S1130-01082008000200003. [ Links ]
14. De Burgos Lunar C, Novo del Castillo S, Llorente Díaz E, et al. Estudio de prescripción-indicación de inhibidores de la bomba de protones. Rev Clin Esp 2006;206:266-70. DOI: 10.1157/13088585. [ Links ]
15. Zink DA, Pohlman M, Barnes M, et al. Long-term use of acid suppression started inappropriately during hospitalization. Aliment Pharmacol Ther 2005;21:1203-9. DOI: 10.1111/j.1365-2036.2005.02454.x. [ Links ]
16. Eid SM, Boueiz A, Paranji S, et al. Patterns and predictors of proton pump inhibitor overuse among academic and non-academic hospitalists. Intern Med 2010;49:2561-8. DOI: 10.2169/internalmedicine.49.4064. [ Links ]
17. García Rodríguez LA, Ruigómez A, Panes J. Use of acid-suppressing drugs and the risk of bacterial gastroenteritis. Clin Gastroenterol Hepatol 2007;5:1418-23. DOI: 10.1016/j.cgh.2007.09.010. [ Links ]
18. Bavishi C, Dupont HL. Systematic review: The use of proton pump inhibitors and increased susceptibility to enteric infection. Aliment Pharmacol Ther 2011;34:1269-1281. DOI: 10.1111/j.1365-2036.2011.04874.x. [ Links ]
19. Janarthanan S, Ditah I, Adler DG, et al. Clostridium difficile-associated diarrhoea and proton pump inhibitor therapy: A meta-analysis. Am J Gastroenterol 2012;107:1001-10. DOI: 10.1038/ajg.2012.179. [ Links ]
20. Leonard J, Marshall JK, Moayyedi P. Systematic review of the risk of enteric infection in patients taking acid suppression. Am J Gastroenterol 2007;102:2047-56. DOI: 10.1111/j.1572-0241.2007. 01275.x. [ Links ]
21. Laheij RJ, Sturkenboom MC, Hassing RJ, et al. Risk of community-acquired pneumonia and use of gastric acidsuppressive drugs. JAMA 2004;292:1955-60. DOI: 10.1001/jama.292.16.1955. [ Links ]
22. Gulmez SE, Holm A, Frederiksen H, et al. Use of proton pump inhibitors and the risk of community-acquired pneumonia: A population-based case-control study. Arch Intern Med 2007;167:950-5. DOI: 10.1001/archinte.167.9.950. [ Links ]
23. Eom CS, Jeon CY, Lim JW, et al. Use of acid-suppressive drugs and risk of pneumonia: A systematic review and metaanalysis. CMAJ 2011;183:310-19. DOI: 10.1503/cmaj.092129. [ Links ]
24. Dublin S, Walker RL, Jackson ML, et al. Use of proton pump inhibitors and H2 blockers and risk of pneumonia in older adults: A population-based case control study. Pharmacoepidemiol Drug Saf 2010;19:792-802. DOI: 10.1002/pds.1978. [ Links ]
25. Filion KB, Chateau D, Targownik LE, et al. Proton pump inhibitors and the risk of hospitalization for community-acquired pneumonia: Replicated cohort studies with meta-analysis. Gut 2014;63:552-8. DOI: 10.1136/gutjnl-2013-304738. [ Links ]
26. Wang YP, Liu CJ, Chen TJ, et al. Proton pump inhibitor use significantly increases the risk of cryptogenic liver abscess: A population-based study. Aliment Pharmacol Ther 2015;41:1175-81. DOI: 10.1111/apt.13203. [ Links ]
27. Khalili H, Huang ES, Jacobson BC, et al. Use of proton pump inhibitors and risk of hip fracture in relation to dietary and lifestyle factors: A prospective cohort study. BMJ 2012;344:e372. DOI: 10.1136/bmj.e372. [ Links ]
28. Targownik LE, Lix LM, Leung S, et al. Proton-pump inhibitor use is not associated with osteoporosis or accelerated bone mineral density loss. Gastroenterology 2010;138:896-904. DOI: 10.1053/j.gastro.2009.11.014. [ Links ]
29. Lam JR, Schneider JL, Zhao W, et al. Gastric acid-inhibiting medications and vitamin B12 deficiency. JAMA 2013;310:2435-42. DOI: 10.1001/jama.2013.280490. [ Links ]
30. Jung SB, Nagaraja V, Kapur A, et al. Association between vitamin B12 deficiency and long-term use of acid-lowering agents: A systematic review and meta-analysis. Intern Med J 2015;45:409-16. DOI: 10.1111/imj.12697. [ Links ]
31. Danziger J, William JH, Scott DJ, et al. Proton-pump inhibitor use is associated with low serum magnesium concentrations. Kidney Int 2013;83:692-699. DOI: 10.1038/ki.2012.452. [ Links ]
32. Sumukadas D, McMurdo MET, Habicht D. Proton pump inhibitors are associated with lower magnesium levels in older people with chronic kidney disease. J Am Geriatr Soc 2012;60:392-3. DOI: 10.1111/j.1532-5415.2011.03808.x. [ Links ]
33. FDA Drug Safety Communication. Low magnesium levels can be associated with long term use of proton pump inhibitor drugs (PPIs). Washington DC, US. Food and Drug Administration, 2011. [ Links ]
34. Attwood SE, Ell C, Galmiche JP, et al. Long-term safety of proton pump inhibitor therapy assessed under controlled, randomized clinical trial conditions: Data from the SOPRAN and LOTUS studies. Aliment Pharmacol Ther 2015;41:1162-74. DOI: 10.1111/apt.13194. [ Links ]
35. Esplugues JV. A pharmacological approach to gastric acid inhibition. Drugs 2005;65(Suppl1):7-12. DOI: 10.2165/00003495-200565001-00003. [ Links ]
36. Gomollon F, Calvet X. Optimizing acid inhibition treatment. Drugs 2005;65(Suppl1):25-33. DOI: 10.2165/00003495-200565001-00004. [ Links ]
37. Sjostrom JE, Larsson H. Factors affecting growth and antibiotic susceptibility of Helicobacter pylori: Effect of pH and urea on the survival of a wild-type strain and a urease-deficient mutant. J Med Microbiol 1996;44:425-33. DOI: 10.1099/00222615-44-6-425. [ Links ]
38. Robinson M, Horn J. Clinical pharmacology of proton pump inhibitors: What the practicing physician needs to know. Drugs 2003;63:2739-54. DOI: 10.2165/00003495-200363240-00004. [ Links ]
39. Martín de Argila C. Safety of potent gastric acid inhibition. Drugs 2005;65(Suppl1):97-104. DOI: 10.2165/00003495-200565001-00013. [ Links ]
40. Kuo CH, Lu CY, Shih HY, et al. CYP2C19 polymorphism influences Helicobacter pylori eradication. World J Gastroenterol 2014;20:16029-36. [ Links ]
41. Inaba T, Mizuno M, Kawai K, et al. Randomized open trial for comparison of proton pump inhibitors in triple therapy for Helicobacter pylori infection in relation to CYP2C19 genotype. J Gastroenterol Hepatol 2002;17:748-53. DOI: 10.1046/j.1440-1746.2002.02790.x. [ Links ]
42. Ishizaki T, Horai Y. Review article: Cytochrome P450 and the metabolism of proton pump inhibitors - Emphasis on rabeprazole. Aliment Pharmacol Ther 1999;13(Suppl3):27-36. DOI: 10.1046/j.1365-2036.1999.00022.x. [ Links ]
43. Furuta T, Sugimoto M, Shirai N, et al. CYP2C19 pharmacogenomics associated with therapy of Helicobacter pylori infection and gastro-esophageal reflux diseases with a proton pump inhibitor. Pharmacogenomics 2007;8:1199-210. DOI: 10.2217/14622416.8.9.1199. [ Links ]
44. Orlando RC. Why is the high grade inhibition of gastric acid secretion afforded by proton pump inhibitors often required for healing of reflux esophagitis? An epithelial perspective. Am J Gastroenterol 1996;91:1692-6. [ Links ]
45. Calvet X, Gomollon F. What is potent acid inhibition, and how can it be achieved? Drugs 2005;65(Suppl1):13-23. DOI: 10.2165/00003495-200565001-00004. [ Links ]
46. Hatlebakk JG. Review article: gastric acidity - Comparison of esomeprazole with other proton pump inhibitors. Aliment Pharmacol Ther 2003;17(Suppl1):10-5. DOI: 10.1046/j.1365-2036.17.s1.3.x. [ Links ]
47. Verdu EF, Armstrong D, Idstrom JP, et al. Intragastric pH during treatment with omeprazole: Role of Helicobacter pylori and H. pylori-associated gastritis. Scand J Gastroenterol 1996;31:1151-6. [ Links ]
48. Labenz J, Tillenburg B, Peitz U, et al. Efficacy of omeprazole one year after cure of Helicobacter pylori infection in duodenal ulcer patients. Am J Gastroenterol 1997;92:576-81. [ Links ]
49. Holtmann G, Bytzer P, Metz M, et al. A randomized, double-blind, comparative study of standard-dose rabeprazole and high-dose omeprazole in gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2002;16:479-85. DOI: 10.1046/j.1365-2036.2002.01207.x. [ Links ]
50. Miner PJr, Katz PO, Chen Y, et al. Gastric acid control with esomeprazole, lansoprazole, omeprazole, pantoprazole, and rabeprazole: A five-way crossover study. Am J Gastroenterol 2003;98:2616-20. DOI: 10.1111/j.1572-0241.2003.08783.x. [ Links ]
51. Labenz J, Petersen KU, Rösch W, et al. A summary of food and drug administration-reported adverse events and drug interactions occurring during therapy with omeprazole, lansoprazole and pantoprazole. Aliment Pharmacol Ther 2003;17:1015-9. DOI: 10.1046/j.1365-2036.2003.01550.x. [ Links ]
52. Gisbert JP, Martín de Argila de Prados C. Tratamiento de las enfermedades gastroenterológicas. Asociación Española de Gastroenterología. En: Ponce García J, editor. Úlcera péptica e infección por Helicobacter pylori. Barcelona: Elsevier; 2011. p. 109-21. [ Links ]
53. Arroyo Villarino MT, Lanas Arbeloa A. Tratamiento de las enfermedades gastroenterológicas. Asociación Española de Gastroenterología, Ponce García J, editores. Gastroenteropatía por AINE. Barcelona: Elsevier; 2011. p. 123-31. [ Links ]
54. Mo C, Sun G, Lu ML, et al. Proton pump inhibitors in prevention of low-dose aspirin-associated upper gastrointestinal injuries. World J Gastroenterol 2015;21:5382-92. DOI: 10.3748/wjg.v21.i17.5382. [ Links ]
55. Sung JJ, Barkun A, Kuipers EJ, et al. Intravenous esomeprazole for prevention of recurrent peptic ulcer bleeding: A randomized trial. Ann Intern Med 2009;150:455-64. DOI: 10.7326/0003-4819-150-7-200904070-00105. [ Links ]
56. Sachar H, Vaidya K, Laine L. Intermittent vs. continuous proton pump inhibitor therapy for high-risk bleeding ulcers: A systematic review and meta-analysis. JAMA Intern Med 2014;174:1755-62. DOI: 10.1001/jamainternmed.2014.4056. [ Links ]
57. Hsu YC, Lin HJ. Intermittent bolus or continuous infusion of proton pump inhibitors for ulcer bleeding? JAMA Intern Med 2015;175:461. [ Links ]
58. Yen HH, Yang CW, Su WW, et al. Oral versus intravenous proton pump inhibitors in preventing re-bleeding for patients with peptic ulcer bleeding after successful endoscopic therapy. BMC Gastroenterol 2012;12:66. DOI: 10.1186/1471-230X-12-66. [ Links ]
59. Dean BB, Gano AD, Knight K, et al. Effectiveness of proton pump inhibitors in non-erosive reflux disease. Clin Gastroenterol Hepatol 2004;2:656-64. DOI: 10.1016/S1542-3565(04)00288-5. [ Links ]
60. Leite LP, Johnston BT, Just RJ, et al. Persistent acid secretion during omeprazole therapy: A study of gastric acid profiles in patients demonstrating failure of omeprazole therapy. Am J Gastroenterol 1996;91:1527-31. [ Links ]
61. Badillo R, Francis D. Diagnosis and treatment of gastroesophageal reflux disease. World J Gastrointest Pharmacol Ther 2014;5:105-12. DOI: 10.4292/wjgpt.v5.i3.105. [ Links ]
62. Subramanian CR, Triadafilopoulos G. Refractory gastroesophageal reflux disease. Gastroenterol Rep (Oxf) 2015;3:41-53. DOI: 10.1093/gastro/gou061. [ Links ]
63. Gisbert JP, Calvet X, Ferrandiz J, et al. Guía de práctica clínica sobre el manejo del paciente con dispepsia. Actualizacion 2012. Gastroenterol Hepatol 2012;35:725e1-38. DOI: 10.1016/j.gastrohep.2012.05.002. [ Links ]
64. Soo S, Moayyedi P, Deeks J, et al. Pharmacological interventions for non-ulcer dyspepsia. The Cochrane database of systematic reviews 2000; CD001960. [ Links ]
65. Talley NJ, Lauritsen K. The potential role of acid suppression in functional dyspepsia: The BOND, OPERA, PILOT, and ENCORE studies. Gut 2002;50(Suppl4):36-41. DOI: 10.1136/gut.50.suppl_4.iv36. [ Links ]
66. Mascort JJ, Marzo M, Alonso-Coello P, et al. Guía de práctica clínica sobre el manejo del paciente con dispepsia. Gastroenterol Hepatol 2003;26:571-613. DOI: 10.1016/S0210-5705(03)70414-2. [ Links ]
67. Dellon ES. Diagnosis and management of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:1066-78. DOI: 10.1016/j.cgh.2012.06.003. [ Links ]
68. Molina-Infante J, Katzka DA, Dellon ES. Proton pump inhibitor-responsive esophageal eosinophilia: A historical perspective on a novel and evolving entity. Rev Esp Enferm Dig 2015;107:29-36. [ Links ]
69. Lindkvist B. Diagnosis and treatment of pancreatic exocrine insufficiency. World J Gastroenterol 2013;19:7258-66. DOI: 10.3748/wjg.v19.i42.7258. [ Links ]
70. Boparai V, Rajagopalan J, Triadafilopoulos G. Guide to the use of proton pump inhibitors in adult patients. Drugs 2008;68:925-47. DOI: 10.2165/00003495-200868070-00004. [ Links ]
71. Kirchheiner J, Glatt S, Fuhr U, et al. Relative potency of proton-pump inhibitors-comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009;65:19-31. DOI: 10.1007/s00228-008-0576-5. [ Links ]
72. McKeage K, Blick SK, Croxtall JD, et al. Esomeprazole: A review of its use in the management of gastric acid-related diseases in adults. Drugs 2008;68:1571-607. DOI: 10.2165/00003495-200868110-00009. [ Links ]
73. Baldwin CM, Keam SJ. Rabeprazole: A review of its use in the management of gastric acid-related diseases in adults. Drugs 2009;69:1373-401. DOI: 10.2165/00003495-200969100-00007. [ Links ]
74. McNicholl AG, Linares PM, Nyssen OP, et al. Meta-analysis: Esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 2012;36:414-25. DOI: 10.1111/j.1365-2036.2012.05211.x. [ Links ]
75. Eggleston A, Katelaris PH, Nandurkar S, et al. Clinical trial: The treatment of gastro-oesophageal reflux disease in primary care - Prospective randomized comparison of rabeprazole 20 mg with esomeprazole 20 and 40 mg. Aliment Pharmacol Ther 2009;29:967-78. DOI: 10.1111/j.1365-2036.2009.03948.x. [ Links ]
76. Zheng RN. Comparative study of omeprazole, lansoprazole, pantoprazole and esomeprazole for symptom relief in patients with reflux esophagitis. World J Gastroenterol 2009;15:990-5. DOI: 10.3748/wjg.15.990. [ Links ]
77. Takeuchi T, Oota K, Harada S, et al. Characteristics of refractory gastroesophageal reflux disease (GERD) symptoms - Is switching proton pump inhibitors based on the patient's CYP2C19 genotype an effective management strategy? Intern Med 2015;54:97-105. [ Links ]
78. Edwards SJ, Lind T, Lundell L, et al. Systematic review: Standard and double-dose proton pump inhibitors for the healing of severe erosive oesophagitis - A mixed treatment comparison of randomized controlled trials. Aliment Pharmacol Ther 2009;30:547-56. DOI: 10.1111/j.1365-2036.2009.04077.x. [ Links ]
79. Vakil N, Fennerty MB. Direct comparative trials of the efficacy of proton pump inhibitors in the management of gastro-oesophageal reflux disease and peptic ulcer disease. Aliment Pharmacol Ther 2003;18:559-68. DOI: 10.1046/j.1365-2036.2003.01756.x. [ Links ]
80. Klok RM, Postma MJ, Van Hout BA, et al. Meta-analysis: Comparing the efficacy of proton pump inhibitors in short-term use. Aliment Pharmacol Ther 2003;17:1237-45. DOI: 10.1046/j.1365-2036.2003.01562.x. [ Links ]
81. Díez MV, Errecalde MF. Aclaraciones al concepto de genérico. Información terapéutica del Sistema Nacional de Salud 1998;22:68-72. [ Links ]
82. Niv Y. Comparison of proton pump inhibitor-based triple therapy with losec and the generic drug, Omepradex, for efficacy of Helicobacter pylori eradication. Dig Dis Sci 2005;50:623-5. DOI: 10.1007/s10620-005-2546-4. [ Links ]
83. Hatlebakk JG, Katz PO, Kuo B, et al. Nocturnal gastric acidity and acid breakthrough on different regimens of omeprazole 40 mg daily. Aliment Pharmacol Ther 1998;12:1235-40. DOI: 10.1046/j.1365-2036.1998.00426.x. [ Links ]
84. Gisbert JP, Calvet X, Bermejo F, et al. III Conferencia Española de Consenso sobre la infección por Helicobacter pylori. Gastroenterol Hepatol 2013;36:340-74. DOI: 10.1016/j.gastrohep.2013.01.011. [ Links ]
85. Villoria A, Garcia P, Calvet X, et al. Meta-analysis: High-dose proton pump inhibitors vs. standard dose in triple therapy for Helicobacter pylori eradication. Aliment Pharmacol Ther 2008;28:868-77. [ Links ]
86. Vallve M, Vergara M, Gisbert JP, et al. Single vs. double dose of a proton pump inhibitor in triple therapy for Helicobacter pylori eradication: A meta-analysis. Aliment Pharmacol Ther 2002;16:1149-56. DOI: 10.1046/j.1365-2036.2002.01270.x. [ Links ]
87. Lanas A. Inhibidores de la bomba de protones y clopidogrel en el paciente cardiovascular: ¿Riesgo cardiovascular versus riesgo gastrointestinal? Gastroenterol Hepatol 2010;33:1-5. [ Links ]
88. Huang B, Huang Y, Li Y, et al. Adverse cardiovascular effects of concomitant use of proton pump inhibitors and clopidogrel in patients with coronary artery disease: A systematic review and meta-analysis. Arch Med Res 2012;43:212-24. DOI: 10.1016/j.arcmed.2012.04.004. [ Links ]











 texto en
texto en