Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.39 no.6 Toledo nov./dic. 2015
https://dx.doi.org/10.7399/fh.2015.39.6.8305
ORIGINALES
Toxicidad hematológica inducida por linezolid
Linezolid-induced haematological toxicity
Libe Moraza, Leire Leache, Irene Aquerreta y Ana Ortega
Pharmacy Unit, Clínica Universidad de Navarra, Pamplona, Spain.
Dirección para correspondencia
RESUMEN
Objetivo: determinar la incidencia de toxicidad hematológica por linezolid. Estudiar la influencia del aclaramiento renal en su aparición y la efectividad de la piridoxina en su prevención.
Método: estudio observacional retrospectivo de todos los pacientes tratados con linezolid en un hospital universitario en seis meses. Se consideró toxicidad hematológica a la disminución del 25% de la hemoglobina, del 25% de las plaquetas y/o del 50% de neutrófilos al final respecto al inicio del tratamiento. Se comparó en los pacientes con y sin fallo renal (aclaramiento de creatinina inferior a 50 mL/min), con más o menos de 30 mL/min, y con o sin piridoxina, la incidencia de toxicidad hematológica mediante Chi-Cuadrado y la disminución en el porcentaje de variables analíticas hematológicas mediante U Mann-Whitney.
Resultados: se evaluaron 38 pacientes. Dieciséis (42%) presentaron toxicidad hematológica (2 por disminución de hemoglobina, 9 de plaquetas y 8 de neutrófilos). En 2 pacientes (5%) se suspendió el tratamiento por plaquetopenia. La incidencia de toxicidad fue similar en pacientes con y sin insuficiencia renal, 42% vs. 42%, p = 0,970, con más o menos de 30 mL/min, 67% vs. 40%, p = 0,369, con piridoxina o sin ella, 47,8% vs. 33%, p = 0,376. Los pacientes con fallo renal presentaron una reducción significativamente mayor de plaquetas, p = 0,0185.
Conclusiones: un 42% de los pacientes presentó toxicidad hematológica, más frecuentemente disminución de plaquetas y neutrófilos. Esta no fue significativamente mayor en los pacientes con fallo renal, ni en aquellos sin piridoxina. Se halló mayor reducción de plaquetas en los pacientes con insuficiencia renal.
Palabras clave: Linezolid; Piridoxina; Insuficiencia renal; Neutropenia; Trombocitopenia.
ABSTRACT
Objective: to determine the incidence of linezolid-induced haematological toxicity and study the influence of renal clearance on its appearance and the preventive effect of pyridoxine.
Methods: a retrospective observational study was conducted. Every patient treated with linezolid in a university hospital during 6 months was included. Haematological toxicity was defined as a decrease of 25% in hemoglobin, of 25% in platelets and/or 50% in neutrophils from baseline. The incidence of haematological toxicity and the percentage decrease in analytical variables were compared in patients with and without renal failure (creatinine clearance lower than 50 mL/min), using the 30 mL/min threshold, and with or without pyridoxine; using Chi -Square and U Mann-Whitney tests, respectively.
Results: thirty-eight patients were evaluated. Sixteen (42%) presented haematological toxicity (2 due to a decrease in haemoglobin, 9 in platelets and 8 in neutrophils). Two patients (5%) discontinued treatment due to thrombocytopenia. Toxicity incidence was similar in patients with and without renal failure, 42% vs 42%, p = 0.970, with more or less than 30 ml/min, 67% vs 40%, p = 0.369, or with or without pyridoxine, 47.8% vs 33%, p = 0.376. Patients with renal failure had a significantly greater reduction in platelet count, p = 0.0185.
Conclusion: forty-two percent of patients had haematological toxicity, being more frequent platelets and neutrophils reduction. This was not significantly higher in patients with renal failure or in those without pyridoxine. Greater reduction in platelet count was observed in patients with renal failure.
Key words: Linezolid; Pyridoxine; Renal insufficiency; Neutropenia; Thrombocytopenia.
Introducción
Linezolid es un agente antibacteriano sintético perteneciente al grupo de las oxazolidinonas1-6. Es un antibiótico de amplio espectro que posee actividad frente a bacterias aeróbicas grampositivas y microorganismos anaerobios1-6. Presenta actividad bacteriostática contra enterococos y estafilococos, y bactericida contra la mayoría de las cepas de estreptococos6.
Las indicaciones aprobadas por la Agencia Española de Medicamentos y Productos Sanitarios son neumonía nosocomial, neumonía adquirida en la comunidad e infección de piel y tejidos blandos1-6.
En lo que respecta a su perfil de seguridad, la principal reacción adversa consiste en la toxicidad hematológica1-6. Están especialmente descritas la trombocitopenia, con una incidencia entre el 32%7 y el 45,8%8, y la anemia, con una incidencia de un 25%8. En algunos pacientes estos eventos han llevado a la suspensión del tratamiento8-9. En otras ocasiones, los efectos adversos han llevado a la necesidad de transfusión7,10.
En la práctica clínica se encuentra extendida la administración simultánea de piridoxina para la prevención de la toxicidad hematológica. Sin embargo, existen datos contradictorios sobre su eficacia y se desconoce el mecanismo exacto por el cual se podría explicar este efecto8,9,11.
Por otra parte, se ha observado una mayor probabilidad de desarrollar toxicidad hematológica en aquellos pacientes que presentan deterioro de la función renal9,12-15.
Ante esta variabilidad en la información publicada, el objetivo principal de este estudio es determinar la incidencia de toxicidad hematológica en los pacientes tratados con linezolid en un hospital universitario. Como objetivos secundarios, además, se pretende analizar el posible efecto protector de la administración de piridoxina y la posible influencia de la función renal en el desarrollo de la toxicidad hematológica.
Métodos
Se diseñó un estudio observacional de tipo retrospectivo. El estudio fue aprobado por el Comité de Ética autonómico y recibió la autorización y clasificación de la Agencia Española de Medicamentos y Productos Sanitarios.
Se incluyeron aquellos pacientes ingresados en un hospital universitario que recibieron tratamiento con linezolid por vía intravenosa u oral en un periodo de 6 meses.
Para el cálculo del tamaño muestral se tomó como referencia el estudio de Plachouras et al.8, donde se observó una incidencia de trombocitopenia de un 45,8%. Tomando un margen de error, para el intervalo de confianza del 95%, de ± 17%, serían necesarios 33 pacientes. Se estimó que en 6 meses se reclutaría este número de pacientes.
Para evaluar la toxicidad hematológica se recogió la analítica correspondiente al primer y último día del tratamiento con linezolid. En caso de no disponer de la analítica correspondiente a las fechas mencionadas, se tomó como referencia la analítica del día anterior o posterior a la misma. Los pacientes que no disponían de analítica correspondiente al inicio y al final del tratamiento con linezolid fueron excluidos.
Se recogieron las siguientes variables de las historias clínicas de los pacientes incluidas en el sistema de información del centro:
a. Variables recogidas al inicio del tratamiento con linezolid:
- Demográficas: sexo, edad, peso, talla, superficie corporal (SC), índice de masa corporal (IMC).
- Clínicas: diagnóstico oncológico (si/no), administración o no de quimioterapia en los últimos 6 meses, administración o no de tratamiento inmunosupresor, creatinina, aclaramiento de creatinina estimado mediante la fórmula de Cockcroft y Gault (ClCr), Urea, proteína C reactiva, procalcitonina.
b. Variables recogidas respecto al tratamiento con linezolid y piridoxina:
- Indicación de uso del linezolid, dosis de linezolid, intervalo posológico de linezolid, vía de administración de linezolid, dosis de piridoxina, vía de administración de piridoxina.
c. Variables analíticas recogidas al inicio y final del tratamiento con linezolid para evaluar la toxicidad hematológica: Hematíes, hemoglobina, hematocrito, leucocitos, neutrófilos, linfocitos, monocitos, plaquetas.
d. Otras variables: Transfusiones sanguíneas
La base de datos utilizada para el análisis fue anonimizada.
Se clasificó el grado de anemia, plaquetopenia y neutropenia siguiendo la clasificación de la versión 4.0 de la Common Terminology Criteria for Adverse Events (CT-CAE)16 y según la analítica correspondiente al último día de tratamiento con linezolid.
En cada paciente, se calculó el porcentaje de disminución, entre el inicio y el fin de tratamiento con linezolid, en el nivel de hemoglobina (DH), en el recuento de plaquetas (DPQ) y en el recuento de neutrófilos (DN).
Se consideró toxicidad hematológica una DH mayor o igual a un 25% (TDH)17, una DPQ mayor o igual a un 25 % (TDPQ)9,11,17 y/o una DN mayor o igual a un 50% (TDN)11.
Se consideró insuficiencia renal un ClCr inferior a 50 mL/min (IR). También se evaluó la influencia de un ClCr menor a 30 mL/min.
Se compararon los valores de DH, DPQ y DN entre los pacientes con y sin tratamiento simultáneo con piridoxina, entre los pacientes con y sin IR y entre los pacientes con ClCr mayor o menor a 30 mL/min mediante el test de U Mann-Whitney. Se analizó la diferencia en la incidencia en toxicidad hematológica entre estos grupos de pacientes mediante Chi-Cuadrado. Adicionalmente se estudió la relación entre el ClCr, o la duración del tratamiento con linezolid, y DH, DPQ y DN mediante regresión lineal. Además se estudió el coeficiente de correlación de Spearman de la relación entre ClCr y DH, DPQ y DN. La normalidad de las variables se estudió mediante el test de Shapiro-Wilk. El análisis estadístico se llevó a cabo mediante el programa STATA 12.
Resultados
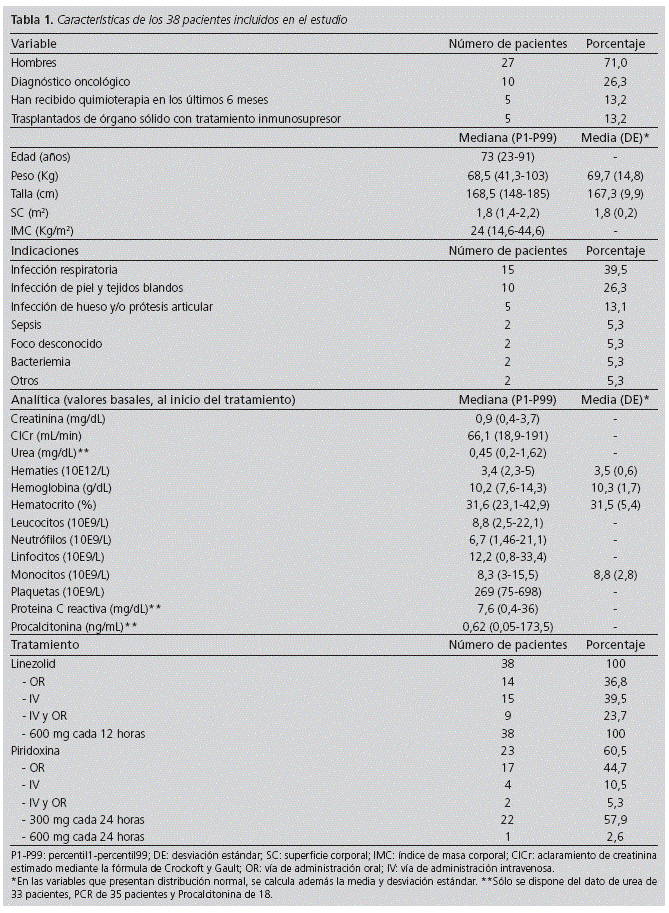
Se incluyeron un total de 38 pacientes en el estudio. En la tabla 1 se muestran las características demográficas, clínicas y analíticas de los pacientes incluidos en el estudio, así como las características de sus tratamientos con linezolid y piridoxina. Se excluyeron 7 pacientes, ya que no se disponía de la analítica para evaluar la toxicidad hematológica.
Todos los pacientes incluidos en el estudio recibieron linezolid a dosis de 600 mg cada 12 horas, por vía oral o intravenosa. El 60,5 % de los pacientes, 23 pacientes, recibieron además piridoxina durante la duración del tratamiento con linezolid, a dosis de 300 mg al día por vía oral o intravenosa, excepto un paciente que recibió 600 mg al día. El uso de piridoxina no estaba protocolizado y fue mayor cuando se publicaron estudios favorables a su uso. La mediana (Percentil 1-Percentil 99) y la media (desviación estándar (DE)) de la duración de la terapia con linezolid en nuestra población fue de 7,5 (1-46) y 8,4 (7,4) días, respectivamente.
Respecto a las indicaciones del tratamiento con linezolid, 15 pacientes (39,5%) fueron diagnosticados de infección respiratoria y 10 pacientes (26,3%) de infección de piel y tejidos blandos. Entre estos últimos, la mayoría presentaban celulitis y/o úlcera o infección de herida quirúrgica abdominal. El resto de los pacientes incluidos en el estudio, 13 pacientes, presentaban infección de hueso y/o prótesis articular (5 pacientes), sepsis, bacteriemia o infección de origen desconocido.
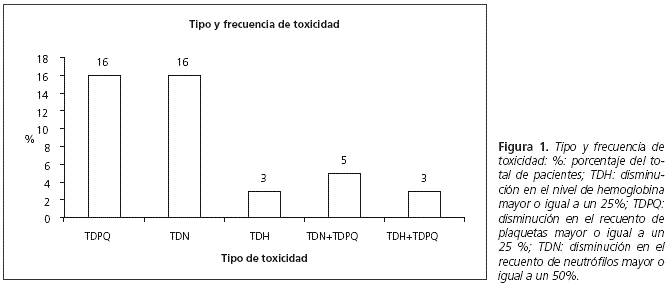
Un total de 16 pacientes, el 42% de los incluidos en el estudio, presentó toxicidad hematológica. El 5% del total de pacientes, 2 pacientes, tuvo toxicidad por diminución en el valor de hemoglobina, el 24%, 9 pacientes, por diminución en las plaquetas y el 21%, 8 pacientes, por disminución de los neutrófilos. En la figura 1 se muestran el tipo y frecuencia de toxicidad observada, teniendo en cuenta que algunos pacientes presentaron más de un tipo de toxicidad. De los pacientes con diagnóstico oncológico, 4 (40 %) presentaron toxicidad hematológica. En la tabla 2 se muestra el porcentaje de reducción en la hemoglobina, plaquetas y neutrófilos en los pacientes que presentaron toxicidad hematológica y en los que no la presentaron.
Entre los pacientes que al finalizar el tratamiento con linezolid presentaron un empeoramiento de los parámetros hematológicos respecto al inicio de tratamiento, 6 pacientes (16%) presentaron anemia grado II y 3 pacientes (8%) anemia grado III. Un paciente presentó neutropenia grado I, otro plaquetopenia grado I y otro plaquetopenia grado III.
En 2 (5%) pacientes se suspendió el tratamiento debido a plaquetopenia y cinco pacientes (13,2%) requirieron transfusión sanguínea durante el ingreso hospitalario.
No se observaron diferencias estadísticamente significativas en la incidencia de toxicidad hematológica global entre los pacientes con y sin insuficiencia renal 42% vs 42%, p = 0,970, ni entre los pacientes con ClCr menor o mayor de 30 mL/min, 67% frente a 40%, p = 0,369.
El análisis de la relación entre el ClCr y el porcentaje de reducción de hemoglobina, plaquetas y neutrófilos se realizó mediante regresión lineal y no mostró significación estadística para ninguna de las relaciones (R2 = 0,0187, p = 0,4131; R2 = 0,0018, p = 0,7982 y R2 = 0,0168, p = 0,4374, respectivamente). Tampoco fue significativa la correlación entre las variables citadas en el test de correlación de Spearman (p = 0,7771, p = 0,4692 y p = 0,9449, respectivamente).
Sin embargo, sí se encontraron diferencias estadísticamente significativas en el porcentaje de reducción del recuento de plaquetas entre los pacientes con fallo renal y sin éste (p = 0,0185). Este resultado no se repitió con los pacientes con ClCr inferior a 30 mL/min (p = 0,9784), como se muestra en la tabla 3, pero esto puede ser debido a que sólo 3 pacientes presentaban un ClCr menor de 30 ml/min.
En cuanto a la influencia de la piridoxina, no se observaron diferencias significativas en la incidencia de toxicidad hematológica entre los pacientes que recibieron piridoxina y entre los que no la recibieron (48% frente a 33%, p = 0,376), ni tampoco se encontraron diferencias en el porcentaje de disminución de hemoglobina, neutrófilos o plaquetas entre estos dos grupos de pacientes (Tabla 3).
Cuando se estudió la relación entre la duración del tratamiento con linezolid y la disminución en el nivel de hemoglobina y en el recuento de plaquetas y neutrófilos, ésta no fue estadísticamente significativa, R2 = 0,0442, p = 0,2053, R2 = 0,0031 p = 0,7381 y R2 = 0,0012, p = 0,8366, respectivamente.
Discusión
En este estudio, un 42% de los pacientes tratados con linezolid presentó algún tipo de toxicidad hematológica, con mayor incidencia de plaquetopenia (24%) y neutropenia (21%). La toxicidad hematológica por linezolid ha sido descrita en la literatura en diferentes estudios, en forma de trombocitopenia, en 11 de 24 pacientes (46%)8 o en 6 de 19 (32%)7 pacientes, y anemia, en 6 de 24 pacientes (25%)8. En nuestro caso, la incidencia de toxicidad parece algo inferior a la descrita, aunque los tamaños de muestra pequeños de todos los estudios hacen difícil la comparación de los resultados.
La toxicidad hematológica llevó a suspender el tratamiento en un 5% de los pacientes tratados. La causa de la suspensión del tratamiento no se conoce con seguridad en algunos pacientes, por lo que este porcentaje puede ser algo superior. En cualquier caso parece ser inferior a lo descrito en la literatura. En el estudio de Soriano A et al.9, se suspendió el tratamiento en 7 de 52 pacientes (13%) debido a trombocitopenia severa, y en 4 de 52 pacientes (8%) debido a anemia severa. Plachouras D et al.8 indican que suspendieron el tratamiento en 15 de 24 pacientes (63%) debido a efectos adversos.
Un factor que puede contribuir a la diferencia en la incidencia de toxicidad hematológica entre estudios es la duración del tratamiento. En nuestro estudio la mediana y media de duración del tratamiento con linezolid fueron de 7,5 días y 8,4 días respectivamente; frente a la mediana de 3,5 semanas del estudio de Plachouras et al.8, o los más de 40 días del estudio de Soriano A et al.9. Otros autores también han descrito duraciones del tratamiento con linezolid superiores a la de nuestro estudio, como duraciones medias (DE) de 16,9 (10) días15, 12,1 (7,1) días14, y 15,9 semanas (rango: 6-36)10. En el estudio de Senneville et al.10 sólo se incluyeron pacientes con osteomielitis crónica y Plachouras et al.8 sólo estudiaron pacientes con infección de hueso y prótesis articular de larga duración. En nuestro estudio, la mayoría de pacientes, un 65,8%, fueron diagnosticados de infección respiratoria e infección de piel y tejidos blandos. En cambio, tan sólo 5 pacientes (13,1%) fueron diagnosticados de infección de hueso y/o prótesis articular. La duración del tratamiento con linezolid en infección respiratoria e infección de piel y tejidos blandos suele ser inferior a la duración del tratamiento en casos de infección de hueso y/o prótesis articular18-20.
En nuestro estudio no se encontró una asociación significativa entre la duración del tratamiento y la toxicidad hematológica, posiblemente debido a la corta duración de la mayoría de los tratamientos. Sin embargo, en la literatura, diferentes autores han observado asociación entre ambas. Gerson et al.21, observaron un mayor riesgo de desarrollar trombocitopenia y anemia en aquellos pacientes en tratamiento con linezolid durante más de 2 semanas. Por otro lado, Attassi et al.7, asociaron trombocitopenia en tratamientos de más de 10 días de duración. Senseville et al.10, evidenciaron anemia en terapias de más de 4 semanas de duración en pacientes con osteomielitis crónica.
En el estudio llevado a cabo en nuestro centro, el 13% de los pacientes con toxicidad medular requirió transfusión de sangre durante el ingreso hospitalario, que resulta inferior a lo descrito en la bibliografía. En el estudio de Senseville et al.10 el 28,9% de los pacientes requirió transfusión sanguínea y en el estudio de Attasi et al.7 un 21% requirió transfusión de plaquetas. Esta discrepancia, puede ser debida de nuevo a la duración más corta del tratamiento con linezolid en nuestros pacientes.
En relación a la influencia de la función renal en el desarrollo de toxicidad hematológica, en nuestro estudio no se observó una relación significativa entre ambos, a excepción de que los pacientes con IR sí que presentaron una reducción significativamente mayor de las plaquetas. A este respecto, conviene señalar que en pacientes con función renal normal o con insuficiencia renal leve o moderada, linezolid se excreta principalmente en orina como hidroxietilglicina (40%), fármaco inalterado (30%) y ácido aminoetoxiacético (10%). El aclaramiento extrarrenal constituye aproximadamente un 65% del aclaramiento total de linezolid1,2. Por tanto, en principio, estos pacientes no tendrían por qué presentar una mayor exposición a linezolid clínicamente significativa ni desarrollar con mayor frecuencia toxicidad hematológica.
La evidencia acerca de la relación entre la función renal y la farmacocinética de linezolid es escasa. Sin embargo, ciertos autores como Soriano et al.9 concluyen que el riesgo de toxicidad producida por el fármaco es superior en pacientes que presentan insuficiencia renal. Sasaki et al.12, concluyen que en pacientes con ClCr inferior a 30 mL/min y cirrosis hepática asociada, se debería considerar un ajuste posológico. En concordancia con nuestros resultados, Lin et al.15, observan una mayor incidencia de trombocitopenia en aquellos pacientes con insuficiencia renal. Estos observan mayor incidencia de trombocitopenia en pacientes con tratamientos prolongados de más de 2 semanas e insuficiencia renal, también identificaron como factor de riesgo la administración previa de vancomicina.
En cuanto al empleo de piridoxina con el objetivo de evitar la toxicidad hematológica inducida por linezolid, en este estudio no se observó un efecto protector. El uso de la piridoxina con este fin" es una práctica extendida en la actualidad. A pesar de ello, la evidencia disponible no aporta datos concluyentes que apoyen el beneficio de su administración. Youssef et al.11, observan que la administración de piridoxina administrada a dosis de 50 mg al día podría tener impacto en la prevención de la anemia asociada a linezolid, no así en la trombocitopenia y leucopenia. Por el contrario, Plachouras et al.8 y Soriano et al.9, no encontraron diferencias significativas en la prevención de mielosupresión inducida por linezolid cuando se añadió dicha vitamina al tratamiento. Por ello, parecen necesarios más estudios con tamaños de muestra mayores para evaluar adecuadamente su posible impacto.
El presente estudio presenta la ventaja de reflejar la práctica clínica habitual en muchos hospitales, sin embargo también tiene limitaciones. Las principales limitaciones son el reducido tamaño de la muestra y el carácter retrospectivo. Por ello, los resultados obtenidos deberían ser confirmados con estudios prospectivos con mayor número de pacientes. Por otra parte, la duración media del tratamiento ha sido inferior a la descrita en la literatura, hecho que podría haber influido en los resultados.
En conclusión, la incidencia de toxicidad hematológica en los pacientes tratados con linezolid en la práctica clínica es alta, en torno al 42%, en ocasiones con consecuencias graves, que puede llevar a la suspensión del tratamiento. Por ello, resulta especialmente relevante la monitorización de parámetros hematológicos tanto al inicio como durante el transcurso del tratamiento con linezolid. La influencia de la insuficiencia renal en su aparición no está clara y debería confirmarse en estudios de mayor tamaño. Tampoco lo está el uso de piridoxina en su prevención, y el control hematológico se hace necesario a pesar del uso de ésta.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: iaquerreta@unav.es
(Irene Aquerreta González).
Recibido: el 29 de octubre de 2014;
Aceptado: el 23 de agosto de 2015.
Bibliografía
1. Ficha técnica de Zyvoxid® (linezolid) 2 mg/ml solución para perfusión. (Acceso Junio 2014). Disponible en: http://www.aemps.gob.es/cima/pdfs/es/ft/64106/FT_64106.pdf. [ Links ]
2. Ficha técnica de Zyvoxid® (linezolid) 600 mg comprimidos recubiertos con película y ficha técnica de Zyvoxid 100 mg/5 ml granulado para suspensión oral. (Acceso Junio 2014). Disponible en: http://www.aemps.gob.es/cima/pdfs/es/ft/64109/FT_64109.pdf. [ Links ]
3. Johns Hopkins Antibiotic Guide (Base de datos en Internet) (Acceso Junio 2014). Disponible en: http://www.hopkinsguides.com. [ Links ]
4. Micromedex® 2.0 (Base de datos en Internet) (Acceso Junio 2014). Disponible en: http://www.micromedexsolutions.com. [ Links ]
5. Guía Sandford (Acceso Junio 2014). Disponible en: http://webedition.sanfordguide.com. [ Links ]
6. Guía LexiComp (Base de datos en Internet) (Acceso junio 2014). Disponible en: http://online.lexi.com/crlsql/servlet/crlonline. [ Links ]
7. Attassi K, Hershberger E, Alam R, Zervos MJ. Thrombocytopenia associated with linezolid therapy. Clin Infect Dis. 2002; 34:695-698. [ Links ]
8. Plachouras D, Giannitsioti E, Athanassia S, Kontopidou F, Papadopoulos A, Kanellakopoulou K, et al. No effects of pyridoxine on the incidence of myelosuppression during prolonged linezolid treatment. Clin Infect Dis. 2006; 43(9): 89-91. [ Links ]
9. Soriano A, Ortega M, García S, Peñarroja G, Bové A, Marcos M, et al. Comparative study of the effects of Pyridoxine, Rifampin, and renal function on hematological adverse events induced by Linezolid. Antimicrob Agents Chemother. 2007; 51(7):2559-63. [ Links ]
10. Senneville E, Legout L, Valette M, Yazdanpanah Y, Giraud F, Beltrand E, et al. Risk factors for anaemia in patients on prolonged linezolid therapy for chronic osteomyelitis: a case-control study. J Antimicrob Chemother. 2004; 54: 798-802. [ Links ]
11. Youssef S, Hachem R, Chemaly RF, Adachi J, Ying J, Rolston K, et al. The role of vitamin B6 in the prevention of haematological toxic effects of linezolid in patients with cancer. J Antimicrob Chemother. 2008; 61(2):421-4. [ Links ]
12. Sasaki T, Takane H, Ogawa K, Isagawa S, Hirota T, Higuchi S, et al. Population Pharmacokinetic and Pharmacodynamic Analysis of Linezolid and a Hematologic Side Effect, Thrombocytopenia, in Japanese Patients. Antimicrob Agents Chemother. 2011; 55(5):1867-73. [ Links ]
13. Matsumoto K, Takeda Y, Takeshita A, Fukunaga N, Shigemi A, Yaji K, et al. Renal function as a predictor of linezolid-induced thrombocytopenia. Int J Antimicrob Agents. 2009; 33:98-99. [ Links ]
14. Matsumoto K, Takeshita A, Ikawa K, Shigemi A, Yaji K, Shimodozono Y, et al. Higher linezolid exposure and higher frequency of thrombocytopenia in patients with renal dysfunction. Int J Antimicrobial Agents. 2010; 36(2):179-81. [ Links ]
15. Lin YH, Wu VC, Tsai IJ, Ho YL, Hwang JJ, Tsau YK, et al. High frequency of linezolid-associated thrombocytopenia among patients with renal insufficiency. Int J Antimicrob Agents. 2006; 28:345-351. [ Links ]
16. U.S. Department of Health and human services. National Institutes of Health. National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE). Version 4.0. 2009 (v4.03: June 14, 2010). Disponible en: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf. [ Links ]
17. Garazzino S, De Rosa FG, Bargiacchi O, Audagnotto S, Maiello A, Di Perri G. Haematological safety of long-term therapy with linezolid. Int J Antimicrob Agents. 2007; 29 (4): 480-3. [ Links ]
18. Infectious Diseases Society of America. Practice Guidelines for the Diagnosis and Management of Skin and Soft Tissue Infections: 2014 Update by the Infectious Diseases Society of America. Clinical Infectious Diseases Advance Access published June 18, 2014. Disponible en: http://cid.oxfordjournals.org/content/early/2014/06/14/cid.ciu296.full.pdf+html. [ Links ]
19. Infectious Diseases Society of America. Diagnosis and Management of Prosthetic Joint Infection: Clinical Practice Guidelines by the Infectious Diseases Society of America. Clinical Infectious Diseases Advance Access published December 6, 2012. Disponible en: http://cid.oxfordjournals.org/content/early/2012/11/29/cid.cis803.full.pdf+html. [ Links ]
20. American Thoracic Society and the Infectious Diseases Society of America. Guidelines for the Management of Adults with Hospital-acquired, Ventilatorassociated, and Healthcare-associated Pneumonia. Am J Respir Crit Care Med. 2005; 171 (4): 388-416. Disponible en: http://www.idsociety.org/uploadedFiles/IDSA/Guidelines-Patient_Care/PDF_Library/HAP.pdf. [ Links ]
21. Gerson SL, Kaplan SL, Bruss JB, Le V, Arellano FM, Hafkin B, et al. Hematologic effects of linezolid: summary of clinical experience. Antimicrob Agents Chemother. 2002; 46:2723-2726. [ Links ]











 texto en
texto en