Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.41 no.2 Toledo mar./abr. 2017
https://dx.doi.org/10.7399/fh.2017.41.2.10565
Originales
Eficiencia de un protocolo de uso de palivizumab en pacientes prematuros
1Servicio de Farmacia del Complejo Hospitalario Universitario Insular Materno Infantil Canarias. Avd. Marítima del Sur s/n; 35016, Las Palmas de Gran Canaria. España.
2Servicio de Farmacia del Hospital Regional Universitario de Málaga. Avd. Carlos Haya s/n; 29010, Málaga. España.
3Unidad de Gestión Analítica del Complejo Hospitalario Universitario Insular Materno Infantil Canarias. España.
Objetivo:
El objetivo principal fue evaluar el coste-efectividad del protocolo de uso de palivizumab en prematuros instaurado por consenso en nuestro hospital comparándolo con el basado en las recomendaciones de diferentes sociedades científicas. Como objetivo secundario se analizaron los factores de riesgo y gravedad de los pacientes hospitalizados atendiendo al protocolo establecido en nuestro centro.
Material y métodos:
El periodo de estudio fue de cuatro temporadas con el protocolo ampliado (datos retrospectivos) frente a dos con el protocolo restringido o consensuado (datos prospectivos). La perspectiva del estudio fue la del sistema sanitario, incluyendo los costes de hospitalización y del palivizumab en nuestro centro. El cálculo de la efectividad se determinó con la tasa de ingresos de pacientes prematuros estratificados por semanas de edad gestacional: < de 29, <32 y <35.
Para el análisis de los factores de riesgo y gravedad en pacientes ingresados en las temporadas con el nuevo protocolo se recogen, de forma prospectiva, datos clínicos y factores ambientales y sociales.
Resultados:
En los estratos de edad gestacional <29 y <32 no se demostró una mayor efectividad del protocolo ampliado frente al consensuado. Solamente se objetivó una mayor efectividad para EG<35 en los datos acumulados y al comparar las temporadas 08/09 con la 12/13 y 13/14 para datos individuales. Este estrato lleva asociado un cociente coste eficacia incremental de 53.250,07 € (rango: 14.793,39 € a 90.446,47 € para los datos individuales y 50.525,53 € (28.688,22 € a 211.575,65 €) para los acumulados. La instauración de este protocolo en nuestro centro supuso un ahorro medio por temporada de 169.911,51 €.
Se constata una relación coste-efectividad adecuada del protocolo ampliado si el coste del palivizumab por paciente fuese menor de 1.206,67 € (calculados para el máximo aprovechamiento del vial) y para una tasa de hospitalización mayor de 9,21%.
Los niños que ingresan en las temporadas con el nuevo protocolo (temporada 12/13 y 13/14) son en un 63,4% niños menores de 3 meses y el 90% son neonatos a término que no pertenecen a ninguna población de riesgo, mientras que muchos de ellos tienen asociados varías factores de riesgo como tener hermanos en edad escolar, residencia rural, padres fumadores, escasa formación académica de los progenitores, ausencia de lactancia artificial e historia familiar de alergia.
Conclusiones:
El protocolo consensuado no ha supuesto un aumento significativo en las tasas de hospitalización en los pacientes prematuros <32 semanas de EG. En aquellos <35 se ha observado una mayor tasa de hospitalización, con una relación coste-efectividad muy desfavorable para todos los escenarios clínicos valorados.
PALABRAS CLAVE: Virus sincitial respiratorio; Palivizumab; Prematuro; Neonato; Eficiencia; Edad gestacional
Aportación a la literatura científica
En la actualidad existen diferentes protocolos de uso de palivizumab para la prevención del virus respiratorio sincitial, bien sean directrices de los hospitales o bien de diferentes Comunidades Autónomas. El trabajo pretende poner de manifiesto en qué tipo de pacientes prematuros es coste-efectiva la utilización de palivizumab en nuestro medio hospitalario. Para eso se ha realizado un estudio farmacoeconómico con datos de efectividad propios y costes extraídos de las bases de datos de nuestro centro. Aunque ya existen publicados muchos trabajos de este tipo, la mayor parte están basados en modelos analíticos de decisión, donde se realizan varias asunciones sobre la eficacia y los costes difieren sustancialmente a los de nuestro medio. La novedad de este estudio es que nos basamos en datos recabados en nuestro hospital.
Los resultados obtenidos en nuestro estudio, con sus limitaciones expuestas, pueden ayudar a la toma de decisiones de uso de palivizumb a otros centros sanitarios de nuestro entorno.
Introducción
La bronquiolitis es la enfermedad del tracto respiratorio inferior más frecuente durante los dos primeros años de vida. Aparece de forma epidémica durante el invierno y su etiología es predominantemente viral, siendo el virus respiratorio sincitial (VRS) el responsable de más del 50% de los casos1.
El tratamiento de la bronquiolitis aguda es sintomático ya que no existe un tratamiento etiológico efectivo. La prevención de la bronquiolitis producida por el VRS se fundamenta actualmente en las medidas higiénico-sanitarias y la inmunoprofilaxis pasiva, indicada en pacientes prematuros, afectos de enfermedad pulmonar crónica (EPC) y con cardiopatía congénita hemodinámicamente significativa1-4.
La eficacia de palivizumab en niños prematuros se pone de manifiesto en el ensayo clínico IMpact donde se observó una disminución de los ingresos hospitalarios por infección por VRS, no observándose una disminución en los días con oxígeno, ventilación mecánica y mortalidad. El estudio mostró que palivizumab producía una disminución de los ingresos del 10,6 al 4,8% con una reducción absoluta del riesgo (RAR) de 5,8% y el número de pacientes a tratar para disminuir un ingreso (NNT) fue de 17; y una RAR de 1,7 y NNT de 59 en las unidades de cuidados intensivos5.
Los datos de eficacia se han constatado en estudios posteriores6,7, sin embargo, no existe unanimidad en los estudios farmacoeconómicos realizados ya que las conclusiones son muy divergentes y en muchos casos contradictorias -desde un coste incremental hasta ahorros importantes por ingreso evitado- debido, fundamentalmente, a las diferentes metodologías utilizadas y a las asunciones realizadas8-14.
En base a una revisión exhaustiva de la literatura científica publicada en ese momento, se decidió, por consenso, restringir el uso de palivizumab en nuestro hospital en la temporada 2012-2013 (12/13) a pacientes prematuros menores de 9 meses de edad al inicio de la temporada del VRS con EPC y con altas necesidades de oxígeno.
El objetivo principal de nuestro estudio fue evaluar la eficiencia (coste-efectividad) del nuevo protocolo de uso de palivizumab para prevenir la infección por VRS en prematuros de EG de 29 a 35 semanas y como objetivo secundario realizar un análisis de los factores de riesgo y de la gravedad en los pacientes que ingresan en las temporadas con el nuevo protocolo.
Material y método
El estudio se llevó a cabo en un hospital de tercer nivel que da cobertura a la población pediátrica de la provincia de Las Palmas (Complejo Hospitalario Universitario Insular Materno-Infantil) sito en Gran Canaria, que cuenta con una población de 851.157 habitantes.
Periodo de estudio
El periodo de estudio abarcó desde la temporada de bronquiolitis 08/09 hasta la temporada 13/14; 4 temporadas con el protocolo ampliado y 2 temporadas con el nuevo protocolo. En el anexo 1 se detalla el protocolo de uso de palivizumab desde la temporada 08/09 -11/12, de aquí en adelante protocolo ampliado; y en el anexo 2 se detalla el protocolo de la temporada 12/13 y 13/14, de aquí en adelante protocolo consensuado.
Perspectiva del estudio y costes analizados
La perspectiva del estudio fue la del Sistema Sanitario, incluyendo los gastos de hospitalización, que fueron proporcionados por la Unidad de Gestión Analítica de nuestro hospital, y el coste de palivizumab por paciente, calculado para cada temporada fue extraído del aplicativo de gestión de farmacia, Farmatools®. En nuestro hospital dosificamos individualmente todas las dosis para un mayor aprovechamiento del vial.
Efectividad
Para el cálculo de la efectividad se determinó la tasa de ingresos por VRS de pacientes prematuros, excluyendo los pacientes con cardiopatías congénitas, estratificados por EG de la siguiente manera: < 29; < 32 y < 35.
La tasa de ingresos para cada temporada o acumulada se determinó como el cociente entre los ingresos por VRS (desde 1 de octubre hasta 31 de marzo) y el total de prematuros nacidos en esa temporada (desde el 1 de abril hasta el 31 de marzo) para cada uno de los estratos anteriormente reseñados.
Los ingresos por bronquiolitis por VRS (CIE-9-MC 466.11) para las temporadas 08/09 hasta la 11/12 se extrajeron del Servicio de Codificación del Hospital y los nacimientos del aplicativo del Servicio de Obstetricia.
Los pacientes ingresados en las temporadas con el protocolo consensuado, 12/13 y 13/14 se obtuvieron de forma prospectiva, mediante la consulta de la historia clínica electrónica, Selene®; recogiéndose: ingresos por bronquiolitis por VRS desde octubre a marzo, fecha de nacimiento, de ingreso y de alta, edad al ingreso en meses y días, EG en semanas, peso al nacer en gramos, sexo, afectación de EPC, indicación de palivizumab y grupo de riesgo según protocolo ampliado, profilaxis con palivizumab y mortalidad.
En la temporada 13/14 se recogieron también los siguientes factores de riesgo: aspectos ambientales y sociales tales como exposición al tabaco, condiciones sociales de la vivienda, convivencia con animales, asistencia a guardería, tipo de alimentación, nivel educativo de los padres, historia familiar de alergias y hermanos en edad escolar. Para valorar la gravedad del episodio se recoge: días de estancia, ingreso en la Unidad de Cuidados Intensivos (UCI), necesidad de oxígeno y/o necesidad de ventilación mecánica y el periodo utilizado con estos recursos terapéuticos.
Medición de los resultados: cociente coste eficacia incremental (CCEI)
El CCEI se calculó como el cociente entre la diferencia de los costes (incluyendo coste por ingreso más coste de palivizumab) y la diferencia de eficacia (tasa de ingresos protocolo ampliado menos tasa de ingresos protocolo restringido). Este cociente se halló para datos individuales (cada temporada con el protocolo ampliado frente a la 12/13 y frente a la 13/14) y para datos acumulados de ingresos y nacimientos (etapa con protocolo ampliado: desde la temporada 08/09 hasta la 11/12 frente a la etapa con protocolo consensuado: temporada 12/13 y 13/14).
Resultados
En la Tabla 1 se detallan los pacientes ingresados por bronquiolitis por VRS y el total de prematuros nacidos por temporada así como el coste número de pacientes tratados con palivizumab, el coste por paciente con palivizumab y el coste por ingreso al día en una Unidad de Hospitalización.
Tabla 1 Datos estratificados por temporada: natalidad, número de ingresos por infección del VRS, pacientes tratados con palivizumab y los costes por ingreso y palivizumab

* Pacientes nacidos en cada estrado de EG desde 6 meses antes de comienzo de la temporada (desde el 1 de abril hasta el final de la temporada, 31 de marzo).
**Ingresos por VRS en el periodo del 1 de octubre hasta el 31 de marzo.
Cálculo de la efectividad para los datos individuales
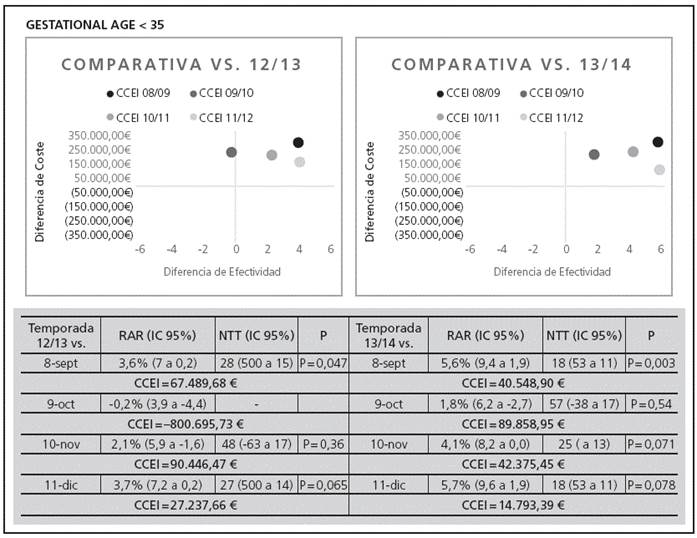
A partir de los datos reflejados en la Tabla 1 se calcula la tasa de ingresos para cada temporada, la RAR y el NNT de las 4 temporadas con el protocolo ampliado frente a aquellas con el protocolo consensuado para cada estrato de EG. Solamente para la EG < 35 comparando la temporada 08/09 frente a la 12/13 y la 13/14 se observó una disminución significativa de los ingresos RAR de 3,6% (IC95%: 7% a 0,2%) y NNT 28 (IC95%: 500 a 15) p = 0,047 y de RAR 5,6% (IC95%: 9,4% a 1,9%) y NNT 18 (IC95%: 53 a 11) p = 0,003 respectivamente. En las 30 comparaciones restantes entre temporadas no se observó una disminución significativa de los ingresos; consultar los pies de Figura 1, Figura 2 y Figura 3.

Figura 1 Comparativa entre temporadas para el estrato de EG < 29: efectividad y cociente coste efectividad incremental.

Figura 2 Comparativa entre temporadas para el estrato de EG < 32: efectividad y cociente coste efectividad incremental.
Cálculo de la efectividad para los datos acumulados de ingresos y nacimientos
La tasa de ingresos acumulada con el protocolo ampliado frente al consensuado para cada estrato de EG se detalla en la Tabla 2. Solamente para la EG < 35, la disminución de la hospitalización con el protocolo ampliado fue significativa (p = 0,005).
Tabla 2 Valoración de la efectividad con los datos acumulados por cada estrato de EG

RAR: diferencia del riesgo absoluto; IC: intervalo de confianza; NNT: número de pacientes a tratar para obtener una unidad de eficacia adicional (en este caso para disminuir un ingreso).
*No se calcula la significación estadística debido a que en el protocolo consensuado la tasa de ingresos es menor que en el ampliado.
** El IC de la RAR incluye el cero por lo que no tiene significación estadística, siendo uno de los límites del NNT negativo, por lo que incluiría a pacientes que tanto se benefician como se perjudican con el protocolo ampliado.
Para la EG < 29 no se calcula la significación estadística debido a que en el protocolo consensuado la tasa de ingresos es menor que en el ampliado. En la EG < 32 el intervalo de confianza de la RAR incluye el cero por lo que no tiene significación estadística, siendo uno de los límites del NNT negativo, por lo que incluiría a pacientes que tanto se benefician como se perjudican con el protocolo ampliado.
Cálculo de CCEI para los datos individuales y acumulados
El cálculo del CCEI aplicando la estancia media hospitalaria de 7 días para cada temporada con el protocolo ampliado, frente a la temporada 12/13 y frente a la 13/14, protocolo consensuado se detalla en las Figura 1, Figura 2 y Figura 3.
El CCEI en el estrato de EG < 29 (Figura 1) para las temporadas 08/09 y 09/10 vs las temporadas 12/13 y 13/14 resultó negativo derivado de una mayor tasa de ingresos con el protocolo ampliado frente al consensuado. La media del CCEI para los datos valorables fue de 51.346,06€ (rango: 5.380,33€ a 165.759,00€). Para la EG < 32 (Figura 2) la media del CCEI fue de 77.273,61€ (rango: 22.648,42€ a 228.396,19€).
Los recursos necesarios para conseguir una reducción en el porcentaje de pacientes ingresados en el estrato de EG < 35 (Figura 3), único estrato donde se observó una reducción significativa de los ingresos, son de 53.250,07€ (rango: 14.793,39€ a 90.446,47€). Cabe destacar la RAR negativa de la temporada 9/10 frente a las 12/13 derivado de una mayor tasa de ingresos en la temporada con el protocolo ampliado. El CCEI para los datos acumulados para la EG < 35 fue de 50.525,53€ (28.688,22€ a 211.575,65€).
Atendiendo al coste por temporada de palivizumab, al coste por ingreso y a la estancia media por paciente de 7 días, la instauración del nuevo protocolo de uso de palivizumab supuso un ahorro económico medio por cada una de las 6 temporadas del estudio de 169.911,51€.
Cálculo del umbral de eficiencia
En base a los costes y efectividad reseñados se ha realizado una simulación para calcular cuál debería ser la tasa de ingreso o el coste del medicamento por paciente para considerar el protocolo ampliado coste-efectivo; considerando el umbral de eficiencia en 30.000€. La mediana del coste de palivizumab por paciente considerado coste-efectivo sería de 1.206,67€; estos costes están calculados para el máximo aprovechamiento del vial. La mediana de la tasa de hospitalización estimada coste-efectiva calculada sería de 9,21%.
Análisis de los factores de riesgo y gravedad de los pacientes hospitalizados con el protocolo consensuado
A continuación se detallan los datos recopilados de forma prospectiva de los pacientes ingresados por bronquiolitis por VRS en las temporadas 12/13 y 13/14 (el dato entre paréntesis corresponde a la temporada 13/14). El número de ingresos por VRS fue 167 (153) pacientes. La mediana de edad al ingreso en meses fue de 2(0,2-20,1) (2(0,5-18,1)) correspondiendo el 63,47% (63,40 %) de los ingresos a niños menores de 3 meses; Tabla 3. En cuanto a la distribución por sexo un 58% (50,33%) fueron varones. La media del peso en gramos de los pacientes fue de 2.990g ± 752 (2.930g ± 930). La media de la EG en semanas fue 38 ± 3,00 (38,37 ± 2,88), donde un 91,62% (87,58%) de los pacientes presentó una EG > 35 semanas; en la Tabla 4 se describe el número de pacientes en función de su EG.
El 10 (5,99%) (11 (7,19%)) cumplían criterios de profilaxis según el protocolo ampliado. Ninguno de los pacientes ingresados presentó displasia broncopulmonar (DBP). No se registró ningún éxitus.
Durante la temporada 13/14 necesitaron oxígeno un 52,28%, con una media en días de 3,63 (± 1,9), ninguno precisó ventilación mecánica. La estancia media en días en la Unidad de Hospitalización fue de 7,12 (± 3,61); ingresaron en UCI 6 pacientes (3,9%) con una mediana de 5 días (2-24).
Según factores de riesgo ambientales se identificó que el 67,77% no recibía lactancia materna; el 46,67% estaba expuesto al tabaco; el 30,76% vivía bajo condiciones de hacinamiento; el 64,71% de los padres presentaban nivel educativo bajo y 6,62% superiores; el 33,33% presentaban historia familiar de atopia; el 31,53% convivía con animales y el 58,99% tenía hermanos en edad escolar.
Discusión
Del análisis de los datos del estudio, tanto acumulados (Tabla 2) como pormenorizados (Figura 1, Figura 2 y Figura 3), podemos afirmar que no se ha podido demostrar de forma concluyente una mayor efectividad del protocolo ampliado frente al consensuado en prematuros < 32 semanas de EG.
No obstante, al analizar los datos acumulados en prematuros < 35 semanas de EG si se ha constatado una una disminución significativa de la hospitalización con el protocolo ampliado. En el análisis individual de los datos solo se objetivó una disminución de la hospitalización en prematuros < 35 semanas de EG cuando se compara la temporada 08/09 frente a la 12/13 y la 13/14; siendo este resultado esperable ya que el protocolo consensuado no abarca la profilaxis en este grupo de prematuros sin patología asociada.
Sin embargo, esa efectividad lleva asociada una NNT del orden de 30 y un CCEI incremental de 50.525,53€ para conseguir una unidad de eficacia adicional para los datos acumulados y para los datos individuales por temporada de 67.489,68€ (12/13 versus 08/09) y 40.548,90€ (13/14 versus 08/09). Aunque en nuestro país no existe un umbral de eficiencia sobre lo que resultaría económicamente aceptable, estos resultados son excesivos para la mayoría de los supuestos clínicos reseñados.
Cabe señalar el mayor índice de ingresos encontrado con el protocolo ampliado en los datos acumulados para la EG < 29 y cuando comparamos individualmente las temporadas, este mayor índice se observa en la temporada 09/10. Esto puede deberse a que trabajamos con un número de ingresos por VRS muy pequeño en gran prematuros y a que la temporada 09/10 haya sido el resultado de una estación con mayor virulencia. Lo expuesto nos hace reflexionar sobre la necesidad de prolongar el estudio en el tiempo para minimizar las limitaciones antes descritas.
Debemos destacar los sesgos que se puedan derivar de que los datos de la etapa con el protocolo ampliado fueron retrospectivos y con el protocolo consensuado prospectivos, por lo que cabría esperar una tasa real de ingresos mayor a la descrita en las temporadas con el protocolo ampliado. Por otro lado, solamente se han contemplado los niños prematuros nacidos en nuestro hospital, por lo que este dato puede estar infravalorado al no tener en cuenta los nacidos en otros centros sanitarios.
Nuestros resultados son compatibles con otros estudios coste efectividad, como el realizado por la Agencia de Valoración de Tecnologías de la Salud Británica de 2011, que llevó a cabo una revisión sistemática de la evidencia científica para valorar el coste efectividad de palivizumab para la inmunoprofilaxis de la bronquiolitis del VRS. Incluyeron 13 estudios y realizaron un análisis por subgrupos con 256 combinaciones diferentes de factores de riesgo, llegando a la conclusión de que la profilaxis con palivizumab sólo sería coste-efectiva en ciertos subgrupos de pacientes que presenten DBP o cardiopatía congénita con una determinada EG o edad al inicio de la temporada14.
Otro estudio establece que la profilaxis sólo es efectiva en los prematuros con EPC y en los meses de alto riesgo de infección, de noviembre a enero, ascendiendo el coste por ingreso evitado en febrero y marzo a 47.145€ y 105.120€ respectivamente15,16.
Un estudio reciente obtiene unos costes incrementales superiores a los nuestros -coste incremental para evitar un ingreso por bronquiolitis de 202.635$- debido, principalmente, a costes más elevados del medicamento.1
No obstante, podemos encontrar en la literatura estudios farmacoeconómicos con un balance coste efectividad o utilidad muy favorable al uso de palivizumab, que como ya hemos apuntado, se debe a las diferentes asunciones realizadas, siendo una de las principales la reducción de la mortalidad, además del sesgo encontrado por el financiador8,11-13.
Así el estudio realizado en nuestro país en prematuros de EG de 32-35 semanas y dos o más factores de riesgo estimó el coste del año de vida ganado ajustado por calidad (AVAC) en 13.849 € con la perspectiva del Sistema Nacional de Salud y en 4.605 € con la perspectiva social8. Otros estudios realizados en Austria, Holanda y el Reino Unido obtienen unos coste del AVAC del orden de 20.704€ (prematuros ≤ 35 semanas de EG), 18.563€ (prematuros entre 32-35 semanas de EG) y 14.883€ (prematuros ≤ 35 semanas de EG) respectivamente. El diseño de estos estudios son modelos analíticos de decisión donde se realizan diferentes asunciones, entre ellas, una reducción relevante de la mortalidad11-13.
Debemos destacar que el coste calculado de palivizumab por paciente coste-efectivo para un umbral de gasto de 30.000€ sería menos de la mitad del coste real de nuestros datos por paciente y temporada. Respecto a la tasa de ingresos debería ser alrededor del 10%; este dato es incluso menor al publicado por otros autores que establecen que la inmunoprofilaxis con palivizumab solamente es coste-efectiva en pacientes de 23-36 semanas de EG, con 28 días de oxigenoterapia y dados de alta en los meses de septiembre a noviembre, periodo en el que el riesgo de hospitalización lo han establecido entre el 11-24,6%18-19.
Respecto del análisis pormenorizado de los niños que ingresaron en las temporadas 12/13 y 13/14, debemos tener en cuenta que son niños de corta de edad, con una mayor prevalencia de menores de 3 meses y que, respecto a la EG, un 90% son neonatos a término que no pertenecen a una población de alto riesgo, por lo que no podemos dejar de cuestionarnos la necesidad de la inmunoprofilaxis indiscriminada a todos los niños prematuros. Estos datos son acordes con los recogidos en diversas publicaciones donde se ponen de manifiesto los factores de riesgo asociados a la bronquiolitis aguda, como son tener hermanos en edad escolar, residencia rural, padres fumadores, escasa formación académica de los progenitores, ausencia de lactancia materna e historia familiar de alergia 20,21.
Las actuales recomendaciones de la Academia Americana de Pediatría (AAP) sobre la inmunoprofilaxis con palivizumab incluyen a prematuros de EG < 29 y de edad inferior a 12 meses al inicio de la temporada VRS. Para la EG > 29 el uso de palivizumab debe venir determinado por la existencia de algún factor de riesgo asociado como EPC (necesidad de oxígeno al menos durante 28 días desde el nacimiento); destacando asimismo entre estas recomendaciones la importancia de las medidas higiénico-sanitarias. Estas recomendaciones son similares a las establecidas por la Academia Canadiense, que en el grupo de EG < 29 acota la inmunoprofilaxis a pacientes con menos de 6 meses al inicio de la temporada y la clasifica como razonable pero no esencial cuando no tienen una patología asociada como EPC. Para pacientes de > 29 semanas de EG su uso no se recomienda si no tienen una enfermedad asociada, debido a la baja incidencia de hospitalización. Al igual que la AAP incide en las estrategias de educación sanitaria22-24.
Las últimas directrices sobre inmunización frente al VRS recogidas en el Green Book de 2015 del Reino Unido continúan incluyendo a pacientes prematuros sólo si presentan EPC, delimitando su coste-efectividad en base a la edad cronológica y EG25.
La Sociedad Española de Neonatología no ha realizado ningún cambio en las directrices de uso de palivizumab en los prematuros de EG < 29 en el primer año de vida y para su segunda estación solamente si son < 9 meses. Para el grupo de 29-32 semanas de EG recomienda su uso si la edad al inicio de la estación es < de 6 meses y para la EG de 32-35 si tienen presentes dos factores de riesgo mayores26.
El protocolo adoptado por consenso en nuestro hospital no ha supuesto un aumento significativo en las tasas de hospitalización en los pacientes prematu ros < 32 semanas de EG; en aquellos prematuros > de 35 semanas de EG se ha observado una mayor tasa de hospitalización sin que se haya podido demostrar una mayor eficiencia del protocolo ampliado frente al consensuado.
La infección por VRS se asoció con una sustancial morbilidad en nuestro medio, sin embargo la mayor parte de los pacientes ingresados en las temporadas con el protocolo consensuado no presentaban ciertos condicionantes médicos como EPC o prematuridad, sino otros factores de riesgo ambientales y sociales ya descritos, así como una corta edad postnatal al comienzo de la estación del VRS.
Las estrategias de prevención de la infección por el VRS deben ir más allá de la profilaxis con palivizumab y centrarse en programas de educación dirigidos a los padres o cuidadores, realizados desde los centros hospitalarios al alta del paciente, con independencia de su pertenencia a un grupo de riesgo.
REFERENCIAS
Watts KD, Goodman DM. Wheezing, bronchiolitis, and bronchitis. En: Kliegman RM, Stanton BF, St. Geme JW, Schor NF, Behrman RE, editores. Nelson Textbook of pediatrics. 19 ed. Philadelphia: Elsevier; 2011. p. 1456-59. [ Links ]
Carbonell-Estrany X, Figueras-Aloy J. Prevención de la infección por virus respiratorio sincitial. En: Protocolos de Neonatología. (monografía en Internet). Madrid: Asociación Española de Pediatría; 2008 (acceso 2013) Disponible en: http://www.aeped.es/documentos/protocolos-neonatologia. [ Links ]
Barr F, Graham B. Respiratory syncytial virus infection: Clinical features and diagnosis. In: UpToDate, Basow, DS (Ed), UpToDate, Waltham, MA, 2013. [ Links ]
Crowe JE. Respiratory Syncytial virus. En: Kliegman RM, Stanton BF, St. Geme JW, Schor NF, Behrman RE, editores. Nelson Text-book of pediatrics. 19 ed. Philadelphia: Elsevier; 2011. p. 1126-29. [ Links ]
The IMpact-RSV Study Group. Palivizumab, a humanized respiratory syncytial virus monoclonal antibody, reduces hospitalization from respiratory syncytial virus infection in high-risk infants. Pediatrics 1998; 102: 531-7. [ Links ]
Pedraz C, Carbonell-Estrany X, Figueras Aloy J, Quero J. and de Iris Study Group. Effect of palivizumab prophylaxis in decreasing respiratory syncytial virus hospitalizations in premature infants. Pediatr Infect Dis J. 2003; 22: 823-7. [ Links ]
Hervás D, Reina J, Yañez A, del Valle JM, Figuerola J, Hervás JA. Epidemiology of hospitalization for acute bronchiolitis in children: differences between RSV and non-RSV Bronchiolitis. Eur J Clin Microbiol Infect Dis. 2012; 31:1975-81. [ Links ]
Lázaro y de Mercado P, Figueras J, Doménech E, Echániz I, Closa R, Wood MA et al. La eficiencia (coste-efectividad) de palivizumab como profilaxis para la infección por virus respiratorio sincitial de 32-35 semanas en España. An Pediatr. 2006; 65(4): 316-24. [ Links ]
Smart KA, Lanctôt KL, Paes BA. The cost effectiveness of palivizumab: a systematic review of the evidence. J Med Econ. 2010; 13(3): 453-63. [ Links ]
Hampp C, Kauf TL, Saidi AS, Winterstein AG. Cost-effectiveness of Respiratory Syncytial Virus Prophylaxis in Various Indications. Arch Pediatr Adolesc Med 2011; 165(6):498-505. [ Links ]
Resch B, Gusenleitner W, Nuijten M, Lebmeier M, and Wittenberg W. Cost-Effectiveness of Palivizumab Against Respiratory Syncytial Viral Infection in High-Risk Children in Austria. Clin Ther. 2008; 30: 749-60. [ Links ]
Nuijten M, Lebmeier M, Wittenberg W. Cost effectiveness of palivizumab for RSV prevention in high-risk children in the Netherlands. Journal of Medical Economics 2009; 12(4): 291-300. [ Links ]
Nuijten M, Lebmeier M, Wittenberg W. Cost Effectiveness of Palivizumab for Respiratory Syncytial Virus Prophylaxis in High-Risk Children A UK Analysis. Pharmacoeconomics 2007; 25 (1): 55-71. [ Links ]
Wang D, Bayliss S, Meads C. Palivizumab for immunoprophylaxis of respiratory syncytial virus (RSV) bronchiolitis in high-risk infants and young children: systematic review and additional economic modelling of subgroup analyses. Health Technology Assessment 2011; vol.15 nº5. [ Links ]
Rietveld E, Steyerberg EW, Polder JJ, Veeze HJ, Vergouwe Y, Huysman MWA, et al. Passive immunisation against respiratory syncytial virus: a cost-effectiveness analysis. Arch Dis Child. 2010; 95: 493-8 [ Links ]
González de Dios J, Ochoa Sangrador C. La inmunización con palivizumab frente al virus respiratorio sincitial solo es coste-efectiva en prematuros con displasia broncopulmonar y en los meses de alto riesgo de la infección. Evid Pediatr. 2010; 6: 81. [ Links ]
Cody Meissner H, Kimberlin D. RSV Immunoprophylaxis: Does the Benefit Justify the Cost? Pediatrics 2013; 132: 915-18. [ Links ]
Joffe S, Ray GT, Escobar GJ, Black SB, Lieu TA. Cost-effectiveness of respiratory syncytial virus prophylaxis among preterm infants. Pediatrics 1999; 104: 419-27. [ Links ]
Comas F, Puigventós F, Martínez-López I, De Carlos JC, Fiol M, Delgado O. Palivizumab: evidencia, eficiencia y recomendaciones de la profilaxis del Virus Respiratorio Sincitial. Gestión y Evaluación de Costes Sanitarios 2002; 3 (4): 25-34. [ Links ]
Figueras-Aloy J, Carbonell-Estrany X, Quero-Jiménez J. Estudios de Casos y Controles de los Factores de Riesgo Relacionados con la Infección por el Virus Respiratorio Sincitial que Precisa Hospitalización en Niños Prematuros de 33-35 Semanas de Edad Gestacional en España. Pediatric Infect Dis J. 2004; 23: 815-20 [ Links ]
Figueras-Aloy J, Carbonell-Estrany X, Quero-Jiménez J, Fernández-Colomer B, Guzmán-Cabañas J, Echaniz-Urcelay I, et al. Risk Factors Linked to Respiratory Syncytial Virus Infection Requiring Hospitalization in Premature Infants Born in Spain at a Gestational Age of 32 to 35 Weeks. Pediatr Infect Dis J. 2008; 27: 788-93. [ Links ]
Committee on Infectious Diseases and Bronchiolitis Guidelines Committee. Updated Guidance for Palivizumab Prophylaxis Among Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection. Pediatrics 2014;134: 415-20. [ Links ]
Robison JL, Le Saux N, Canadian Paediatric Society. Infectious Diseases and Immunization Committee. Preventing hospitalizations for respiratory syncytial virus infection. Paediatr Child Health. 2015; 20 (6): 321-26. [ Links ]
Bracht M, Basevitz D, Cranis M, Paulley R, Paes B. Practical Resources for Nurses and Other Health Care Providers Involved in the Care of Children at Risk for Respiratory Syncytial Virus Infection. Neonatal Netw. 2012; 31(6): 387-400. [ Links ]
Public Health England. Respiratory Syncital Virus. Green Book Chapter 27a. Sep 2015. (acceso enero 2016) Disponible en: https://www.gov.uk/government/publications/respiratory-syncytial-virus-the-green-book-chapter-27a. [ Links ]
Figueras-Aloy J, Carbonell-Estrany X, Comité de estándares de la SENeo. Actualización de las recomendaciones de la Sociedad Española de Neonatología para la utilización del palivizumab como profilaxis de las infecciones graves por el virus respiratorio sincitial. An Pediatr. 2015; 82: 199.e1-2. [ Links ]
Anexo 1
Protocolo ampliado para las temporadas 2008/2009 a 2011/2012.
1. Pacientes pretérmino
1.1 Edad gestacional ≤ de 28 semanas y 6 días y con ≤ 12 meses al inicio de la temporada o dados de alta durante la misma.
Edad gestacional entre 29-31 semanas y 6 días y con ≤ 6 meses al inicio de la temporada o dados de alta durante la misma.
Edad gestacional entre 32 y 34 semanas y 6 días, con menos de 3 meses al inicio de la temporada epidémica y que cumpla al menos uno de los criterios siguientes:
Asistir a guardería.
Tener algún hermano u otro niño menor de 5 años que conviva en el mismo domicilio.
Estos niños recibirán inmunoprofilaxis mensual hasta cumplir 90 días de vida o finalice la epidemia (lo que ocurra antes). Se administrarán un máximo de tres dosis según el mes de nacimiento (los nacidos en Julio y Febrero, una dosis; los nacidos en Agosto y Enero dos dosis y los nacidos en Septiembre, Octubre, Noviembre y Diciembre tres dosis).
2. Paciente con enfermedad pulmonar crónica.
Niños menores de 2 años con displasia broncopulmonar que han requerido tratamiento (suplementos de oxígeno, broncodilatadores, diuréticos o corticoides) en los 6 meses anteriores al inicio de la estación del VRS o que son dados de alta durante la misma.
Anexo 2
Protocolo consensuado para las temporadas 2012/2013 y 2013/20014.
1.-Pacientes prematuros y enfermedad pulmonar
Pacientes prematuros menores de 9 meses de edad al inicio de la temporada epidémica del virus respiratorio sincitial, con enfermedad pulmonar crónica que hayan necesitado oxígeno durante, al menos 28 días de tratamiento desde el nacimiento.
(Especifiquen diagnóstico y edad gestacional en semanas).
Recibido: 07 de Junio de 2016; Aprobado: 27 de Octubre de 2016











 texto en
texto en