Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.42 no.1 Toledo ene./feb. 2018
https://dx.doi.org/10.7399/fh.10845
Original Breve
Utilización del recambio plasmático como herramienta terapéutica en la práctica clínica
1Servicio de Farmacia, Complejo Hospitalario Universitario de Pontevedra, Pontevedra. Spain.
Introducción
El recambio plasmático terapéutico (RPT) es un procedimiento terapéutico de depuración sanguínea extracorpórea consistente en la extracción de un volumen determinado de plasma que es reemplazado por un líquido de reposición. Su finalidad es la eliminación de moléculas de gran peso molecular, patógenos o inmunocomplejos circulantes en el plasma que intervienen en la respuesta inmune patológica y que se consideran responsables de una enfermedad o sus manifestaciones clínicas.
A pesar de haber sido utilizado en más de 80 enfermedades: renales, metabólicas, autoinmunes, reumatológicas, hematológicas, neurológicas, aparato digestivo, hepáticas…, la experiencia a nivel mundial con esta técnica es relativamente pequeña, y se apoya en publicaciones de series de casos, no estudios controlados, debido al carácter esporádico de estas enfermedades, lo que impide alcanzar un nivel evidencia sólida.
Actualmente juega un papel importante en el tratamiento de enfermedades fundamentalmente de etiología autoinmune, y constituye una opción válida en casos de enfermedad refractaria a los tratamientos convencionales, pero en la práctica clínica se ha observado una gran variabilidad de resultados según las indicaciones. La American Society for Apheresis (ASFA) ha editado guías de utilización donde establecen cuatro categorías que son constantemente revisadas y actualizadas teniendo en cuenta los datos aportados por las diferentes investigaciones clínicas publicadas1.
El objetivo de este trabajo es describir la utilización del RPT en distintas patologías y su ajuste a las guías internacionales de referencia.
Métodos
Estudio observacional, descriptivo y retrospectivo, que incluyó a todos los pacientes que recibieron RPT desde enero de 2014 a diciembre 2015 en un hospital público de tercer nivel.
Para comprobar la adecuación de la indicación del RPT se utilizaron las guías establecidas por la ASFA que dividen las enfermedades tratadas por plasmaféresis en cuatro categorías1,2. Se siguió también el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) que asigna grados de recomendación y se basa en la calidad de las evidencias publicadas (Tabla 1)3.
Tabla 1 Grados de recomendación y categoría del RPT según la American Society for Apheresis (ASFA)(3)
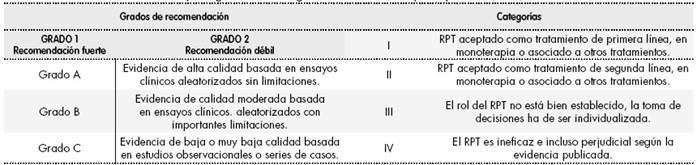
RPT: Recambio plasmático terapéutico. Extraída de: Laínez-Andrés JM et al. Recambio plasmático terapéutico: aplicaciones en Neurología. Rev Neurol. 2015;60(3):120-31
A partir de la historia clínica electrónica IANUS® se recopilaron las siguientes variables: edad, sexo, patología, número de RPT recibidos en un año, líquido de reposición utilizado, duración del tratamiento, medicación concomitante, reacciones adversas y respuesta. Todos los datos fueron anonimizados, según el procedimiento establecido por la Ley 41/2002 de 14 de noviembre4.
En nuestro hospital, el RPT se realizó en el Banco de Sangre mediante una máquina Spectra Optia Apheresis System® que realiza el procedimiento mediante centrifugación de flujo continuo a través de un catéter central. El anticoagulante utilizado fue el citrato-ácido-cítrico-citrato-dextrosa (CAD). Para prevenir la hipocalcemia se administró previamente carbonato cálcico vía oral. Tras la extracción del plasma, el volumen extraído se remplazó por albúmina 5%5.
En todos los pacientes, la indicación, volumen plasmático (VP) a recambiar, número de sesiones y periodicidad de estas fueron establecidos por el Servicio de Hematología en función de la enfermedad de base y el curso clínico de la patología.
En el Servicio de Farmacia se analizó la utilización del RPT en cada paciente como terapia en diferentes patologías contrastando la adecuación de su indicación, según los criterios establecidos por la ASFA y la bibliografía disponible.
Resultados
Durante el periodo revisado se solicitó RPT para 11 pacientes, 8 mujeres y 3 hombres, de edades comprendidas entre 28 y 72 años (mediana 46). Las patologías tratadas fueron de origen neurológico en 9 pacientes (81,8% de los casos) y un paciente con enfermedad de Waldenström. En un paciente con un proceso de hipertrigliceridemia aguda asociado a pancreatitis grave (seguimiento por los servicios de Medicina Intensiva y Endocrinología y Nutrición) no se llegó a realizar RPT por resolución del proceso con medidas generales (fluidoterapia, insulina, dieta).
En el grupo de los 9 pacientes con indicación neurológica para diferentes patologías se utilizó el RPT como terapia de primera línea en un caso de Guillain-Barré y en el resto, como alternativa tras el fracaso del tratamiento habitual. En el caso del paciente hematológico diagnosticado de enfermedad del Waldenström, se utilizó el RPT como tratamiento de primera línea con el objeto de disminuir paraproteínas de forma previa a instaurar el tratamiento específico.
En todos los casos, se utilizó un volumen de reposición de albúmina al 5% equivalente a 1-1,5 VP con ajuste según tolerancia del paciente. El volumen medio de reposición fue 1,27 VP.
De los 10 pacientes tratados únicamente 3 recibieron más de un proceso de RPT durante el periodo revisado. La mediana del número de sesiones por cada RPT fue de 6 (rango 1-12 sesiones). La duración de cada sesión osciló entre 2-3 horas.
En cuanto a la medicación concomitante durante el RPT, 1 paciente estaba en tratamiento con ciclosporina, 1 paciente con gentamicina, 4 pacientes con amikacina, 2 pacientes con vancomicina y 1 paciente con antiepilépticos (fenobarbital, fenitoína y ácido valproico). Esta medicación se administró tras la realización del RPT. Los niveles plasmáticos de dichos fármacos fueron determinados y ajustados mediante monitorización farmacocinética5.
En todos los casos, el hematólogo pautó profilaxis frente a hipocalcemia con calcio oral previo a RPT y posteriormente con calcio intravenoso según necesidad.
El RPT fue bien tolerado en el 70% de los pacientes, que no presentaron reacciones adversas. Un paciente presentó náuseas y vómitos en la primera sesión, mejorando posteriormente la tolerancia al tratamiento. Dos pacientes presentaron complicaciones relacionadas con el catéter central (proceso infeccioso).
En la Tabla 2 se presentan las características de cada caso.
Discusión
En nuestra serie de casos las patologías de origen neurológico fueron las más frecuentes; sin embargo, el resultado más favorable se obtuvo en el paciente hematológico con macroglobulinemia de Waldenströn6-8 (paciente K) (categoría I, grado 1C)1 en el que la hiperviscosidad causada por los niveles altos de proteínas IgM impedía iniciar el tratamiento. Después de una única sesión de RPT como medida primaria, se pudo iniciar el tratamiento con bortezomib+corticoides con el que se alcanzó una estabilidad clínica y analítica, no siendo necesario asociar rituximab como se había programado inicialmente. A pesar de la complejidad del paciente, el RPT permitió obtener mejores resultados del tratamiento farmacológico, evitando así medidas terapéuticas más complejas y costosas. La utilización de RPT como medida previa a tratamiento más específico está recogida en la bibliografía para disminuir la hiperviscosidad debida a altos niveles de IgM, dado que puede reducir dichos niveles en un 50% y la hiperviscosidad en un 60%8.
De los 2 pacientes neurológicos diagnosticados de Guillain-Barré3,9, en un paciente (paciente C) se utilizó RPT como primera línea de tratamiento (Categoría I, grado 1A)1 y como segunda línea en otro paciente (paciente B) con mala evolución y no respondedor al tratamiento inicial (Categoría III, grado 2C)1. A pesar de la alta recomendación del RPT en el primer caso, la respuesta obtenida no fue acorde a la esperada y tuvo que ser derivado al Servicio de Rehabilitación. El segundo paciente presentó una respuesta nula al RPT con posterior evolución tórpida.
En los dos casos simultáneos de encefalitis por anticuerpos anticanales de K10,11 (Ac anti-CKVD), a pesar de ser un diagnóstico con categoría III y grado 2C1 para RPT, se obtuvo una respuesta inicial muy favorable. Una de las pacientes (paciente I) recibió el alta hospitalaria con tratamiento antiepiléptico sin ningún ingreso posterior mientras que en el otro caso (paciente J), a pesar de la buena respuesta inicial al RPT, la enfermedad evolucionó tórpidamente necesitando nuevos RPT tras el periodo estudiado y concluyendo en exitus. Al igual que en la bibliografía consultada11, los pacientes presentaron una mejoría temporal subjetiva relacionada con el RPT.
Una de las indicaciones neurológicas en las que la técnica de RPT ha demostrado mayor eficacia es la miastenia gravis (Categoría I, grado 1B)1. Nuestra paciente (paciente A) era un caso de miastenia generalizada, seronegativa y refractaria a inmunosupresores, inmunoglobulinas intravenosas (IGIV) y corticoides. El RPT conllevó una mejoría parcial de los síntomas. Nuestros resultados coinciden con la bibliografía publicada. En un estudio retrospectivo realizado por Kumar y cols.12, en 35 pacientes con miastenia gravis se observó una mejoría a corto plazo de las crisis miasténicas. El estudio realizado por Mandawat y cols.13 compara RPT e IGIV en el tratamiento de miastenia gravis, concluyendo que ambos tratamientos son similares clínicamente, aunque recomiendan las IGIV para pacientes ancianos y/o con comorbilidades. Trantafyllou y cols.14 sugieren que un RPT periódico es seguro y efectivo en el control de los síntomas de pacientes con miastenia gravis moderada a grave que no responden a terapia inmunosupresora.
Se utilizó el RPT en una paciente de 40 años con miopatía inflamatoria refractaria3,5 (paciente G), previamente tratada con azatioprina, metotrexato, ciclosporina, ciclofosfamida, micofenolato, rituximab sin respuesta. A pesar de ser una indicación con categoría IV, grado 2C1, esta paciente se benefició del RPT, con unos resultados muy positivos que conllevaron al alta hospitalaria con prednisona como único tratamiento.
Otros casos tratados (pacientes D, E, F) estaban diagnosticados de enfermedades neurológicas como neuromielitis óptica, polineuropatía, síndrome de Eaton-Lambert3, con buena respuesta inicial y resultados finales dispares (ver Tabla 2).
Respecto a las complicaciones de la técnica solamente presentaron reacciones adversas un 30% de los pacientes, lo que se ajusta a la frecuencia global descrita (25%-60%)5.
Dado que el RPT podría disminuir los niveles plasmáticos de algunos fármacos5, es importante realizar un seguimiento farmacocinético para garantizar la eficacia del tratamiento concomitante En conclusión, el 80% de los pacientes tratados pudieron beneficiarse de una mejoría en su proceso.
El RPT en los pacientes revisados se ajustó a las guías de referencia aunque no se observó correlación directa entre el grado de recomendación de dichas guías y la respuesta obtenida. El número reducido de pacientes supone una limitación para extraer resultados concluyentes.
Aportación a la literatura científica
El estudio realizado con la técnica de recambio plasmático terapéutico aporta información de la utilización de este procedimiento en las diferentes patologías tratadas, en nuestro ámbito de trabajo habitual. La importancia de disponer de este tipo de información radica en la variabilidad encontrada en las diferentes publicaciones recogidas en la bibliografía en cuanto a indicaciones, pauta, resultados obtenidos e interacciones con el tratamiento habitual de los pacientes.
La técnica de recambio plasmático terapéutico es utilizada en diferentes patologías de origen autoinmune. Todas estas enfermedades presentan una baja incidencia por lo que disponer de información sobre este procedimiento permitirá implantar, en los Servicios de Farmacia Hospitalaria, una atención farmacéutica más exhaustiva para contribuir a obtener los mejores resultados terapéuticos posibles.
References
Schwartz J, Winters JL, Padmanabhan A, Balogun RA, Delaney M, Linenberger ML et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice-Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Sixth Special Issue. J Clin Apher. 2013;28(3):145-284. (Consultado 15/02/2016). Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/jca.21276/epdf [ Links ]
Anaya F. Manual de aféresis terapéutica basada en la evidencia. 2012 (citado 22/08/2016). Disponible en: http://www.ucm.es/data/cont/docs/796-2016-05-09-Dr.%20Anaya_Manual_aferesis_terapeutica_fernando_anaya.pdf [ Links ]
Laínez-Andrés JM, Gascón-Giménez F, Coret-Ferrer F, Casanova-Estruch B, Santonja JM. Recambio plasmático terapéutico: aplicaciones en Neurología. Rev Neurol. 2015;60(3):120-31. (Consultado 18/02/2016). Disponible en: https://www.researchgate.net/profile/Miguel_Lainez/publication/271594512_Therapeutic_plasma_exchange_Applications_in_neurology/links/54f5d78e0cf27d8ed71cccc6.pdf [ Links ]
Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Boletín Oficial del Estado, n.º 274, (15 de noviembre de 2002). [ Links ]
Pons-Estel GJ, Serrano R, Lozano M, Cid J, Cervera R, Espinosa G. Recambio plasmático en las enfermedades autoinmunes sistémicas. Semin Fund Esp Reumatol. 2013;14(2):43-50. (Consultado 24/02/2016). Disponible en: http://www.elsevier.es/es-revista-seminarios-fundacion-espanola-reumatologia-274-articulorecambio-plasmatico-las-enfermedades-autoinmunes-S1577356613000183 [ Links ]
Treon S. Proteasome inhibitors in Waldenströn macroglobulinemia. Blood. 2013;122:3243-4. (Consultado 15/02/2016). Disponible en: http://www.bloodjournal.org/content/122/ 19/3243.long?sso-checked=true [ Links ]
Ghobrial IM. Choice of therapy for patients with Waldenstrom macroglobulinemia. J Clin Oncol. 2013;31(3):291-3. (Consultado 15/02/2017). Disponible en: http://ascopubs.org/doi/pdf/10.1200/JCO.2012.46.6177 [ Links ]
Siami GA, Siami FS. Plasmapheresis and paraproteinemia: cryoprotein-induced diseases, monoclonal gammopathy, Waldenström’s macroglobulinemia, hyperviscosity syndrome, multiple myeloma, light chain disease, and amyloidosis. Ther Apher. 1999;3(1):8-19. (Consultado 17/02/2016). Disponible en: http://onlinelibrary.wiley.com/doi/10.1046/j.1526-0968.1999.00146.x/abstract;jsessionid=AF521196CACA7D24F1E8F156AB48320C.f01t01 [ Links ]
Gwathmey K, Balogun RA, Burns T. Neurologic indications for therapeutic plasma Exchange: 2013 update. J Clin Apher. 2014;29(4):211-9. (Consultado 20/02/2016). Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/jca.21331/abstract [ Links ]
Montojo MT, Petit-Pedrol M, Graus F, Dalmau J. Espectro clínico y valor diagnóstico de los anticuerpos contra el complejo proteico asociado a canales de potasio. Neurología. 2015;30(5):295-301. (Consultado 10/02/2016). Disponible en: http://ac.els-cdn.com/S2173580815000668/1-s2.0-S2173580815000668-main.pdf?_tid=4a9c1982-35b4-11e7-adac-00000aacb35f&acdnat=1494443592_f5481dd81acbff0b950a8afeb067ed9b [ Links ]
Martin IW, Martin CL, Dunbar NM, Lee SL, Szczepiorkowski ZM. Therapeutic Plasma Exchange as a Steroid-Sparing Therapy in a Patient with Limbic Encephalitis Due to Antibodies to Voltage-Gated Potassium Channels. J. Clin. Apher. 2016;31:63-5. (Consultado 06/04/2016). Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/jca.21395/abstract [ Links ]
Rajesh K, Birinder SP, Gupta S, Singh G, Kaur A. Therapeutic plasma exchange in the treatment of myasthenia gravis. Indian J Crit Care Med. 2015;19(1): 9-13. (Consultado 15/03/2016). Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4296418/ [ Links ]
Mandawat A, Kaminski HJ, Gatter G, Katirji B, Alshekhlee A. Comparative analysis of Therapeutic options used for Myasthenia Gravis. Ann Neurol. 2010;68(6):797-805. (Consultado 25/02/2016). Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/ana.22139/epdf [ Links ]
Triantafyllou NI, Grapsa EI, Karanzou E, Psimenou E, Lagguranis A, Dimopoulos A. Periodic therapeutic plasma exchange in patients with moderate to severe chronic myasthenia gravis non-responsive to immunosuppressive agents: an eight year followup. Ther Apher Dial. 2009;13(3):174-8. (Consultado 22/02/2016). Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1744-9987.2009.00684.x/epdf [ Links ]
Recibido: 30 de Junio de 2017; Aprobado: 20 de Septiembre de 2017











 texto en
texto en 



